再構成系および1分子観察により同定されたショウジョウバエにおけるRISCの形成の過程
岩崎信太郎・佐々木 浩・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:岩崎信太郎,佐々木 浩,泊 幸秀
DOI: 10.7875/first.author.2015.053
Defining fundamental steps in the assembly of the Drosophila RNAi enzyme complex.
Shintaro Iwasaki, Hiroshi M. Sasaki, Yuriko Sakaguchi, Tsutomu Suzuki, Hisashi Tadakuma, Yukihide Tomari
Nature, 521, 533-536 (2015)
RNAi法は遺伝子の発現を特異的に抑制することのできる手法として,現在,生物学の研究に広く用いられている.RNAiはsiRNAとよばれる小分子RNAとAgoとよばれるタンパク質との複合体であるRISCによりひき起こされるが,RISCが形成される過程は十分に理解されていなかった.この研究において,ショウジョウバエにおけるAgo2を含むRISCの形成の過程を,Dicer-2-R2D2複合体およびシャペロンマシナリーであるHsc70,Hsp90,Hop,Hsp40,p23の計7種のタンパク質により完全に再構成することに成功した.また,1分子観察技術を用いることにより,RISCの形成の過程を詳細に調べた.シャペロンマシナリーはDicer-2,R2D2,2本鎖siRNAからなる複合体が単にAgo2と結合すること自体に必須ではなかったが,この複合体が2本鎖siRNAのガイド鎖の5’末端にあるリン酸基に依存して長時間にわたりAgo2と結合しつづけることには必要であることがわかった.この研究は,RNAiの作用機構を詳細に解明しただけでなく,RNAi法を利用した次世代の医薬の開発をいっそう促進することが期待される.
siRNAやmiRNAといった約21~22塩基の小分子RNAは,その配列と相補的な配列をもつmRNAからの遺伝子発現を抑制することが知られている1).この現象は一般にRNAサイレンシングとよばれる.小分子RNAはそれだけでは機能することはできず,RISC(RNA-induced silencing complex)とよばれる小分子RNAとタンパク質からなる複合体を形成してはじめて機能する.小分子RNAに直接に結合しRISCの中核をなすのはArgonaute(Ago)とよばれるタンパク質である.RISCの構成タンパク質はAgoのほかにも数多く同定されているが,ここでは,小分子RNAとAgoとの複合体を最小の単位としての“RISC”の意味で用いる.また,この研究では,歴史的にもっともよく研究されているショウジョウバエのAgo2とsiRNAから構成されるRISCをモデルとした.
RISCの形成は大きく2つの過程,1)2本鎖siRNAがAgoに取り込まれる反応(ローディング)と,2)2本鎖siRNAが複合体において1本鎖になる反応(パッセンジャー鎖の放出)とに分けることができる.2本鎖siRNAのうち,最終的にAgoに保持されるRNA鎖をガイド鎖,1本鎖化により放出されるRNA鎖をパッセンジャー鎖とよぶ.
通常,2本鎖siRNAはウイルス複製中間体やトランスポゾンなどに由来する長い2本鎖RNAから,RNaseIIIファミリーのひとつであるDicer-2とそのパートナータンパク質であるR2D2との複合体により切りだされる2).Dicer-2-R2D2複合体は,2本鎖siRNAの生成という機能にくわえ,2本鎖siRNAのAgo2へのローディングにも必須であり,2本鎖siRNAはDicer-2,R2D2,2本鎖siRNAからなる複合体からAgo2へとうけわたされる3,4).たとえば,トラスフェクションや生化学反応において長い2本鎖RNAではなく2本鎖siRNAから反応をはじめたとしても,Dicer-2-R2D2複合体は必要である.これに対し,ショウジョウバエAgo1やヒトのAgo(Ago1~Ago4)はローディングにDicerを必要としない5,6).これまでの研究により,Dicerの必要性の有無にかかわらず,ローディングにはATPにくわえ,分子シャペロンであるHsc70およびHsp90が必要であることが明らかにされている7-9).
これに対し,パッセンジャー鎖の放出はATPや分子シャペロンを必要としない.ショウジョウバエのAgo2はそれ自体のもつヌクレアーゼ活性により一方のRNA鎖を切断することでパッセンジャー鎖の放出をひき起こす10-12).切断をうけたパッセンジャー鎖がC3POとよばれる別のヌクレアーゼによりさらに消化をうけることにより,パッセンジャー鎖の放出は促進される13).
ローディングには分子シャペロンであるHsc70およびHsp90が必須であるが,それでは,ローディングに十分な最小のタンパク質はどのようなものであろうか? 予備実験において,組換えタンパク質として精製したDicer-2-R2D2複合体,Hsc70,Hsp90だけではローディングを引き起こすことはできなかった.このことから,ここにはローディングに必要十分なタンパク質が不足しているのであろうと考えた.
Hsc70およびHsp90はコシャペロンとよばれるアクセサリータンパク質とともにHsc70-Hsp90シャペロンマシナリーを形成することが知られている14).Hsc70-Hsp90シャペロンマシナリーにより制御される機構の代表としては,ステロイド受容体の成熟化の例がよく研究されている.ステロイド受容体はそれ自体だけではリガンドであるステロイドと結合することはできないが,Hsc70-Hsp90シャペロンマシナリーにより構造変化をうけることによりはじめてステロイドと結合する14).2本鎖siRNAをAgo2のリガンドととらえると,ステロイド受容体の成熟化の機構はローディングと非常に類似した反応であると考えられた.そこで,ステロイド受容体の成熟化に十分であることのわかっているHsc70,Hsp90,Hop,Hsp40,p23の5つのタンパク質に注目した.p23を除くそれぞれのホモログであるHsc70-4,Hsp83,Hop,Droj2は,Ago2と結合していることが質量分析法により同定されていた8).これにくわえ,p23の阻害剤によりAgo2へのローディングが阻害されたことから,p23も必須であると考えられた.
HopはHsc70およびHsp90のそれぞれと結合し,2つの分子シャペロンをひとつのマシナリーにつなぎとめる役割をもつタンパク質である.まず,SBPタグを付与したHopをショウジョウバエS2細胞において発現させ,SBPタグを介してアフィニティー精製することにより内在するHsc70-Hop-Hsp90三者複合体を精製した.Hsc70-Hop-Hsp90三者複合体あるいはDicer-2-R2D2複合体は,どちらか一方だけではローディングをひき起こすことはできなかったが,両者が存在すると効率よくローディングがひき起こされた.さらに,組換えタンパク質として精製したDroj2あるいはp23のそれぞれによりローディングはさらに促進された.Hsc70,Hop,Hsp90をそれぞれ独立に組換えタンパク質として精製しても,同様にこの3つすべてがあれば効率的なローディングが観察された.Dicer-2-R2D2複合体はローディングに必須であったのに対し,Hsc70-Hsp90シャペロンマシナリーを構成するタンパク質は1つが欠損しても効率は下がるもののローディングをひき起こした.このような現象はステロイド受容体の場合にも同様に観察されており,Hsc70-Hsp90シャペロンマシナリーに一般的にみられる現象のようであった.
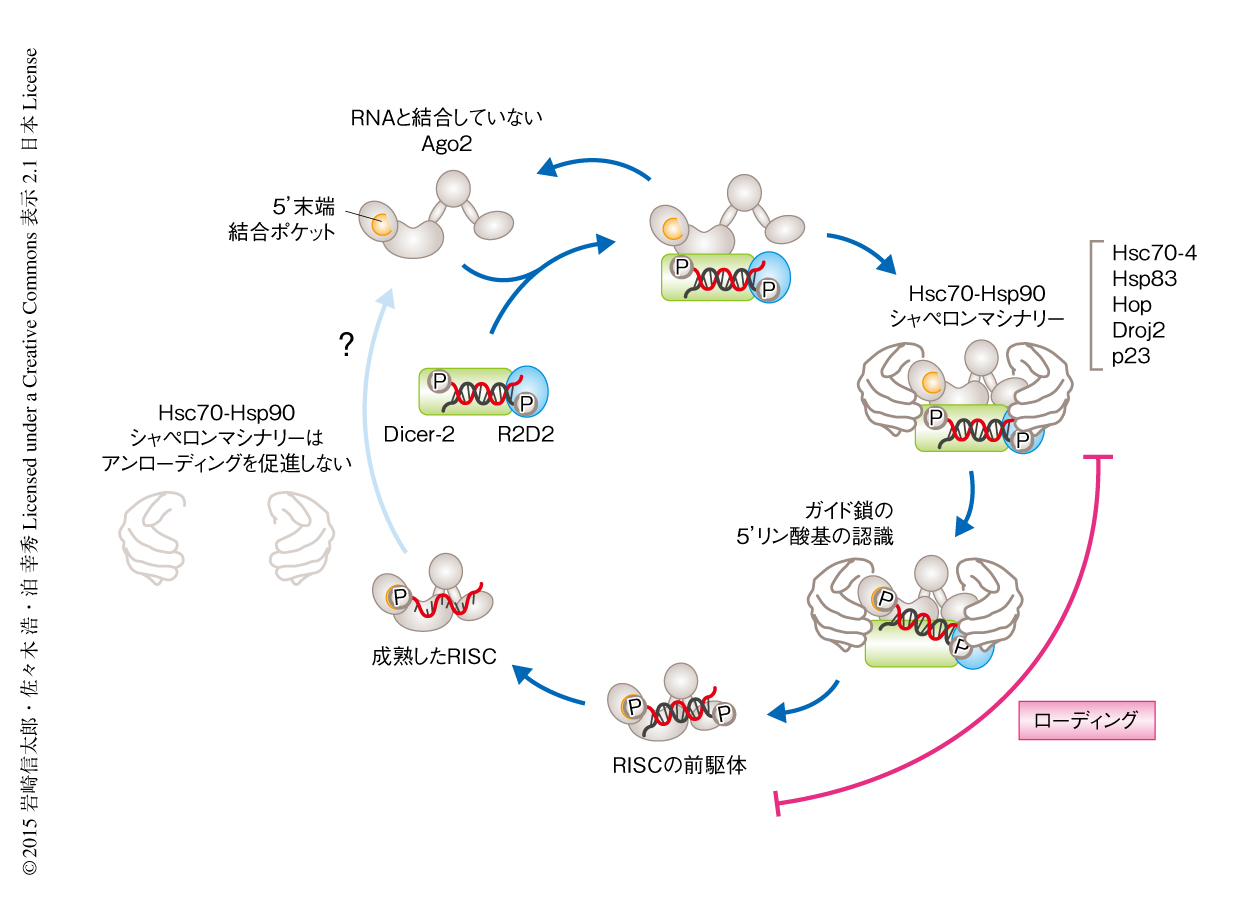
以上のRISCの再構成系は,これまでに報告されていた以下のようなローディングの特徴を完全に再現した.1)再構成系によりローディングされた2本鎖siRNAは最終的に1本鎖となり標的RNAに対する切断活性をもち,再構成されたRISCの活性は細胞抽出液において形成させたRISCと遜色はなかった.2)2本鎖siRNAのうちどちらがガイド鎖として選択されるかは2本鎖siRNAの末端の熱力学的な安定性に依存し非対称であることが知られているが,再構成系は2本鎖siRNAの非対称性を反映しガイド鎖の選択性を再現した.3)再構成系はATPに依存的であり,ATPaseであるHsc70あるいはHsp90のATPase活性の変異体はローディングの効率をいちじるしく低下させた.以上の点から,このRISCの再構成系はローディングを完全に再現すると結論づけた(図1).
近年,いったんAgoにローディングされたsiRNAがAgoから取り除かれる“アンローディング”という現象が報告された15).この報告は,ローディングはつまり,すでにローディングされたsiRNAをアンローディングすることである可能性を示唆した.そこで,再構成系を用いてこの可能性について検証した.結論として,ローディングはアンローディングをともなうことはなく,いったんローディングされたsiRNAはローディングの過程で取り除かれることはなかった.この結果は,RISCの再構成系があってはじめて検証することができたものであった.
ショウジョウバエにおけるAgo2を含むRISCの形成について再構成系を構築したことは,RISCの形成の過程について生化学的な実験により調べることのできるひとつのゴールに達したことを意味した.しかし,RISCの形成の過程,とくに,ローディングの過程がどのように起こるのかについてはまだ大きな謎がいくつも残されていた.2本鎖siRNAはどのようにDicer-2-R2D2複合体からAgo2へとうけわたされるのか? そして,Hsc70-Hsp90シャペロンマシナリーはどのようにRISCの形成を促進しているのか? こうした問いに答えるためには,RISCの形成の過程においてその中間状態をとらえて解析する必要がある.しかし,中間状態は不安定であり,生化学的な実験ではローディングおよびパッセンジャー鎖の放出の2つのステップより切り分けて解析することは不可能であった.そこで,RISCの再構成系と生物物理学的な手法とを組み合わせ,RISCが形成されるようすを1分子レベルでリアルタイムに観察することを試みた.
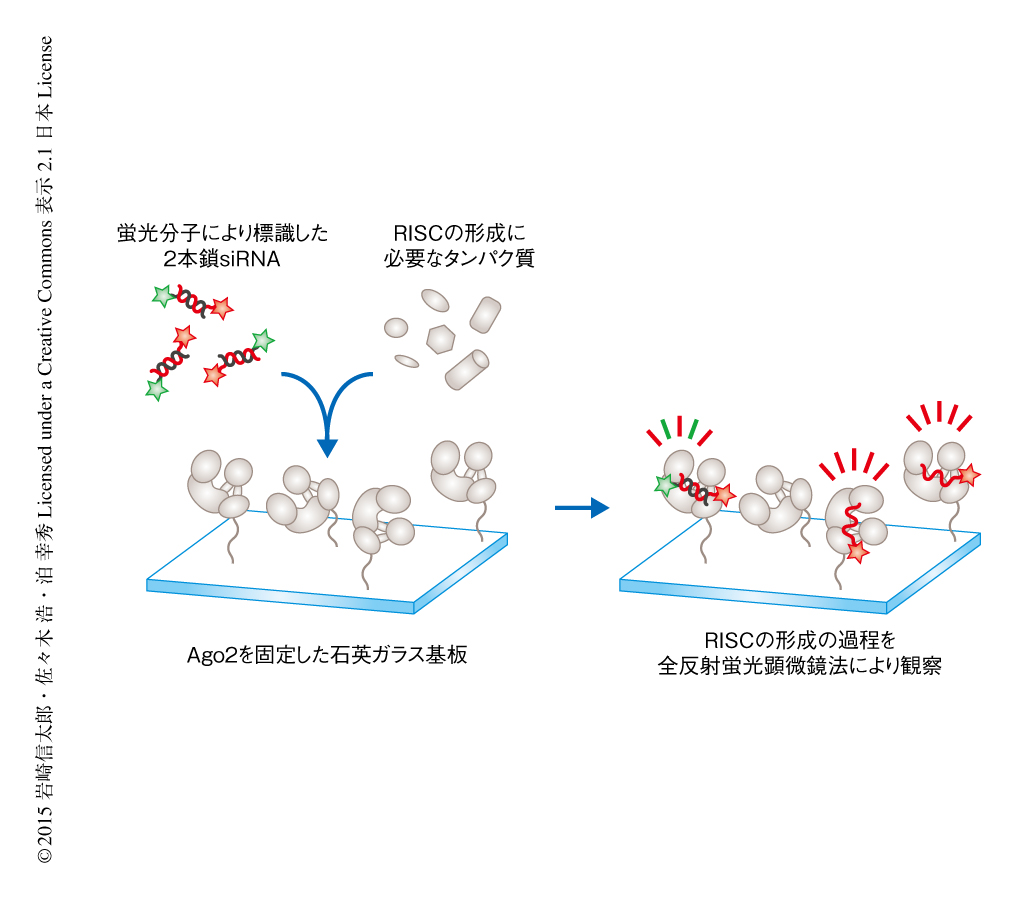
全反射蛍光顕微鏡法は石英ガラス基板の表面に存在する蛍光分子のみを選択的に可視化する方法として生物物理学的な実験に広く用いられている.この手法とRISCの再構成系とを組み合わせ,RISCの形成の1分子観察系を構築した(図2).具体的には,まず,Ago2を石英ガラス基板に固定し,プルダウン実験と同様に高塩濃度かつ界面活性剤を含む緩衝液によりほかのタンパク質を洗い流した.つぎに,Ago2を固定化した基板に蛍光分子により3’末端を標識した2本鎖siRNAを含むRISCの再構成系をくわえた.のちにガイド鎖として取り込まれるほうを赤色の蛍光分子Alexa647により,パッセンジャー鎖として放出されるほうを緑色の蛍光分子Alexa555により標識した.2本鎖siRNAが取り込まれたRISCの前駆体は赤色と緑色の両方の蛍光色素を含むため黄色の輝点として観察されるが,そののち,パッセンジャー鎖の放出によりガイド鎖のみを含む成熟したRISCができると赤色の輝点として観察される.
構築した1分子観察系がこれまでの生化学的な実験による知見と合致するか検証した.Ago2を固定した基板に2本鎖siRNAを含むRISCの再構成系をくわえ1時間のち,基板の表面を洗い流して残った輝点を観察したところ,Ago2,Dicer-2-R2D2複合体,Hsc70-Hsp90シャペロンマシナリーのすべてが存在する条件でのみ,黄色および赤色の輝点が観察された.さらに,RISCの前駆体は形成されるもののパッセンジャー鎖の放出の起こらない,切断活性を欠損したAgo2変異体を固定した場合には黄色の輝点しか観察されず,赤色の輝点はAgo2の酵素活性に依存して生じることが確かめられた.さらに,輝点が観察された基板をTEVプロテアーゼで処理することによりAgo2と固定化に用いたタグタンパク質とのあいだに挿入しておいたTEVプロテアーゼ切断配列を切断したところ,輝点の消失が観察された.これらの実験結果から,構築したRISCの形成の1分子観察系はこれまでの生化学的な知見と合致しており,RISCの形成を基板のうえで再現していると結論づけた.
生化学的な実験ではとらえることのできなかったRISCの形成の中間状態を明らかにするため,RISCの形成の1分子観察系を用いて,反応の開始から20分間にわたり連続観察した.現われた輝点の多く(86%以上)は時定数が約20秒で消失し,これは短時間の結合を示していた.その一方で,約9%の輝点は赤色および緑色とも100秒以上にわたり光りつづける長時間の結合を示しており,約3%の輝点はパッセンジャー鎖に対応する緑色の輝点のみが途中で消失したことから,パッセンジャー鎖の放出に対応した.興味深いことに,Ago2およびDicer-2-R2D2複合体が存在すればHsc70-Hsp90シャペロンマシナリーの有無にかかわらずくり返して起こる短時間の結合が観察されたことから,Dicer-2,R2D2,2本鎖siRNAからなる複合体はHsc70-Hsp90シャペロンマシナリーに依存することなくAgo2と一時的に結合することがわかった.しかし,100秒以上にわたり光りつづける輝点に注目したところ,Ago2およびDicer-2-R2D2複合体だけでなく,Hsc70-Hsp90シャペロンマシナリーも存在してはじめて長時間の結合が起こることが明らかにされた.
ガイド鎖の5’末端にあるリン酸基がいつ認識されるかに注目した.成熟したRISCでは,ガイド鎖の5’リン酸基が,Agoのもつ5’末端結合ポケットにより強固に認識されている.生化学的な実験から,ガイド鎖の5’末端をOH基に変えた場合や,Agoの5’末端結合ポケットに変異を導入した場合には,RISCは形成されないことがわかっていた.1分子観察系を用いた連続観察により,ガイド鎖の5’リン酸基が認識されない場合にも多くの短時間の結合が観察された.この結果は,短時間の結合はガイド鎖の5’リン酸基の認識を必要としないことを示した.しかし同時に,ガイド鎖の5リン酸基が認識された場合のみ,長時間の結合が観察された.
これらの結果をまとめると,RISCの形成について,以下のような基本過程が明らかにされた(図1).1)Dicer-2,R2D2,2本鎖siRNAからなる複合体はAgo2に対しHsc70-Hsp90シャペロンマシナリーに非依存的に結合と解離をくり返す.2)Hsc70-Hsp90シャペロンマシナリーの存在によりDicer-2,R2D2,2本鎖siRNAからなる複合体のAgo2との結合時間が延長しうけわたしが促進される.3)Ago2との結合時間の延長には同時にガイド鎖の5’リン酸基の認識を必要とする.
RNAと結合していないAgo2はフレキシブルであることから,Hsc70-Hsp90シャペロンマシナリーはAgo2に対し,ガイド鎖の5’リン酸基を認識し2本鎖siRNAをローディングできるような状態にささえる役割をはたすと考えられた.そして,ガイド鎖の5’リン酸基がAgo2により正しく認識されることにより,残りの部分の2本鎖siRNAもAgo2に取り込まれてRISCの前駆体を形成し,成熟したRISCの形成へとつながると考えられた.
RISCの再構成系の構築は偶然の賜物であった.タンパク質の精製においてはDTTなどの還元剤を含む緩衝液を用いるのがつねであるが,Hsc70-Hop-Hsp90三者複合体の精製を試行していたとき,DTTをくわえるのを忘れたバッチがあった.もちろん,そのことは実験ノートに記しておいたのだが,DTTを含むバッチにはまったく活性がなかったのに対し,DTTを入れ忘れたバッチは強いローディング活性を示した(その詳細な理由は不明であるが,ヒトやショウジョウバエにおいてHsp90のもつCysの酸化還元状態はHsp90の活性に影響をあたえるというという報告があるため,おそらく,Hsp90がDTTに感受性なのであろうと考えている).この偶然の失敗がなく,また,そのことを実験ノートに記していなければ,RISCの再構成系を構築することは非常にむずかしかったであろう.このことは,きちんと実験ノートをとることの大切さをあらためて認識させてくれた.
1分子観察系の構築はただひたすらに不安定さとの戦いだった.まったく同じ試薬および同じ試料を使っているにもかかわらず1時間まえに自分が行った観察結果すら満足に再現できない状況から,ひとつずつ問題点を克服し,系を安定させ信頼できるデータがとれるようになるまでには,結果として1年以上を費やした.それでも,いつかは系を安定させることができると信じることのできたのは,赤色の輝点の出現はAgo2の酵素活性に依存しているという,偶然では説明のできないデータがあったからだった.そしてもうひとつ,問題を解決する糸口はすべて研究室におけるディスカッションからみつかったことを記しておきたい.うまくいかない結果について何度もくり返し相談することがなければ,そして,研究室のメンバーが話し相手になってくれなければ,1分子観察系が完成することはなかった.確たる実験データと研究室におけるディスカッション,あたりまえの2つのことが長くつづいた戦いのささえになった.
略歴:2011年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助教,2013年 米国Carnegie Institution for Science博士研究員を経て,同年より米国California大学Berkeley校 博士研究員.
研究テーマ:翻訳およびその制御の分子機構.
関心事:次世代シークエンサーを用いた網羅的な解析.
佐々木 浩(Hiroshi M. Sasaki)
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:分子レベルの生命現象を可視化する.
関心事:“自分が分子だったら”あるいは“自分が石英ガラスの表面だったら”ということを1日3回は考えます.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2015 岩崎信太郎・佐々木 浩・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:岩崎信太郎,佐々木 浩,泊 幸秀
DOI: 10.7875/first.author.2015.053
Defining fundamental steps in the assembly of the Drosophila RNAi enzyme complex.
Shintaro Iwasaki, Hiroshi M. Sasaki, Yuriko Sakaguchi, Tsutomu Suzuki, Hisashi Tadakuma, Yukihide Tomari
Nature, 521, 533-536 (2015)
要 約
RNAi法は遺伝子の発現を特異的に抑制することのできる手法として,現在,生物学の研究に広く用いられている.RNAiはsiRNAとよばれる小分子RNAとAgoとよばれるタンパク質との複合体であるRISCによりひき起こされるが,RISCが形成される過程は十分に理解されていなかった.この研究において,ショウジョウバエにおけるAgo2を含むRISCの形成の過程を,Dicer-2-R2D2複合体およびシャペロンマシナリーであるHsc70,Hsp90,Hop,Hsp40,p23の計7種のタンパク質により完全に再構成することに成功した.また,1分子観察技術を用いることにより,RISCの形成の過程を詳細に調べた.シャペロンマシナリーはDicer-2,R2D2,2本鎖siRNAからなる複合体が単にAgo2と結合すること自体に必須ではなかったが,この複合体が2本鎖siRNAのガイド鎖の5’末端にあるリン酸基に依存して長時間にわたりAgo2と結合しつづけることには必要であることがわかった.この研究は,RNAiの作用機構を詳細に解明しただけでなく,RNAi法を利用した次世代の医薬の開発をいっそう促進することが期待される.
はじめに
siRNAやmiRNAといった約21~22塩基の小分子RNAは,その配列と相補的な配列をもつmRNAからの遺伝子発現を抑制することが知られている1).この現象は一般にRNAサイレンシングとよばれる.小分子RNAはそれだけでは機能することはできず,RISC(RNA-induced silencing complex)とよばれる小分子RNAとタンパク質からなる複合体を形成してはじめて機能する.小分子RNAに直接に結合しRISCの中核をなすのはArgonaute(Ago)とよばれるタンパク質である.RISCの構成タンパク質はAgoのほかにも数多く同定されているが,ここでは,小分子RNAとAgoとの複合体を最小の単位としての“RISC”の意味で用いる.また,この研究では,歴史的にもっともよく研究されているショウジョウバエのAgo2とsiRNAから構成されるRISCをモデルとした.
RISCの形成は大きく2つの過程,1)2本鎖siRNAがAgoに取り込まれる反応(ローディング)と,2)2本鎖siRNAが複合体において1本鎖になる反応(パッセンジャー鎖の放出)とに分けることができる.2本鎖siRNAのうち,最終的にAgoに保持されるRNA鎖をガイド鎖,1本鎖化により放出されるRNA鎖をパッセンジャー鎖とよぶ.
通常,2本鎖siRNAはウイルス複製中間体やトランスポゾンなどに由来する長い2本鎖RNAから,RNaseIIIファミリーのひとつであるDicer-2とそのパートナータンパク質であるR2D2との複合体により切りだされる2).Dicer-2-R2D2複合体は,2本鎖siRNAの生成という機能にくわえ,2本鎖siRNAのAgo2へのローディングにも必須であり,2本鎖siRNAはDicer-2,R2D2,2本鎖siRNAからなる複合体からAgo2へとうけわたされる3,4).たとえば,トラスフェクションや生化学反応において長い2本鎖RNAではなく2本鎖siRNAから反応をはじめたとしても,Dicer-2-R2D2複合体は必要である.これに対し,ショウジョウバエAgo1やヒトのAgo(Ago1~Ago4)はローディングにDicerを必要としない5,6).これまでの研究により,Dicerの必要性の有無にかかわらず,ローディングにはATPにくわえ,分子シャペロンであるHsc70およびHsp90が必要であることが明らかにされている7-9).
これに対し,パッセンジャー鎖の放出はATPや分子シャペロンを必要としない.ショウジョウバエのAgo2はそれ自体のもつヌクレアーゼ活性により一方のRNA鎖を切断することでパッセンジャー鎖の放出をひき起こす10-12).切断をうけたパッセンジャー鎖がC3POとよばれる別のヌクレアーゼによりさらに消化をうけることにより,パッセンジャー鎖の放出は促進される13).
1.RISCの形成にはHsc70-Hsp90シャペロンマシナリーが必須である
ローディングには分子シャペロンであるHsc70およびHsp90が必須であるが,それでは,ローディングに十分な最小のタンパク質はどのようなものであろうか? 予備実験において,組換えタンパク質として精製したDicer-2-R2D2複合体,Hsc70,Hsp90だけではローディングを引き起こすことはできなかった.このことから,ここにはローディングに必要十分なタンパク質が不足しているのであろうと考えた.
Hsc70およびHsp90はコシャペロンとよばれるアクセサリータンパク質とともにHsc70-Hsp90シャペロンマシナリーを形成することが知られている14).Hsc70-Hsp90シャペロンマシナリーにより制御される機構の代表としては,ステロイド受容体の成熟化の例がよく研究されている.ステロイド受容体はそれ自体だけではリガンドであるステロイドと結合することはできないが,Hsc70-Hsp90シャペロンマシナリーにより構造変化をうけることによりはじめてステロイドと結合する14).2本鎖siRNAをAgo2のリガンドととらえると,ステロイド受容体の成熟化の機構はローディングと非常に類似した反応であると考えられた.そこで,ステロイド受容体の成熟化に十分であることのわかっているHsc70,Hsp90,Hop,Hsp40,p23の5つのタンパク質に注目した.p23を除くそれぞれのホモログであるHsc70-4,Hsp83,Hop,Droj2は,Ago2と結合していることが質量分析法により同定されていた8).これにくわえ,p23の阻害剤によりAgo2へのローディングが阻害されたことから,p23も必須であると考えられた.
2.RISCの形成は7種のタンパク質により再構成された
HopはHsc70およびHsp90のそれぞれと結合し,2つの分子シャペロンをひとつのマシナリーにつなぎとめる役割をもつタンパク質である.まず,SBPタグを付与したHopをショウジョウバエS2細胞において発現させ,SBPタグを介してアフィニティー精製することにより内在するHsc70-Hop-Hsp90三者複合体を精製した.Hsc70-Hop-Hsp90三者複合体あるいはDicer-2-R2D2複合体は,どちらか一方だけではローディングをひき起こすことはできなかったが,両者が存在すると効率よくローディングがひき起こされた.さらに,組換えタンパク質として精製したDroj2あるいはp23のそれぞれによりローディングはさらに促進された.Hsc70,Hop,Hsp90をそれぞれ独立に組換えタンパク質として精製しても,同様にこの3つすべてがあれば効率的なローディングが観察された.Dicer-2-R2D2複合体はローディングに必須であったのに対し,Hsc70-Hsp90シャペロンマシナリーを構成するタンパク質は1つが欠損しても効率は下がるもののローディングをひき起こした.このような現象はステロイド受容体の場合にも同様に観察されており,Hsc70-Hsp90シャペロンマシナリーに一般的にみられる現象のようであった.
以上のRISCの再構成系は,これまでに報告されていた以下のようなローディングの特徴を完全に再現した.1)再構成系によりローディングされた2本鎖siRNAは最終的に1本鎖となり標的RNAに対する切断活性をもち,再構成されたRISCの活性は細胞抽出液において形成させたRISCと遜色はなかった.2)2本鎖siRNAのうちどちらがガイド鎖として選択されるかは2本鎖siRNAの末端の熱力学的な安定性に依存し非対称であることが知られているが,再構成系は2本鎖siRNAの非対称性を反映しガイド鎖の選択性を再現した.3)再構成系はATPに依存的であり,ATPaseであるHsc70あるいはHsp90のATPase活性の変異体はローディングの効率をいちじるしく低下させた.以上の点から,このRISCの再構成系はローディングを完全に再現すると結論づけた(図1).
近年,いったんAgoにローディングされたsiRNAがAgoから取り除かれる“アンローディング”という現象が報告された15).この報告は,ローディングはつまり,すでにローディングされたsiRNAをアンローディングすることである可能性を示唆した.そこで,再構成系を用いてこの可能性について検証した.結論として,ローディングはアンローディングをともなうことはなく,いったんローディングされたsiRNAはローディングの過程で取り除かれることはなかった.この結果は,RISCの再構成系があってはじめて検証することができたものであった.
3.RISCの形成の1分子観察系の構築
ショウジョウバエにおけるAgo2を含むRISCの形成について再構成系を構築したことは,RISCの形成の過程について生化学的な実験により調べることのできるひとつのゴールに達したことを意味した.しかし,RISCの形成の過程,とくに,ローディングの過程がどのように起こるのかについてはまだ大きな謎がいくつも残されていた.2本鎖siRNAはどのようにDicer-2-R2D2複合体からAgo2へとうけわたされるのか? そして,Hsc70-Hsp90シャペロンマシナリーはどのようにRISCの形成を促進しているのか? こうした問いに答えるためには,RISCの形成の過程においてその中間状態をとらえて解析する必要がある.しかし,中間状態は不安定であり,生化学的な実験ではローディングおよびパッセンジャー鎖の放出の2つのステップより切り分けて解析することは不可能であった.そこで,RISCの再構成系と生物物理学的な手法とを組み合わせ,RISCが形成されるようすを1分子レベルでリアルタイムに観察することを試みた.
全反射蛍光顕微鏡法は石英ガラス基板の表面に存在する蛍光分子のみを選択的に可視化する方法として生物物理学的な実験に広く用いられている.この手法とRISCの再構成系とを組み合わせ,RISCの形成の1分子観察系を構築した(図2).具体的には,まず,Ago2を石英ガラス基板に固定し,プルダウン実験と同様に高塩濃度かつ界面活性剤を含む緩衝液によりほかのタンパク質を洗い流した.つぎに,Ago2を固定化した基板に蛍光分子により3’末端を標識した2本鎖siRNAを含むRISCの再構成系をくわえた.のちにガイド鎖として取り込まれるほうを赤色の蛍光分子Alexa647により,パッセンジャー鎖として放出されるほうを緑色の蛍光分子Alexa555により標識した.2本鎖siRNAが取り込まれたRISCの前駆体は赤色と緑色の両方の蛍光色素を含むため黄色の輝点として観察されるが,そののち,パッセンジャー鎖の放出によりガイド鎖のみを含む成熟したRISCができると赤色の輝点として観察される.
構築した1分子観察系がこれまでの生化学的な実験による知見と合致するか検証した.Ago2を固定した基板に2本鎖siRNAを含むRISCの再構成系をくわえ1時間のち,基板の表面を洗い流して残った輝点を観察したところ,Ago2,Dicer-2-R2D2複合体,Hsc70-Hsp90シャペロンマシナリーのすべてが存在する条件でのみ,黄色および赤色の輝点が観察された.さらに,RISCの前駆体は形成されるもののパッセンジャー鎖の放出の起こらない,切断活性を欠損したAgo2変異体を固定した場合には黄色の輝点しか観察されず,赤色の輝点はAgo2の酵素活性に依存して生じることが確かめられた.さらに,輝点が観察された基板をTEVプロテアーゼで処理することによりAgo2と固定化に用いたタグタンパク質とのあいだに挿入しておいたTEVプロテアーゼ切断配列を切断したところ,輝点の消失が観察された.これらの実験結果から,構築したRISCの形成の1分子観察系はこれまでの生化学的な知見と合致しており,RISCの形成を基板のうえで再現していると結論づけた.
4.RISCの形成は複数の基本過程からなる
生化学的な実験ではとらえることのできなかったRISCの形成の中間状態を明らかにするため,RISCの形成の1分子観察系を用いて,反応の開始から20分間にわたり連続観察した.現われた輝点の多く(86%以上)は時定数が約20秒で消失し,これは短時間の結合を示していた.その一方で,約9%の輝点は赤色および緑色とも100秒以上にわたり光りつづける長時間の結合を示しており,約3%の輝点はパッセンジャー鎖に対応する緑色の輝点のみが途中で消失したことから,パッセンジャー鎖の放出に対応した.興味深いことに,Ago2およびDicer-2-R2D2複合体が存在すればHsc70-Hsp90シャペロンマシナリーの有無にかかわらずくり返して起こる短時間の結合が観察されたことから,Dicer-2,R2D2,2本鎖siRNAからなる複合体はHsc70-Hsp90シャペロンマシナリーに依存することなくAgo2と一時的に結合することがわかった.しかし,100秒以上にわたり光りつづける輝点に注目したところ,Ago2およびDicer-2-R2D2複合体だけでなく,Hsc70-Hsp90シャペロンマシナリーも存在してはじめて長時間の結合が起こることが明らかにされた.
ガイド鎖の5’末端にあるリン酸基がいつ認識されるかに注目した.成熟したRISCでは,ガイド鎖の5’リン酸基が,Agoのもつ5’末端結合ポケットにより強固に認識されている.生化学的な実験から,ガイド鎖の5’末端をOH基に変えた場合や,Agoの5’末端結合ポケットに変異を導入した場合には,RISCは形成されないことがわかっていた.1分子観察系を用いた連続観察により,ガイド鎖の5’リン酸基が認識されない場合にも多くの短時間の結合が観察された.この結果は,短時間の結合はガイド鎖の5’リン酸基の認識を必要としないことを示した.しかし同時に,ガイド鎖の5リン酸基が認識された場合のみ,長時間の結合が観察された.
これらの結果をまとめると,RISCの形成について,以下のような基本過程が明らかにされた(図1).1)Dicer-2,R2D2,2本鎖siRNAからなる複合体はAgo2に対しHsc70-Hsp90シャペロンマシナリーに非依存的に結合と解離をくり返す.2)Hsc70-Hsp90シャペロンマシナリーの存在によりDicer-2,R2D2,2本鎖siRNAからなる複合体のAgo2との結合時間が延長しうけわたしが促進される.3)Ago2との結合時間の延長には同時にガイド鎖の5’リン酸基の認識を必要とする.
RNAと結合していないAgo2はフレキシブルであることから,Hsc70-Hsp90シャペロンマシナリーはAgo2に対し,ガイド鎖の5’リン酸基を認識し2本鎖siRNAをローディングできるような状態にささえる役割をはたすと考えられた.そして,ガイド鎖の5’リン酸基がAgo2により正しく認識されることにより,残りの部分の2本鎖siRNAもAgo2に取り込まれてRISCの前駆体を形成し,成熟したRISCの形成へとつながると考えられた.
おわりに
RISCの再構成系の構築は偶然の賜物であった.タンパク質の精製においてはDTTなどの還元剤を含む緩衝液を用いるのがつねであるが,Hsc70-Hop-Hsp90三者複合体の精製を試行していたとき,DTTをくわえるのを忘れたバッチがあった.もちろん,そのことは実験ノートに記しておいたのだが,DTTを含むバッチにはまったく活性がなかったのに対し,DTTを入れ忘れたバッチは強いローディング活性を示した(その詳細な理由は不明であるが,ヒトやショウジョウバエにおいてHsp90のもつCysの酸化還元状態はHsp90の活性に影響をあたえるというという報告があるため,おそらく,Hsp90がDTTに感受性なのであろうと考えている).この偶然の失敗がなく,また,そのことを実験ノートに記していなければ,RISCの再構成系を構築することは非常にむずかしかったであろう.このことは,きちんと実験ノートをとることの大切さをあらためて認識させてくれた.
1分子観察系の構築はただひたすらに不安定さとの戦いだった.まったく同じ試薬および同じ試料を使っているにもかかわらず1時間まえに自分が行った観察結果すら満足に再現できない状況から,ひとつずつ問題点を克服し,系を安定させ信頼できるデータがとれるようになるまでには,結果として1年以上を費やした.それでも,いつかは系を安定させることができると信じることのできたのは,赤色の輝点の出現はAgo2の酵素活性に依存しているという,偶然では説明のできないデータがあったからだった.そしてもうひとつ,問題を解決する糸口はすべて研究室におけるディスカッションからみつかったことを記しておきたい.うまくいかない結果について何度もくり返し相談することがなければ,そして,研究室のメンバーが話し相手になってくれなければ,1分子観察系が完成することはなかった.確たる実験データと研究室におけるディスカッション,あたりまえの2つのことが長くつづいた戦いのささえになった.
文 献
- Kawamata, T. & Tomari, Y.: Making RISC. Trends Biochem. Sci., 35, 368-376 (2010)[PubMed]
- Lee, Y. S., Nakahara, K., Pham, J. W. et al.: Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell, 117, 69-81 (2004)[PubMed]
- Pham, J. W., Pellino, J. L., Lee, Y. S. et al.: A Dicer-2-dependent 80s complex cleaves targeted mRNAs during RNAi in Drosophila. Cell, 117, 83-94 (2004)[PubMed]
- Tomari, Y., Du, T., Haley, B. et al.: RISC assembly defects in the Drosophila RNAi mutant armitage. Cell, 116, 831-841 (2004)[PubMed]
- Kawamata, T., Seitz, H. & Tomari, Y.: Structural determinants of miRNAs for RISC loading and slicer-independent unwinding. Nat. Struct. Mol. Biol., 16, 953-960 (2009)[PubMed]
- Betancur, J. G. & Tomari, Y.: Dicer is dispensable for asymmetric RISC loading in mammals. RNA, 18, 24-30 (2012)[PubMed]
- Miyoshi, T., Takeuchi, A., Siomi, H. et al.: A direct role for Hsp90 in pre-RISC formation in Drosophila. Nat. Struct. Mol. Biol., 17, 1024-1026 (2010)[PubMed]
- Iwasaki, S., Kobayashi, M., Yoda, M. et al.: Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes. Mol. Cell, 39, 292-299 (2010)[PubMed] [新着論文レビュー]
- Iki, T., Yoshikawa, M., Nishikiori, M. et al.: In vitro assembly of plant RNA-induced silencing complexes facilitated by molecular chaperone HSP90. Mol. Cell, 39, 282-291 (2010)[PubMed] [新着論文レビュー]
- Rand, T. A., Petersen, S., Du, F. et al.: Argonaute2 cleaves the anti-guide strand of siRNA during RISC activation. Cell, 123, 621-629 (2005)[PubMed]
- Matranga, C., Tomari, Y., Shin, C. et al.: Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes. Cell, 123, 607-620 (2005)[PubMed]
- Miyoshi, K., Tsukumo, H., Nagami, T. et al.: Slicer function of Drosophila Argonautes and its involvement in RISC formation. Genes Dev, 19, 2837-2848 (2005)[PubMed]
- Liu, Y., Ye, X., Jiang, F. et al.: C3PO, an endoribonuclease that promotes RNAi by facilitating RISC activation. Science, 325, 750-753 (2009)[PubMed]
- Pratt, W. B. & Toft, D. O.: Regulation of signaling protein function and trafficking by the hsp90/hsp70-based chaperone machinery. Exp. Biol. Med., 228, 111-133 (2003)[PubMed]
- De, N., Young, L., Lau, P. W. et al.: Highly complementary target RNAs promote release of guide RNAs from human Argonaute2. Mol. Cell, 50, 344-355 (2013)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助教,2013年 米国Carnegie Institution for Science博士研究員を経て,同年より米国California大学Berkeley校 博士研究員.
研究テーマ:翻訳およびその制御の分子機構.
関心事:次世代シークエンサーを用いた網羅的な解析.
佐々木 浩(Hiroshi M. Sasaki)
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:分子レベルの生命現象を可視化する.
関心事:“自分が分子だったら”あるいは“自分が石英ガラスの表面だったら”ということを1日3回は考えます.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2015 岩崎信太郎・佐々木 浩・泊 幸秀 Licensed under CC 表示 2.1 日本