植物の受精における細胞融合による残存助細胞の迅速な排除
丸山大輔・東山哲也
(名古屋大学トランスフォーマティブ生命分子研究所)
email:丸山大輔
DOI: 10.7875/first.author.2015.051
Rapid elimination of the persistent synergid through a cell fusion mechanism.
Daisuke Maruyama, Ronny Völz, Hidenori Takeuchi, Toshiyuki Mori, Tomoko Igawa, Daisuke Kurihara, Tomokazu Kawashima, Minako Ueda, Masaki Ito, Masaaki Umeda, Shuh-ichi Nishikawa, Rita Groß-Hardt, Tetsuya Higashiyama
Cell, 161, 907-918 (2015)
種子のもとになる胚珠は受精ののちすぐに花粉管の誘引を停止する.被子植物において雄と雌とが一対一で結びつくことを保証するこのしくみは残存助細胞の排除により制御されている.筆者らは,シロイヌナズナの残存助細胞は胚乳と細胞融合することにより選択的に不活性化されることを明らかにした.残存助細胞では細胞融合につづいて,花粉管誘引ペプチドの急激な希釈と,胚乳における核の分裂にともなう核の選択的な崩壊が観察された.このようなすばやい残存助細胞の不活性化は花粉管の余分な誘引をふせいでいると考えられた.助細胞と胚乳との細胞融合は中央細胞の受精により誘導される一方で,卵細胞の受精は助細胞における核の崩壊をうながすエチレンシグナルの活性化を強く誘導した.したがって,残存助細胞の排除を協調的に制御する卵細胞の受精と中央細胞の受精に依存した経路の実体が明らかにされた.
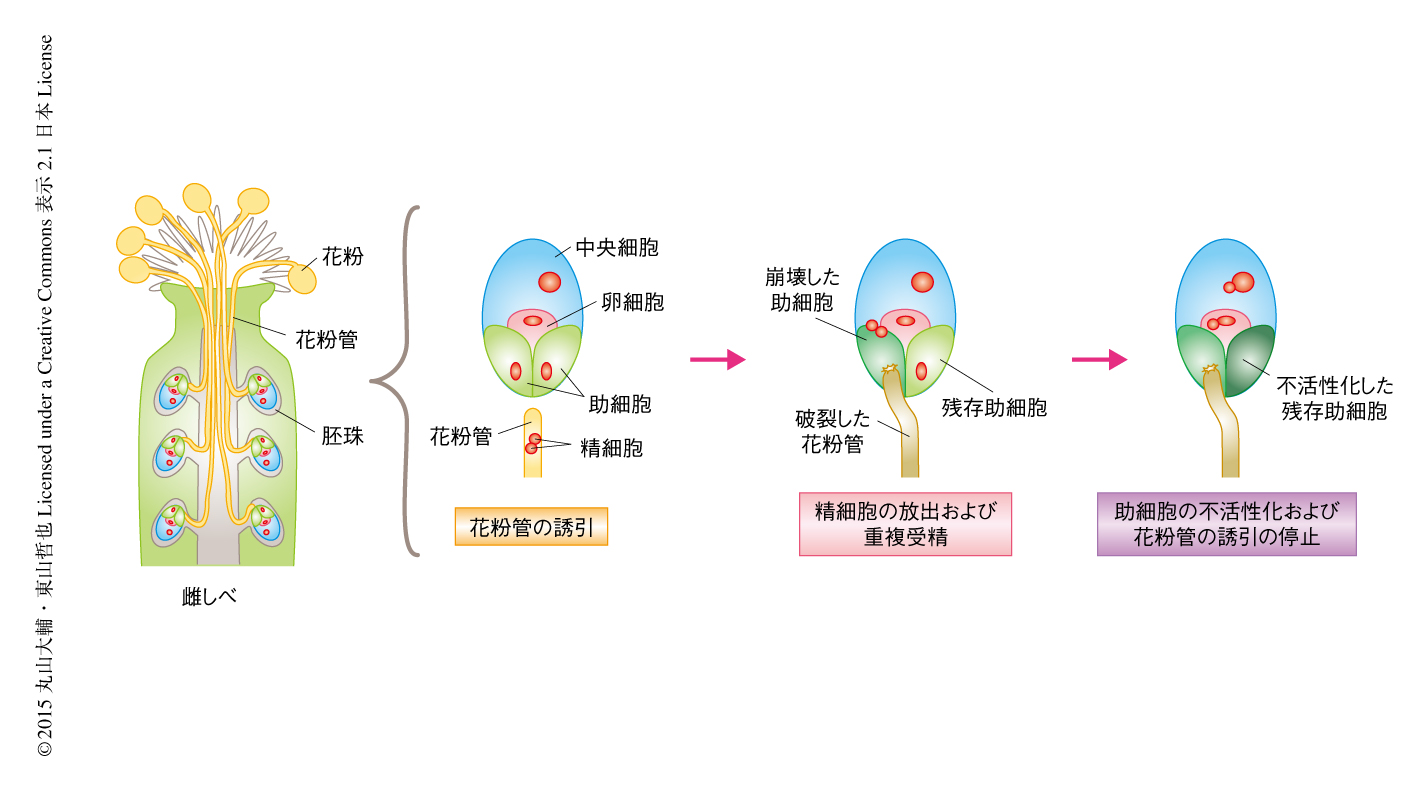
被子植物の精細胞は鞭毛などそれ自体を動かす構造をもたない代わり,活発に伸長する花粉管の先端に保持され,雌しべの先端の柱頭から卵細胞をもつ胚珠のならぶ雌しべの深部へと運ばれる.この過程は驚くほど精密に制御されており,シロイヌナズナでは約50個つくられる胚珠のすべてに1本ずつ花粉管が挿入されて受精が完了する1).花粉管と胚珠とを厳密に一対一で対応させる鍵は,卵細胞のとなりで花粉管誘引ペプチドを分泌する2つの助細胞の不活性化にある2,3).花粉管が胚珠に到達すると,2個1組の精細胞の放出とともに片方の助細胞が崩壊する.さらに,これら精細胞が雌性配偶子である卵細胞と中央細胞とを別々に受精させる重複受精が完了したのち,残された助細胞(残存助細胞)も不活性化される(図1).とりわけ,近年,残存助細胞は2本目の花粉管の接近をすばやくふせぐために重要な役割をはたしていることが示されたが2,3),残存助細胞の経時的な変化をくわしく調べた報告はこれまでになかった.
ただし,細胞学的な実体はブラックボックスのままでも,残存助細胞の不活性化に必要なシグナル伝達経路は少しずつ明らかにされてきた.たとえば,2013年,植物ホルモンであるエチレンのシグナル伝達経路が重複受精ののち活性化して残存助細胞における核の崩壊をひき起こすことが示された4).また,同じ年に筆者らは,卵細胞の受精と中央細胞の受精とが独立かつ協調的に胚珠が花粉管を誘引する活性の低下をひき起こすことをつきとめ,中央細胞のかかわる経路ではポリコーム抑制複合体FIS-PRC2が重要な役割をはたすことを示した5)(新着論文レビュー でも掲載).この論文では,シロイヌナズナの胚珠のライブイメージングにより残存助細胞が不活性化する過程を観察した.さらに,これらのシグナル伝達経路とのかかわりを調べることにより,残存助細胞の不活性化の分子機構の実体を明らかにした.
なお,植物における受精については,東山 哲也, 領域融合レビュー, 1, e007, 2012 も参照されたい.
受精ののちの残存助細胞の変化をとらえるため,受精ののちまもない胚珠をかき出して液体培地において観察する系を構築した.この系により助細胞において特異的にGFPを発現する形質転換植物6) を観察したところ,受精ののち2~3時間のある時点から残存助細胞のGFPの蛍光が急激に低下した.その一方で,受精ののち中央細胞に相当する胚乳においてGFPの蛍光の上昇がみられたことから,残存助細胞から胚乳へとGFPが移動していることが示唆された.そこで,胚乳の核やサイトゾルがGFPにより標識された形質転換植物7) を観察したところ,残存助細胞においてGFPの蛍光の上昇がみられた.したがって,受精ののちのある時点において,残存助細胞と胚乳とのあいだに孔が生じGFPなどのタンパク質が行き来できるようになることが示唆された.
助細胞においてミトコンドリアのシグナル配列を付加したGFPを特異的に発現する形質転換植物を観察したところ,残存助細胞から胚乳へとミトコンドリアが移動した.そのため,両者のあいだの孔は少なくともミトコンドリアより大きいことがわかった.透過型電子顕微鏡により解析したところ,残存助細胞と胚乳のあいだには5.9±2.8μmにわたり細胞壁および細胞膜のみられない領域が観察された.さらに,助細胞において発現させた細胞膜のアクアポリンも胚乳へと移動したことから,残存助細胞と胚乳とのあいだの細胞壁がなくなり細胞膜どうしが融合したことが示唆された.この新奇の細胞融合の現象を“助細胞胚乳融合”と名づけた.通常,植物の細胞は丈夫な細胞壁によりおおわれているため,細胞融合が起こるとは考えられていなかった.その例外として知られているのは,卵細胞の受精および中央細胞の受精であった.今回の現象は,1898年に報告された重複受精8) のほかに通常の植物の発生において示された細胞融合といえた.
胚珠の近傍にまで伸長した花粉管は助細胞から分泌される花粉管誘引ペプチドAtLURE1により誘引される9).助細胞胚乳融合が残存助細胞の機能の停止にどのような役割をはたすのかを調べるため,AtLURE1をGFPにより標識した形質転換植物の胚珠を観察した.すると,残存助細胞に蓄積していたAtLURE1は胚乳へと急激に移動することにより希釈された.実際に,AtLURE1に対する抗体を用いて免疫染色を行ったところ,ほぼすべての未受精の胚珠において検出されていた助細胞の先端におけるシグナルが,助細胞胚乳融合がほぼ完了する四胚乳核期にはみられなくなった.以上の結果から,助細胞胚乳融合が花粉管誘引ペプチドAtLURE1の分泌を乱すことにより花粉管の誘引は停止することが示唆された(図2).
これまでの研究においては,核の崩壊が残存助細胞の不活性化の指標として用いられていた2,4).この核の崩壊はヒストンH2Bと蛍光タンパク質tdTomatoとの融合タンパク質を構成的に発現する形質転換植物を用いて観察できる.核の崩壊だけでなく助細胞胚乳融合も同一の胚珠において解析する必要があると考え,この形質転換植物の雌しべに,ヒストンH2BとGFPとを融合させたタンパク質を発現する形質転換植物の花粉を授粉した.受精ののちすぐに胚乳において発現するGFP融合ヒストンH2Bは,父親に由来するゲノムをもたない残存助細胞では発現できない.したがって,残存助細胞の核における胚乳に由来するGFPの蛍光の上昇から細胞融合のタイミングを調べることができる.こうして58個の胚珠を解析したところ,残存助細胞における核の崩壊は助細胞胚乳融合よりもあとで起こることがわかった.さらに,胚乳において核が分裂をするのにあわせて,助細胞の核においては染色体の凝集や,場合により染色体分配のような挙動も観察された.このような結果から,同一のサイトゾルを共有するようになった残存助細胞の核と胚乳の核は互いの細胞周期がくいちがっており,胚乳の核の分裂にあわせ残存助細胞の核が分裂に失敗することにより選択的に崩壊することが示唆された.細胞周期のマーカーを発現する形質転換植物を用いた解析からも,この説を支持する結果が得られた.
以前に筆者らは,中央細胞や胚乳において特異的にはたらくポリコーム抑制複合体FIS-PRC2を欠損する変異体は2本目の花粉管を頻繁に誘引することを明らかにした5).しかし,FIS-PRC2を欠損する変異体の残存助細胞が示すと予想された不活性化の異常についてはくわしく調べられていなかった.そこで,FIS-PRC2を構成する4つのタンパク質のひとつMEDEAを欠損した変異体の雌しべに,GFP融合ヒストンH2Bを構成的に発現する形質転換植物の花粉を授粉した.その結果,medea変異体において細胞融合は正常に起こることがわかった.核への局在の有無を指標として核の機能の維持を調べるマーカーとして,胚乳において発現する転写因子AGL62をGFPにより可視化した形質転換植物の花粉を用いた.すると,野生株においては残存助細胞の核に蓄積したGFPの蛍光はすぐに消失したのに対し,medea変異体においては四胚乳核期に達したのちにもGFPの蛍光が観察された.したがって,FIS-PRC2は胚乳における核の分裂にともなう残存助細胞における核の崩壊に必要であることがわかった.FIS-PRC2を含むポリコーム抑制複合体はヒストンH3のLys27のメチル化をつうじて遺伝子の発現を抑制する.おそらく,FIS-PRC2の下流に残存助細胞における核の崩壊の鍵をにぎるタンパク質が存在するのだろう.
胚乳の核やサイトゾルがGFPにより標識された形質転換植物の授粉により,重複受精の有無により助細胞胚乳融合の頻度を比較したところ,重複受精に強く依存することが示された.そこで,精細胞の受精能が低下するkokopelli変異体の花粉を用いることにより10),野生株においてはほぼ同時に起こる卵細胞の受精と中央細胞の受精による影響を分けて解析した.すると,中央細胞のみ受精して卵細胞が未受精の胚珠では助細胞胚乳融合が観察されたが,逆に,卵細胞のみ受精して中央細胞が未受精の胚珠では助細胞胚乳融合はまったくみられなかった.したがって,助細胞胚乳融合は中央細胞の受精を必要とすることが示された(図2).
残存助細胞における核の崩壊を誘導するエチレンシグナルの活性化は卵細胞と中央細胞のどちらの受精を必要とするか調べため,エチレンシグナルのマーカーを発現する形質転換植物に精細胞の受精能が低下するkokopelli変異体の花粉を授粉した.すると,卵細胞と中央細胞いずれの単独の受精でもエチレンシグナルの活性化が示された.しかし,卵細胞の単独受精は中央細胞の単独受精よりも強い作用を示し,重複受精の起こった場合と同等の頻度でエチレンシグナルの活性化が示された.この結果から,エチレンシグナルの活性化をつうじた残存助細胞における核の崩壊は,おもに卵細胞の受精により制御されることが示唆された(図2).
2つの雌性配偶子である卵細胞と中央細胞の受精により制御される3段階の残存助細胞の不活性化の分子機構を提唱した(図2).まず,助細胞胚乳融合により残存助細胞の内容物が胚乳へと流入して花粉管誘引ペプチドAtLURE1の供給が乱れることで,花粉管の誘引に必要なAtLURE1の濃度勾配が失われる.つぎに,卵細胞の受精により強く活性化されるエチレンシグナルにより残存助細胞の核は崩壊しやすくなる.最後に,ポリコーム抑制複合体FIS-PRC2のかかわる胚乳における核の分裂にともなうシグナル伝達により残存助細胞の核の選択的な崩壊が起こることで,助細胞のアイデンティティは完全に失われる.
シロイヌナズナの胚珠は,受精が失敗した場合には2本目の花粉管を誘引することにより受精の回復を試み,受精が成功した場合には多精をふせぐため花粉管の誘引をすみやかに停止する3,5).卵細胞と中央細胞のおのおのが2本目の花粉管の誘引に対する決定権を行使できるよう進化した結果,残存助細胞の不活性化の複雑なしくみができたのであろう.今後,エチレンシグナル伝達経路とFIS-PRC2シグナル伝達経路の相互作用を探ることにより重複受精の新たな側面がみえてくるかもしれない.
助細胞胚乳融合の発見は細胞生物学に新しい視点をもたらすと期待される.これまでプログラム細胞死といえば,死ぬべき細胞それ自体が自殺のプログラムを実行するものであった.しかし,助細胞胚乳融合は細胞融合の相手を積極的に不活性化するという意味で新しいタイプの細胞死を提示した.また,受精のほかにも細胞融合の存在が示されたことから,植物においては細胞壁の制御も含め細胞融合の意義それ自体がみなおされるだろう.これにより,別の生物種や組織においてみすごされてきた植物の細胞融合が発見されはじめるのではないだろうか.
略歴:2010年 名古屋大学大学院理学研究科 修了,同年 同 研究員を経て,2014年より同 特任助教.
東山 哲也(Tetsuya Higashiyama)
名古屋大学トランスフォーマティブ生命分子研究所 教授.科学技術振興機構ERATO東山ライブホロニクスプロジェクト 研究総括 兼任.
研究室URL:http://www.higashiyama-lab.com
© 2015 丸山大輔・東山哲也 Licensed under CC 表示 2.1 日本
(名古屋大学トランスフォーマティブ生命分子研究所)
email:丸山大輔
DOI: 10.7875/first.author.2015.051
Rapid elimination of the persistent synergid through a cell fusion mechanism.
Daisuke Maruyama, Ronny Völz, Hidenori Takeuchi, Toshiyuki Mori, Tomoko Igawa, Daisuke Kurihara, Tomokazu Kawashima, Minako Ueda, Masaki Ito, Masaaki Umeda, Shuh-ichi Nishikawa, Rita Groß-Hardt, Tetsuya Higashiyama
Cell, 161, 907-918 (2015)
要 約
種子のもとになる胚珠は受精ののちすぐに花粉管の誘引を停止する.被子植物において雄と雌とが一対一で結びつくことを保証するこのしくみは残存助細胞の排除により制御されている.筆者らは,シロイヌナズナの残存助細胞は胚乳と細胞融合することにより選択的に不活性化されることを明らかにした.残存助細胞では細胞融合につづいて,花粉管誘引ペプチドの急激な希釈と,胚乳における核の分裂にともなう核の選択的な崩壊が観察された.このようなすばやい残存助細胞の不活性化は花粉管の余分な誘引をふせいでいると考えられた.助細胞と胚乳との細胞融合は中央細胞の受精により誘導される一方で,卵細胞の受精は助細胞における核の崩壊をうながすエチレンシグナルの活性化を強く誘導した.したがって,残存助細胞の排除を協調的に制御する卵細胞の受精と中央細胞の受精に依存した経路の実体が明らかにされた.
はじめに
被子植物の精細胞は鞭毛などそれ自体を動かす構造をもたない代わり,活発に伸長する花粉管の先端に保持され,雌しべの先端の柱頭から卵細胞をもつ胚珠のならぶ雌しべの深部へと運ばれる.この過程は驚くほど精密に制御されており,シロイヌナズナでは約50個つくられる胚珠のすべてに1本ずつ花粉管が挿入されて受精が完了する1).花粉管と胚珠とを厳密に一対一で対応させる鍵は,卵細胞のとなりで花粉管誘引ペプチドを分泌する2つの助細胞の不活性化にある2,3).花粉管が胚珠に到達すると,2個1組の精細胞の放出とともに片方の助細胞が崩壊する.さらに,これら精細胞が雌性配偶子である卵細胞と中央細胞とを別々に受精させる重複受精が完了したのち,残された助細胞(残存助細胞)も不活性化される(図1).とりわけ,近年,残存助細胞は2本目の花粉管の接近をすばやくふせぐために重要な役割をはたしていることが示されたが2,3),残存助細胞の経時的な変化をくわしく調べた報告はこれまでになかった.
ただし,細胞学的な実体はブラックボックスのままでも,残存助細胞の不活性化に必要なシグナル伝達経路は少しずつ明らかにされてきた.たとえば,2013年,植物ホルモンであるエチレンのシグナル伝達経路が重複受精ののち活性化して残存助細胞における核の崩壊をひき起こすことが示された4).また,同じ年に筆者らは,卵細胞の受精と中央細胞の受精とが独立かつ協調的に胚珠が花粉管を誘引する活性の低下をひき起こすことをつきとめ,中央細胞のかかわる経路ではポリコーム抑制複合体FIS-PRC2が重要な役割をはたすことを示した5)(新着論文レビュー でも掲載).この論文では,シロイヌナズナの胚珠のライブイメージングにより残存助細胞が不活性化する過程を観察した.さらに,これらのシグナル伝達経路とのかかわりを調べることにより,残存助細胞の不活性化の分子機構の実体を明らかにした.
なお,植物における受精については,東山 哲也, 領域融合レビュー, 1, e007, 2012 も参照されたい.
1.受精ののち残存助細胞と胚乳の内容物は互いに入り混じる
受精ののちの残存助細胞の変化をとらえるため,受精ののちまもない胚珠をかき出して液体培地において観察する系を構築した.この系により助細胞において特異的にGFPを発現する形質転換植物6) を観察したところ,受精ののち2~3時間のある時点から残存助細胞のGFPの蛍光が急激に低下した.その一方で,受精ののち中央細胞に相当する胚乳においてGFPの蛍光の上昇がみられたことから,残存助細胞から胚乳へとGFPが移動していることが示唆された.そこで,胚乳の核やサイトゾルがGFPにより標識された形質転換植物7) を観察したところ,残存助細胞においてGFPの蛍光の上昇がみられた.したがって,受精ののちのある時点において,残存助細胞と胚乳とのあいだに孔が生じGFPなどのタンパク質が行き来できるようになることが示唆された.
2.残存助細胞と胚乳とは細胞融合する
助細胞においてミトコンドリアのシグナル配列を付加したGFPを特異的に発現する形質転換植物を観察したところ,残存助細胞から胚乳へとミトコンドリアが移動した.そのため,両者のあいだの孔は少なくともミトコンドリアより大きいことがわかった.透過型電子顕微鏡により解析したところ,残存助細胞と胚乳のあいだには5.9±2.8μmにわたり細胞壁および細胞膜のみられない領域が観察された.さらに,助細胞において発現させた細胞膜のアクアポリンも胚乳へと移動したことから,残存助細胞と胚乳とのあいだの細胞壁がなくなり細胞膜どうしが融合したことが示唆された.この新奇の細胞融合の現象を“助細胞胚乳融合”と名づけた.通常,植物の細胞は丈夫な細胞壁によりおおわれているため,細胞融合が起こるとは考えられていなかった.その例外として知られているのは,卵細胞の受精および中央細胞の受精であった.今回の現象は,1898年に報告された重複受精8) のほかに通常の植物の発生において示された細胞融合といえた.
3.助細胞胚乳融合が花粉管誘引ペプチドの供給を乱す
胚珠の近傍にまで伸長した花粉管は助細胞から分泌される花粉管誘引ペプチドAtLURE1により誘引される9).助細胞胚乳融合が残存助細胞の機能の停止にどのような役割をはたすのかを調べるため,AtLURE1をGFPにより標識した形質転換植物の胚珠を観察した.すると,残存助細胞に蓄積していたAtLURE1は胚乳へと急激に移動することにより希釈された.実際に,AtLURE1に対する抗体を用いて免疫染色を行ったところ,ほぼすべての未受精の胚珠において検出されていた助細胞の先端におけるシグナルが,助細胞胚乳融合がほぼ完了する四胚乳核期にはみられなくなった.以上の結果から,助細胞胚乳融合が花粉管誘引ペプチドAtLURE1の分泌を乱すことにより花粉管の誘引は停止することが示唆された(図2).
4.助細胞胚乳融合ののち助細胞の核は選択的に崩壊する
これまでの研究においては,核の崩壊が残存助細胞の不活性化の指標として用いられていた2,4).この核の崩壊はヒストンH2Bと蛍光タンパク質tdTomatoとの融合タンパク質を構成的に発現する形質転換植物を用いて観察できる.核の崩壊だけでなく助細胞胚乳融合も同一の胚珠において解析する必要があると考え,この形質転換植物の雌しべに,ヒストンH2BとGFPとを融合させたタンパク質を発現する形質転換植物の花粉を授粉した.受精ののちすぐに胚乳において発現するGFP融合ヒストンH2Bは,父親に由来するゲノムをもたない残存助細胞では発現できない.したがって,残存助細胞の核における胚乳に由来するGFPの蛍光の上昇から細胞融合のタイミングを調べることができる.こうして58個の胚珠を解析したところ,残存助細胞における核の崩壊は助細胞胚乳融合よりもあとで起こることがわかった.さらに,胚乳において核が分裂をするのにあわせて,助細胞の核においては染色体の凝集や,場合により染色体分配のような挙動も観察された.このような結果から,同一のサイトゾルを共有するようになった残存助細胞の核と胚乳の核は互いの細胞周期がくいちがっており,胚乳の核の分裂にあわせ残存助細胞の核が分裂に失敗することにより選択的に崩壊することが示唆された.細胞周期のマーカーを発現する形質転換植物を用いた解析からも,この説を支持する結果が得られた.
5.ポリコーム抑制複合体FIS-PRC2は残存助細胞における核の崩壊において重要な役割をはたす
以前に筆者らは,中央細胞や胚乳において特異的にはたらくポリコーム抑制複合体FIS-PRC2を欠損する変異体は2本目の花粉管を頻繁に誘引することを明らかにした5).しかし,FIS-PRC2を欠損する変異体の残存助細胞が示すと予想された不活性化の異常についてはくわしく調べられていなかった.そこで,FIS-PRC2を構成する4つのタンパク質のひとつMEDEAを欠損した変異体の雌しべに,GFP融合ヒストンH2Bを構成的に発現する形質転換植物の花粉を授粉した.その結果,medea変異体において細胞融合は正常に起こることがわかった.核への局在の有無を指標として核の機能の維持を調べるマーカーとして,胚乳において発現する転写因子AGL62をGFPにより可視化した形質転換植物の花粉を用いた.すると,野生株においては残存助細胞の核に蓄積したGFPの蛍光はすぐに消失したのに対し,medea変異体においては四胚乳核期に達したのちにもGFPの蛍光が観察された.したがって,FIS-PRC2は胚乳における核の分裂にともなう残存助細胞における核の崩壊に必要であることがわかった.FIS-PRC2を含むポリコーム抑制複合体はヒストンH3のLys27のメチル化をつうじて遺伝子の発現を抑制する.おそらく,FIS-PRC2の下流に残存助細胞における核の崩壊の鍵をにぎるタンパク質が存在するのだろう.
6.助細胞胚乳融合は中央細胞の受精により誘導される
胚乳の核やサイトゾルがGFPにより標識された形質転換植物の授粉により,重複受精の有無により助細胞胚乳融合の頻度を比較したところ,重複受精に強く依存することが示された.そこで,精細胞の受精能が低下するkokopelli変異体の花粉を用いることにより10),野生株においてはほぼ同時に起こる卵細胞の受精と中央細胞の受精による影響を分けて解析した.すると,中央細胞のみ受精して卵細胞が未受精の胚珠では助細胞胚乳融合が観察されたが,逆に,卵細胞のみ受精して中央細胞が未受精の胚珠では助細胞胚乳融合はまったくみられなかった.したがって,助細胞胚乳融合は中央細胞の受精を必要とすることが示された(図2).
7.卵細胞の受精はエチレンシグナルの活性化を誘導する
残存助細胞における核の崩壊を誘導するエチレンシグナルの活性化は卵細胞と中央細胞のどちらの受精を必要とするか調べため,エチレンシグナルのマーカーを発現する形質転換植物に精細胞の受精能が低下するkokopelli変異体の花粉を授粉した.すると,卵細胞と中央細胞いずれの単独の受精でもエチレンシグナルの活性化が示された.しかし,卵細胞の単独受精は中央細胞の単独受精よりも強い作用を示し,重複受精の起こった場合と同等の頻度でエチレンシグナルの活性化が示された.この結果から,エチレンシグナルの活性化をつうじた残存助細胞における核の崩壊は,おもに卵細胞の受精により制御されることが示唆された(図2).
8.花粉管の誘引を停止する分子機構
2つの雌性配偶子である卵細胞と中央細胞の受精により制御される3段階の残存助細胞の不活性化の分子機構を提唱した(図2).まず,助細胞胚乳融合により残存助細胞の内容物が胚乳へと流入して花粉管誘引ペプチドAtLURE1の供給が乱れることで,花粉管の誘引に必要なAtLURE1の濃度勾配が失われる.つぎに,卵細胞の受精により強く活性化されるエチレンシグナルにより残存助細胞の核は崩壊しやすくなる.最後に,ポリコーム抑制複合体FIS-PRC2のかかわる胚乳における核の分裂にともなうシグナル伝達により残存助細胞の核の選択的な崩壊が起こることで,助細胞のアイデンティティは完全に失われる.
おわりに
シロイヌナズナの胚珠は,受精が失敗した場合には2本目の花粉管を誘引することにより受精の回復を試み,受精が成功した場合には多精をふせぐため花粉管の誘引をすみやかに停止する3,5).卵細胞と中央細胞のおのおのが2本目の花粉管の誘引に対する決定権を行使できるよう進化した結果,残存助細胞の不活性化の複雑なしくみができたのであろう.今後,エチレンシグナル伝達経路とFIS-PRC2シグナル伝達経路の相互作用を探ることにより重複受精の新たな側面がみえてくるかもしれない.
助細胞胚乳融合の発見は細胞生物学に新しい視点をもたらすと期待される.これまでプログラム細胞死といえば,死ぬべき細胞それ自体が自殺のプログラムを実行するものであった.しかし,助細胞胚乳融合は細胞融合の相手を積極的に不活性化するという意味で新しいタイプの細胞死を提示した.また,受精のほかにも細胞融合の存在が示されたことから,植物においては細胞壁の制御も含め細胞融合の意義それ自体がみなおされるだろう.これにより,別の生物種や組織においてみすごされてきた植物の細胞融合が発見されはじめるのではないだろうか.
文 献
- Yadegari, R. & Drews, G. N.: Female gametophyte development. Plant Cell, 16, S133-S141 (2004)[PubMed]
- Beale, K. M., Leydon, A. R. & Johnson, M. A.: Gamete fusion is required to block multiple pollen tubes from entering an Arabidopsis ovule. Curr. Biol., 22, 1090-1094 (2012)[PubMed]
- Kasahara, R. D., Maruyama, D., Hamamura, Y. et al.: Fertilization recovery after defective sperm cell release in Arabidopsis. Curr. Biol., 22, 1084-1089 (2012)[PubMed]
- Volz, R., Heydlauff, J., Ripper, D. et al.: Ethylene signaling is required for synergid degeneration and the establishment of a pollen tube block. Dev. Cell, 25, 310-316 (2013)[PubMed]
- Maruyama, D., Takeuchi, H., Susaki, D. et al.: Independent control by each female gamete prevents the attraction of multiple pollen tubes. Dev. Cell, 25, 317-323 (2013)[PubMed] [新着論文レビュー]
- Kasahara, R. D., Portereiko, M. F., Sandaklie-Nikolova, L. et al.: MYB98 is required for pollen tube guidance and synergid cell differentiation in Arabidopsis. Plant Cell, 17, 2981-2992 (2005)[PubMed]
- Kinoshita, T., Miura, A., Choi, Y. et al.: One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science, 303, 521-523 (2004)[PubMed]
- Nawashin, S. G.: Resultate einer Revision der Befruchtungsvorgange bei Lilium martagon und Fritillaria tenella. Bull. Acad. Imp. Sci. St. Petersburg, 9, 377-382 (1898)
- Takeuchi, H. & Higashiyama, T.: A species-specific cluster of defensin-like genes encodes diffusible pollen tube attractants in Arabidopsis. PLoS Biol., 10, e1001449 (2012)[PubMed]
- Ron, M., Saez, M. A., Williams, L. E. et al.: Proper regulation of a sperm-specific cis-nat-siRNA is essential for double fertilization in Arabidopsis. Genes Dev., 24, 1010-1021 (2010)[PubMed]
著者プロフィール
略歴:2010年 名古屋大学大学院理学研究科 修了,同年 同 研究員を経て,2014年より同 特任助教.
東山 哲也(Tetsuya Higashiyama)
名古屋大学トランスフォーマティブ生命分子研究所 教授.科学技術振興機構ERATO東山ライブホロニクスプロジェクト 研究総括 兼任.
研究室URL:http://www.higashiyama-lab.com
© 2015 丸山大輔・東山哲也 Licensed under CC 表示 2.1 日本