ヒトのアディポネクチン受容体の結晶構造
田辺弘明1・横山茂之1・山内敏正2・門脇 孝2
(1理化学研究所 横山構造生物学研究室,2東京大学大学院医学系研究科 代謝・栄養病態学)
email:田辺弘明,横山茂之,山内敏正,門脇 孝
DOI: 10.7875/first.author.2015.048
Crystal structures of the human adiponectin receptors.
Hiroaki Tanabe, Yoshifumi Fujii, Miki Okada-Iwabu, Masato Iwabu, Yoshihiro Nakamura, Toshiaki Hosaka, Kanna Motoyama, Mariko Ikeda, Motoaki Wakiyama, Takaho Terada, Noboru Ohsawa, Masakatsu Hato, Satoshi Ogasawara, Tomoya Hino, Takeshi Murata, So Iwata, Kunio Hirata, Yoshiaki Kawano, Masaki Yamamoto, Tomomi Kimura-Someya, Mikako Shirouzu, Toshimasa Yamauchi, Takashi Kadowaki, Shigeyuki Yokoyama
Nature, 520, 312-316 (2015)
アディポネクチン受容体AdipoR1およびAdipoR2は,脂肪細胞から分泌されるアディポネクチンにより活性化されると細胞において糖および脂質の代謝を促進する.アディポネクチン受容体は7回膜貫通型の膜タンパク質であるが,Gタンパク質共役受容体とは逆の配向性をもつことが予想されていた.今回,筆者らは,ヒトのAdipoR1およびAdipoR2の結晶構造をそれぞれ分解能2.9Åおよび分解能2.4Åで決定した.アディポネクチン受容体の7つの膜貫通ヘリックスはGタンパク質共役受容体のものとは構造的に異なり,さらに,それらの内側に空洞を形成し,なかにZn2+を配位するという,まったく新規の構造であった.また,アディポネクチン受容体は細胞の外側の広い表面にてアディポネクチンと相互作用している可能性があった.今回の結果は,アディポネクチン受容体にかかわるシグナル伝達の解明につながるとともに,2型糖尿病のような肥満に関連した疾患の治療薬の開発および最適化を加速すると期待される.
近年,世界規模での肥満の増加とともに,肥満によりひき起こされるメタボリックシンドロームや糖尿病の患者が増加しており,その対策が急務となっている.2003年に同定されたアディポネクチン受容体AdipoR1およびAdipoR2は,糖および脂質の代謝にかかわる膜タンパク質で,そのホモログは植物からヒトまで保存されている1).AdipoR1は骨格筋に,AdipoR2は肝臓に高く発現している.脂肪細胞から分泌されたアディポネクチンにより活性化されたAdipoR1およびAdipoR2は,それぞれ,AMPキナーゼおよびPPARを活性化し,糖および脂質の代謝を促進することにより抗糖尿病作用を発揮する2,3).アディポネクチン受容体の活性化の機構を解明することは,メタボリックシンドロームや糖尿病の治療法の改善,治療薬の開発につながると考えられている.2013年には,アディポネクチン受容体を活性化する低分子化合物が発見され,今後の創薬に大きな期待がよせられている4)(新着論文レビュー でも掲載).
アディポネクチン受容体は7回膜貫通型の膜タンパク質であると予想されていたが,N末端が細胞内,C末端が細胞外と,7回膜貫通型の膜タンパク質として広く知られるGタンパク質共役受容体とは細胞膜への配向性が逆だと推測されていた.Gタンパク質共役受容体はその下流のタンパク質である三量体型Gタンパク質との複合体の構造解析により,その活性化の機構が明らかにされつつある5).一方で,アディポネクチン受容体の構造は未知であった.今回,筆者らは,X線結晶構造解析によりアディポネクチン受容体の立体構造を明らかにし,その構造から機能の解明を試みた.
アディポネクチン受容体の発現系および精製法を構築した6).全長のアディポネクチン受容体は性状が悪く結晶化には不向きであったが,N末端側の配列の最適化により性状のよい変異体を見い出し結晶化に用いた.それらの変異体は野生型のアディポネクチン受容体と同等の活性を保持していることが確認された.既知の方法7) によりアディポネクチン受容体の構造を認識する抗体を作製し,アディポネクチン受容体と抗体の断片との複合体を脂質メソフェーズ法8) により結晶化した.得られた結晶からAdipoR1およびAdipoR2の結晶構造をそれぞれ分解能2.9Åおよび分解能2.4Åで決定した(図1,PDB ID:3WXV,3WXW).
AdipoR1およびAdipoR2はN末端側細胞内領域,1本の短い細胞内ヘリックス,7本の膜貫通ヘリックス,C末端側細胞外領域から構成されていた.結晶化に用いた抗体の断片はN末端側細胞内領域を認識していた.また,細胞外第3ループおよび細胞内第3ループにそれぞれ短いヘリックスが存在した.細胞内ヘリックスは膜貫通ヘリックスI~膜貫通ヘリックスIIIの細胞の内側の末端,および,細胞内第1ループと疎水性の相互作用をしていた.7本の膜貫通ヘリックスは細胞の外からみると束になり反時計回りに配置していた(図1).AdipoR1とAdipoR2の構造は非常によく似ていた.
アディポネクチン受容体と立体構造の類似性の高いタンパク質を検索したが,タンパク質立体構造データベースにはそのようなタンパク質は登録されていなかった.C末端が細胞外にあるアディポネクチン受容体の7回膜貫通ドメインは,細菌型ロドプシンやGタンパク質共役受容体のようなN末端が細胞内にある従来型の7回膜貫通ドメインとは細胞膜に対し逆の配向性をもっていたことにくわえ,アディポネクチン受容体にはGタンパク質共役受容体の特徴的な構造であるProに誘引されたヘリックスの折れ曲がりが存在しなかった.アディポネクチン受容体にはヘリックスの折れ曲がりはないものの,膜貫通ヘリックスVに存在する3つのGlyによる湾曲がみられた.
以上のことから,アディポネクチン受容体AdipoR1およびAdipoR2の構造は新規であると結論づけられた.
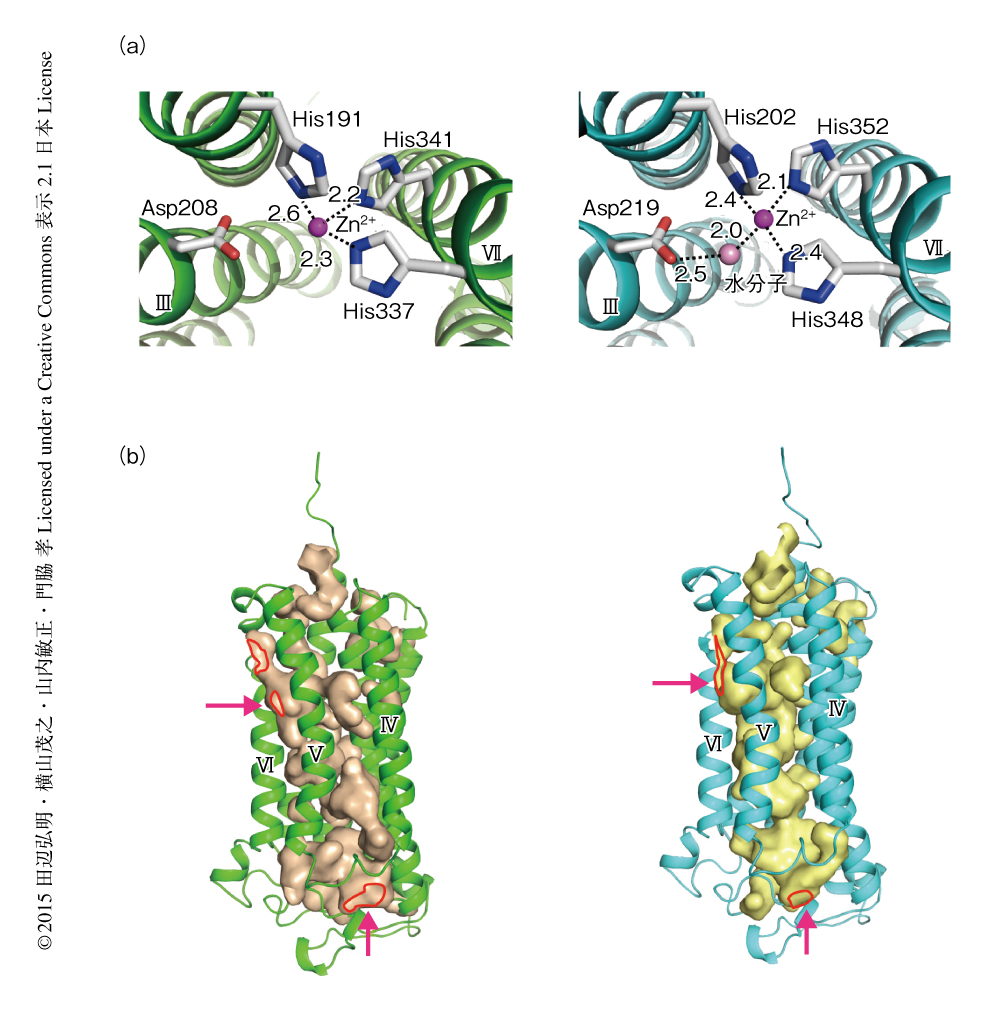
AdipoR1およびAdipoR2の7回膜貫通ドメインに1つのZn2+の存在を見い出した.Zn2+結合部位は細胞の内側の細胞膜からおよそ4Åの距離に位置した.Zn2+は3つのHisと2.1~2.6Åの距離で配位していた(図2a).さらに,AdipoR2においては,Zn2+とAspの側鎖カルボキシル基とのあいだに1つの水分子が存在した.Zn2+は膜貫通ヘリックスII,膜貫通ヘリックスIII,膜貫通ヘリックスVIIを固定し,疎水性の相互作用をしている膜貫通ヘリックスIとあわせ,膜貫通ヘリックスI,膜貫通ヘリックスII,膜貫通ヘリックスIII,膜貫通ヘリックスVIIから構成されるサブドメインの構造を安定化している可能性があった.これら3つのHisおよびAspはアディポネクチン受容体のホモログに保存されていた.
これらのZn2+の配位にかかわるアミノ酸残基をAlaに置換して活性との相関について解析した.AdipoR1において,3つのHisの三重変異体,および,3つのHisおよびAspの四重変異体はアディポネクチンで刺激したときのAMPキナーゼの活性化を低下させたが,単一のアミノ酸残基の変異体は活性を維持していた.このことから,AdipoR1において,Zn2+との結合はAMPキナーゼの活性化に直接的には必要なく,構造の維持に効果のあることが示唆された.
対照的に,AdipoR2においては,アディポネクチンで刺激したときのUCP2遺伝子のmRNAの発現の量は,AspあるいはHis348の単一の変異体において低下し,3つのHisの三重変異体や3つのHisおよびAspの四重変異体においてはほぼ完全に消失していた.このことから,AdipoR2において,Zn2+との結合は構造の維持にくわえシグナル伝達にも影響していることが示唆された.AdipoR2がZn2+に依存的な加水分解活性を保持するというのは魅力的な仮説である.アディポネクチンで刺激されたAdipoR2による脂肪の加水分解により遊離脂肪酸の生じる可能性があり,生じた遊離脂肪酸がPPARαの活性を上昇させ,UCP2遺伝子のようなターゲット遺伝子の発現を亢進するのかもしれない.3つのHisおよびAspはアルカリセラミダーゼの膜貫通ドメインにおいても保存されているが,アルカリセラミダーゼはいまだ構造が解かれていないこともあり,アディポネクチン受容体がセラミダーゼ活性をもつかどうかは判断ができない.
AdipoR1およびAdipoR2の膜貫通ドメインにZn2+結合部位を含む空洞を見い出した(図2b).この空洞は2つのサブドメインより形成されており,膜貫通ヘリックスIVと膜貫通ヘリックスVIのあいだの細胞の内側から,膜貫通ヘリックスVと膜貫通ヘリックスVIのあいだの細胞膜の外側の脂質の真ん中へと伸びていた.また,空洞には未同定の分子の電子密度が存在した.この電子密度は,アディポネクチン受容体が加水分解活性をもつとするならばその基質あるいは生成物に相当するのかもしれない.
アディポネクチン受容体の細胞の外側の表面は3つの細胞外ループとC末端側細胞外領域から構成されていた.膜貫通ヘリックスVIIは細胞膜から2ターンほど突き出ていた.膜貫通ヘリックスVIIのあとのC末端側の領域は柔軟性が高く,特定の構造をとっていないと推測された.
以前に,酵母ツーハイブリッド実験から,アディポネクチンはアディポネクチン受容体のC末端側細胞外領域と相互作用することが示されていた9).C末端側を膜貫通ヘリックスVIIのあとのC末端側の領域まで欠損させたAdipoR1の変異体においては,アディポネクチンで刺激したときのAMPキナーゼの活性化に変化はなかった.しかし,膜貫通ヘリックスVIIの2残基を含め欠損させたところ,AMPキナーゼの活性化は低下した.このことから,膜貫通ヘリックスVIIのC末端側の突き出たターンの部分はアディポネクチンのシグナル伝達にかかわることが示唆された.
さらに,AdipoR1およびAdipoR2において保存されている細胞外ループのアミノ酸残基をGlyあるいはSerと置換して活性を測定した.その結果,3つの細胞外ループのすべてについて置換を導入し,かつ,C末端側を膜貫通ヘリックスVIIの2残基まで欠損させたAdipoR1の変異体は,アディポネクチンで刺激したときのAMPキナーゼの活性化がいちじるしく低下していた.一方,細胞外ループの1つ,2つ,3つについて置換を導入したAdipoR1の変異体では,AMPキナーゼの活性化の低下は小さかった.これらのことから,AdipoR1は3つの細胞外ループおよび膜貫通ヘリックスVIIのC末端側を含む細胞の外側の広い表面にて,アディポネクチンと相互作用している可能性が示唆された.
以上の結果から,アディポネクチン受容体AdipoR1およびAdipoR2は,Gタンパク質共役受容体とはまったく異なる構造および機能をもつことが示された.このことから,アディポネクチン受容体は新しいクラスの受容体として位置づけられた.今回,得られた結晶構造の情報が,アディポネクチン受容体の作動薬の開発および最適化を加速することが期待される.また,植物からヒトまで保存されているアディポネクチン受容体のホモログについても,そのシグナル伝達経路の役割や分子機構の理解の一端になれば幸いである.
略歴:理化学研究所ライフサイエンス技術基盤研究センター リサーチアソシエイト.
研究テーマ:膜タンパク質の構造解析.
関心事:細胞の外から細胞の内部へのシグナル伝達.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
山内 敏正(Toshimasa Yamauchi)
東京大学大学院医学系研究科 准教授.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
研究室URL:http://dm301k.umin.jp/
© 2015 田辺弘明・横山茂之・山内敏正・門脇 孝 Licensed under CC 表示 2.1 日本
(1理化学研究所 横山構造生物学研究室,2東京大学大学院医学系研究科 代謝・栄養病態学)
email:田辺弘明,横山茂之,山内敏正,門脇 孝
DOI: 10.7875/first.author.2015.048
Crystal structures of the human adiponectin receptors.
Hiroaki Tanabe, Yoshifumi Fujii, Miki Okada-Iwabu, Masato Iwabu, Yoshihiro Nakamura, Toshiaki Hosaka, Kanna Motoyama, Mariko Ikeda, Motoaki Wakiyama, Takaho Terada, Noboru Ohsawa, Masakatsu Hato, Satoshi Ogasawara, Tomoya Hino, Takeshi Murata, So Iwata, Kunio Hirata, Yoshiaki Kawano, Masaki Yamamoto, Tomomi Kimura-Someya, Mikako Shirouzu, Toshimasa Yamauchi, Takashi Kadowaki, Shigeyuki Yokoyama
Nature, 520, 312-316 (2015)
要 約
アディポネクチン受容体AdipoR1およびAdipoR2は,脂肪細胞から分泌されるアディポネクチンにより活性化されると細胞において糖および脂質の代謝を促進する.アディポネクチン受容体は7回膜貫通型の膜タンパク質であるが,Gタンパク質共役受容体とは逆の配向性をもつことが予想されていた.今回,筆者らは,ヒトのAdipoR1およびAdipoR2の結晶構造をそれぞれ分解能2.9Åおよび分解能2.4Åで決定した.アディポネクチン受容体の7つの膜貫通ヘリックスはGタンパク質共役受容体のものとは構造的に異なり,さらに,それらの内側に空洞を形成し,なかにZn2+を配位するという,まったく新規の構造であった.また,アディポネクチン受容体は細胞の外側の広い表面にてアディポネクチンと相互作用している可能性があった.今回の結果は,アディポネクチン受容体にかかわるシグナル伝達の解明につながるとともに,2型糖尿病のような肥満に関連した疾患の治療薬の開発および最適化を加速すると期待される.
はじめに
近年,世界規模での肥満の増加とともに,肥満によりひき起こされるメタボリックシンドロームや糖尿病の患者が増加しており,その対策が急務となっている.2003年に同定されたアディポネクチン受容体AdipoR1およびAdipoR2は,糖および脂質の代謝にかかわる膜タンパク質で,そのホモログは植物からヒトまで保存されている1).AdipoR1は骨格筋に,AdipoR2は肝臓に高く発現している.脂肪細胞から分泌されたアディポネクチンにより活性化されたAdipoR1およびAdipoR2は,それぞれ,AMPキナーゼおよびPPARを活性化し,糖および脂質の代謝を促進することにより抗糖尿病作用を発揮する2,3).アディポネクチン受容体の活性化の機構を解明することは,メタボリックシンドロームや糖尿病の治療法の改善,治療薬の開発につながると考えられている.2013年には,アディポネクチン受容体を活性化する低分子化合物が発見され,今後の創薬に大きな期待がよせられている4)(新着論文レビュー でも掲載).
アディポネクチン受容体は7回膜貫通型の膜タンパク質であると予想されていたが,N末端が細胞内,C末端が細胞外と,7回膜貫通型の膜タンパク質として広く知られるGタンパク質共役受容体とは細胞膜への配向性が逆だと推測されていた.Gタンパク質共役受容体はその下流のタンパク質である三量体型Gタンパク質との複合体の構造解析により,その活性化の機構が明らかにされつつある5).一方で,アディポネクチン受容体の構造は未知であった.今回,筆者らは,X線結晶構造解析によりアディポネクチン受容体の立体構造を明らかにし,その構造から機能の解明を試みた.
1.アディポネクチン受容体の精製および結晶化
アディポネクチン受容体の発現系および精製法を構築した6).全長のアディポネクチン受容体は性状が悪く結晶化には不向きであったが,N末端側の配列の最適化により性状のよい変異体を見い出し結晶化に用いた.それらの変異体は野生型のアディポネクチン受容体と同等の活性を保持していることが確認された.既知の方法7) によりアディポネクチン受容体の構造を認識する抗体を作製し,アディポネクチン受容体と抗体の断片との複合体を脂質メソフェーズ法8) により結晶化した.得られた結晶からAdipoR1およびAdipoR2の結晶構造をそれぞれ分解能2.9Åおよび分解能2.4Åで決定した(図1,PDB ID:3WXV,3WXW).
2.アディポネクチン受容体の構造解析
AdipoR1およびAdipoR2はN末端側細胞内領域,1本の短い細胞内ヘリックス,7本の膜貫通ヘリックス,C末端側細胞外領域から構成されていた.結晶化に用いた抗体の断片はN末端側細胞内領域を認識していた.また,細胞外第3ループおよび細胞内第3ループにそれぞれ短いヘリックスが存在した.細胞内ヘリックスは膜貫通ヘリックスI~膜貫通ヘリックスIIIの細胞の内側の末端,および,細胞内第1ループと疎水性の相互作用をしていた.7本の膜貫通ヘリックスは細胞の外からみると束になり反時計回りに配置していた(図1).AdipoR1とAdipoR2の構造は非常によく似ていた.
アディポネクチン受容体と立体構造の類似性の高いタンパク質を検索したが,タンパク質立体構造データベースにはそのようなタンパク質は登録されていなかった.C末端が細胞外にあるアディポネクチン受容体の7回膜貫通ドメインは,細菌型ロドプシンやGタンパク質共役受容体のようなN末端が細胞内にある従来型の7回膜貫通ドメインとは細胞膜に対し逆の配向性をもっていたことにくわえ,アディポネクチン受容体にはGタンパク質共役受容体の特徴的な構造であるProに誘引されたヘリックスの折れ曲がりが存在しなかった.アディポネクチン受容体にはヘリックスの折れ曲がりはないものの,膜貫通ヘリックスVに存在する3つのGlyによる湾曲がみられた.
以上のことから,アディポネクチン受容体AdipoR1およびAdipoR2の構造は新規であると結論づけられた.
3.アディポネクチン受容体のZn2+結合部位
AdipoR1およびAdipoR2の7回膜貫通ドメインに1つのZn2+の存在を見い出した.Zn2+結合部位は細胞の内側の細胞膜からおよそ4Åの距離に位置した.Zn2+は3つのHisと2.1~2.6Åの距離で配位していた(図2a).さらに,AdipoR2においては,Zn2+とAspの側鎖カルボキシル基とのあいだに1つの水分子が存在した.Zn2+は膜貫通ヘリックスII,膜貫通ヘリックスIII,膜貫通ヘリックスVIIを固定し,疎水性の相互作用をしている膜貫通ヘリックスIとあわせ,膜貫通ヘリックスI,膜貫通ヘリックスII,膜貫通ヘリックスIII,膜貫通ヘリックスVIIから構成されるサブドメインの構造を安定化している可能性があった.これら3つのHisおよびAspはアディポネクチン受容体のホモログに保存されていた.
これらのZn2+の配位にかかわるアミノ酸残基をAlaに置換して活性との相関について解析した.AdipoR1において,3つのHisの三重変異体,および,3つのHisおよびAspの四重変異体はアディポネクチンで刺激したときのAMPキナーゼの活性化を低下させたが,単一のアミノ酸残基の変異体は活性を維持していた.このことから,AdipoR1において,Zn2+との結合はAMPキナーゼの活性化に直接的には必要なく,構造の維持に効果のあることが示唆された.
対照的に,AdipoR2においては,アディポネクチンで刺激したときのUCP2遺伝子のmRNAの発現の量は,AspあるいはHis348の単一の変異体において低下し,3つのHisの三重変異体や3つのHisおよびAspの四重変異体においてはほぼ完全に消失していた.このことから,AdipoR2において,Zn2+との結合は構造の維持にくわえシグナル伝達にも影響していることが示唆された.AdipoR2がZn2+に依存的な加水分解活性を保持するというのは魅力的な仮説である.アディポネクチンで刺激されたAdipoR2による脂肪の加水分解により遊離脂肪酸の生じる可能性があり,生じた遊離脂肪酸がPPARαの活性を上昇させ,UCP2遺伝子のようなターゲット遺伝子の発現を亢進するのかもしれない.3つのHisおよびAspはアルカリセラミダーゼの膜貫通ドメインにおいても保存されているが,アルカリセラミダーゼはいまだ構造が解かれていないこともあり,アディポネクチン受容体がセラミダーゼ活性をもつかどうかは判断ができない.
4.アディポネクチン受容体のもつ空洞
AdipoR1およびAdipoR2の膜貫通ドメインにZn2+結合部位を含む空洞を見い出した(図2b).この空洞は2つのサブドメインより形成されており,膜貫通ヘリックスIVと膜貫通ヘリックスVIのあいだの細胞の内側から,膜貫通ヘリックスVと膜貫通ヘリックスVIのあいだの細胞膜の外側の脂質の真ん中へと伸びていた.また,空洞には未同定の分子の電子密度が存在した.この電子密度は,アディポネクチン受容体が加水分解活性をもつとするならばその基質あるいは生成物に相当するのかもしれない.
5.アディポネクチン受容体の細胞の外側の表面
アディポネクチン受容体の細胞の外側の表面は3つの細胞外ループとC末端側細胞外領域から構成されていた.膜貫通ヘリックスVIIは細胞膜から2ターンほど突き出ていた.膜貫通ヘリックスVIIのあとのC末端側の領域は柔軟性が高く,特定の構造をとっていないと推測された.
以前に,酵母ツーハイブリッド実験から,アディポネクチンはアディポネクチン受容体のC末端側細胞外領域と相互作用することが示されていた9).C末端側を膜貫通ヘリックスVIIのあとのC末端側の領域まで欠損させたAdipoR1の変異体においては,アディポネクチンで刺激したときのAMPキナーゼの活性化に変化はなかった.しかし,膜貫通ヘリックスVIIの2残基を含め欠損させたところ,AMPキナーゼの活性化は低下した.このことから,膜貫通ヘリックスVIIのC末端側の突き出たターンの部分はアディポネクチンのシグナル伝達にかかわることが示唆された.
さらに,AdipoR1およびAdipoR2において保存されている細胞外ループのアミノ酸残基をGlyあるいはSerと置換して活性を測定した.その結果,3つの細胞外ループのすべてについて置換を導入し,かつ,C末端側を膜貫通ヘリックスVIIの2残基まで欠損させたAdipoR1の変異体は,アディポネクチンで刺激したときのAMPキナーゼの活性化がいちじるしく低下していた.一方,細胞外ループの1つ,2つ,3つについて置換を導入したAdipoR1の変異体では,AMPキナーゼの活性化の低下は小さかった.これらのことから,AdipoR1は3つの細胞外ループおよび膜貫通ヘリックスVIIのC末端側を含む細胞の外側の広い表面にて,アディポネクチンと相互作用している可能性が示唆された.
おわりに
以上の結果から,アディポネクチン受容体AdipoR1およびAdipoR2は,Gタンパク質共役受容体とはまったく異なる構造および機能をもつことが示された.このことから,アディポネクチン受容体は新しいクラスの受容体として位置づけられた.今回,得られた結晶構造の情報が,アディポネクチン受容体の作動薬の開発および最適化を加速することが期待される.また,植物からヒトまで保存されているアディポネクチン受容体のホモログについても,そのシグナル伝達経路の役割や分子機構の理解の一端になれば幸いである.
文 献
- Yamauchi, T., Kamon, J., Ito, Y. et al.: Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature, 423, 762-769 (2003)[PubMed]
- Yamauchi, T., Kamon, J., Minokoshi, Y. et al.: Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase. Nat. Med., 8, 1288-1295 (2002)[PubMed]
- Yamauchi, T., Kamon, J., Waki, H. et al.: Globular adiponectin protected ob/ob mice from diabetes and ApoE-deficient mice from atherosclerosis. J. Biol. Chem., 278, 2461-2468 (2003)[PubMed]
- Okada-Iwabu, M., Yamauchi, T., Iwabu, M. et al.: A small-molecule AdipoR agonist for type 2 diabetes and short life in obesity. Nature, 503, 493-499 (2013)[PubMed] [新着論文レビュー]
- Rasmussen, S. G., DeVree, B. T., Zou, Y. et al.: Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature, 477, 549-555 (2011)[PubMed]
- Tanabe, H., Motoyama, K., Ikeda, M. et al.: Expression, purification, crystallization, and preliminary X-ray crystallographic studies of the human adiponectin receptors, AdipoR1 and AdipoR2. J. Struct. Funct. Genomics, 16, 11-23 (2015)[PubMed]
- Hino, T., Iwata, S. & Murata, T.: Generation of functional antibodies for mammalian membrane protein crystallography. Curr. Opin. Struct. Biol., 23, 563-568 (2013)[PubMed]
- Hato, M., Hosaka, T., Tanabe, H. et al.: A new manual dispensing system for in meso membrane protein crystallization with using a stepping motor-based dispenser. J. Struct. Funct. Genomics, 15, 165-171 (2014)[PubMed]
- Mao, X., Kikani, C. K., Riojas, R. A. et al.: APPL1 binds to adiponectin receptors and mediates adiponectin signalling and function. Nat. Cell Biol., 8, 516-523 (2006)[PubMed]
著者プロフィール
略歴:理化学研究所ライフサイエンス技術基盤研究センター リサーチアソシエイト.
研究テーマ:膜タンパク質の構造解析.
関心事:細胞の外から細胞の内部へのシグナル伝達.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
山内 敏正(Toshimasa Yamauchi)
東京大学大学院医学系研究科 准教授.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
研究室URL:http://dm301k.umin.jp/
© 2015 田辺弘明・横山茂之・山内敏正・門脇 孝 Licensed under CC 表示 2.1 日本