アディポネクチン受容体を活性化する低分子化合物AdipoRonの取得
山内敏正・岩部美紀・岩部真人・門脇 孝
(東京大学大学院医学系研究科 代謝・栄養病態学)
email:山内敏正,門脇 孝
DOI: 10.7875/first.author.2013.166
A small-molecule AdipoR agonist for type 2 diabetes and short life in obesity.
Miki Okada-Iwabu, Toshimasa Yamauchi, Masato Iwabu, Teruki Honma, Ken-ichi Hamagami, Koichi Matsuda, Mamiko Yamaguchi, Hiroaki Tanabe, Tomomi Kimura-Someya, Mikako Shirouzu, Hitomi Ogata, Kumpei Tokuyama, Kohjiro Ueki, Tetsuo Nagano, Akiko Tanaka, Shigeyuki Yokoyama, Takashi Kadowaki
Nature, 503, 493-499 (2013)
高脂肪食や運動不足などによる肥満はメタボリックシンドロームや糖尿病などの発症および増悪を促進し,心血管疾患やがんなどのリスクを高める.健康長寿の実現のため,それら分子機構の解明と予防法および治療法の開発を試みた.その結果,肥満にともない脂肪細胞から分泌されるアディポネクチンが低下することが主因のひとつであることを見い出し,アディポネクチン受容体を同定した.アディポネクチン受容体の活性化はAMPK,SIRT1,PPARを活性化するなど,カロリー制限や運動と同様に生活習慣病を改善するのみならず,寿命の延長効果を発揮し健康長寿の実現に貢献できる可能性があった.大規模な化合物ライブラリーを用いてアディポネクチン受容体を活性化する経口投与の可能な低分子化合物のスクリーニングを行い,アディポネクチン受容体のアゴニストとしてAdipoRonを見い出した.AdipoRonは高脂肪食や過食による糖尿病を改善させ,運動持久力を増加させて,糖尿病モデルマウスの短縮していた寿命を延伸させた.今後,立体構造の情報やヒト型アディポネクチン受容体を発現したマウスなどを用いて最適化を行うことにより,ヒトにおいて安全で有効性の高い健康長寿薬の創製に貢献できる可能性がある.
高脂肪食や運動不足による肥満はメタボリックシンドロームや糖尿病などの発症および増悪を促進するのみならず,心血管疾患やがんなどのリスクを高めることがよく知られており,健康長寿の実現のためには,これらの分子機構を明らかにし予防法および治療法を開発することがもっとも重要である1).筆者らも含めた国内外の研究により,脂肪細胞に特異的に発現し分泌されるアディポネクチンの血中でのレベルが肥満において低下することが,肥満にともなうメタボリックシンドローム,糖尿病,心血管疾患,がんなどの生活習慣病の発症および増悪の鍵となることが明らかにされている2-4).逆に,低下しているアディポネクチンを補充することはAMPKやPPARを活性化し,これらの治療法になることが示されている5-7).筆者らは,このアディポネクチンの特異的な結合を指標とした発現クローニング法により,アディポネクチン受容体,AdipoR1およびAdipoR2を同定し報告した8).遺伝子改変マウスの解析により,アディポネクチン受容体は個体レベルにおいてもアディポネクチンの結合と作用に必要な受容体であること,インスリン感受性と糖代謝および脂質代謝に重要な役割をはたすことを示した.また,その分子機構として,AdipoR1は運動による代謝の改善作用に重要なAMPKおよび長寿遺伝子産物であるSIRT1を活性化すること,AdipoR2はPPARを活性化することを示してきた.これらは,最終的に脂質の異所性の蓄積や酸化ストレスを低減させ,慢性炎症を抑制することにより,インスリン抵抗性や動脈硬化から個体を保護していることが明らかになってきている9-11).
アディポネクチンを過剰に発現するマウスが健康長寿になることが報告されたので11),この研究では,AdipoR1あるいはAdipoR2がアディポネクチンの健康長寿に対する作用を伝達するかどうかを明らかにすることを目的としてそれらのノックアウトマウスの寿命を解析したところ,AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスはともに野生型マウスと比較して有意に短命であること,さらに,AdipoR1 AdipoR2ダブルノックアウトマウスはもっとも短命であることが明らかになり,AdipoR1とAdipoR2がともに健康寿命の延伸作用をもつことが示唆された.
アディポネクチン-アディポネクチン受容体経路を活性化することが肥満で増加する生活習慣病の治療法となり健康長寿の実現につながるのではないかと想定し,そのような低分子化合物の取得をめざした.そのため,東京大学創薬オープンイノベーションセンターのもつ化合物ライブラリーなどをもとにスクリーニングを行った.アディポネクチン受容体を標的として予測および収集したフォーカスライブラリーから,in silicoスクリーニングをへて,まずはin vitroにおけるアディポネクチン様の作用およびアディポネクチン受容体への依存性を確かめ,活性の高かった上位の化合物についてin vivoにおける効果を確かめることにより,アディポネクチン受容体を活性化する低分子化合物の取得に成功した.このアディポネクチン受容体アゴニスト(作動薬)は,“アディポネクチン受容体AdipoRをonにする”という意味も含めAdipoRonと名づけた.
AdipoRonのAdipoR1およびAdipoR2に対する結合実験を行った.表面プラズモン共鳴法を用いて結合性を検討したところ,AdipoRonはAdipoR1およびAdipoR2ともに直接に結合することが確かめられた.アディポネクチン受容体を活性化する低分子化合物のなかでもアゴニストとしての作用をもつものをとくに重要と考え,3Hにより標識したAdipoRonを用いた結合アッセイでも結合を確かめた.野生型マウスに由来する初代培養肝細胞においては結合曲線が得られたが,AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスに由来する初代培養肝細胞,すなわち,AdipoR1あるいはAdipoR2に対するAdipoRonの結合は,野生型マウスに由来する初代培養肝細胞に比べ部分的で,AdipoR1 AdipoR2ダブルノックアウトマウスに由来する初代培養肝細胞では用量への依存性もなくなり結合はほとんど消失した.
in vitroにおける作用を検討した.アディポネクチンは分化したC2C12骨格筋細胞においてAMPKを活性化する.AdipoRonを添加すると用量に依存してAMPKを活性化した.つぎに,AdipoRonによるC2C12細胞におけるAMPKの活性化がアディポネクチンによるAMPKの活性化にどのような影響を及ぼすのか検討した.アディポネクチンによるAMPKの活性化が最大値の約半分のときAdipoRonを添加すると,AMPKの活性は相加的に上昇することが認められた.一方,アディポネクチンによるAMPKの活性化が最大値のときAdipoRonを添加してもその効果は阻害されず,活性を維持していることが認められた.また,メトホルミンはミトコンドリアの複合体Iを阻害してAMP/ATP比を上昇させAMPKを活性化することが報告されているが.AdipoRonは複合体Iを阻害しないことも確かめられた.また,アディポネクチンにはPGC-1αのmRNAレベルでの発現を上昇させる作用があるが,AdipoRonもアディポネクチンと同様に用量に依存してPGC-1αの発現を上昇させるのが認められた.PGC-1αのmRNAレベルでの発現制御には細胞内Ca2+シグナル伝達系が関与しており,実際にCa2+をキレートすると発現の上昇が抑制されたため,AdipoRonによるPGC-1αのmRNAレベルでの発現の上昇はアディポネクチンと同じ分子機構による可能性が高いと示唆された.さらに,AdipoRonはアディポネクチンと同じようにミトコンドリアの量を増加させる作用をもつことが認められた.
以上より,in vitroにおいてAdipoRonはアディポネクチンと同様の効果をもつ可能性が示唆された.
マウスにAdipoRonを投与しin vivoにおいて効果を発揮するかどうか検討した.まず,単回投与による血糖値の低下作用について検討した.アディポネクチンの1回の腹腔内投与により対照に比べ有意な血糖値の低下作用が認められたのと同様に,AdipoRonの単回の経口投与により対照に比べ有意な血糖値の低下が確かめられた.実際に,血中におけるAdipoRonの濃度を測定したところ,細胞レベルで十分に活性化する濃度まで達していることが確かめられ,AdipoRonは実際に経口投与が可能であるというデータが得られた.AdipoRonの血中濃度とin vivoでの効果の発現の経時変化を詳細に検討したところ,AdipoRonの血中濃度は経口投与から40分後に最高濃度に達し,そののち,投与から2時間後に血糖値の低下作用は最大に達した.AdipoRonの血中濃度の半減期は約2時間であったが,血糖値の低下作用の効果の半減期は約8時間と,実際の血中濃度より効果が持続していることが明らかになった.
連日経口投与の実験を行った.高脂肪食を負荷し,1日1回,10日間の経口投与では,摂食量および体重ともに変化は認められなかった.同じ条件において糖負荷試験を行い,AdipoRonのインスリン抵抗性の改善作用と抗糖尿病作用について検討した.野生型マウスにおいてはAdipoRonの経口投与によりインスリン抵抗性と糖尿病の改善が認められた.AdipoR1 AdipoR2ダブルノックアウトマウスでは野生型マウスでみられたインスリン抵抗性の改善は認められなかった.AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスではインスリン抵抗性と糖尿病が部分的に改善されていたことより,AdipoRonによるインスリン抵抗性の改善作用と抗糖尿病作用はAdipoR1およびAdipoR2のどちらも介していることが示唆された.
正常血糖高インスリンクランプ試験を行った.AdipoRonを投与した高脂肪食を負荷したマウスでは,骨格筋を中心とした全身における糖の取り込みが増加し,肝臓を中心とした糖産生の抑制が認められた.すなわち,AdipoRonは骨格筋と肝臓の両方に作用してインスリン抵抗性を改善させている可能性が示唆された.そこで,代謝に重要な組織である肝臓と骨格筋において,実際にインスリンの作用を検討した.野生型マウスにインスリンを投与すると,肝臓においてインスリン受容体のチロシンリン酸化,AKTのリン酸化,GSK3のリン酸化が増加するが,AdipoRonの投与は,アディポネクチンと同じように,これらのインスリンの作用を増強させることが認められた.一方,AdipoR1 AdipoR2ダブルノックアウトマウスではAdipoRonを投与してもインスリンの作用の増強は認められなかった.骨格筋においても同様に,AdipoRonは野生型マウスにおいてインスリンの作用を増強したのに対し,AdipoR1 AdipoR2ダブルノックアウトマウスでは増強させなかった.さらに,野生型マウスおよびAdipoR1 AdipoR2ダブルノックアウトマウスに由来する初代培養肝細胞を用いた実験,また,摘出筋を用いた実験においても結果は同様であったので,AdipoRonは少なくとも骨格筋細胞と肝細胞のもつアディポネクチン受容体を介し,直接にインスリンの作用を増強させる作用をもつことが示唆された.
骨格筋におけるAdipoRonによるAMPKの活性化について検討した.アディポネクチンと同様に,AdipoRonは骨格筋においてAMPKの活性を有意に上昇させたが,AdipoR1 AdipoR2ダブルノックアウトマウスではその効果は認められなかった.また,AdipoRonは野生型マウスの骨格筋においては,アディポネクチンと同様に,ミトコンドリアのおもな制御タンパク質であるPGC-1α,さらにPGC-1αの下流に位置するErrαなど,ミトコンドリアの生合成や転写にかかわるタンパク質の発現を上昇させ,ミトコンドリアDNA含量により評価したミトコンドリアの量も増加させていることが示唆された.一方,AdipoR1 AdipoR2ダブルノックアウトマウスではこれらの有意な変化は認められなかった.そこで,マウスの持久力に対する効果について検討した.野生型マウスではAdipoRonを投与すると運動持久力が増加したのに対し,AdipoR1 AdipoR2ダブルノックアウトマウスでは野生型マウスに比べてそもそも筋の持久力が低下しているが,AdipoRonを投与してもその改善効果は認められなかった.また,エネルギー代謝についても検討し,酸素消費量を測定した.AdipoRonを投与すると一日をとおして酸素消費量が増加しているのが認められた.
AdipoRonは肝臓においてAdipoR1を介してAMPKを活性化し,PEPCKなど糖新生にかかわるタンパク質の発現を低下させ,糖新生を抑制する作用のあることがわかった.また,AdipoR2を介して脂肪酸の異化にかかわるACOなどの発現も上昇させることが認められた.これらの結果より,AdipoRonはAdipoR1およびAdipoR2の両方に作用する可能性のあることが示唆された.また,肝臓において中性脂質の含量を低下させる作用をもつこともわかった.さらに,AdipoRonは肝臓においてカタラーゼなどの酸化ストレスの消去にはたらくタンパク質の発現を上昇させ,実際に酸化ストレスを低減させるとともに,TNFαなど炎症性サイトカインの発現を抑制していることも認められた.
AdipoRonは脂肪組織において,F4/80などのマクロファージおよびM1マクロファージの浸潤を抑制し,炎症性サイトカインであるTNFα,インターロイキン6,MCP-1の発現を抑制して,さらに,酸化ストレスを低減させることが認められた.
肥満2型糖尿病モデルマウスであるdb/dbマウスにおいてもAdipoRonの効果が発揮されるかどうか検討した.2週間の経口投与では摂食量および体重ともに変化は認められなかったが,AdipoRonによりインスリン抵抗性および糖尿病の改善することが認められた.さらに,血中の中性脂肪および遊離脂肪酸は有意に低下し,糖代謝および脂質代謝の改善していることが示唆された.さらに,db/dbマウスの骨格筋,肝臓,脂肪組織においても,高脂肪食を負荷したマウスで認められたのとほぼ同じ効果が認められ,db/dbマウスにおいてもAdipoRonはこれらの代謝に重要な組織に作用することが明らかになった.
以上のようなAdipoRonのさまざまな組織における作用の結果をふまえ,個体レベルにおいて寿命に対する影響を検討した.db/dbマウスに高脂肪食を負荷すると,普通食をあたえた場合に比べ寿命は約100日と短くなるが,AdipoRonを投与するとその短縮した寿命が延伸されることが示された.
AdipoRonは全身における糖代謝および脂質代謝を改善し,個体レベルでは結果として肥満で短縮した健康寿命を延伸させることが明らかになった.
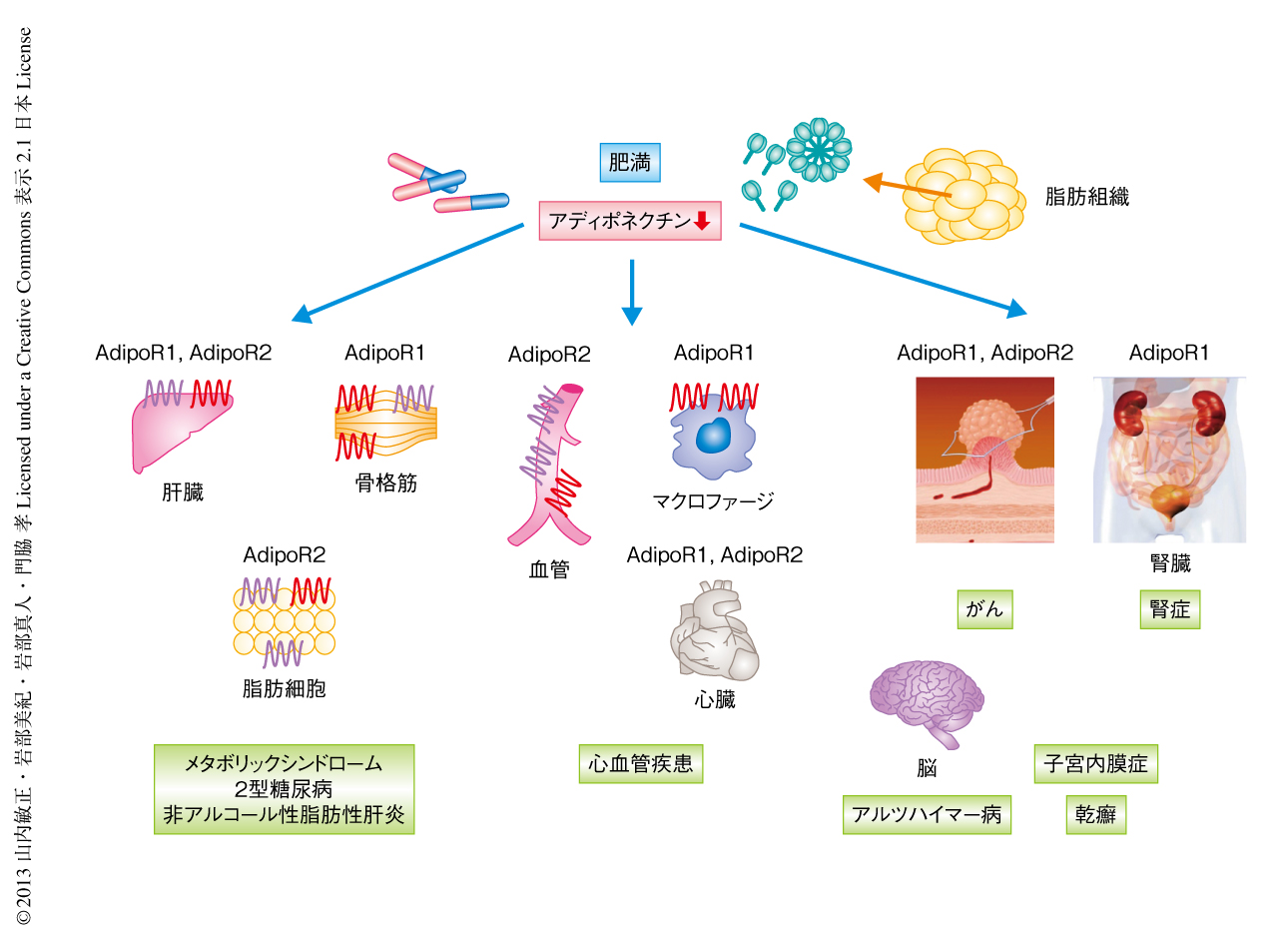
肥満にともなうアディポネクチンの低下が,メタボリックシンドローム,心血管疾患,がんなど,肥満によりリスクの高まる生活習慣病の主要な原因になっていることが明らかになってきている.AdipoRonを含めた,アディポネクチン受容体を活性化するアゴニストはこれらに対する根本的な治療法となり,健康長寿の実現への貢献が期待される(図1).とくに,内科的な疾患や運動器の疾患などにより運動ができない場合において,それら病態の効果的な治療薬となることが強く期待される.
日本発の分子標的医薬として,アディポネクチン受容体を活性化する低分子化合物AdipoRonの活力ある健康長寿社会をめざした開発臨床への応用にむけ,産業界を含めた“オールジャパン”の開発体制が重要と考えている.
略歴:1998年 東京大学大学院医学系研究科 修了,同 研究員,2003年より同 助手,2004年 東京大学医学部附属病院 特任准教授を経て,2010年より東京大学大学院医学系研究科 講師.
研究テーマ:肥満が生活習慣病を惹起して寿命を短縮させる分子機構の解明と,それにもとづいた予防法および治療法の開発.
抱負:アディポネクチン受容体のアゴニストを実際の臨床で使えるよう開発し,健康長寿を実現させる.
岩部 美紀(Miki Okada-Iwabu)
東京大学医学部附属病院 特任助教.
岩部 真人(Masato Iwabu)
東京大学医学部附属病院 特任助教.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
© 2013 山内敏正・岩部美紀・岩部真人・門脇 孝 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 代謝・栄養病態学)
email:山内敏正,門脇 孝
DOI: 10.7875/first.author.2013.166
A small-molecule AdipoR agonist for type 2 diabetes and short life in obesity.
Miki Okada-Iwabu, Toshimasa Yamauchi, Masato Iwabu, Teruki Honma, Ken-ichi Hamagami, Koichi Matsuda, Mamiko Yamaguchi, Hiroaki Tanabe, Tomomi Kimura-Someya, Mikako Shirouzu, Hitomi Ogata, Kumpei Tokuyama, Kohjiro Ueki, Tetsuo Nagano, Akiko Tanaka, Shigeyuki Yokoyama, Takashi Kadowaki
Nature, 503, 493-499 (2013)
要 約
高脂肪食や運動不足などによる肥満はメタボリックシンドロームや糖尿病などの発症および増悪を促進し,心血管疾患やがんなどのリスクを高める.健康長寿の実現のため,それら分子機構の解明と予防法および治療法の開発を試みた.その結果,肥満にともない脂肪細胞から分泌されるアディポネクチンが低下することが主因のひとつであることを見い出し,アディポネクチン受容体を同定した.アディポネクチン受容体の活性化はAMPK,SIRT1,PPARを活性化するなど,カロリー制限や運動と同様に生活習慣病を改善するのみならず,寿命の延長効果を発揮し健康長寿の実現に貢献できる可能性があった.大規模な化合物ライブラリーを用いてアディポネクチン受容体を活性化する経口投与の可能な低分子化合物のスクリーニングを行い,アディポネクチン受容体のアゴニストとしてAdipoRonを見い出した.AdipoRonは高脂肪食や過食による糖尿病を改善させ,運動持久力を増加させて,糖尿病モデルマウスの短縮していた寿命を延伸させた.今後,立体構造の情報やヒト型アディポネクチン受容体を発現したマウスなどを用いて最適化を行うことにより,ヒトにおいて安全で有効性の高い健康長寿薬の創製に貢献できる可能性がある.
はじめに
高脂肪食や運動不足による肥満はメタボリックシンドロームや糖尿病などの発症および増悪を促進するのみならず,心血管疾患やがんなどのリスクを高めることがよく知られており,健康長寿の実現のためには,これらの分子機構を明らかにし予防法および治療法を開発することがもっとも重要である1).筆者らも含めた国内外の研究により,脂肪細胞に特異的に発現し分泌されるアディポネクチンの血中でのレベルが肥満において低下することが,肥満にともなうメタボリックシンドローム,糖尿病,心血管疾患,がんなどの生活習慣病の発症および増悪の鍵となることが明らかにされている2-4).逆に,低下しているアディポネクチンを補充することはAMPKやPPARを活性化し,これらの治療法になることが示されている5-7).筆者らは,このアディポネクチンの特異的な結合を指標とした発現クローニング法により,アディポネクチン受容体,AdipoR1およびAdipoR2を同定し報告した8).遺伝子改変マウスの解析により,アディポネクチン受容体は個体レベルにおいてもアディポネクチンの結合と作用に必要な受容体であること,インスリン感受性と糖代謝および脂質代謝に重要な役割をはたすことを示した.また,その分子機構として,AdipoR1は運動による代謝の改善作用に重要なAMPKおよび長寿遺伝子産物であるSIRT1を活性化すること,AdipoR2はPPARを活性化することを示してきた.これらは,最終的に脂質の異所性の蓄積や酸化ストレスを低減させ,慢性炎症を抑制することにより,インスリン抵抗性や動脈硬化から個体を保護していることが明らかになってきている9-11).
1.アディポネクチン受容体は健康長寿において重要な役割をはたす
アディポネクチンを過剰に発現するマウスが健康長寿になることが報告されたので11),この研究では,AdipoR1あるいはAdipoR2がアディポネクチンの健康長寿に対する作用を伝達するかどうかを明らかにすることを目的としてそれらのノックアウトマウスの寿命を解析したところ,AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスはともに野生型マウスと比較して有意に短命であること,さらに,AdipoR1 AdipoR2ダブルノックアウトマウスはもっとも短命であることが明らかになり,AdipoR1とAdipoR2がともに健康寿命の延伸作用をもつことが示唆された.
2.アディポネクチン受容体を活性化する低分子化合物の取得
アディポネクチン-アディポネクチン受容体経路を活性化することが肥満で増加する生活習慣病の治療法となり健康長寿の実現につながるのではないかと想定し,そのような低分子化合物の取得をめざした.そのため,東京大学創薬オープンイノベーションセンターのもつ化合物ライブラリーなどをもとにスクリーニングを行った.アディポネクチン受容体を標的として予測および収集したフォーカスライブラリーから,in silicoスクリーニングをへて,まずはin vitroにおけるアディポネクチン様の作用およびアディポネクチン受容体への依存性を確かめ,活性の高かった上位の化合物についてin vivoにおける効果を確かめることにより,アディポネクチン受容体を活性化する低分子化合物の取得に成功した.このアディポネクチン受容体アゴニスト(作動薬)は,“アディポネクチン受容体AdipoRをonにする”という意味も含めAdipoRonと名づけた.
3.AdipoRonはAdipoR1およびAdipoR2に直接に結合する
AdipoRonのAdipoR1およびAdipoR2に対する結合実験を行った.表面プラズモン共鳴法を用いて結合性を検討したところ,AdipoRonはAdipoR1およびAdipoR2ともに直接に結合することが確かめられた.アディポネクチン受容体を活性化する低分子化合物のなかでもアゴニストとしての作用をもつものをとくに重要と考え,3Hにより標識したAdipoRonを用いた結合アッセイでも結合を確かめた.野生型マウスに由来する初代培養肝細胞においては結合曲線が得られたが,AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスに由来する初代培養肝細胞,すなわち,AdipoR1あるいはAdipoR2に対するAdipoRonの結合は,野生型マウスに由来する初代培養肝細胞に比べ部分的で,AdipoR1 AdipoR2ダブルノックアウトマウスに由来する初代培養肝細胞では用量への依存性もなくなり結合はほとんど消失した.
4.AdipoRonはin vitroにおいてアディポネクチン様の作用を発揮する
in vitroにおける作用を検討した.アディポネクチンは分化したC2C12骨格筋細胞においてAMPKを活性化する.AdipoRonを添加すると用量に依存してAMPKを活性化した.つぎに,AdipoRonによるC2C12細胞におけるAMPKの活性化がアディポネクチンによるAMPKの活性化にどのような影響を及ぼすのか検討した.アディポネクチンによるAMPKの活性化が最大値の約半分のときAdipoRonを添加すると,AMPKの活性は相加的に上昇することが認められた.一方,アディポネクチンによるAMPKの活性化が最大値のときAdipoRonを添加してもその効果は阻害されず,活性を維持していることが認められた.また,メトホルミンはミトコンドリアの複合体Iを阻害してAMP/ATP比を上昇させAMPKを活性化することが報告されているが.AdipoRonは複合体Iを阻害しないことも確かめられた.また,アディポネクチンにはPGC-1αのmRNAレベルでの発現を上昇させる作用があるが,AdipoRonもアディポネクチンと同様に用量に依存してPGC-1αの発現を上昇させるのが認められた.PGC-1αのmRNAレベルでの発現制御には細胞内Ca2+シグナル伝達系が関与しており,実際にCa2+をキレートすると発現の上昇が抑制されたため,AdipoRonによるPGC-1αのmRNAレベルでの発現の上昇はアディポネクチンと同じ分子機構による可能性が高いと示唆された.さらに,AdipoRonはアディポネクチンと同じようにミトコンドリアの量を増加させる作用をもつことが認められた.
以上より,in vitroにおいてAdipoRonはアディポネクチンと同様の効果をもつ可能性が示唆された.
5.AdipoRonの経口投与は高脂肪食によるインスリン抵抗性を改善する
マウスにAdipoRonを投与しin vivoにおいて効果を発揮するかどうか検討した.まず,単回投与による血糖値の低下作用について検討した.アディポネクチンの1回の腹腔内投与により対照に比べ有意な血糖値の低下作用が認められたのと同様に,AdipoRonの単回の経口投与により対照に比べ有意な血糖値の低下が確かめられた.実際に,血中におけるAdipoRonの濃度を測定したところ,細胞レベルで十分に活性化する濃度まで達していることが確かめられ,AdipoRonは実際に経口投与が可能であるというデータが得られた.AdipoRonの血中濃度とin vivoでの効果の発現の経時変化を詳細に検討したところ,AdipoRonの血中濃度は経口投与から40分後に最高濃度に達し,そののち,投与から2時間後に血糖値の低下作用は最大に達した.AdipoRonの血中濃度の半減期は約2時間であったが,血糖値の低下作用の効果の半減期は約8時間と,実際の血中濃度より効果が持続していることが明らかになった.
連日経口投与の実験を行った.高脂肪食を負荷し,1日1回,10日間の経口投与では,摂食量および体重ともに変化は認められなかった.同じ条件において糖負荷試験を行い,AdipoRonのインスリン抵抗性の改善作用と抗糖尿病作用について検討した.野生型マウスにおいてはAdipoRonの経口投与によりインスリン抵抗性と糖尿病の改善が認められた.AdipoR1 AdipoR2ダブルノックアウトマウスでは野生型マウスでみられたインスリン抵抗性の改善は認められなかった.AdipoR1ノックアウトマウスおよびAdipoR2ノックアウトマウスではインスリン抵抗性と糖尿病が部分的に改善されていたことより,AdipoRonによるインスリン抵抗性の改善作用と抗糖尿病作用はAdipoR1およびAdipoR2のどちらも介していることが示唆された.
正常血糖高インスリンクランプ試験を行った.AdipoRonを投与した高脂肪食を負荷したマウスでは,骨格筋を中心とした全身における糖の取り込みが増加し,肝臓を中心とした糖産生の抑制が認められた.すなわち,AdipoRonは骨格筋と肝臓の両方に作用してインスリン抵抗性を改善させている可能性が示唆された.そこで,代謝に重要な組織である肝臓と骨格筋において,実際にインスリンの作用を検討した.野生型マウスにインスリンを投与すると,肝臓においてインスリン受容体のチロシンリン酸化,AKTのリン酸化,GSK3のリン酸化が増加するが,AdipoRonの投与は,アディポネクチンと同じように,これらのインスリンの作用を増強させることが認められた.一方,AdipoR1 AdipoR2ダブルノックアウトマウスではAdipoRonを投与してもインスリンの作用の増強は認められなかった.骨格筋においても同様に,AdipoRonは野生型マウスにおいてインスリンの作用を増強したのに対し,AdipoR1 AdipoR2ダブルノックアウトマウスでは増強させなかった.さらに,野生型マウスおよびAdipoR1 AdipoR2ダブルノックアウトマウスに由来する初代培養肝細胞を用いた実験,また,摘出筋を用いた実験においても結果は同様であったので,AdipoRonは少なくとも骨格筋細胞と肝細胞のもつアディポネクチン受容体を介し,直接にインスリンの作用を増強させる作用をもつことが示唆された.
6.AdipoRonは骨格筋においてミトコンドリアの数と機能を高める
骨格筋におけるAdipoRonによるAMPKの活性化について検討した.アディポネクチンと同様に,AdipoRonは骨格筋においてAMPKの活性を有意に上昇させたが,AdipoR1 AdipoR2ダブルノックアウトマウスではその効果は認められなかった.また,AdipoRonは野生型マウスの骨格筋においては,アディポネクチンと同様に,ミトコンドリアのおもな制御タンパク質であるPGC-1α,さらにPGC-1αの下流に位置するErrαなど,ミトコンドリアの生合成や転写にかかわるタンパク質の発現を上昇させ,ミトコンドリアDNA含量により評価したミトコンドリアの量も増加させていることが示唆された.一方,AdipoR1 AdipoR2ダブルノックアウトマウスではこれらの有意な変化は認められなかった.そこで,マウスの持久力に対する効果について検討した.野生型マウスではAdipoRonを投与すると運動持久力が増加したのに対し,AdipoR1 AdipoR2ダブルノックアウトマウスでは野生型マウスに比べてそもそも筋の持久力が低下しているが,AdipoRonを投与してもその改善効果は認められなかった.また,エネルギー代謝についても検討し,酸素消費量を測定した.AdipoRonを投与すると一日をとおして酸素消費量が増加しているのが認められた.
7.AdipoRonは肝臓において糖新生を抑制し脂肪肝を改善させる
AdipoRonは肝臓においてAdipoR1を介してAMPKを活性化し,PEPCKなど糖新生にかかわるタンパク質の発現を低下させ,糖新生を抑制する作用のあることがわかった.また,AdipoR2を介して脂肪酸の異化にかかわるACOなどの発現も上昇させることが認められた.これらの結果より,AdipoRonはAdipoR1およびAdipoR2の両方に作用する可能性のあることが示唆された.また,肝臓において中性脂質の含量を低下させる作用をもつこともわかった.さらに,AdipoRonは肝臓においてカタラーゼなどの酸化ストレスの消去にはたらくタンパク質の発現を上昇させ,実際に酸化ストレスを低減させるとともに,TNFαなど炎症性サイトカインの発現を抑制していることも認められた.
8.AdipoRonは脂肪組織においてマクロファージの浸潤を抑制しする
AdipoRonは脂肪組織において,F4/80などのマクロファージおよびM1マクロファージの浸潤を抑制し,炎症性サイトカインであるTNFα,インターロイキン6,MCP-1の発現を抑制して,さらに,酸化ストレスを低減させることが認められた.
9.AdipoRonは2型糖尿病モデルマウスにおいてもインスリン抵抗性を改善させる
肥満2型糖尿病モデルマウスであるdb/dbマウスにおいてもAdipoRonの効果が発揮されるかどうか検討した.2週間の経口投与では摂食量および体重ともに変化は認められなかったが,AdipoRonによりインスリン抵抗性および糖尿病の改善することが認められた.さらに,血中の中性脂肪および遊離脂肪酸は有意に低下し,糖代謝および脂質代謝の改善していることが示唆された.さらに,db/dbマウスの骨格筋,肝臓,脂肪組織においても,高脂肪食を負荷したマウスで認められたのとほぼ同じ効果が認められ,db/dbマウスにおいてもAdipoRonはこれらの代謝に重要な組織に作用することが明らかになった.
10.AdipoRonは健康寿命を延伸させる
以上のようなAdipoRonのさまざまな組織における作用の結果をふまえ,個体レベルにおいて寿命に対する影響を検討した.db/dbマウスに高脂肪食を負荷すると,普通食をあたえた場合に比べ寿命は約100日と短くなるが,AdipoRonを投与するとその短縮した寿命が延伸されることが示された.
AdipoRonは全身における糖代謝および脂質代謝を改善し,個体レベルでは結果として肥満で短縮した健康寿命を延伸させることが明らかになった.
おわりに
肥満にともなうアディポネクチンの低下が,メタボリックシンドローム,心血管疾患,がんなど,肥満によりリスクの高まる生活習慣病の主要な原因になっていることが明らかになってきている.AdipoRonを含めた,アディポネクチン受容体を活性化するアゴニストはこれらに対する根本的な治療法となり,健康長寿の実現への貢献が期待される(図1).とくに,内科的な疾患や運動器の疾患などにより運動ができない場合において,それら病態の効果的な治療薬となることが強く期待される.
日本発の分子標的医薬として,アディポネクチン受容体を活性化する低分子化合物AdipoRonの活力ある健康長寿社会をめざした開発臨床への応用にむけ,産業界を含めた“オールジャパン”の開発体制が重要と考えている.
文 献
- Shulman, G. I.: Cellular mechanisms of insulin resistance. J. Clin. Invest., 106, 171-176 (2000)[PubMed]
- Yamauchi, T., Kamon, J., Waki, H. et al.: The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat. Med., 7, 941-946 (2001)[PubMed]
- Kubota, N., Terauchi, Y., Yamauchi, T. et al.: Disruption of adiponectin causes insulin resistance and neointimal formation. J. Biol. Chem., 277, 25863-25866 (2002)[PubMed]
- Yamauchi, T., Kamon, J., Waki, H. et al.: Globular adiponectin protected ob/ob mice from diabetes and apoE deficient mice from atherosclerosis. J. Biol. Chem., 278, 2461-2468 (2003)[PubMed]
- Yamauchi, T., Kamon, J., Minokoshi, Y. et al.: Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase. Nat. Med., 8, 1288-1295 (2002)[PubMed]
- Zhou, G., Myers, R., Li, Y. et al.: Role of AMP-activated protein kinase in mechanism of metformin action. J. Clin. Invest., 108, 1167-1174 (2001)[PubMed]
- Tomas, E., Tsao, T. S., Saha, A. K. et al.: Enhanced muscle fat oxidation and glucose transport by ACRP30 globular domain: acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation. Proc. Natl. Acad. Sci. USA, 99, 16309-16313 (2002)[PubMed]
- Yamauchi, T., Kamon, J., Ito, Y. et al.: Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature, 423, 762-769 (2003)[PubMed]
- Yamauchi, T., Nio, Y., Maki, T. et al.: Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat. Med., 13, 332-339 (2007)[PubMed]
- Iwabu, M., Yamauchi, T., Okada-Iwabu, M. et al.: Adiponectin and AdipoR1 regulate PGC-1α and mitochondria by Ca2+ and AMPK/SIRT1. Nature, 464, 1313-1319 (2010)[PubMed]
- Yamauchi, T. & Kadowaki, T.: Adiponectin receptor as a key player in healthy longevity and obesity-related diseases. Cell Metab., 17, 185-196 (2013)[PubMed]
著者プロフィール
略歴:1998年 東京大学大学院医学系研究科 修了,同 研究員,2003年より同 助手,2004年 東京大学医学部附属病院 特任准教授を経て,2010年より東京大学大学院医学系研究科 講師.
研究テーマ:肥満が生活習慣病を惹起して寿命を短縮させる分子機構の解明と,それにもとづいた予防法および治療法の開発.
抱負:アディポネクチン受容体のアゴニストを実際の臨床で使えるよう開発し,健康長寿を実現させる.
岩部 美紀(Miki Okada-Iwabu)
東京大学医学部附属病院 特任助教.
岩部 真人(Masato Iwabu)
東京大学医学部附属病院 特任助教.
門脇 孝(Takashi Kadowaki)
東京大学大学院医学系研究科 教授.
© 2013 山内敏正・岩部美紀・岩部真人・門脇 孝 Licensed under CC 表示 2.1 日本