ユビキチンリガーゼ複合体CRL4VprBPはTETタンパク質のモノユビキチン化およびクロマチンとの結合を促進する
中川 直1・中山啓子2・Yue Xiong 1
(1米国North Carolina大学Chapel Hill校Lineberger Comprehensive Cancer Center,2東北大学大学院医学系研究科 細胞増殖制御分野)
email:中川 直
DOI: 10.7875/first.author.2015.015
CRL4VprBP E3 ligase promotes monoubiquitylation and chromatin binding of TET dioxygenases.
Tadashi Nakagawa, Lei Lv, Makiko Nakagawa, Yanbao Yu, Chao Yu, Ana C. D'Alessio, Keiko Nakayama, Heng-Yu Fan, Xian Chen, Yue Xiong
Molecular Cell, 57, 247-260 (2015)
エピジェネティックな修飾のひとつであるDNAのメチル化は,遺伝子発現を制御し発生や細胞の初期化などの過程に関与することが知られている.DNAのメチル化は長いあいだ不可逆的であると考えられてきたが,近年の研究から,TETタンパク質(TET1,TET2,TET3)による酸化型中間体をへて脱メチル化されることが明らかになった.しかしながら,TETタンパク質の活性制御の分子機構については不明であった.筆者らは,ユビキチンリガーゼ複合体CRL4VprBPにより3つのTETタンパク質すべてがモノユビキチン化されること,このモノユビキチン化はTETタンパク質とクロマチンとの結合を促進することを見い出した.TETタンパク質のユビキチン化部位の解析から,CRL4VprBPによるユビキチン化は白血病の患者において同定されていたいくつかのTET2のアミノ酸変異により阻害され,結果として,TET2の活性が抑制されることが判明した.以上の結果は,TETタンパク質の活性はCRL4VprBPによるモノユビキチン化により制御されており,その破綻は白血病の原因となることを示唆した.
タンパク質はユビキチン化されると分解や局在の変化などがひき起こされ,その機能が制御される.CRL4はRBX1-CUL4-DDB1複合体をコアとして構成されるユビキチンリガーゼ複合体であり,DWDタンパク質とよばれる一群の基質結合サブユニットを介してさまざまな基質と結合しこれをユビキチン化する1).DWDタンパク質は哺乳類の細胞において30~100あると考えられているが,CDT2やDDB2などいくつかを除きほとんど解析されていない.とくに,VprBPはCRL4ともっとも強く結合するDWDタンパク質であるが,その基質は不明であった2).これまでの解析から,CRL4の基質の特徴として複製,転写,修復にかかわるクロマチン制御タンパク質の多いことが知られていた.そこで,筆者らは,VprBPの基質もクロマチン制御タンパク質である可能性が高いと想定し,VprBPに結合するタンパク質の同定および解析を行った.
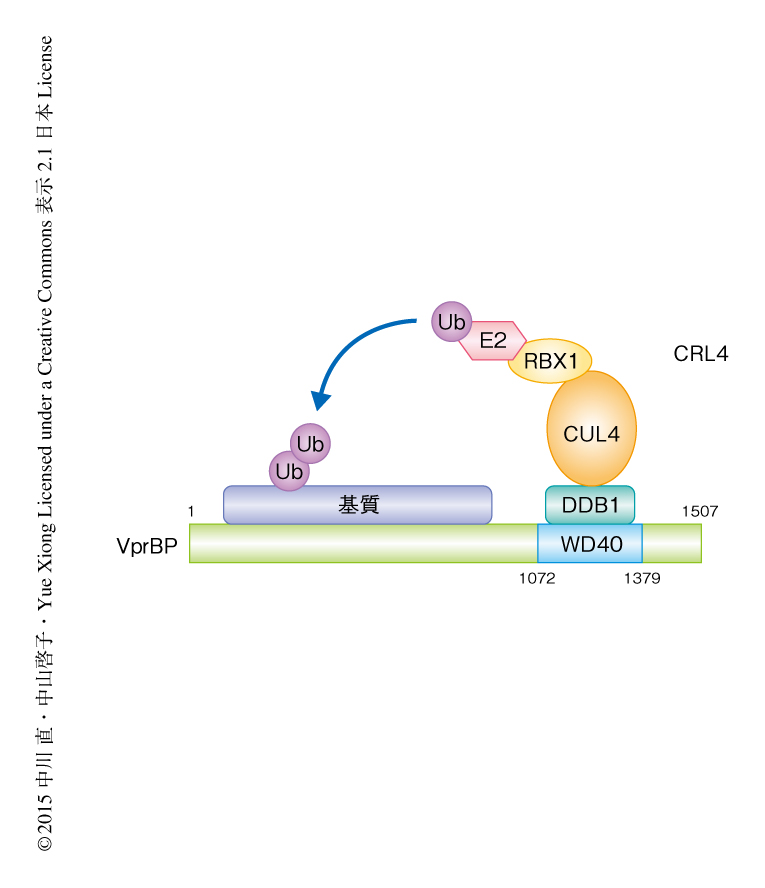
VprBPは1507アミノ酸残基から構成され,C末端側に存在するWD40ドメイン(1072残基~1379残基)を介してCRL4と結合する3).それに対し,N末端側の領域の機能は不明であった.そこで,この領域に基質が結合すると考え,VprBPのN末端側(1残基~909残基)と結合するタンパク質の同定を試みた(図1).FLAGタグを付加したVprBPのN末端側を安定して発現する293T細胞を作製し,これを含むタンパク質複合体を抗FLAG抗体により免疫沈降して,それに含まれるタンパク質を質量分析法により網羅的に同定した.同定されたタンパク質のうち,クロマチン制御タンパク質を中心にさらに解析したところ,メチル化したDNAの酸化的な脱メチル化反応を触媒するTETタンパク質との強い結合が確認された.
哺乳類の細胞にはTET1,TET2,TET3の3つのTETタンパク質が存在する4).VprBPとの結合タンパク質として同定されたのはTET2のみであったが,ほかのTETタンパク質についてもVprBPと結合するかどうか調べたところ,VprBPはいずれのTETタンパク質とも,その触媒ドメインと結合することが確認された.また,VprBPはTETタンパク質の触媒活性とは非依存的に結合することが判明した.
VprBPとの結合がTETタンパク質の活性にはたす役割について検討した.酸化ストレスはDNAを非特異的にメチル化するが,生理的な環境においても,DNAはDNAメチルトランスフェラーゼによりシトシンの5位がメチル化され機能を発揮することが知られている5).TETタンパク質はDNAに存在する5-メチル化シトシンの酸化を触媒し5-ヒドロキシメチルシトシンに変換する.TETタンパク質の活性の定量法としては,5-ヒドロキシメチルシトシンの量を抗原抗体反応により検出する方法が汎用されている.
マウスの繊維芽細胞においてVprBPをノックアウトして5-ヒドロキシメチルシトシンの量を調べたところ,顕著に減少していることがわかった.また,TET3は受精の直後に父親に由来するDNAを5-ヒドロキシメチルシトシン化することが知られているが6),TET3を供給する卵においてVprBPをノックアウトすると,父親に由来するDNAの5-ヒドロキシメチルシトシン化が低下した.これらのことから,VprBPは培養細胞においても受精卵においてもTETタンパク質の活性に必要であることが示唆された.
VprBPはユビキチンリガーゼ複合体CRL4の基質結合サブユニットと考えられたことから,VprBPと結合したTETタンパク質がCRL4を介してユビキチン化されるかどうか検討した.その結果,細胞においてTETタンパク質はモノユビキチン化されており,VprBPの過剰発現によりそのレベルは上昇することがわかった.TETタンパク質との結合領域を欠損したVprBP,CRL4との結合領域を欠損したVprBP,CRL4との結合を障害する点変異を導入したVprBPでは,この効果は認められなかったことから,VprBPはTETタンパク質およびCRL4と同時に結合し,CRL4によるTETタンパク質のユビキチン化を仲介することが示唆された.また,CRL4の構成サブユニットであるCUL4あるいはDDB1のsiRNAを用いたノックダウンによりTETタンパク質のモノユビキチン化のレベルが低下したことから,細胞においてCRL4VprBPはTETタンパク質の主要なユビキチンリガーゼであることが示唆された.試験管内再構成系においても,CRL4VprBPによるTETタンパク質のモノユビキチン化が認められた.
多くの場合,タンパク質のユビキチン化はLysの側鎖に共有結合によりユビキチンが付加される反応である.タンパク質を分解に導くタイプのポリユビキチン化の場合はユビキチン化部位が厳密に決まっていないことが多く,ユビキチン化されるLysを決定することの困難なことが多いが,モノユビキチン化の場合はいくつかの例においてユビキチン化されるLysが決定されている.そこで,TETタンパク質のユビキチン化部位の同定を試みた.はじめに,TET2のユビキチン化部位を質量分析法により同定しようとしたが,ペプチドの回収率が悪く同定できなかった.
CRL4VprBPによるTETタンパク質のモノユビキチン化はTETタンパク質の活性に必須であるため,TETタンパク質のユビキチン化部位に変異が生じユビキチン化できなくなると,TETタンパク質の活性は阻害されると考えられた.TET2ノックアウトマウスは白血病様の症状を示すが7),白血病の患者においてもTET2の変異がいくつか報告されており8),なかでも,そのいくつかはナンセンス変異であるがTET2ノックアウトマウスの表現型から機能抑制をひき起こしていると考えられた.そこで,これらのTET2の変異のうちLysの点変異を探索し,2つの点変異を見い出した.このうち,Lys1299はマウスにおいても保存されていた.白血病の患者のもつLys1299の変異はGluあるいはAsnに置換するものであったため,マウスにおいてこれらと相同の変異体を作製したところ,細胞においてモノユビキチン化のレベルは顕著に低下していた.さらに,TET1およびTET3についても相同の変異体を作製したところ,これらのモノユビキチン化のレベルも顕著に低下していた.さらに,Lys1299のユビキチン化したTET2を認識する抗体を作製し,細胞において実際にこのLysがユビキチン化されていること,および,そのユビキチン化のレベルが血清による刺激あるいは脱ユビキチン化酵素の阻害薬により上昇することを確認した.これらの結果から,CRL4VprBPはTETタンパク質のLysをモノユビキチン化し,その活性を正に制御することが示唆された.
モノユビキチン化によるTETタンパク質の活性化の分子機構について検討した.TETタンパク質のモノユビキチン化部位はTETタンパク質のあいだでよく保存されているC末端側の領域のN末端側に位置していたが,2-オキソグルタル酸およびFe2+と結合する触媒中心はそのC末端側に存在するため,このN末端側の機能は不明であった.これまでの研究から,TETタンパク質はメチル化していないDNAと結合することが示されていたため9),TETタンパク質のメチル化していないDNAとの結合能とモノユビキチン化との関係について調べた.以前の報告どおり,細胞から調製したTETタンパク質とメチル化していないDNAとの結合が試験管内において確認されたが,モノユビキチン化部位の変異体ではその結合量が減少していた.また,その結合量はVprBPを過剰発現した細胞から調製したTETタンパク質では増加していた.さらに,細胞におけるTETタンパク質のうち,免疫沈降法によりユビキチン化したTETタンパク質を濃縮するとメチル化していないDNAとの結合は増加し,逆に,ユビキチン化したTETタンパク質を除去すると結合は減少した.細胞分画法により核タンパク質をクロマチン画分と非クロマチン画分とに分画したところ,ユビキチン化したTETタンパク質はクロマチン画分に,ユビキチン化していないTETタンパク質は非クロマチン画分に回収された.クロマチン免疫沈降-塩基配列決定法を用いた以前の解析から,293T細胞におけるTET2のゲノム結合領域が網羅的に同定されている10).クロマチン免疫沈降-定量PCR法によりこれらの結合領域のうちいくつかに関し個別にTET2の結合量を調べたところ,VprBPの過剰発現は結合量を増加させるが,CRL4との結合を阻害する変異をもつVprBPではこの効果は認められなかった.また,モノユビキチン化部位に変異をもつTET2はこれらの結合領域への結合が認められなかった.以上の結果から,TETタンパク質のモノユビキチン化はクロマチンとの結合を促進することが示唆された.
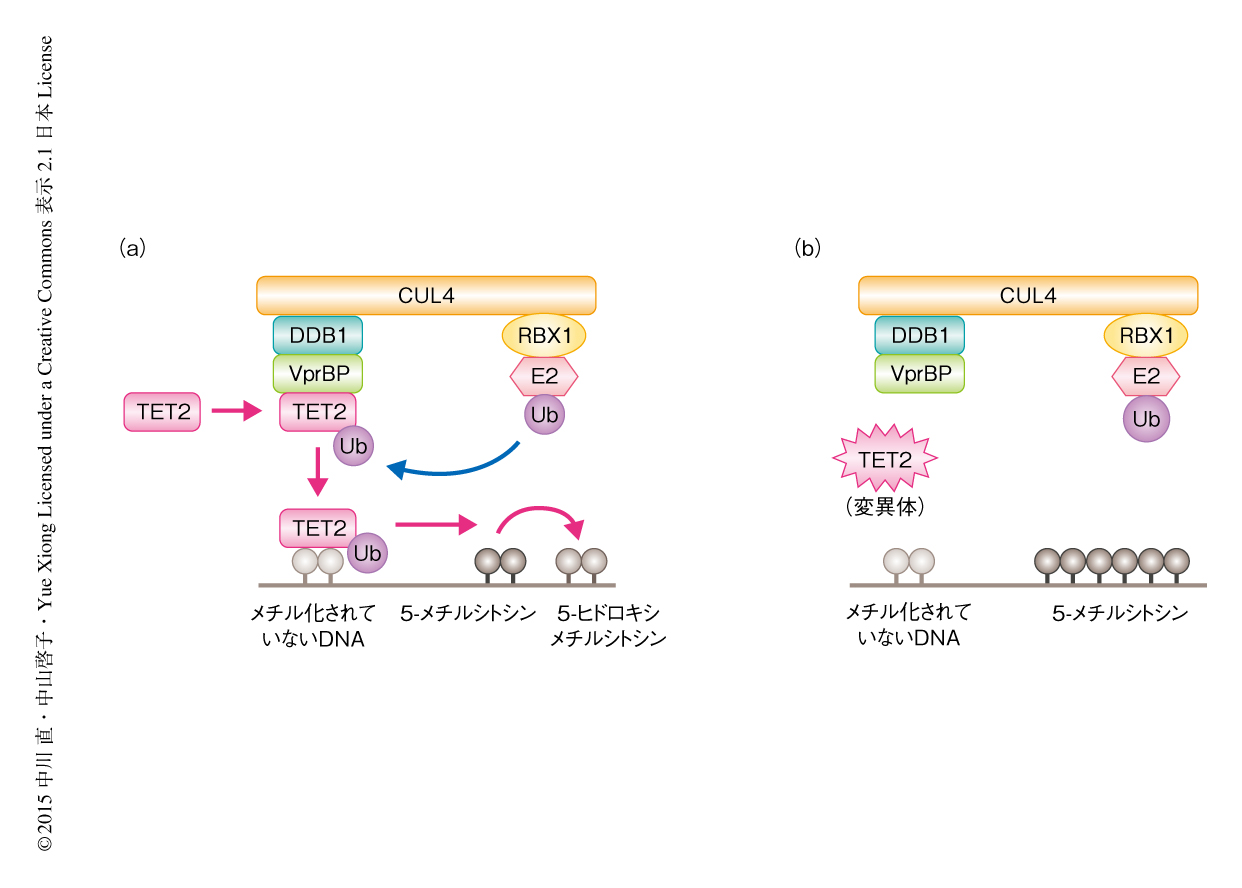
これまで述べてきたように,白血病の患者にはTET2のモノユビキチン化部位にあるLys1299に変異がみられ,この変異をもつTET2はCRL4VprBPによるモノユビキチン化をうけることができないためDNAと結合することができず活性を失っていると思われた.白血病の患者にはLys1299の周辺のアミノ酸残基にも点変異が同定されているため,これらの点変異がCRL4VprBPによるモノユビキチン化および活性に影響するかどうか検討した.その結果,Lys1299のとなりの残基,Cys1298のTyrへの変異あるいはPhe1300のSerへの変異をもつTET2は,Lys1299の変異と同様にモノユビキチン化のレベルが低く活性が認められなかった.Phe1300の変異をもつTET2はVprBPとの結合が減弱していたが,Cys1298の変異をもつTET2はVprBPとの結合に影響はなかったため,CRL4VprBPと結合したのちのLys1299のモノユビキチン化の過程が阻害されると考えられた.同様に,Arg1302のGlyへの変異をもつTET2についてもVprBPとの結合が減弱し,モノユビキチン化のレベルの低下と活性の消失が認められた.Lys1299から少し離れた,Phe1287のSerへの変異をもつTET2,Ser1292のArgへの変異をもつTET2,Glu1318のGlyへの変異をもつTET2では,VprBPとの結合,モノユビキチン化,活性がいずれも認められたため,これらの変異が白血病の発症にどのような貢献をしているのかは不明であった.以上の結果から,TET2の点変異はVprBPとの結合を阻害する,あるいは,VprBPとの結合ののちのモノユビキチン化を阻害することにより,TET2の活性を抑制し白血病を発症させることが示唆された.
今回の解析において,DWDタンパク質のひとつであるVprBPがユビキチンリガーゼ複合体CRL4とTETタンパク質との結合を仲介し,TETタンパク質のモノユビキチン化およびそれにひきつづくクロマチンとの結合を促進することを見い出した.また,白血病の患者から同定されたTET2の点変異の一部は,この経路を抑制することによりTET2の活性を消失させることが明らかになった(図2).
しかしながら,TETタンパク質のモノユビキチン化がどのようにクロマチンとの結合を促進するのかは不明である.また,VprBPはもともとヒト免疫不全ウイルスのVprと結合するタンパク質として同定されたことから,ヒト免疫不全ウイルスの病原性とTETタンパク質との関係性がうたがわれる.今後の研究により,これらのことが明らかにされることが期待される.
略歴:2008年 九州大学大学院医学研究院博士課程 修了,同年 米国North Carolina大学Chapel Hill校 博士研究員を経て,2013年より東北大学大学院医学系研究科 助教.
研究テーマ:ユビキチンリガーゼによるクロマチンの制御機構.
中山 啓子(Keiko Nakayama)
東北大学大学院医学系研究科 教授.
Yue Xiong
米国North Carolina大学Chapel Hill校Professor.
研究室URL:http://cancer.med.unc.edu/xionglab/public_html/
© 2015 中川 直・中山啓子・Yue Xiong Licensed under CC 表示 2.1 日本
(1米国North Carolina大学Chapel Hill校Lineberger Comprehensive Cancer Center,2東北大学大学院医学系研究科 細胞増殖制御分野)
email:中川 直
DOI: 10.7875/first.author.2015.015
CRL4VprBP E3 ligase promotes monoubiquitylation and chromatin binding of TET dioxygenases.
Tadashi Nakagawa, Lei Lv, Makiko Nakagawa, Yanbao Yu, Chao Yu, Ana C. D'Alessio, Keiko Nakayama, Heng-Yu Fan, Xian Chen, Yue Xiong
Molecular Cell, 57, 247-260 (2015)
要 約
エピジェネティックな修飾のひとつであるDNAのメチル化は,遺伝子発現を制御し発生や細胞の初期化などの過程に関与することが知られている.DNAのメチル化は長いあいだ不可逆的であると考えられてきたが,近年の研究から,TETタンパク質(TET1,TET2,TET3)による酸化型中間体をへて脱メチル化されることが明らかになった.しかしながら,TETタンパク質の活性制御の分子機構については不明であった.筆者らは,ユビキチンリガーゼ複合体CRL4VprBPにより3つのTETタンパク質すべてがモノユビキチン化されること,このモノユビキチン化はTETタンパク質とクロマチンとの結合を促進することを見い出した.TETタンパク質のユビキチン化部位の解析から,CRL4VprBPによるユビキチン化は白血病の患者において同定されていたいくつかのTET2のアミノ酸変異により阻害され,結果として,TET2の活性が抑制されることが判明した.以上の結果は,TETタンパク質の活性はCRL4VprBPによるモノユビキチン化により制御されており,その破綻は白血病の原因となることを示唆した.
はじめに
タンパク質はユビキチン化されると分解や局在の変化などがひき起こされ,その機能が制御される.CRL4はRBX1-CUL4-DDB1複合体をコアとして構成されるユビキチンリガーゼ複合体であり,DWDタンパク質とよばれる一群の基質結合サブユニットを介してさまざまな基質と結合しこれをユビキチン化する1).DWDタンパク質は哺乳類の細胞において30~100あると考えられているが,CDT2やDDB2などいくつかを除きほとんど解析されていない.とくに,VprBPはCRL4ともっとも強く結合するDWDタンパク質であるが,その基質は不明であった2).これまでの解析から,CRL4の基質の特徴として複製,転写,修復にかかわるクロマチン制御タンパク質の多いことが知られていた.そこで,筆者らは,VprBPの基質もクロマチン制御タンパク質である可能性が高いと想定し,VprBPに結合するタンパク質の同定および解析を行った.
1.VprBPはTETタンパク質の触媒ドメインと結合する
VprBPは1507アミノ酸残基から構成され,C末端側に存在するWD40ドメイン(1072残基~1379残基)を介してCRL4と結合する3).それに対し,N末端側の領域の機能は不明であった.そこで,この領域に基質が結合すると考え,VprBPのN末端側(1残基~909残基)と結合するタンパク質の同定を試みた(図1).FLAGタグを付加したVprBPのN末端側を安定して発現する293T細胞を作製し,これを含むタンパク質複合体を抗FLAG抗体により免疫沈降して,それに含まれるタンパク質を質量分析法により網羅的に同定した.同定されたタンパク質のうち,クロマチン制御タンパク質を中心にさらに解析したところ,メチル化したDNAの酸化的な脱メチル化反応を触媒するTETタンパク質との強い結合が確認された.
哺乳類の細胞にはTET1,TET2,TET3の3つのTETタンパク質が存在する4).VprBPとの結合タンパク質として同定されたのはTET2のみであったが,ほかのTETタンパク質についてもVprBPと結合するかどうか調べたところ,VprBPはいずれのTETタンパク質とも,その触媒ドメインと結合することが確認された.また,VprBPはTETタンパク質の触媒活性とは非依存的に結合することが判明した.
2.VprBPはTETタンパク質の触媒活性に必須である
VprBPとの結合がTETタンパク質の活性にはたす役割について検討した.酸化ストレスはDNAを非特異的にメチル化するが,生理的な環境においても,DNAはDNAメチルトランスフェラーゼによりシトシンの5位がメチル化され機能を発揮することが知られている5).TETタンパク質はDNAに存在する5-メチル化シトシンの酸化を触媒し5-ヒドロキシメチルシトシンに変換する.TETタンパク質の活性の定量法としては,5-ヒドロキシメチルシトシンの量を抗原抗体反応により検出する方法が汎用されている.
マウスの繊維芽細胞においてVprBPをノックアウトして5-ヒドロキシメチルシトシンの量を調べたところ,顕著に減少していることがわかった.また,TET3は受精の直後に父親に由来するDNAを5-ヒドロキシメチルシトシン化することが知られているが6),TET3を供給する卵においてVprBPをノックアウトすると,父親に由来するDNAの5-ヒドロキシメチルシトシン化が低下した.これらのことから,VprBPは培養細胞においても受精卵においてもTETタンパク質の活性に必要であることが示唆された.
3.CRL4VprBPはTETタンパク質のLysをモノユビキチン化する
VprBPはユビキチンリガーゼ複合体CRL4の基質結合サブユニットと考えられたことから,VprBPと結合したTETタンパク質がCRL4を介してユビキチン化されるかどうか検討した.その結果,細胞においてTETタンパク質はモノユビキチン化されており,VprBPの過剰発現によりそのレベルは上昇することがわかった.TETタンパク質との結合領域を欠損したVprBP,CRL4との結合領域を欠損したVprBP,CRL4との結合を障害する点変異を導入したVprBPでは,この効果は認められなかったことから,VprBPはTETタンパク質およびCRL4と同時に結合し,CRL4によるTETタンパク質のユビキチン化を仲介することが示唆された.また,CRL4の構成サブユニットであるCUL4あるいはDDB1のsiRNAを用いたノックダウンによりTETタンパク質のモノユビキチン化のレベルが低下したことから,細胞においてCRL4VprBPはTETタンパク質の主要なユビキチンリガーゼであることが示唆された.試験管内再構成系においても,CRL4VprBPによるTETタンパク質のモノユビキチン化が認められた.
多くの場合,タンパク質のユビキチン化はLysの側鎖に共有結合によりユビキチンが付加される反応である.タンパク質を分解に導くタイプのポリユビキチン化の場合はユビキチン化部位が厳密に決まっていないことが多く,ユビキチン化されるLysを決定することの困難なことが多いが,モノユビキチン化の場合はいくつかの例においてユビキチン化されるLysが決定されている.そこで,TETタンパク質のユビキチン化部位の同定を試みた.はじめに,TET2のユビキチン化部位を質量分析法により同定しようとしたが,ペプチドの回収率が悪く同定できなかった.
CRL4VprBPによるTETタンパク質のモノユビキチン化はTETタンパク質の活性に必須であるため,TETタンパク質のユビキチン化部位に変異が生じユビキチン化できなくなると,TETタンパク質の活性は阻害されると考えられた.TET2ノックアウトマウスは白血病様の症状を示すが7),白血病の患者においてもTET2の変異がいくつか報告されており8),なかでも,そのいくつかはナンセンス変異であるがTET2ノックアウトマウスの表現型から機能抑制をひき起こしていると考えられた.そこで,これらのTET2の変異のうちLysの点変異を探索し,2つの点変異を見い出した.このうち,Lys1299はマウスにおいても保存されていた.白血病の患者のもつLys1299の変異はGluあるいはAsnに置換するものであったため,マウスにおいてこれらと相同の変異体を作製したところ,細胞においてモノユビキチン化のレベルは顕著に低下していた.さらに,TET1およびTET3についても相同の変異体を作製したところ,これらのモノユビキチン化のレベルも顕著に低下していた.さらに,Lys1299のユビキチン化したTET2を認識する抗体を作製し,細胞において実際にこのLysがユビキチン化されていること,および,そのユビキチン化のレベルが血清による刺激あるいは脱ユビキチン化酵素の阻害薬により上昇することを確認した.これらの結果から,CRL4VprBPはTETタンパク質のLysをモノユビキチン化し,その活性を正に制御することが示唆された.
4.TETタンパク質のモノユビキチン化はクロマチンとの結合を促進する
モノユビキチン化によるTETタンパク質の活性化の分子機構について検討した.TETタンパク質のモノユビキチン化部位はTETタンパク質のあいだでよく保存されているC末端側の領域のN末端側に位置していたが,2-オキソグルタル酸およびFe2+と結合する触媒中心はそのC末端側に存在するため,このN末端側の機能は不明であった.これまでの研究から,TETタンパク質はメチル化していないDNAと結合することが示されていたため9),TETタンパク質のメチル化していないDNAとの結合能とモノユビキチン化との関係について調べた.以前の報告どおり,細胞から調製したTETタンパク質とメチル化していないDNAとの結合が試験管内において確認されたが,モノユビキチン化部位の変異体ではその結合量が減少していた.また,その結合量はVprBPを過剰発現した細胞から調製したTETタンパク質では増加していた.さらに,細胞におけるTETタンパク質のうち,免疫沈降法によりユビキチン化したTETタンパク質を濃縮するとメチル化していないDNAとの結合は増加し,逆に,ユビキチン化したTETタンパク質を除去すると結合は減少した.細胞分画法により核タンパク質をクロマチン画分と非クロマチン画分とに分画したところ,ユビキチン化したTETタンパク質はクロマチン画分に,ユビキチン化していないTETタンパク質は非クロマチン画分に回収された.クロマチン免疫沈降-塩基配列決定法を用いた以前の解析から,293T細胞におけるTET2のゲノム結合領域が網羅的に同定されている10).クロマチン免疫沈降-定量PCR法によりこれらの結合領域のうちいくつかに関し個別にTET2の結合量を調べたところ,VprBPの過剰発現は結合量を増加させるが,CRL4との結合を阻害する変異をもつVprBPではこの効果は認められなかった.また,モノユビキチン化部位に変異をもつTET2はこれらの結合領域への結合が認められなかった.以上の結果から,TETタンパク質のモノユビキチン化はクロマチンとの結合を促進することが示唆された.
5.白血病の患者のもつTET2の点変異のいくつかはVprBPによる制御を阻害する
これまで述べてきたように,白血病の患者にはTET2のモノユビキチン化部位にあるLys1299に変異がみられ,この変異をもつTET2はCRL4VprBPによるモノユビキチン化をうけることができないためDNAと結合することができず活性を失っていると思われた.白血病の患者にはLys1299の周辺のアミノ酸残基にも点変異が同定されているため,これらの点変異がCRL4VprBPによるモノユビキチン化および活性に影響するかどうか検討した.その結果,Lys1299のとなりの残基,Cys1298のTyrへの変異あるいはPhe1300のSerへの変異をもつTET2は,Lys1299の変異と同様にモノユビキチン化のレベルが低く活性が認められなかった.Phe1300の変異をもつTET2はVprBPとの結合が減弱していたが,Cys1298の変異をもつTET2はVprBPとの結合に影響はなかったため,CRL4VprBPと結合したのちのLys1299のモノユビキチン化の過程が阻害されると考えられた.同様に,Arg1302のGlyへの変異をもつTET2についてもVprBPとの結合が減弱し,モノユビキチン化のレベルの低下と活性の消失が認められた.Lys1299から少し離れた,Phe1287のSerへの変異をもつTET2,Ser1292のArgへの変異をもつTET2,Glu1318のGlyへの変異をもつTET2では,VprBPとの結合,モノユビキチン化,活性がいずれも認められたため,これらの変異が白血病の発症にどのような貢献をしているのかは不明であった.以上の結果から,TET2の点変異はVprBPとの結合を阻害する,あるいは,VprBPとの結合ののちのモノユビキチン化を阻害することにより,TET2の活性を抑制し白血病を発症させることが示唆された.
おわりに
今回の解析において,DWDタンパク質のひとつであるVprBPがユビキチンリガーゼ複合体CRL4とTETタンパク質との結合を仲介し,TETタンパク質のモノユビキチン化およびそれにひきつづくクロマチンとの結合を促進することを見い出した.また,白血病の患者から同定されたTET2の点変異の一部は,この経路を抑制することによりTET2の活性を消失させることが明らかになった(図2).
しかしながら,TETタンパク質のモノユビキチン化がどのようにクロマチンとの結合を促進するのかは不明である.また,VprBPはもともとヒト免疫不全ウイルスのVprと結合するタンパク質として同定されたことから,ヒト免疫不全ウイルスの病原性とTETタンパク質との関係性がうたがわれる.今後の研究により,これらのことが明らかにされることが期待される.
文 献
- Jackson, S. & Xiong, Y.: CRL4s: the CUL4-RING E3 ubiquitin ligases. Trends Biochem. Sci., 34, 562-570 (2009)[PubMed]
- McCall, C. M., Miliani de Marval, P. L., Chastain, P. D. 2nd et al.: Human immunodeficiency virus type 1 Vpr-binding protein VprBP, a WD40 protein associated with the DDB1-CUL4 E3 ubiquitin ligase, is essential for DNA replication and embryonic development. Mol. Cell. Biol., 28, 5621-5633 (2008)[PubMed]
- Nakagawa, T., Mondal, K. & Swanson, S. C.: VprBP (DCAF1): a promiscuous substrate recognition subunit that incorporates into both RING-family CRL4 and HECT-family EDD/UBR5 E3 ubiquitin ligases. BMC Mol. Biol., 14, 22 (2013)[PubMed]
- Ito, S., D'Alessio, A. C., Taranova, O. V. et al.: Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification. Nature, 466, 1129-1133 (2010)[PubMed] [新着論文レビュー]
- Goll, M. G. & Bestor, T. H.: Eukaryotic cytosine methyltransferases. Annu. Rev. Biochem., 74, 481-514 (2005)[PubMed]
- Nakamura, T., Liu, Y. J., Nakashima, H. et al.: PGC7 binds histone H3K9me2 to protect against conversion of 5mC to 5hmC in early embryos. Nature, 486, 415-419 (2012)[PubMed] [新着論文レビュー]
- Moran-Crusio, K., Reavie, L., Shih, A. et al.: Tet2 loss leads to increased hematopoietic stem cell self-renewal and myeloid transformation. Cancer Cell, 20, 11-24 (2011)[PubMed]
- Cimmino, L., Abdel-Wahab, O., Levine, R. L. et al.: TET family proteins and their role in stem cell differentiation and transformation. Cell Stem Cell, 9, 193-204 (2011)[PubMed]
- Ko, M., An, J., Bandukwala, H. S. et al.: Modulation of TET2 expression and 5-methylcytosine oxidation by the CXXC domain protein IDAX. Nature, 497, 122-126 (2013)[PubMed]
- Deplus, R., Delatte, B., Schwinn, M. K. et al.: TET2 and TET3 regulate GlcNAcylation and H3K4 methylation through OGT and SET1/COMPASS. EMBO J., 32, 645-655 (2013)[PubMed]
著者プロフィール
略歴:2008年 九州大学大学院医学研究院博士課程 修了,同年 米国North Carolina大学Chapel Hill校 博士研究員を経て,2013年より東北大学大学院医学系研究科 助教.
研究テーマ:ユビキチンリガーゼによるクロマチンの制御機構.
中山 啓子(Keiko Nakayama)
東北大学大学院医学系研究科 教授.
Yue Xiong
米国North Carolina大学Chapel Hill校Professor.
研究室URL:http://cancer.med.unc.edu/xionglab/public_html/
© 2015 中川 直・中山啓子・Yue Xiong Licensed under CC 表示 2.1 日本