T細胞に依存性の免疫グロブリンAの誘導には腸管のパイエル板におけるTh17細胞の可塑性が関与する
廣田 圭司
(英国Medical Research Council National Institute for Medical Research,Division of Molecular Immunology)
email:廣田圭司
DOI: 10.7875/first.author.2013.033
Plasticity of T H17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses.
Keiji Hirota, Jan-Eric Turner, Matteo Villa, João H Duarte, Jocelyne Demengeot, Oliver M. Steinmetz, Brigitta Stockinger
Nature Immunology, 14, 372-379 (2013)
腸管のパイエル板は腸管の恒常性維持のため重要なT細胞に依存性の免疫グロブリンAの産生に必須のリンパ組織である.筆者らは,インターロイキン17運命レポーターノックインマウスを用いることにより,末梢のリンパ節におけるTh17細胞は特異的に腸管組織に遊走すること,また,腸管のTh17細胞はインターロイキン23に依存せずに維持されていることを見い出した.さらに,腸管のパイエル板においてTh17細胞は濾胞性ヘルパーT細胞の表現型を獲得し,免疫グロブリンAを産生する胚中心B細胞を誘導した.また,Th17細胞を欠損する骨髄キメラマウスを作製しコレラ毒素を経口的に免疫することにより,抗原特異的なT細胞に依存性の高親和性免疫グロブリンAの産生にはTh17細胞が重要であることを明らかにした.
粘膜組織における恒常性の破綻が感染症のみならず慢性炎症性疾患やがんに結びつくことが知られており,粘膜の恒常性は免疫系および上皮細胞のバリア機能により綿密に維持されている.なかでも,多くの自然免疫細胞および獲得免疫細胞が粘膜組織に常駐しており,高次の免疫ネットワークを構築することにより健全な状態を維持している.獲得免疫系のなかで,免疫グロブリンAを産生するB細胞は粘膜における恒常性維持と生体防御に重要な役割をはたし,また,Th17細胞は粘膜固有層に常駐して積極的な腸管免疫にかかわっていることが知られている1,2).
二量体として存在する免疫グロブリンAは腸管腔に分泌される免疫グロブリンの主要なアイソタイプであり,T細胞に依存性の免疫グロブリンA産生B細胞は小腸のパイエル板において分化する.選択的免疫グロブリンA欠損免疫不全症は欧米では約600人に1人の割合でみられ,重度の臨床的な症状を示すことはまれであるが,臨床症状を呈する免疫グロブリンA欠損患者は呼吸器や腸管への感染症に罹患しやすいことが報告されている3).一方,Th17細胞は粘膜における生体防御に重要なヘルパーT細胞のサブセットであるが,過剰な活性化により自己免疫疾患を惹起することが明らかになってきた2).Th17細胞は小腸の粘膜固有層に常在し,その分化はセグメント細菌など腸管に常在する細菌叢に依存している4).注目すべきことに,セグメント細菌による刺激は腸管において免疫グロブリンAを高発現させることも知られている5).
腸管のパイエル板における免疫細胞の主要な機能は,腸管腔のサーベイランスとそれにともなう免疫グロブリンAの誘導である.分泌された免疫グロブリンAは細菌やその毒素の中和に重要である一方,常在細菌叢の多様性の形成において必須の役割をはたしている.T細胞の補助のもとB細胞の活性化は胚中心の形成を促進し,胚中心B細胞は活性化誘導シチジンデアミナーゼ(activation-induced cytidine deaminase:AID)の誘導により体細胞の超突然変異と免疫グロブリンのクラススイッチ組換えをうける.パイエル板におけるT細胞に依存性の免疫グロブリンA産生B細胞の分化とは別に,T細胞に非依存性の免疫グロブリンA産生形質細胞の分化は胚中心の形成なしに粘膜固有層において起こることが知られている.T細胞に依存性の免疫グロブリンA産生B細胞は胚中心において免疫グロブリンの抗原反応部分に体細胞超突然変異をうけることにより,高親和性免疫グロブリンAを産生する形質細胞へと分化する.これら腸管パイエル板における免疫グロブリンAの産生機構については,どのヘルパーT細胞サブセットが決定的な役割をはたしているのか明らかになっていなかった.そこで筆者らは,インターロイキン17運命レポーターノックインマウスを用いることにより,抗原特異的な免疫グロブリンAの免疫応答におけるTh17細胞の役割について調べた.
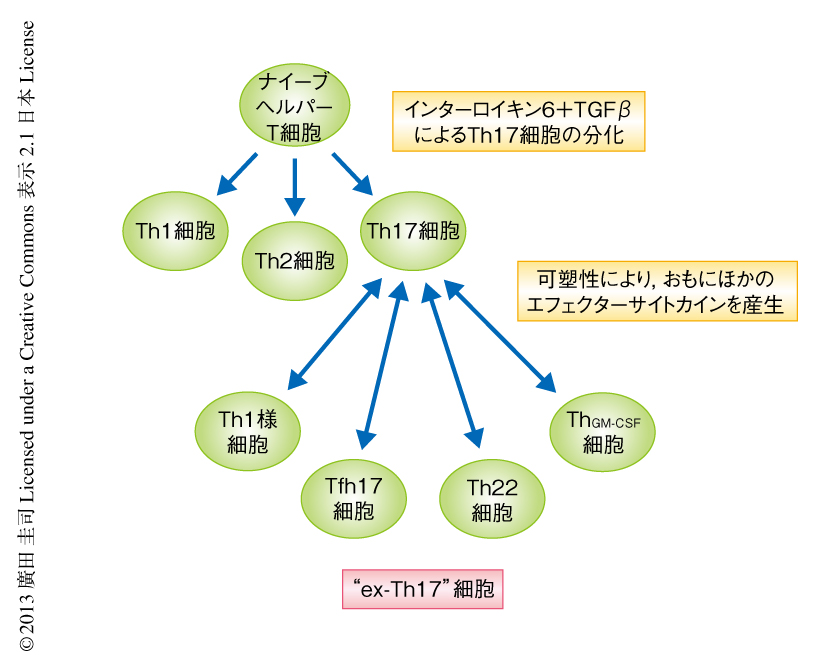
いちどインターロイキン17を高発現したTh17細胞を永続的に追跡できる系として,インターロイキン17運命レポーターノックインマウスを作製した6).この系により,細胞を固定したのちの細胞内サイトカイン染色にたよることなく,蛍光タンパク質eYFPに陽性の細胞としてTh17細胞を生きたまま追跡することが可能なだけでなく,インターロイキン17の発現を停止した“ex-Th17”細胞を同定することも可能である.したがって,インターロイキン17運命レポーターマウスはTh17細胞の潜在的な可塑性やエフェクター能を評価できる強力な研究ツールである(図1).
末梢リンパ節や脾臓では0.1%程度のCD4陽性ヘルパーT細胞はeYFPに陽性を示すTh17細胞であり,それらの大部分は細胞内染色によりTh17細胞の特徴であるインターロイキン17やマスター転写因子であるRorγtに陽性を示した.表面抗原の解析から,これらのTh17細胞は腸管遊走性の受容体であるCCR6やCD103を高発現し,T細胞欠損マウスへ養子移入したところ,腸管のパイエル板および粘膜固有層への遊走能が非常に高いことがわかった.くわえて,生理的な条件におけるTh17細胞の分化は腸内細菌叢に依存していること,および,腸管常在菌の存在しない無菌マウスでは末梢リンパ節にTh17細胞がみられなかったことから,リンパ節のTh17細胞は腸管に由来する細胞であることが示唆された.
Th17細胞のパイエル板への集積はパイエル板における胚中心B細胞への分化になんらかの役割を担っている可能性を示唆した.これまで,表面マーカーであるCXCR5,PD-1,ICOS,サイトカインであるインターロイキン21,転写因子であるBcl6を高発現する濾胞性ヘルパーT細胞は胚中心に位置するヘルパーT細胞サブセットであり,そこでのB細胞の活性化および分化に重要な役割を担っていることが明らかにされている.パイエル板において約15%のTh17細胞はCXCR5およびPD-1を高発現し,濾胞性ヘルパーT細胞の表現型に変移していることがわかった.非常に興味深いことに,インターロイキン21およびBcl6の発現が上昇した濾胞性ヘルパーT細胞への変移はパイエル板においてのみ観察され,同時に,Th17細胞の特徴であるインターロイキン17およびRorγtの発現は低下していた.
これまで,自己免疫疾患モデルにおいてTh17細胞のエフェクター機能および可塑性はインターロイキン23に依存しており,インターロイキン23欠損マウスを使った実験からTh17細胞の機能維持に必須であることが知られていた7).そこで,濾胞性ヘルパーT細胞への可塑性においてもインターロイキン23が機能しているかどうか調べるため,インターロイキン23を欠損したインターロイキン17運命レポーターノックインマウスを作製した.その結果,自己免疫反応のときのTh17細胞の機能維持への役割とは非常に対照的に,インターロイキン23は腸管においてTh17細胞の恒常的な生存維持には関与せず,Th17細胞の濾胞性ヘルパーT細胞への可塑性にも影響をあたえなかった.一方,これまでに報告されている結果と一致して,インターロイキン23は腸管においてTh17細胞のインターロイキン22産生能およびインターフェロンγを産生するTh1様細胞への可塑性に強い影響をあたえていた.
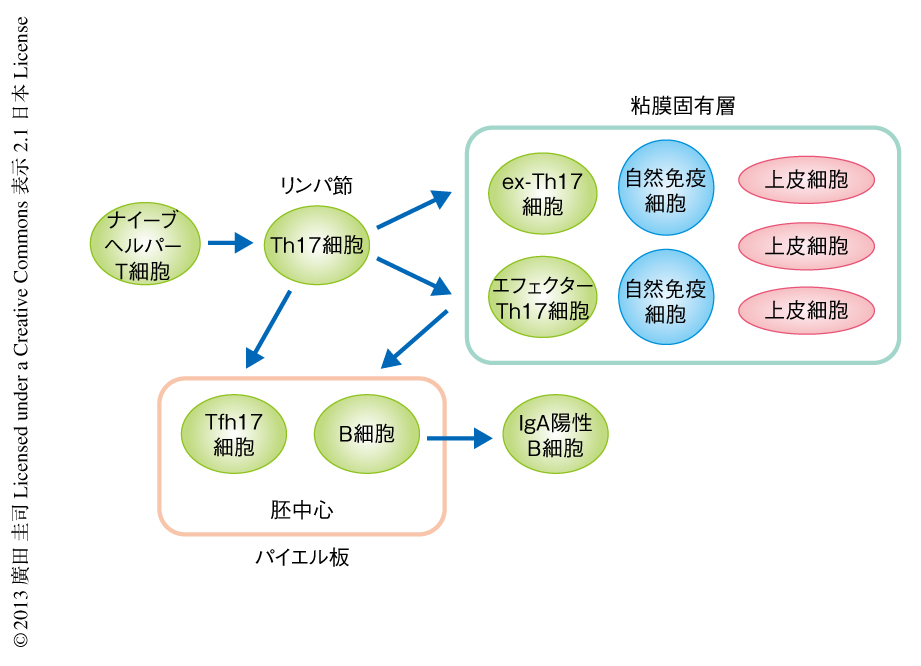
生理的な環境においてインターロイキン17の発現を停止したヘルパーT細胞(“ex-Th17”細胞)への可塑性がパイエル板においてB細胞にどのような作用をするか調べた.通常,T細胞欠損マウスはパイエル板での胚中心の形成はみられず,B細胞の活性化誘導シチジンデアミナーゼの発現は低い.T細胞欠損マウスにTh17細胞を養子移入する実験系によりB細胞に対する影響を調べると,移入されたTh17細胞は胚中心に位置し胚中心の形成促進がみられ,B細胞における活性化誘導シチジンデアミナーゼの強い上昇が観察された.さらに,その胚中心B細胞では免疫グロブリンAの産生が上昇し,血清中の免疫グロブリンアイソタイプのうち免疫グロブリンAのみが特異的に上昇した(図2).
これまでの報告では,Foxp3陽性の制御性T細胞が濾胞性ヘルパーT細胞の表現型を示し胚中心B細胞の免疫応答を制御すると報告されている8-10).とくに,パイエル板において養子移入を行った制御性T細胞が濾胞性ヘルパーT細胞の表現型を示すのかどうか,Th17細胞との共移入の系および制御性T細胞の単移入の系を用いて評価した.その結果,どちらの系においても,Th17細胞と比較して移入された制御性T細胞は濾胞性ヘルパーT細胞の表現型を示さず,腸管の制御性T細胞の単移入によっても胚中心B細胞および血清中の免疫グロブリンAの産生亢進は観察されなかった.報告されている結果8) との相違は,制御性T細胞の純化方法の違い,または,養子移入を行うレシピエントマウスの遺伝的な背景の相違に起因するのかもしれない.
T細胞欠損マウスにTh17細胞を養子移入する非生理的な実験系だけでなく,正常のマウスでのT細胞に依存的な免疫グロブリンAの産生におけるTh17細胞の役割を検証した.T細胞をもつ正常のインターロイキン17運命レポーターノックインマウスに腸管の細菌毒素であるコレラ毒素を経口投与してパイエル板におけるTh17細胞の表現型を解析したところ,ヘルパーT細胞のうちTh17細胞の割合に変化はみられなかったが,コレラ毒素の投与前はTh17細胞のうち15%程度が濾胞性ヘルパーT細胞の表現系を示していたが投与後は50%程度がこの表現型を示した.このことから,コレラ毒素の経口免疫によりTh17細胞は濾胞性ヘルパーT細胞への積極的な変移シグナルをうけていることが示唆された.この経口免疫ののち,コレラ毒素に特異的な免疫グロブリンAの産生も確認された.つぎに,これら抗原特異的な免疫グロブリンAの産生機構に対しTh17細胞が直接にかかわっているのかどうか調べるため,Rorγtを欠損した骨髄細胞をT細胞欠損マウスに対し再構築することにより骨髄キメラマウスを作製し,コレラ毒素に特異的な免疫グロブリンAの産生機構を検証した.この骨髄キメラマウスのパイエル板を解析したところ,Th1細胞,Th2細胞,および,Foxp3陽性の制御性T細胞は正常なマウスと同様に再構築されていたが,RorγtはTh17細胞のマスター転写因子であることから期待したとおり,Th17細胞への分化は阻害されていた.これら骨髄キメラマウスにコレラ毒素を経口投与したところ,対照となる骨髄キメラマウスでは正常なマウスと同様にコレラ毒素に特異的な免疫グロブリンAの産生が増加していたが,Rorγtを欠損した骨髄キメラマウスでは産生の上昇はみられなかった.これらの結果から,Th17細胞はパイエル板の胚中心B細胞における免疫グロブリンAの産生機構に必要なヘルパーT細胞サブセットであることが明らかとなった.
筆者らが以前に報告した,慢性炎症のもとで誘導される病理的なTh17細胞の可塑性のみならず6),生理的な腸管のパイエル板において生じるTh17細胞の可塑性とその機能が明らかになった.今回,新しく明らかになったTh17細胞の機能から,これまでに知られていた粘膜の上皮細胞に対する抗菌ペプチドの誘導や上皮バリア機能の亢進にくわえ,病原細菌や病原毒素に対する高親和性免疫グロブリンAを誘導することにより複数からなる粘膜の生体防御層が構築されることがわかった(図2).
今後も,運命レポーターノックインマウスを駆使することにより,これまで別のヘルパーT細胞サブセットであると考えられてきた細胞も環境因子により別のエフェクター表現型を示しているだけであって,祖先となる細胞は特定のヘルパーT細胞サブセットであることが明らかになってくるものと思われる.これらの細胞が異なる組織や環境因子に暴露することにより,もとのサブセットに機能がもどる可能性も考えられる.今後,ヘルパーT細胞サブセットのエフェクター機能および可塑性の研究が進展することにより,ヘルパーT細胞を標的とした感染症,自己免疫疾患,腫瘍,移植に対する免疫療法が可能となるかもしれない.
略歴:2006年 京都大学大学院医学研究科博士課程 修了,同年 京都大学再生医科学研究所 研究員,2007年 英国Medical Research Council National Institute for Medical Research博士研究員,2010年 同 上級研究員を経て,2012年より大阪大学免疫フロンティア研究センター 特任准教授.
研究テーマ:Th17細胞の分化および機能の制御.
抱負:Th17細胞を標的とした免疫制御法を開発したい.
© 2013 廣田 圭司 Licensed under CC 表示 2.1 日本
(英国Medical Research Council National Institute for Medical Research,Division of Molecular Immunology)
email:廣田圭司
DOI: 10.7875/first.author.2013.033
Plasticity of T H17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA responses.
Keiji Hirota, Jan-Eric Turner, Matteo Villa, João H Duarte, Jocelyne Demengeot, Oliver M. Steinmetz, Brigitta Stockinger
Nature Immunology, 14, 372-379 (2013)
要 約
腸管のパイエル板は腸管の恒常性維持のため重要なT細胞に依存性の免疫グロブリンAの産生に必須のリンパ組織である.筆者らは,インターロイキン17運命レポーターノックインマウスを用いることにより,末梢のリンパ節におけるTh17細胞は特異的に腸管組織に遊走すること,また,腸管のTh17細胞はインターロイキン23に依存せずに維持されていることを見い出した.さらに,腸管のパイエル板においてTh17細胞は濾胞性ヘルパーT細胞の表現型を獲得し,免疫グロブリンAを産生する胚中心B細胞を誘導した.また,Th17細胞を欠損する骨髄キメラマウスを作製しコレラ毒素を経口的に免疫することにより,抗原特異的なT細胞に依存性の高親和性免疫グロブリンAの産生にはTh17細胞が重要であることを明らかにした.
はじめに
粘膜組織における恒常性の破綻が感染症のみならず慢性炎症性疾患やがんに結びつくことが知られており,粘膜の恒常性は免疫系および上皮細胞のバリア機能により綿密に維持されている.なかでも,多くの自然免疫細胞および獲得免疫細胞が粘膜組織に常駐しており,高次の免疫ネットワークを構築することにより健全な状態を維持している.獲得免疫系のなかで,免疫グロブリンAを産生するB細胞は粘膜における恒常性維持と生体防御に重要な役割をはたし,また,Th17細胞は粘膜固有層に常駐して積極的な腸管免疫にかかわっていることが知られている1,2).
二量体として存在する免疫グロブリンAは腸管腔に分泌される免疫グロブリンの主要なアイソタイプであり,T細胞に依存性の免疫グロブリンA産生B細胞は小腸のパイエル板において分化する.選択的免疫グロブリンA欠損免疫不全症は欧米では約600人に1人の割合でみられ,重度の臨床的な症状を示すことはまれであるが,臨床症状を呈する免疫グロブリンA欠損患者は呼吸器や腸管への感染症に罹患しやすいことが報告されている3).一方,Th17細胞は粘膜における生体防御に重要なヘルパーT細胞のサブセットであるが,過剰な活性化により自己免疫疾患を惹起することが明らかになってきた2).Th17細胞は小腸の粘膜固有層に常在し,その分化はセグメント細菌など腸管に常在する細菌叢に依存している4).注目すべきことに,セグメント細菌による刺激は腸管において免疫グロブリンAを高発現させることも知られている5).
腸管のパイエル板における免疫細胞の主要な機能は,腸管腔のサーベイランスとそれにともなう免疫グロブリンAの誘導である.分泌された免疫グロブリンAは細菌やその毒素の中和に重要である一方,常在細菌叢の多様性の形成において必須の役割をはたしている.T細胞の補助のもとB細胞の活性化は胚中心の形成を促進し,胚中心B細胞は活性化誘導シチジンデアミナーゼ(activation-induced cytidine deaminase:AID)の誘導により体細胞の超突然変異と免疫グロブリンのクラススイッチ組換えをうける.パイエル板におけるT細胞に依存性の免疫グロブリンA産生B細胞の分化とは別に,T細胞に非依存性の免疫グロブリンA産生形質細胞の分化は胚中心の形成なしに粘膜固有層において起こることが知られている.T細胞に依存性の免疫グロブリンA産生B細胞は胚中心において免疫グロブリンの抗原反応部分に体細胞超突然変異をうけることにより,高親和性免疫グロブリンAを産生する形質細胞へと分化する.これら腸管パイエル板における免疫グロブリンAの産生機構については,どのヘルパーT細胞サブセットが決定的な役割をはたしているのか明らかになっていなかった.そこで筆者らは,インターロイキン17運命レポーターノックインマウスを用いることにより,抗原特異的な免疫グロブリンAの免疫応答におけるTh17細胞の役割について調べた.
1.インターロイキン17運命レポーターノックインマウス
いちどインターロイキン17を高発現したTh17細胞を永続的に追跡できる系として,インターロイキン17運命レポーターノックインマウスを作製した6).この系により,細胞を固定したのちの細胞内サイトカイン染色にたよることなく,蛍光タンパク質eYFPに陽性の細胞としてTh17細胞を生きたまま追跡することが可能なだけでなく,インターロイキン17の発現を停止した“ex-Th17”細胞を同定することも可能である.したがって,インターロイキン17運命レポーターマウスはTh17細胞の潜在的な可塑性やエフェクター能を評価できる強力な研究ツールである(図1).
2.末梢リンパ節のTh17細胞は腸管に親和性を示す
末梢リンパ節や脾臓では0.1%程度のCD4陽性ヘルパーT細胞はeYFPに陽性を示すTh17細胞であり,それらの大部分は細胞内染色によりTh17細胞の特徴であるインターロイキン17やマスター転写因子であるRorγtに陽性を示した.表面抗原の解析から,これらのTh17細胞は腸管遊走性の受容体であるCCR6やCD103を高発現し,T細胞欠損マウスへ養子移入したところ,腸管のパイエル板および粘膜固有層への遊走能が非常に高いことがわかった.くわえて,生理的な条件におけるTh17細胞の分化は腸内細菌叢に依存していること,および,腸管常在菌の存在しない無菌マウスでは末梢リンパ節にTh17細胞がみられなかったことから,リンパ節のTh17細胞は腸管に由来する細胞であることが示唆された.
3.Th17細胞は腸管のパイエル板において濾胞性ヘルパーT細胞の表現型へと変移する
Th17細胞のパイエル板への集積はパイエル板における胚中心B細胞への分化になんらかの役割を担っている可能性を示唆した.これまで,表面マーカーであるCXCR5,PD-1,ICOS,サイトカインであるインターロイキン21,転写因子であるBcl6を高発現する濾胞性ヘルパーT細胞は胚中心に位置するヘルパーT細胞サブセットであり,そこでのB細胞の活性化および分化に重要な役割を担っていることが明らかにされている.パイエル板において約15%のTh17細胞はCXCR5およびPD-1を高発現し,濾胞性ヘルパーT細胞の表現型に変移していることがわかった.非常に興味深いことに,インターロイキン21およびBcl6の発現が上昇した濾胞性ヘルパーT細胞への変移はパイエル板においてのみ観察され,同時に,Th17細胞の特徴であるインターロイキン17およびRorγtの発現は低下していた.
4.腸管においてインターロイキン23はTh17細胞の維持と可塑性に影響しない
これまで,自己免疫疾患モデルにおいてTh17細胞のエフェクター機能および可塑性はインターロイキン23に依存しており,インターロイキン23欠損マウスを使った実験からTh17細胞の機能維持に必須であることが知られていた7).そこで,濾胞性ヘルパーT細胞への可塑性においてもインターロイキン23が機能しているかどうか調べるため,インターロイキン23を欠損したインターロイキン17運命レポーターノックインマウスを作製した.その結果,自己免疫反応のときのTh17細胞の機能維持への役割とは非常に対照的に,インターロイキン23は腸管においてTh17細胞の恒常的な生存維持には関与せず,Th17細胞の濾胞性ヘルパーT細胞への可塑性にも影響をあたえなかった.一方,これまでに報告されている結果と一致して,インターロイキン23は腸管においてTh17細胞のインターロイキン22産生能およびインターフェロンγを産生するTh1様細胞への可塑性に強い影響をあたえていた.
5.パイエル板においてインターロイキン17の発現を停止したTh17細胞は免疫グロブリンAを産生する胚中心B細胞を誘導する
生理的な環境においてインターロイキン17の発現を停止したヘルパーT細胞(“ex-Th17”細胞)への可塑性がパイエル板においてB細胞にどのような作用をするか調べた.通常,T細胞欠損マウスはパイエル板での胚中心の形成はみられず,B細胞の活性化誘導シチジンデアミナーゼの発現は低い.T細胞欠損マウスにTh17細胞を養子移入する実験系によりB細胞に対する影響を調べると,移入されたTh17細胞は胚中心に位置し胚中心の形成促進がみられ,B細胞における活性化誘導シチジンデアミナーゼの強い上昇が観察された.さらに,その胚中心B細胞では免疫グロブリンAの産生が上昇し,血清中の免疫グロブリンアイソタイプのうち免疫グロブリンAのみが特異的に上昇した(図2).
6.Foxp3陽性の制御性T細胞は免疫グロブリンAを誘導するヘルパーT細胞サブセットではない
これまでの報告では,Foxp3陽性の制御性T細胞が濾胞性ヘルパーT細胞の表現型を示し胚中心B細胞の免疫応答を制御すると報告されている8-10).とくに,パイエル板において養子移入を行った制御性T細胞が濾胞性ヘルパーT細胞の表現型を示すのかどうか,Th17細胞との共移入の系および制御性T細胞の単移入の系を用いて評価した.その結果,どちらの系においても,Th17細胞と比較して移入された制御性T細胞は濾胞性ヘルパーT細胞の表現型を示さず,腸管の制御性T細胞の単移入によっても胚中心B細胞および血清中の免疫グロブリンAの産生亢進は観察されなかった.報告されている結果8) との相違は,制御性T細胞の純化方法の違い,または,養子移入を行うレシピエントマウスの遺伝的な背景の相違に起因するのかもしれない.
7.Th17細胞は抗原特異的な免疫グロブリンAの産生に必要なヘルパーT細胞サブセットである
T細胞欠損マウスにTh17細胞を養子移入する非生理的な実験系だけでなく,正常のマウスでのT細胞に依存的な免疫グロブリンAの産生におけるTh17細胞の役割を検証した.T細胞をもつ正常のインターロイキン17運命レポーターノックインマウスに腸管の細菌毒素であるコレラ毒素を経口投与してパイエル板におけるTh17細胞の表現型を解析したところ,ヘルパーT細胞のうちTh17細胞の割合に変化はみられなかったが,コレラ毒素の投与前はTh17細胞のうち15%程度が濾胞性ヘルパーT細胞の表現系を示していたが投与後は50%程度がこの表現型を示した.このことから,コレラ毒素の経口免疫によりTh17細胞は濾胞性ヘルパーT細胞への積極的な変移シグナルをうけていることが示唆された.この経口免疫ののち,コレラ毒素に特異的な免疫グロブリンAの産生も確認された.つぎに,これら抗原特異的な免疫グロブリンAの産生機構に対しTh17細胞が直接にかかわっているのかどうか調べるため,Rorγtを欠損した骨髄細胞をT細胞欠損マウスに対し再構築することにより骨髄キメラマウスを作製し,コレラ毒素に特異的な免疫グロブリンAの産生機構を検証した.この骨髄キメラマウスのパイエル板を解析したところ,Th1細胞,Th2細胞,および,Foxp3陽性の制御性T細胞は正常なマウスと同様に再構築されていたが,RorγtはTh17細胞のマスター転写因子であることから期待したとおり,Th17細胞への分化は阻害されていた.これら骨髄キメラマウスにコレラ毒素を経口投与したところ,対照となる骨髄キメラマウスでは正常なマウスと同様にコレラ毒素に特異的な免疫グロブリンAの産生が増加していたが,Rorγtを欠損した骨髄キメラマウスでは産生の上昇はみられなかった.これらの結果から,Th17細胞はパイエル板の胚中心B細胞における免疫グロブリンAの産生機構に必要なヘルパーT細胞サブセットであることが明らかとなった.
おわりに
筆者らが以前に報告した,慢性炎症のもとで誘導される病理的なTh17細胞の可塑性のみならず6),生理的な腸管のパイエル板において生じるTh17細胞の可塑性とその機能が明らかになった.今回,新しく明らかになったTh17細胞の機能から,これまでに知られていた粘膜の上皮細胞に対する抗菌ペプチドの誘導や上皮バリア機能の亢進にくわえ,病原細菌や病原毒素に対する高親和性免疫グロブリンAを誘導することにより複数からなる粘膜の生体防御層が構築されることがわかった(図2).
今後も,運命レポーターノックインマウスを駆使することにより,これまで別のヘルパーT細胞サブセットであると考えられてきた細胞も環境因子により別のエフェクター表現型を示しているだけであって,祖先となる細胞は特定のヘルパーT細胞サブセットであることが明らかになってくるものと思われる.これらの細胞が異なる組織や環境因子に暴露することにより,もとのサブセットに機能がもどる可能性も考えられる.今後,ヘルパーT細胞サブセットのエフェクター機能および可塑性の研究が進展することにより,ヘルパーT細胞を標的とした感染症,自己免疫疾患,腫瘍,移植に対する免疫療法が可能となるかもしれない.
文 献
- Shulzhenko, N., Morqun, A., Hsiao, W. et al.: Crosstalk between B lymphocytes, microbiota and the intestinal epithelium governs immunity versus metabolism in the gut. Nat. Med., 17, 1585-1593 (2011)[PubMed]
- Korn, T., Bettelli, E., Oukka, M. et al.: IL-17 and Th17 Cells. Annu. Rev. Immunol., 27, 485-517 (2009)[PubMed]
- Castigli, E., Wilson, S. A., Garibyan, L. et al.: TACI is mutant in common variable immunodeficiency and IgA deficiency. Nat. Genet., 37, 829-834 (2005)[PubMed]
- Ivanov, I. I., Atarashi, K., Manel, N. et al.: Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 139, 485-498 (2009)[PubMed]
- Talham, G. L., Jiang, H. Q., Bos, N. A. et al.: Segmented filamentous bacteria are potent stimuli of a physiologically normal state of the murine gut mucosal immune system. Infect. Immun., 67, 1992-2000 (1999)[PubMed]
- Hirota, K., Duarte, J. H., Veldhoen, M. et al.: Fate mapping of IL-17-producing T cells in inflammatory responses. Nat. Immunol., 12, 255-263 (2011)[PubMed] [新着論文レビュー]
- McGeachy, M. J., Chen, Y., Tato, C. M. et al.: The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat. Immunol., 10, 314-324 (2009)[PubMed]
- Tsuji, M., Komatsu, N., Kawamoto, S. et al.: Preferential generation of follicular B helper T cells from Foxp3+ T cells in gut Peyer's patches. Science, 323, 1488-1492 (2009)[PubMed]
- Linterman, M. A., Pierson, W., Lee, S. K. et al.: Foxp3+ follicular regulatory T cells control the germinal center response. Nat. Med., 17, 975-982 (2011)[PubMed]
- Chung, Y., Tanaka, S., Nurieva, R. I. et al.: Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germinal center reactions. Nat. Med., 17, 983-988 (2011)[PubMed]
著者プロフィール
略歴:2006年 京都大学大学院医学研究科博士課程 修了,同年 京都大学再生医科学研究所 研究員,2007年 英国Medical Research Council National Institute for Medical Research博士研究員,2010年 同 上級研究員を経て,2012年より大阪大学免疫フロンティア研究センター 特任准教授.
研究テーマ:Th17細胞の分化および機能の制御.
抱負:Th17細胞を標的とした免疫制御法を開発したい.
© 2013 廣田 圭司 Licensed under CC 表示 2.1 日本