免疫反応の際のインターロイキン17産生T細胞の可塑性
廣田 圭司
(英国Medical Research Council National Institute for Medical Research,Division of Molecular Immunology)
email:廣田圭司
DOI: 10.7875/first.author.2011.032
Fate mapping of IL-17-producing T cells in inflammatory responses.
Keiji Hirota, João H. Duarte, Marc Veldhoen, Eve Hornsby, Ying Li, Daniel J. Cua, Helena Ahlfors, Christoph Wilhelm, Mauro Tolaini, Ursula Menzel, Anna Garefalaki, Alexandre J. Potocnik, Brigitta Stockinger
Nature Immunology, 12, 255-263 (2011)
インターロイキン17(IL-17)の産生能力をもつヘルパーT細胞であるTh17細胞は,さまざまな炎症反応のときに異なる可塑性を示すことが明らかになった.慢性炎症のモデルである実験的自己免疫性脳脊髄炎では,Th17細胞はIL-17の産生を停止しほかの炎症性サイトカインを産生するようになった.一方,急性炎症のモデルである皮膚カンジダ感染症では,Th17細胞はIL-17の産生およびほかの炎症性サイトカインの産生を停止した.実験的自己免疫性脳脊髄炎モデルでは,脊髄に浸潤しているヘルパーT細胞の産生するインターフェロンγおよびほかの炎症性サイトカインは,ほとんどがIL-17の産生を停止したex-Th17細胞から産生されていることが明らかになった.さらに,IL-23がTh17細胞の変移に重要な因子であることも明らかになった.
Th17細胞は最近になって同定された新規のヘルパーT細胞である.このTh17細胞の分化にはIL-6とTGFβとが必須の因子であり,マスター転写因子であるRORγtおよびRORaがIL-17遺伝子の転写を直接に制御している.一方,Th17細胞の分化にはインターフェロンγ(IFNγ)を産生するTh1細胞,および,IL-4を産生するTh2細胞の分化に必要な転写因子であるT-betやGATA-3を必要としない1-4).最近,in vitroで誘導したTh17細胞は相当な可塑性を示し,容易にIFNγ産生細胞へと変移することが報告されている5).これらの結果から,Th17細胞はTh1細胞への分化における前駆細胞のひとつではないかと示唆されていた.一方,in vivoではTh17細胞の機能は安定しているという相反する報告もなされている6).
筆者らは,in vivoで分化させたTh17細胞の可塑性を調べるため,IL-17産生細胞を同定できるのみならず,以前にはIL-17を産生していたが現在ではIL-17の産生を停止しているヘルパーT細胞(ex-Th17細胞)の運命マッピングを可能にする,IL-17運命レポーターマウスを作製し解析を行った.
IL-17産生細胞の運命マッピングを可能にするにあたって,Cre遺伝子をIL-17遺伝子座に挿入したノックインマウスを作製したのち,IL-17遺伝子プロモーターにより活性化されたCre発現細胞を可視化するため,Rosa26遺伝子プロモーターのもと蛍光タンパク質eYFPを発現するレポーターマウスと掛け合わせて,IL-17運命レポーターマウスを作製した.このIL-17運命レポーターマウスの細胞はいったんCreを発現すると恒常的にeYFPによって標識され,フローサイトメトリーを用いてIL-17産生細胞ならびにex-Th17細胞を細胞内サイトカイン染色なしにeYFP陽性細胞として追跡することが可能となった.
健常マウスの脾臓および小腸の解析ではこれまでの報告と一致して,eYFPに標識されたIL-17産生細胞はCD45陽性の血球系細胞に限局しており,大部分はCD4陽性ヘルパーT細胞ならびにγδT細胞であった.つぎに,健常マウスからナイーブなCD4陽性T細胞を純化したのち,in vitroでTh1細胞,Th2細胞,Th9細胞,Th17細胞,および,誘導性制御性T細胞の誘導条件で培養を行うと,IL-17の産生をともなうTh17細胞の誘導条件でのみeYFPの誘導がみられた.また,リンパ節細胞の細胞内サイトカイン染色を行うと,eYFP陽性T細胞はIL-17を高発現する一方,IFNγの発現はまったくみられなかった.
Th17細胞に依存性の慢性自己免疫疾患のモデルである実験的自己免疫性脳脊髄炎を誘導し,免疫反応のときの生体でのeYFP陽性細胞の誘導ならびにIL-17産生細胞の安定性を調べた.免疫を行った所属リンパ節のTh17細胞とγδT細胞のIL-17およびeYFPの発現を評価すると,IL-17ならびにeYFPの発現が両方の細胞において免疫ののち増加し,eYFP陽性Th17細胞の増殖もみられた.このデータと一致して,所属リンパ節のeYFP陽性Th17細胞の大部分は細胞増殖マーカーであるKi67に陽性であった.つぎに,実験的自己免疫性脳脊髄炎を誘導したマウスの脊髄浸潤リンパ球の解析を行うと,CD4陽性ヘルパーT細胞の約75%,γδT細胞の約80%の細胞がeYFP陽性細胞であった.興味深いことに,大部分の脊髄浸潤eYFP陽性γδT細胞はIL-17産生能を保持していたが,約半分の脊髄浸潤eYFP陽性Th17細胞はIL-17の産生をすでに停止していることがわかった.
これまで,炎症組織でのヘルパーT細胞におけるIL-17とIFNγとの共産生が報告されているが,これらの細胞の発生学的な起源は明らかになっていない.この共産生細胞がex-Th17細胞に由来するものかどうかを調べるため,IL-17運命レポーターマウスに実験的自己免疫性脳脊髄炎を誘導後,所属リンパ節ならびに脊髄浸潤eYFP陽性細胞におけるIFNγ産生能を評価した.免疫3日後の所属リンパ節の解析ではIFNγ産生Th細胞はほとんどみられず,その大部分はeYFP陰性Th1細胞に由来するものであった.また,γδT細胞においても20%のIFNγ陽性細胞は完全にeYFP陰性であった.しかしながら,免疫12日後までに所属リンパ節のIFNγの産生はeYFP陽性細胞において徐々に増加し,大部分のIFNγを産生する脊髄浸潤CD4陽性T細胞はeYFP陽性のex-Th17細胞であることがわかった.対照的に,脊髄浸潤γδT細胞はIL-17産生能を維持しIFNγ産生能の獲得はみられなかった.さらに,免疫に用いたMOGペプチドによるin vitro抗原刺激でも,所属リンパ節および脊髄浸潤リンパ球ともにIFNγはeYFP陽性のex-Th17細胞から産生されることを確認した.一方,転写因子Foxp3に陽性の制御性T細胞がIL-17産生細胞に変移するという報告がなされているが,所属リンパ節および脊髄浸潤リンパ球ともにeYFP陽性細胞がFoxp3の発現を上昇させることはなかった.このことから,eYFP陽性のex-Th17細胞はほかの炎症性サイトカインの産生能を獲得する一方,免疫抑制能をもつFoxp3陽性制御性T細胞へは変移しないことが明らかになった.
つぎに,eYFP陽性Th17細胞のほかの炎症性サイトカインの産生能を調べるため,健常マウスのリンパ節,実験的自己免疫性脳脊髄炎を誘導したマウスの免疫6日後の所属リンパ節,実験的自己免疫性脳脊髄炎を誘導したマウスの脊髄浸潤リンパ球において,eYFP陽性CD4陽性T細胞におけるサイトカインの発現パターンを解析した.健常マウスのリンパ節では大部分のeYFP陽性細胞はIL-17を産生し,一部のIL-17産生細胞はGM-CSF,TNF,IL-2,IL-17Fを共産生していたが,IL-22はほとんど産生していなかった.免疫6日後の所属リンパ節ではeYFP陽性細胞はIL-17産生能を維持しつつ,一部のIL-17産生細胞がIFNγ産生能を獲得し,GM-CSF,TNF,IL-2,IL-22の発現を上昇させていた.対照的に,大部分の脊髄浸潤リンパ球のeYFP陽性細胞はIL-17の産生を停止する一方,IFNγならびにGM-CSF,TNFの発現は維持し,IL-2,IL-17F,IL-22の発現は低下させていた.これらサイトカインの解析をとおして,所属リンパ節でのTh17細胞の活性化および標的組織でのエフェクター機能,ならびに,生体でのTh17細胞のほかの炎症性サイトカイン産生細胞への可塑性が明らかになった.また,脊髄浸潤リンパ球のIFNγ産生CD4陽性T細胞の発生学的な起源はTh17細胞であり,IL-17のみを産生する細胞から,IL-17とIFNγとを共産生するステージをとおり,IFNγのみを産生する細胞へと変移することが明らかになった.
IL-17運命レポーターマウスにおけるeYFP陽性CD4陽性T細胞の集団は,IL-17陽性IFNγ陰性の細胞や,IL-17陰性IFNγ陽性の細胞など,異なった細胞を含んでいたが,この2つの細胞を分離するのに表面抗原であるケモカイン受容体CCR6が有用であることを見い出した.CCR6はIL-17産生Th17細胞に高発現し,Th17細胞のマスター転写因子であるRORγtによって誘導される7).eYFP陽性CD4陽性T細胞の集団をさらにCCR6陽性ならびにCCR6陰性の亜集団に純化したのち細胞内サイトカイン染色を行うと,CCR6陽性細胞の大部分はIL-17陽性IFNγ陰性であり,逆に,CCR6陰性細胞はIL-17陰性IFNγ陽性というサイトカインの産生パターンを示した.したがって,CCR6の発現を利用してeYFP陽性Th17細胞とeYFP陽性ex-Th17とを効率よく純化することが可能であり,脊髄浸潤リンパ球のeYFP陽性細胞を用いてこれらの細胞を純化したのち,Th17細胞からex-Th17細胞へと変移したときの転写制御を解析した.
CCR6陽性細胞はIL-17の産生能と一致してTh17細胞の特徴を維持しており,IL-23受容体およびRORγtを高発現していた.CCR6陽性細胞と比較して,CCR6陰性細胞はIL-17,IL-23受容体,RORγtの発現を低下させ,逆に,IFNγ,T-bet,IL-12受容体β2サブユニットの発現を上昇させた.しかしながら,Th17細胞に特異的に発現していることが報告されている転写因子Ah受容体8) と表面抗原IL-1受容体の発現はCCR6陰性細胞においても維持されていた.このeYPF陽性細胞に発現しているIL-1受容体の機能的な重要性を調べるため,eYFP陽性CD4陽性エフェクターT細胞ならびにeYFP陰性CD4陽性エフェクターT細胞を純化したのち,in vitroでIL-1βの存在のもと培養を行なったところ,IL-1βはeYFP陽性細胞においてIL-17の産生のみならずIFNγの産生をも増加させた.eYFP陰性IFNγ産生Th1細胞はこのIL-1受容体を発現していないことから,IL-1受容体を利用してIFNγ産生エフェクター細胞の発生学的な起源を解析することが可能であり,ヒト検体を使った研究などへの応用の可能性が示唆された.
4.IL-23シグナルはex-Th17細胞のIFNγの産生を制御する
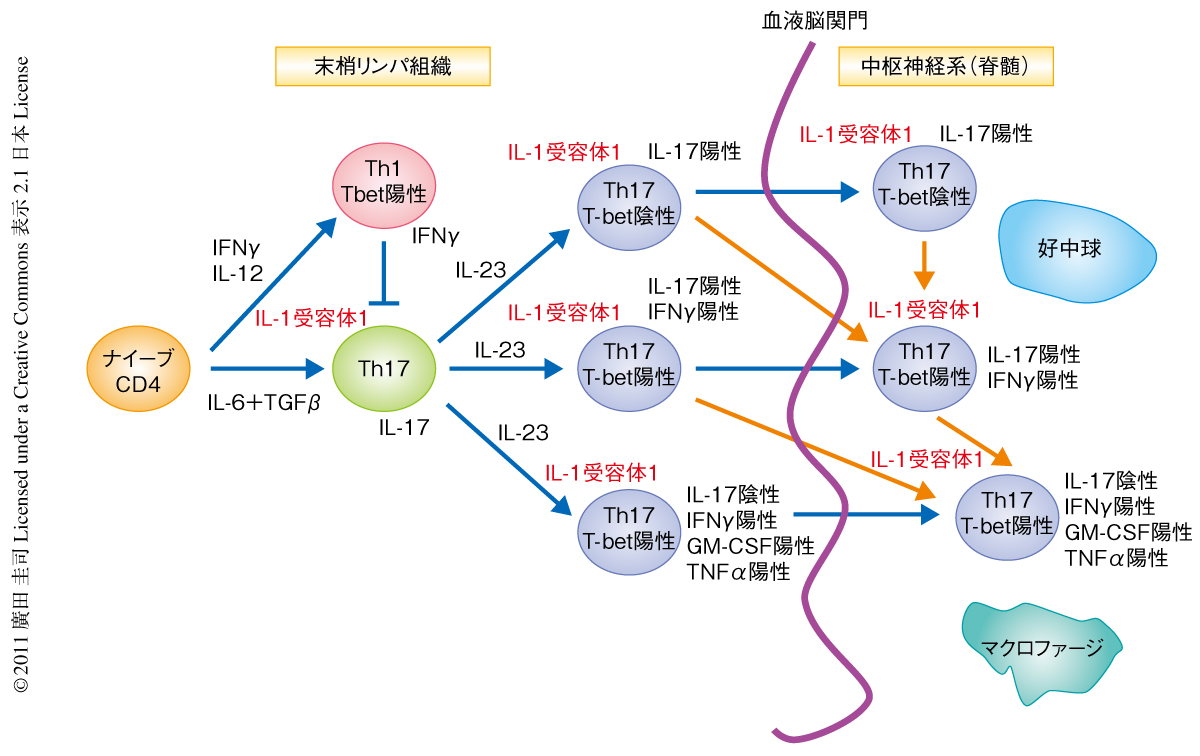
これまで,IL-23シグナルはTh17細胞の維持およびエフェクター機能に重要であることが確かめられている9).in vivoでのex-Th17細胞の変移に対するIL-23の役割を調べるため,IL-23ノックアウトマウスとIL-17運命レポーターマウスを掛け合わせてIL-23ノックアウトIL-17運命レポーターマウスを作製した.実験的自己免疫性脳脊髄炎を誘導したマウスの免疫12日後の所属リンパ節を解析すると,これまでの報告と一致してIL-23ノックアウトマウスではeYFP陽性CD4陽性T細胞が減少していた.さらに興味深いことに,IL-17運命レポーターマウスの所属リンパ節でみられるIFNγ産生eYFP陽性CD4陽性T細胞がIL-23ノックアウトマウスでは完全に欠損していた.IL-23ノックアウトマウスにおけるeYFP陽性IFNγ産生細胞の欠損の分子機構を解析するため,Th1細胞のマスター転写因子であるT-betの発現を解析した.IL-23シグナルの欠損はeYFP陰性CD4陽性T細胞におけるT-betの発現に影響をあたえない一方,eYFP陽性CD4陽性T細胞におけるT-betの発現の上昇を抑制した.IL-23受容体はeYFP陰性Th1細胞に発現していないことからも,ex-Th17細胞のIFNγ産生能の獲得においては,IL-23受容体を発現するTh17ステージを開始点とし,IL-17とIFNγとの共産生のステージを通過したのち,IL-17陰性IFNγ陽性細胞へと変移するものと考えられた.これらの結果から,IL-23シグナルはこれまで示されたようにTh17エフェクター機能に重要な役割をはたすだけでなく,IFNγ産生細胞など異なったエフェクターステージの変移にも重要な役割をはたしていることが明らかになった(図1).
自己免疫疾患モデルにおけるTh17細胞のTh1様の表現型への可塑性は報告されているが,急性炎症モデルにおけるTh17細胞の可塑性はこれまで報告されていない.そこで,IL-17の産生を欠損している患者が重篤な皮膚カンジダ感染症に苦しむこと,また,IL-17産生Th17細胞ならびにIL-17産生γδT細胞が皮膚カンジダ感染症に対する生体防御に重要なはたらきをすることのわかっていることから,この急性炎症モデルでのTh17細胞の動態を調べるためIL-17運命レポーターマウスに皮膚カンジダ感染症を誘導した.慢性炎症を起こす実験的自己免疫性脳脊髄炎とは対照的に,皮膚カンジダ感染症では感染した皮膚に好中球をはじめとする免疫細胞の集積を認め,カンジダ菌は感染後1週間以内に駆逐される.このモデルでのTh17細胞の可塑性を解析すると,実験的自己免疫性脳脊髄炎モデルと同様に,感染後5日後の皮膚に浸潤している半数以上のeYFP陽性Th17細胞はIL-17の産生を停止させていた.しかしながら,実験的自己免疫性脳脊髄炎モデルとは異なり,eYFP陽性IL-17陰性Th17細胞はほかの炎症性サイトカインの産生細胞へとは変移しなかった.これらの結果から,急性炎症あるいは慢性炎症のときのTh17細胞をとりかこむ微小環境の違いがTh17細胞の可塑性に影響をあたえていることが示唆された.
T細胞の生物学として,T細胞の最終分化,安定性,可塑性は非常に重要なトピックであり,in vivoでのT細胞の可塑性の研究に運命レポーターマウスは非常に有用なツールである.IL-17運命レポーターマウスを使った研究はこれまで報告されておらず,Th17細胞の可塑性を解析するためIL-17運命レポーターマウスは必須のツールであった.皮膚カンジダ感染症による急性炎症モデル,実験的自己免疫性脳脊髄炎による慢性炎症モデルを用いて,Th17細胞をとりかこむ微小環境がエフェクター能および可塑性に重要な影響をあたえることを明らかにした.また,実験的自己免疫性脳脊髄炎モデルにより,これまでほかのエフェクターサブセットであると考えられてきたIFNγ産生CD4陽性T細胞やGM-CSF産生CD4陽性T細胞などの発生起源もTh17細胞であり,Ah受容体やIL-1受容体を利用すれば古典的なIFNγ産生Th1細胞とも区別できることが示唆された.これらのマーカーを利用することにより,レポーター細胞の使用が不可能なヒト検体でもエフェクターサイトカイン産生細胞の発生起源を解析することが可能となり,それぞれのエフェクターT細胞に有効な治療法の選択に利用できる可能性が示唆された.
略歴:2006年 京都大学大学院医学研究科博士課程 修了,同年 京都大学再生医科学研究所 研究員を経て,2007年より英国Medical Research Council National Institute for Medical Researchにて博士研究員.
研究テーマ:Th17細胞の分化および機能の制御.
抱負:自己免疫疾患の治療法の開発の手がかりとなるような研究を発表していきたい.
© 2011 廣田 圭司 Licensed under CC 表示 2.1 日本
(英国Medical Research Council National Institute for Medical Research,Division of Molecular Immunology)
email:廣田圭司
DOI: 10.7875/first.author.2011.032
Fate mapping of IL-17-producing T cells in inflammatory responses.
Keiji Hirota, João H. Duarte, Marc Veldhoen, Eve Hornsby, Ying Li, Daniel J. Cua, Helena Ahlfors, Christoph Wilhelm, Mauro Tolaini, Ursula Menzel, Anna Garefalaki, Alexandre J. Potocnik, Brigitta Stockinger
Nature Immunology, 12, 255-263 (2011)
要 約
インターロイキン17(IL-17)の産生能力をもつヘルパーT細胞であるTh17細胞は,さまざまな炎症反応のときに異なる可塑性を示すことが明らかになった.慢性炎症のモデルである実験的自己免疫性脳脊髄炎では,Th17細胞はIL-17の産生を停止しほかの炎症性サイトカインを産生するようになった.一方,急性炎症のモデルである皮膚カンジダ感染症では,Th17細胞はIL-17の産生およびほかの炎症性サイトカインの産生を停止した.実験的自己免疫性脳脊髄炎モデルでは,脊髄に浸潤しているヘルパーT細胞の産生するインターフェロンγおよびほかの炎症性サイトカインは,ほとんどがIL-17の産生を停止したex-Th17細胞から産生されていることが明らかになった.さらに,IL-23がTh17細胞の変移に重要な因子であることも明らかになった.
はじめに
Th17細胞は最近になって同定された新規のヘルパーT細胞である.このTh17細胞の分化にはIL-6とTGFβとが必須の因子であり,マスター転写因子であるRORγtおよびRORaがIL-17遺伝子の転写を直接に制御している.一方,Th17細胞の分化にはインターフェロンγ(IFNγ)を産生するTh1細胞,および,IL-4を産生するTh2細胞の分化に必要な転写因子であるT-betやGATA-3を必要としない1-4).最近,in vitroで誘導したTh17細胞は相当な可塑性を示し,容易にIFNγ産生細胞へと変移することが報告されている5).これらの結果から,Th17細胞はTh1細胞への分化における前駆細胞のひとつではないかと示唆されていた.一方,in vivoではTh17細胞の機能は安定しているという相反する報告もなされている6).
筆者らは,in vivoで分化させたTh17細胞の可塑性を調べるため,IL-17産生細胞を同定できるのみならず,以前にはIL-17を産生していたが現在ではIL-17の産生を停止しているヘルパーT細胞(ex-Th17細胞)の運命マッピングを可能にする,IL-17運命レポーターマウスを作製し解析を行った.
1.IL-17運命レポーターマウスの作製と健常マウスでの解析
IL-17産生細胞の運命マッピングを可能にするにあたって,Cre遺伝子をIL-17遺伝子座に挿入したノックインマウスを作製したのち,IL-17遺伝子プロモーターにより活性化されたCre発現細胞を可視化するため,Rosa26遺伝子プロモーターのもと蛍光タンパク質eYFPを発現するレポーターマウスと掛け合わせて,IL-17運命レポーターマウスを作製した.このIL-17運命レポーターマウスの細胞はいったんCreを発現すると恒常的にeYFPによって標識され,フローサイトメトリーを用いてIL-17産生細胞ならびにex-Th17細胞を細胞内サイトカイン染色なしにeYFP陽性細胞として追跡することが可能となった.
健常マウスの脾臓および小腸の解析ではこれまでの報告と一致して,eYFPに標識されたIL-17産生細胞はCD45陽性の血球系細胞に限局しており,大部分はCD4陽性ヘルパーT細胞ならびにγδT細胞であった.つぎに,健常マウスからナイーブなCD4陽性T細胞を純化したのち,in vitroでTh1細胞,Th2細胞,Th9細胞,Th17細胞,および,誘導性制御性T細胞の誘導条件で培養を行うと,IL-17の産生をともなうTh17細胞の誘導条件でのみeYFPの誘導がみられた.また,リンパ節細胞の細胞内サイトカイン染色を行うと,eYFP陽性T細胞はIL-17を高発現する一方,IFNγの発現はまったくみられなかった.
2.実験的自己免疫性脳脊髄炎を誘導したときのIL-17産生T細胞の可塑性
Th17細胞に依存性の慢性自己免疫疾患のモデルである実験的自己免疫性脳脊髄炎を誘導し,免疫反応のときの生体でのeYFP陽性細胞の誘導ならびにIL-17産生細胞の安定性を調べた.免疫を行った所属リンパ節のTh17細胞とγδT細胞のIL-17およびeYFPの発現を評価すると,IL-17ならびにeYFPの発現が両方の細胞において免疫ののち増加し,eYFP陽性Th17細胞の増殖もみられた.このデータと一致して,所属リンパ節のeYFP陽性Th17細胞の大部分は細胞増殖マーカーであるKi67に陽性であった.つぎに,実験的自己免疫性脳脊髄炎を誘導したマウスの脊髄浸潤リンパ球の解析を行うと,CD4陽性ヘルパーT細胞の約75%,γδT細胞の約80%の細胞がeYFP陽性細胞であった.興味深いことに,大部分の脊髄浸潤eYFP陽性γδT細胞はIL-17産生能を保持していたが,約半分の脊髄浸潤eYFP陽性Th17細胞はIL-17の産生をすでに停止していることがわかった.
これまで,炎症組織でのヘルパーT細胞におけるIL-17とIFNγとの共産生が報告されているが,これらの細胞の発生学的な起源は明らかになっていない.この共産生細胞がex-Th17細胞に由来するものかどうかを調べるため,IL-17運命レポーターマウスに実験的自己免疫性脳脊髄炎を誘導後,所属リンパ節ならびに脊髄浸潤eYFP陽性細胞におけるIFNγ産生能を評価した.免疫3日後の所属リンパ節の解析ではIFNγ産生Th細胞はほとんどみられず,その大部分はeYFP陰性Th1細胞に由来するものであった.また,γδT細胞においても20%のIFNγ陽性細胞は完全にeYFP陰性であった.しかしながら,免疫12日後までに所属リンパ節のIFNγの産生はeYFP陽性細胞において徐々に増加し,大部分のIFNγを産生する脊髄浸潤CD4陽性T細胞はeYFP陽性のex-Th17細胞であることがわかった.対照的に,脊髄浸潤γδT細胞はIL-17産生能を維持しIFNγ産生能の獲得はみられなかった.さらに,免疫に用いたMOGペプチドによるin vitro抗原刺激でも,所属リンパ節および脊髄浸潤リンパ球ともにIFNγはeYFP陽性のex-Th17細胞から産生されることを確認した.一方,転写因子Foxp3に陽性の制御性T細胞がIL-17産生細胞に変移するという報告がなされているが,所属リンパ節および脊髄浸潤リンパ球ともにeYFP陽性細胞がFoxp3の発現を上昇させることはなかった.このことから,eYFP陽性のex-Th17細胞はほかの炎症性サイトカインの産生能を獲得する一方,免疫抑制能をもつFoxp3陽性制御性T細胞へは変移しないことが明らかになった.
つぎに,eYFP陽性Th17細胞のほかの炎症性サイトカインの産生能を調べるため,健常マウスのリンパ節,実験的自己免疫性脳脊髄炎を誘導したマウスの免疫6日後の所属リンパ節,実験的自己免疫性脳脊髄炎を誘導したマウスの脊髄浸潤リンパ球において,eYFP陽性CD4陽性T細胞におけるサイトカインの発現パターンを解析した.健常マウスのリンパ節では大部分のeYFP陽性細胞はIL-17を産生し,一部のIL-17産生細胞はGM-CSF,TNF,IL-2,IL-17Fを共産生していたが,IL-22はほとんど産生していなかった.免疫6日後の所属リンパ節ではeYFP陽性細胞はIL-17産生能を維持しつつ,一部のIL-17産生細胞がIFNγ産生能を獲得し,GM-CSF,TNF,IL-2,IL-22の発現を上昇させていた.対照的に,大部分の脊髄浸潤リンパ球のeYFP陽性細胞はIL-17の産生を停止する一方,IFNγならびにGM-CSF,TNFの発現は維持し,IL-2,IL-17F,IL-22の発現は低下させていた.これらサイトカインの解析をとおして,所属リンパ節でのTh17細胞の活性化および標的組織でのエフェクター機能,ならびに,生体でのTh17細胞のほかの炎症性サイトカイン産生細胞への可塑性が明らかになった.また,脊髄浸潤リンパ球のIFNγ産生CD4陽性T細胞の発生学的な起源はTh17細胞であり,IL-17のみを産生する細胞から,IL-17とIFNγとを共産生するステージをとおり,IFNγのみを産生する細胞へと変移することが明らかになった.
3.実験的自己免疫性脳脊髄炎を誘導したときのex-Th17細胞における転写制御
IL-17運命レポーターマウスにおけるeYFP陽性CD4陽性T細胞の集団は,IL-17陽性IFNγ陰性の細胞や,IL-17陰性IFNγ陽性の細胞など,異なった細胞を含んでいたが,この2つの細胞を分離するのに表面抗原であるケモカイン受容体CCR6が有用であることを見い出した.CCR6はIL-17産生Th17細胞に高発現し,Th17細胞のマスター転写因子であるRORγtによって誘導される7).eYFP陽性CD4陽性T細胞の集団をさらにCCR6陽性ならびにCCR6陰性の亜集団に純化したのち細胞内サイトカイン染色を行うと,CCR6陽性細胞の大部分はIL-17陽性IFNγ陰性であり,逆に,CCR6陰性細胞はIL-17陰性IFNγ陽性というサイトカインの産生パターンを示した.したがって,CCR6の発現を利用してeYFP陽性Th17細胞とeYFP陽性ex-Th17とを効率よく純化することが可能であり,脊髄浸潤リンパ球のeYFP陽性細胞を用いてこれらの細胞を純化したのち,Th17細胞からex-Th17細胞へと変移したときの転写制御を解析した.
CCR6陽性細胞はIL-17の産生能と一致してTh17細胞の特徴を維持しており,IL-23受容体およびRORγtを高発現していた.CCR6陽性細胞と比較して,CCR6陰性細胞はIL-17,IL-23受容体,RORγtの発現を低下させ,逆に,IFNγ,T-bet,IL-12受容体β2サブユニットの発現を上昇させた.しかしながら,Th17細胞に特異的に発現していることが報告されている転写因子Ah受容体8) と表面抗原IL-1受容体の発現はCCR6陰性細胞においても維持されていた.このeYPF陽性細胞に発現しているIL-1受容体の機能的な重要性を調べるため,eYFP陽性CD4陽性エフェクターT細胞ならびにeYFP陰性CD4陽性エフェクターT細胞を純化したのち,in vitroでIL-1βの存在のもと培養を行なったところ,IL-1βはeYFP陽性細胞においてIL-17の産生のみならずIFNγの産生をも増加させた.eYFP陰性IFNγ産生Th1細胞はこのIL-1受容体を発現していないことから,IL-1受容体を利用してIFNγ産生エフェクター細胞の発生学的な起源を解析することが可能であり,ヒト検体を使った研究などへの応用の可能性が示唆された.
4.IL-23シグナルはex-Th17細胞のIFNγの産生を制御する
これまで,IL-23シグナルはTh17細胞の維持およびエフェクター機能に重要であることが確かめられている9).in vivoでのex-Th17細胞の変移に対するIL-23の役割を調べるため,IL-23ノックアウトマウスとIL-17運命レポーターマウスを掛け合わせてIL-23ノックアウトIL-17運命レポーターマウスを作製した.実験的自己免疫性脳脊髄炎を誘導したマウスの免疫12日後の所属リンパ節を解析すると,これまでの報告と一致してIL-23ノックアウトマウスではeYFP陽性CD4陽性T細胞が減少していた.さらに興味深いことに,IL-17運命レポーターマウスの所属リンパ節でみられるIFNγ産生eYFP陽性CD4陽性T細胞がIL-23ノックアウトマウスでは完全に欠損していた.IL-23ノックアウトマウスにおけるeYFP陽性IFNγ産生細胞の欠損の分子機構を解析するため,Th1細胞のマスター転写因子であるT-betの発現を解析した.IL-23シグナルの欠損はeYFP陰性CD4陽性T細胞におけるT-betの発現に影響をあたえない一方,eYFP陽性CD4陽性T細胞におけるT-betの発現の上昇を抑制した.IL-23受容体はeYFP陰性Th1細胞に発現していないことからも,ex-Th17細胞のIFNγ産生能の獲得においては,IL-23受容体を発現するTh17ステージを開始点とし,IL-17とIFNγとの共産生のステージを通過したのち,IL-17陰性IFNγ陽性細胞へと変移するものと考えられた.これらの結果から,IL-23シグナルはこれまで示されたようにTh17エフェクター機能に重要な役割をはたすだけでなく,IFNγ産生細胞など異なったエフェクターステージの変移にも重要な役割をはたしていることが明らかになった(図1).
5.皮膚カンジダ感染症を誘導したときのTh17細胞の可塑性
自己免疫疾患モデルにおけるTh17細胞のTh1様の表現型への可塑性は報告されているが,急性炎症モデルにおけるTh17細胞の可塑性はこれまで報告されていない.そこで,IL-17の産生を欠損している患者が重篤な皮膚カンジダ感染症に苦しむこと,また,IL-17産生Th17細胞ならびにIL-17産生γδT細胞が皮膚カンジダ感染症に対する生体防御に重要なはたらきをすることのわかっていることから,この急性炎症モデルでのTh17細胞の動態を調べるためIL-17運命レポーターマウスに皮膚カンジダ感染症を誘導した.慢性炎症を起こす実験的自己免疫性脳脊髄炎とは対照的に,皮膚カンジダ感染症では感染した皮膚に好中球をはじめとする免疫細胞の集積を認め,カンジダ菌は感染後1週間以内に駆逐される.このモデルでのTh17細胞の可塑性を解析すると,実験的自己免疫性脳脊髄炎モデルと同様に,感染後5日後の皮膚に浸潤している半数以上のeYFP陽性Th17細胞はIL-17の産生を停止させていた.しかしながら,実験的自己免疫性脳脊髄炎モデルとは異なり,eYFP陽性IL-17陰性Th17細胞はほかの炎症性サイトカインの産生細胞へとは変移しなかった.これらの結果から,急性炎症あるいは慢性炎症のときのTh17細胞をとりかこむ微小環境の違いがTh17細胞の可塑性に影響をあたえていることが示唆された.
おわりに
T細胞の生物学として,T細胞の最終分化,安定性,可塑性は非常に重要なトピックであり,in vivoでのT細胞の可塑性の研究に運命レポーターマウスは非常に有用なツールである.IL-17運命レポーターマウスを使った研究はこれまで報告されておらず,Th17細胞の可塑性を解析するためIL-17運命レポーターマウスは必須のツールであった.皮膚カンジダ感染症による急性炎症モデル,実験的自己免疫性脳脊髄炎による慢性炎症モデルを用いて,Th17細胞をとりかこむ微小環境がエフェクター能および可塑性に重要な影響をあたえることを明らかにした.また,実験的自己免疫性脳脊髄炎モデルにより,これまでほかのエフェクターサブセットであると考えられてきたIFNγ産生CD4陽性T細胞やGM-CSF産生CD4陽性T細胞などの発生起源もTh17細胞であり,Ah受容体やIL-1受容体を利用すれば古典的なIFNγ産生Th1細胞とも区別できることが示唆された.これらのマーカーを利用することにより,レポーター細胞の使用が不可能なヒト検体でもエフェクターサイトカイン産生細胞の発生起源を解析することが可能となり,それぞれのエフェクターT細胞に有効な治療法の選択に利用できる可能性が示唆された.
文 献
- Veldhoen, M., Hocking, R. J., Atkins, C. J. et al.: TGFβ in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity, 24, 179-189 (2006)[PubMed]
- Park, H., Li, Z., Yang, X. O. et al.: A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat. Immunol., 6, 1133-1141 (2005)[PubMed]
- Hirota, K., Martin, B. & Veldhoen M.: Development, regulation and functional capacities of Th17 cells. Semin. Immunopathol., 32, 3-16 (2010)[PubMed]
- Harrington, L. E., Hatton, R. D., Mangan, P. R. et al.: Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat. Immunol., 6, 1123-1132 (2005)[PubMed]
- Murphy, K. M. & Stockinger, B.: Effector T cell plasticity: flexibility in the face of changing circumstances. Nat. Immunol., 11, 674-680 (2010)[PubMed]
- Lexberg, M. H., Taubner, A., Forster, A. et al.: Th memory for interleukin-17 expression is stable in vivo. Eur. J. Immunol., 38, 2654-2664 (2008)[PubMed]
- Hirota, K., Yoshitomi, H., Hashimoto, M. et al.: Preferential recruitment of CCR6-expressing Th17 cells to inflamed joints via CCL20 in rheumatoid arthritis and its animal model. J. Exp. Med., 204, 2803-2812 (2007)[PubMed]
- Veldhoen, M., Hirota, K., Westendorf, A. M. et al.: The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins. Nature, 453, 106-109 (2008)[PubMed]
- McGeachy, M. J., Chen, Y., Tato, C. M. et al.: The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat. Immunol., 10, 314-324 (2009)[PubMed]
著者プロフィール
略歴:2006年 京都大学大学院医学研究科博士課程 修了,同年 京都大学再生医科学研究所 研究員を経て,2007年より英国Medical Research Council National Institute for Medical Researchにて博士研究員.
研究テーマ:Th17細胞の分化および機能の制御.
抱負:自己免疫疾患の治療法の開発の手がかりとなるような研究を発表していきたい.
© 2011 廣田 圭司 Licensed under CC 表示 2.1 日本