線条体への微小な刺激はくり返される悲観的な意思決定をひき起こす
雨森賢一・雨森智子・Ann M. Graybiel
(米国Massachusetts Institute of Technology,McGovern Institute for Brain Research)
email:雨森賢一
DOI: 10.7875/first.author.2018.083
Striatal microstimulation induces persistent and repetitive negative decision-making predicted by striatal beta-band oscillation.
Ken-ichi Amemori, Satoko Amemori, Daniel J. Gibson, Ann M. Graybiel
Neuron, 99, 829-841.e6 (2018)
不必要に悲観的な考えが持続的につづいたり,同じ意思決定をくり返してしまったりという症状は,不安障害や強迫性障害においてしばしばみられる.これまで,不安障害と相関して活動する脳の領域は調べられてきたが,こうした症状に因果的にかかわる領域は同定されていない.この研究において,筆者らは,マカクザルに微小な刺激をあたえることにより,こうした症状に似た状態を生成する領野の同定をめざした.葛藤課題を用い悲観的な意思決定の定量化をとおして刺激による変化を調べ,マカクザルの尾状核の局所への微小な刺激により意思決定の変化を調べた.すると,尾状核の一部において,刺激により悲観的な価値判断の固執がひき起こされる部位が同定された.刺激をあたえている際に尾状核における電場電位を同時に記録したところ,ひき起こされた悲観的な価値判断に相関してベータ波の活動が変化することがわかった.これらのことから,尾状核の局所の神経回路は悲観的な価値判断に因果的にかかわり,尾状核における電場電位のベータ波はこの不安に似た状態と相関して活動することが示された.
不安,気分,意欲,あるいは,好き嫌いの価値判断はすべて脳のなかにある神経回路において計算され,行動に対し大きく影響する.こうした情動の情報処理は,大脳辺縁系から大脳基底核にいたるまで広く分散して存在し,つながりをもつ大きな神経回路を形成することがわかってきた.筆者らは,先行研究において,マカクザルの前帯状回皮質膝前部1) への微小な電気刺激により罰の過大評価がひき起こされることを見い出した2)(新着論文レビュー でも掲載).この前帯状回皮質膝前部の解剖学的な結合関係から,線条体のストリオソーム構造がこの部位のおもな投射先であることが知られている3).この知見にもとづき,筆者らはさらに,ラットにおいて対応する脳の部位を調べ,前辺縁系皮質からストリオソームにいたる経路を光遺伝学的な手法により選択的に操作することにより,線条体のストリオソーム構造が不安の生成に因果的にかかわることをつきとめた4).また,このラットの前辺縁系皮質-線条体ストリオソームの経路は慢性ストレスののちの意思決定の変化にも関与することが明らかにされた5).これら一連の研究から,前帯状回皮質膝前部と線条体には結合関係があり,ともに不安の生成および制御にかかわると考えられた.それでは,前帯状回皮質膝前部と線条体とに機能の違いはあるのだろうか? この研究においては,これまでの研究をさらに進め,霊長類であるマカクザルの線条体の尾状核を対象として,微小刺激法を用いて尾状核の局所の神経回路の機能を調べ,さらに,前帯状回皮質膝前部との違いを明らかにしようとした.
報酬と罰とが組み合わされたとき,その組合せを受け入れるのか,拒否するのかを意思決定しているマカクザルの脳の活動を記録しながら,神経回路を操作することにより尾状核の局所の神経回路の機能を同定した.報酬と同時に罰があたえられた場合,その報酬と罰の組合せを受け入れるか(接近),拒否するのか(回避)という意思決定には心理的な葛藤が生じる(接近回避の葛藤).この接近回避の意思決定は不安やうつといった情動や気分と深い関係がある6).たとえば,不安を感じやすい人は回避の選択が多く,逆に,うつの人は接近の選択が有意に少ない7).さらに,このパラダイムは動物を用いて抗不安薬の効用を定量化するための実験などにも用いられており,とくに,ジアゼパムなどの抗不安薬は接近の選択を有意に増加させることが知られている8).神経経済学的な手法を用いると,ロジスティック回帰を用いて意思決定のパターンからどのように利得と罰を計算しているかという期待効用を導くことができ,さらに,どのように利得と罰を統合しているかも数理モデル化される.とくに,利得と罰を統合する際の係数の比をコスト対利益比として,これに注目した.このコスト対利益比は意思決定マトリクスにおいて接近/回避の意思決定の境界線の傾きに対応する.
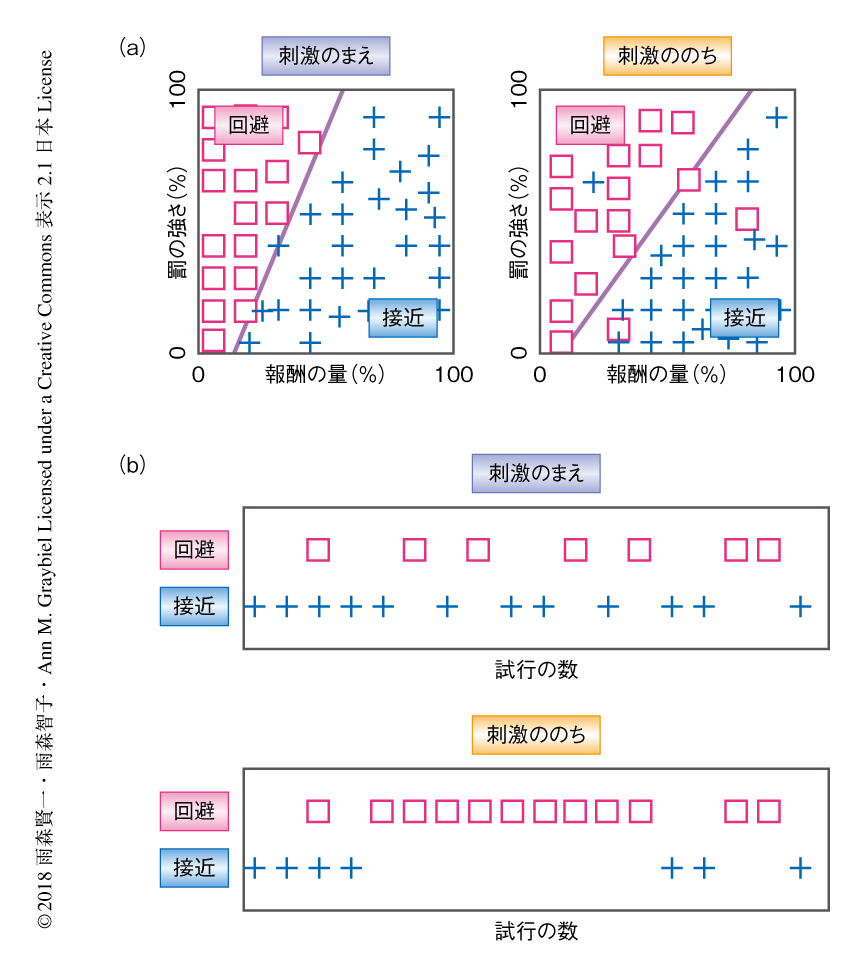
刺激のまえに意思決定のパターンを記録し,尾状核を刺激している際にその意思決定のパターンが変化するかどうか調べた.すると,12%の部位において尾状核への刺激は接近の選択を有意に増加させ,“ポジティブ”な神経回路と同定された.22%の部位において尾状核への刺激は回避の選択を増加させ,“ネガティブ”な神経回路と同定された.このポジティブ神経回路とネガティブ神経回路は尾状核において分散して存在した.とくに,ネガティブ神経回路における刺激の効果についてくわしく調べたところ,刺激は接近/回避の意思決定の境界線の傾きをおもに変化させ,コスト対利益比が有意に上昇することがわかった(図1a).このことから,ネガティブ神経回路に対する刺激は罰に対する過大評価をひき起こすと考えられた.さらに,この効果は刺激を停止してももとにもどることはなく,この悲観的な状態は刺激ののちにも持続する傾向がみられた.
刺激の際の意思決定のパターンをよりくわしく調べたところ,回避の選択の異常なくり返しが統計的に有意に増加していた(図1b).このことから,尾状核への刺激は価値判断の変化だけではなく,意思決定の固執もひき起こすことが示唆された.この意思決定の固執が尾状核への刺激に特徴的な現象であるかどうかを調べるため,以前の実験において記録された,前帯状回皮質膝前部への刺激の効果と比較した.すると,前帯状回皮質膝前部への刺激は回避の選択を増加させるが回避の選択の異常なくり返しはひき起こさず,意思決定の固執は尾状核への刺激にのみみられることがわかった.以上のことから,前帯状回皮質膝前部と尾状核は結合関係にあるが,刺激によりひき起こされる効果には違いがあると考えられた.こうした回避の選択の異常なくり返しは,意思決定の柔軟な変更ができず悲観的な価値判断に固執してしまう現象を表わすものと考えられた.
こうした持続する悲観的な意思決定をささえる神経基盤はどのようなものなのだろうか? これを明らかにするため,刺激をあたえている際に多点埋め込み電極から神経活動を同時に記録し,尾状核の多点における電場電位を解析した.すると,意思決定を予期的にコードする尾状核のベータ波が見い出された.このベータ波の集団平均をくわしく調べると,長期的に持続する刺激の効果に相関して強度が変化することがわかった.したがって,尾状核の一部のベータ波は,こうした持続する悲観的な意思決定をささえる神経基盤になりうると考えられた.
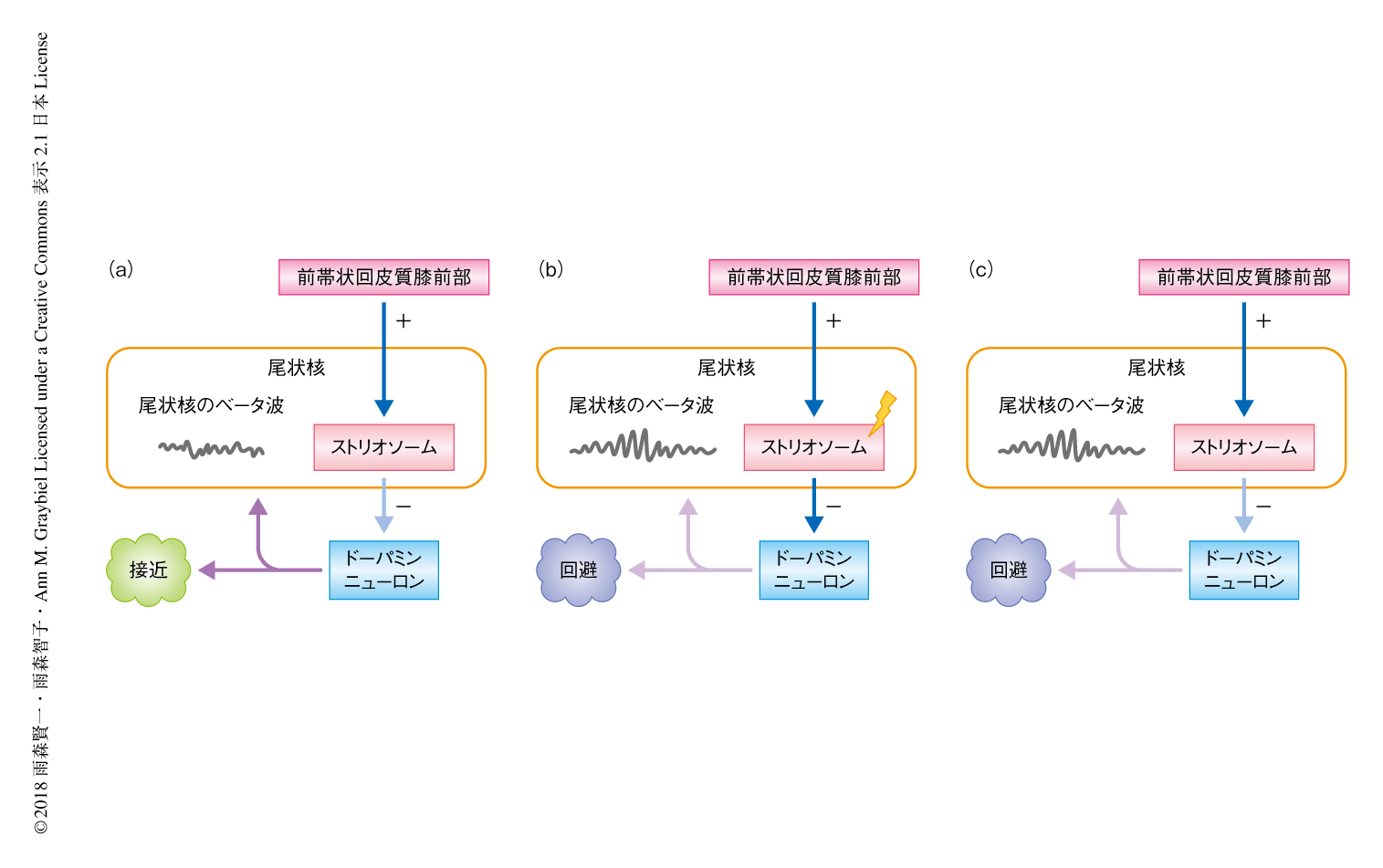
これらの効果はどのような機構により生じるのだろうか? 詳細についてはまだわかっていないことが多いが,ひとつの仮説として,以下のように説明される(図2).筆者らの研究を含むマカクザルやラットを用いた一連の研究から,刺激により罰の過大評価がひき起こされるネガティブ神経回路は,ドーパミンに対し直接の投射があると考えられるストリオソーム構造に対応する可能性がある.その場合,ストリオソーム構造への微小な刺激はドーパミンニューロンを抑制することにより,罰の過大評価をひき起こすと考えられる.この抑制により,ドーパミンニューロンの投射先の線条体においてドーパミンの濃度が一時的に低下し,それにともない,線条体の神経活動に可塑的な変化がひき起こされた可能性がある.実際に,線条体においてドーパミンと拮抗するアセチルコリンの濃度を上昇させると,線条体のベータ波の活動が増強されることが知られている9).このことから,行動の変化との相関した尾状核のベータ波の活動の変化は,尾状核におけるドーパミンとアセチルコリンのバランスの変化に起因した可塑的な変化をともなうのかもしれない.
現在,不安障害,強迫性障害,うつ病に対しては病状の深刻度にかかわらず投薬による対処的な治療がおもに選択されている.しかし,薬物による治療は脳の全体に作用するため大きな副作用がさけられず,効果にもばらつきがある.このことから,標的となる局所の神経回路だけに作用する深部脳刺激法が,投薬による効果の望めない深刻なうつ病や強迫性障害などに用いられるようになった.しかしながら,局所の神経回路の操作による行動の変容についてはまだ不明な点が多く,精神疾患に対する決定的な治療法とはなりえていない.この状況を打開するためには,症例報告にとどまらず,ヒトと脳の相同性をもつ霊長類の情動にかかわる神経回路の体系的な研究がもとめられている.
筆者らの研究により,前帯状回皮質膝前部および尾状核の一部の異常な神経活動により罰の過大評価がひき起こされることが明らかにされた.この罰の過大評価は,普通の状態では気にならないちょっとした罰に対する感受性を増加させ,“心配事がずっと頭にうかんでいる”慢性の不安状態ともとらえられる.さらに,尾状核の異常な神経活動により悲観的な意思決定の固執もひき起こされた.これは前帯状回皮質膝前部の異常な神経活動によりひき起こされなかったことから,尾状核に特徴的な症状である.強迫性障害においては,自分でもつまらないことだとわかっていても,そのことが頭からはなれず,わかっていながら何度も同じ作業をくり返してしまう.尾状核の刺激によりひき起こされる悲観的な状態において大脳皮質は操作されていないことから,自己モニタリングが正常で“自分でもわかっているのに”くり返してしまうという強迫性障害に似た現象なのかもしれない.
うつ病や不安障害は人口の約25%が一生に1回は罹患する一般的な病気である.また,強迫性障害も人口の2%と決してめずらしい病気ではない.この疾患をふせぐ手段をみつけるための不安にかかわる神経回路の研究は,とくにラットやマウスなどを用いて薬理学的および行動学的な手法により進められている.また,生理学的な研究においても,光遺伝学的な手法など遺伝子組換え技術を用いることにより神経回路のレベルの機能が同定されてきている.しかし,将来的にヒトに対する応用を考えるならば,ヒトと脳の相同性をもつ霊長類を用いて,ヒトと同じような高度な判断能力を定量化するような研究が必要となるだろう.この研究においては,霊長類の尾状核を対象とし,不安障害やうつ病に深くかかわる葛藤をともなう意思決定の機構を解明することを目的とした.将来的には,こうした一連の研究がヒトの不安障害やうつ病を治療するための基盤となることを期待している.
略歴:2001年 奈良先端科学技術大学院大学 修了,北海道大学大学院医学研究科 助手,2005年 米国Massachusetts Institute of Technology博士研究員,2009年 同Research Scientistを経て,2017年より京都大学白眉センター 特定准教授.
研究テーマ:霊長類の情動および意思決定におけるシステム神経科学.
関心事:神経系の数理科学,神経工学,情動および社会性の脳機構,精神医学.
雨森 智子(Satoko Amemori)
略歴:2007年 北海道大学大学院医学研究科 修了,2009年 米国Massachusetts Institute of Technology博士研究員,同Research Scientistを経て,2017年より同Research Affiliate.
Ann M. Graybiel
米国Massachusetts Institute of TechnologyにてInstitute Professor.
研究室URL:http://www.graybiel-lab.com/
© 2018 雨森賢一・雨森智子・Ann M. Graybiel Licensed under CC 表示 2.1 日本
(米国Massachusetts Institute of Technology,McGovern Institute for Brain Research)
email:雨森賢一
DOI: 10.7875/first.author.2018.083
Striatal microstimulation induces persistent and repetitive negative decision-making predicted by striatal beta-band oscillation.
Ken-ichi Amemori, Satoko Amemori, Daniel J. Gibson, Ann M. Graybiel
Neuron, 99, 829-841.e6 (2018)
要 約
不必要に悲観的な考えが持続的につづいたり,同じ意思決定をくり返してしまったりという症状は,不安障害や強迫性障害においてしばしばみられる.これまで,不安障害と相関して活動する脳の領域は調べられてきたが,こうした症状に因果的にかかわる領域は同定されていない.この研究において,筆者らは,マカクザルに微小な刺激をあたえることにより,こうした症状に似た状態を生成する領野の同定をめざした.葛藤課題を用い悲観的な意思決定の定量化をとおして刺激による変化を調べ,マカクザルの尾状核の局所への微小な刺激により意思決定の変化を調べた.すると,尾状核の一部において,刺激により悲観的な価値判断の固執がひき起こされる部位が同定された.刺激をあたえている際に尾状核における電場電位を同時に記録したところ,ひき起こされた悲観的な価値判断に相関してベータ波の活動が変化することがわかった.これらのことから,尾状核の局所の神経回路は悲観的な価値判断に因果的にかかわり,尾状核における電場電位のベータ波はこの不安に似た状態と相関して活動することが示された.
はじめに
不安,気分,意欲,あるいは,好き嫌いの価値判断はすべて脳のなかにある神経回路において計算され,行動に対し大きく影響する.こうした情動の情報処理は,大脳辺縁系から大脳基底核にいたるまで広く分散して存在し,つながりをもつ大きな神経回路を形成することがわかってきた.筆者らは,先行研究において,マカクザルの前帯状回皮質膝前部1) への微小な電気刺激により罰の過大評価がひき起こされることを見い出した2)(新着論文レビュー でも掲載).この前帯状回皮質膝前部の解剖学的な結合関係から,線条体のストリオソーム構造がこの部位のおもな投射先であることが知られている3).この知見にもとづき,筆者らはさらに,ラットにおいて対応する脳の部位を調べ,前辺縁系皮質からストリオソームにいたる経路を光遺伝学的な手法により選択的に操作することにより,線条体のストリオソーム構造が不安の生成に因果的にかかわることをつきとめた4).また,このラットの前辺縁系皮質-線条体ストリオソームの経路は慢性ストレスののちの意思決定の変化にも関与することが明らかにされた5).これら一連の研究から,前帯状回皮質膝前部と線条体には結合関係があり,ともに不安の生成および制御にかかわると考えられた.それでは,前帯状回皮質膝前部と線条体とに機能の違いはあるのだろうか? この研究においては,これまでの研究をさらに進め,霊長類であるマカクザルの線条体の尾状核を対象として,微小刺激法を用いて尾状核の局所の神経回路の機能を調べ,さらに,前帯状回皮質膝前部との違いを明らかにしようとした.
1.接近回避の葛藤をともなう意思決定と価値判断のモデル
報酬と罰とが組み合わされたとき,その組合せを受け入れるのか,拒否するのかを意思決定しているマカクザルの脳の活動を記録しながら,神経回路を操作することにより尾状核の局所の神経回路の機能を同定した.報酬と同時に罰があたえられた場合,その報酬と罰の組合せを受け入れるか(接近),拒否するのか(回避)という意思決定には心理的な葛藤が生じる(接近回避の葛藤).この接近回避の意思決定は不安やうつといった情動や気分と深い関係がある6).たとえば,不安を感じやすい人は回避の選択が多く,逆に,うつの人は接近の選択が有意に少ない7).さらに,このパラダイムは動物を用いて抗不安薬の効用を定量化するための実験などにも用いられており,とくに,ジアゼパムなどの抗不安薬は接近の選択を有意に増加させることが知られている8).神経経済学的な手法を用いると,ロジスティック回帰を用いて意思決定のパターンからどのように利得と罰を計算しているかという期待効用を導くことができ,さらに,どのように利得と罰を統合しているかも数理モデル化される.とくに,利得と罰を統合する際の係数の比をコスト対利益比として,これに注目した.このコスト対利益比は意思決定マトリクスにおいて接近/回避の意思決定の境界線の傾きに対応する.
2.尾状核への刺激により持続的な罰の過大評価がひき起される
刺激のまえに意思決定のパターンを記録し,尾状核を刺激している際にその意思決定のパターンが変化するかどうか調べた.すると,12%の部位において尾状核への刺激は接近の選択を有意に増加させ,“ポジティブ”な神経回路と同定された.22%の部位において尾状核への刺激は回避の選択を増加させ,“ネガティブ”な神経回路と同定された.このポジティブ神経回路とネガティブ神経回路は尾状核において分散して存在した.とくに,ネガティブ神経回路における刺激の効果についてくわしく調べたところ,刺激は接近/回避の意思決定の境界線の傾きをおもに変化させ,コスト対利益比が有意に上昇することがわかった(図1a).このことから,ネガティブ神経回路に対する刺激は罰に対する過大評価をひき起こすと考えられた.さらに,この効果は刺激を停止してももとにもどることはなく,この悲観的な状態は刺激ののちにも持続する傾向がみられた.
3.尾状核への刺激により悲観的な意思決定の固執がひき起される
刺激の際の意思決定のパターンをよりくわしく調べたところ,回避の選択の異常なくり返しが統計的に有意に増加していた(図1b).このことから,尾状核への刺激は価値判断の変化だけではなく,意思決定の固執もひき起こすことが示唆された.この意思決定の固執が尾状核への刺激に特徴的な現象であるかどうかを調べるため,以前の実験において記録された,前帯状回皮質膝前部への刺激の効果と比較した.すると,前帯状回皮質膝前部への刺激は回避の選択を増加させるが回避の選択の異常なくり返しはひき起こさず,意思決定の固執は尾状核への刺激にのみみられることがわかった.以上のことから,前帯状回皮質膝前部と尾状核は結合関係にあるが,刺激によりひき起こされる効果には違いがあると考えられた.こうした回避の選択の異常なくり返しは,意思決定の柔軟な変更ができず悲観的な価値判断に固執してしまう現象を表わすものと考えられた.
4.尾状核における電場電位のベータ波は悲観的な価値判断の固執と相関した変化を示す
こうした持続する悲観的な意思決定をささえる神経基盤はどのようなものなのだろうか? これを明らかにするため,刺激をあたえている際に多点埋め込み電極から神経活動を同時に記録し,尾状核の多点における電場電位を解析した.すると,意思決定を予期的にコードする尾状核のベータ波が見い出された.このベータ波の集団平均をくわしく調べると,長期的に持続する刺激の効果に相関して強度が変化することがわかった.したがって,尾状核の一部のベータ波は,こうした持続する悲観的な意思決定をささえる神経基盤になりうると考えられた.
これらの効果はどのような機構により生じるのだろうか? 詳細についてはまだわかっていないことが多いが,ひとつの仮説として,以下のように説明される(図2).筆者らの研究を含むマカクザルやラットを用いた一連の研究から,刺激により罰の過大評価がひき起こされるネガティブ神経回路は,ドーパミンに対し直接の投射があると考えられるストリオソーム構造に対応する可能性がある.その場合,ストリオソーム構造への微小な刺激はドーパミンニューロンを抑制することにより,罰の過大評価をひき起こすと考えられる.この抑制により,ドーパミンニューロンの投射先の線条体においてドーパミンの濃度が一時的に低下し,それにともない,線条体の神経活動に可塑的な変化がひき起こされた可能性がある.実際に,線条体においてドーパミンと拮抗するアセチルコリンの濃度を上昇させると,線条体のベータ波の活動が増強されることが知られている9).このことから,行動の変化との相関した尾状核のベータ波の活動の変化は,尾状核におけるドーパミンとアセチルコリンのバランスの変化に起因した可塑的な変化をともなうのかもしれない.
おわりに
現在,不安障害,強迫性障害,うつ病に対しては病状の深刻度にかかわらず投薬による対処的な治療がおもに選択されている.しかし,薬物による治療は脳の全体に作用するため大きな副作用がさけられず,効果にもばらつきがある.このことから,標的となる局所の神経回路だけに作用する深部脳刺激法が,投薬による効果の望めない深刻なうつ病や強迫性障害などに用いられるようになった.しかしながら,局所の神経回路の操作による行動の変容についてはまだ不明な点が多く,精神疾患に対する決定的な治療法とはなりえていない.この状況を打開するためには,症例報告にとどまらず,ヒトと脳の相同性をもつ霊長類の情動にかかわる神経回路の体系的な研究がもとめられている.
筆者らの研究により,前帯状回皮質膝前部および尾状核の一部の異常な神経活動により罰の過大評価がひき起こされることが明らかにされた.この罰の過大評価は,普通の状態では気にならないちょっとした罰に対する感受性を増加させ,“心配事がずっと頭にうかんでいる”慢性の不安状態ともとらえられる.さらに,尾状核の異常な神経活動により悲観的な意思決定の固執もひき起こされた.これは前帯状回皮質膝前部の異常な神経活動によりひき起こされなかったことから,尾状核に特徴的な症状である.強迫性障害においては,自分でもつまらないことだとわかっていても,そのことが頭からはなれず,わかっていながら何度も同じ作業をくり返してしまう.尾状核の刺激によりひき起こされる悲観的な状態において大脳皮質は操作されていないことから,自己モニタリングが正常で“自分でもわかっているのに”くり返してしまうという強迫性障害に似た現象なのかもしれない.
うつ病や不安障害は人口の約25%が一生に1回は罹患する一般的な病気である.また,強迫性障害も人口の2%と決してめずらしい病気ではない.この疾患をふせぐ手段をみつけるための不安にかかわる神経回路の研究は,とくにラットやマウスなどを用いて薬理学的および行動学的な手法により進められている.また,生理学的な研究においても,光遺伝学的な手法など遺伝子組換え技術を用いることにより神経回路のレベルの機能が同定されてきている.しかし,将来的にヒトに対する応用を考えるならば,ヒトと脳の相同性をもつ霊長類を用いて,ヒトと同じような高度な判断能力を定量化するような研究が必要となるだろう.この研究においては,霊長類の尾状核を対象とし,不安障害やうつ病に深くかかわる葛藤をともなう意思決定の機構を解明することを目的とした.将来的には,こうした一連の研究がヒトの不安障害やうつ病を治療するための基盤となることを期待している.
文 献
- Vogt, B. A.: Cingulate Neurobiology and Disease. Oxford University Press, Oxford (2009)
- Amemori, K. & Graybiel, A. M.: Localized microstimulation of primate pregenual cingulate cortex induces negative decision-making. Nat. Neurosci., 15, 776-785 (2012)[PubMed] [新着論文レビュー]
- Eblen, F. & Graybiel, A. M.: Highly restricted origin of prefrontal cortical inputs to striosomes in the macaque monkey. J. Neurosci., 15, 5999-6013 (1995)[PubMed]
- Friedman, A., Homma, D., Gibb, L. G. et al.: A corticostriatal path targeting striosomes controls decision-making under conflict. Cell, 161, 1320-1333 (2015)[PubMed]
- Friedman, A., Homma, D., Bloem, B. et al.: Chronic stress alters striosome-circuit dynamics, leading to aberrant decision-making. Cell, 171, 1191-1205 (2017)[PubMed]
- Aupperle, R. L. & Paulus, M. P.: Neural systems underlying approach and avoidance in anxiety disorders. Dialogues Clin. Neurosci., 12, 517-531 (2010)[PubMed]
- Dickson, J. M. & MacLeod, A. K.: Approach and avoidance goals and plans: their relationship to anxiety and depression. Cognit. Ther. Res., 28, 415-432 (2004)
- Vogel, J. R., Beer, B. & Clody, D. E.: A simple and reliable conflict procedure for testing anti-anxiety agents. Psychopharmacology, 21, 1-7 (1971)[PubMed]
- McCarthy, M. M., Moore-Kochlacs, C., Gu, X. et al.: Striatal origin of the pathologic beta oscillations in Parkinson's disease. Proc. Natl. Acad. Sci. USA, 108, 11620-11625 (2011)[PubMed]
著者プロフィール
略歴:2001年 奈良先端科学技術大学院大学 修了,北海道大学大学院医学研究科 助手,2005年 米国Massachusetts Institute of Technology博士研究員,2009年 同Research Scientistを経て,2017年より京都大学白眉センター 特定准教授.
研究テーマ:霊長類の情動および意思決定におけるシステム神経科学.
関心事:神経系の数理科学,神経工学,情動および社会性の脳機構,精神医学.
雨森 智子(Satoko Amemori)
略歴:2007年 北海道大学大学院医学研究科 修了,2009年 米国Massachusetts Institute of Technology博士研究員,同Research Scientistを経て,2017年より同Research Affiliate.
Ann M. Graybiel
米国Massachusetts Institute of TechnologyにてInstitute Professor.
研究室URL:http://www.graybiel-lab.com/
© 2018 雨森賢一・雨森智子・Ann M. Graybiel Licensed under CC 表示 2.1 日本