電位依存性のATPチャネルCALHM1-CALHM3複合体によるGタンパク質共役受容体に依存性の味覚の神経伝達
樽野陽幸1・Zhongming Ma 2・J. Kevin Foskett 2
(1京都府立医科大学大学院医学研究科 細胞生理学,2米国Pennsylvania大学Perelman School of Medicine,Department of Physiology)
email:樽野陽幸
DOI: 10.7875/first.author.2018.050
CALHM3 is essential for rapid ion channel-mediated purinergic neurotransmission of GPCR-mediated tastes.
Zhongming Ma, Akiyuki Taruno, Makoto Ohmoto, Masafumi Jyotaki, Jason C. Lim, Hiroaki Miyazaki, Naomi Niisato, Yoshinori Marunaka, Robert J. Lee, Henry Hoff, Riley Payne, Angelo Demuro, Ian Parker, Claire H. Mitchell, Jorge Henao-Mejia, Jessica E. Tanis, Ichiro Matsumoto, Michael G. Tordoff, J. Kevin Foskett
Neuron, 98, 547-561.e10 (2018)
甘味,苦味,うま味を呈する物質はII型味蕾細胞の細胞膜に局在するGタンパク質共役受容体と結合し活動電位を惹起する.この活動電位は電位依存性のATPチャネルを活性化し,味覚の認識を担う味神経にむけ神経伝達物質であるATPが放出される.このATPの放出にはCALHM1が必須であるが,II型味蕾細胞における電位依存性のATPチャネルの分子実体は未解明であった.この研究において,筆者らは,CALHM3がCALHM1と相互作用し,II型味蕾細胞のATPチャネルと同じ速い活性化速度をもつ,ヘテロ六量体からなるATPチャネルCALHM1-CALHM3複合体を形成することを発見した.さらに,味蕾においてCALHM3およびCALHM1はII型味蕾細胞に選択的に共発現し,CALHM3ノックアウトマウスにおいて,II型味蕾細胞のATPチャネル電流,味蕾からの味刺激により誘発されるATPの放出,Gタンパク質共役受容体に依存性の味覚の認識が消失した.以上より,CALHM1-CALHM3複合体がGタンパク質共役受容体に依存性の味覚の認識において必須の電位依存性のATPチャネルの分子実体であると結論された.
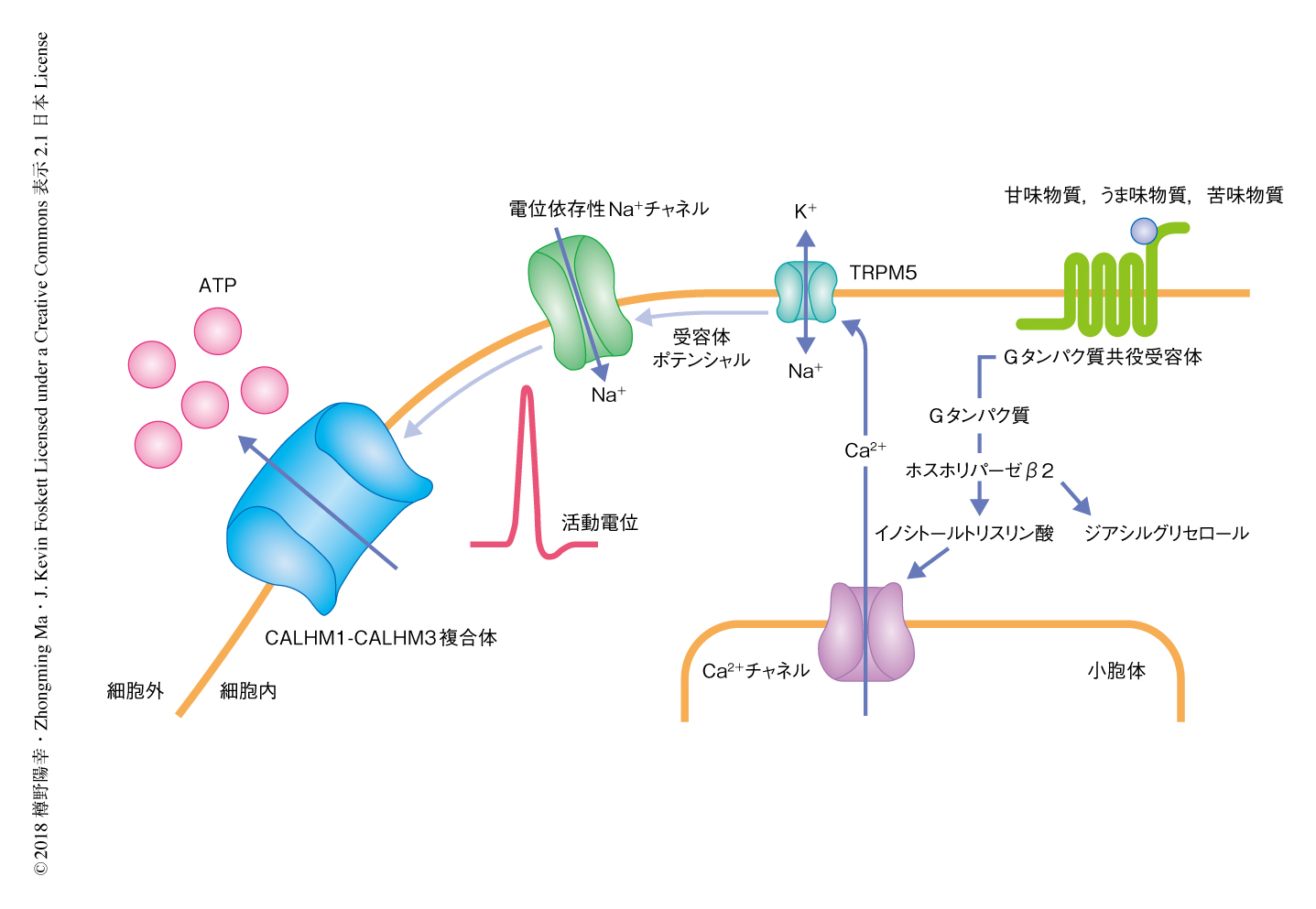
舌や口蓋に存在する味蕾は食べ物や飲み物に含まれる化学物質の検出器としてはたらき,味覚の情報を求心性の味神経を介して脳へと伝達する.ほとんどの哺乳類は甘味,苦味,うま味,塩味,酸味を基本味として検出するが,味覚の受容の機構はイオンチャネルを介するものとGタンパク共役受容体を介するものとに分類される.塩味および酸味はイオンチャネルを介して受容される一方,甘味,苦味,うま味はII型味蕾細胞の細胞膜に発現するGタンパク共役受容体により受容される.甘味,苦味,うま味を呈する物質がGタンパク共役受容体と結合すると,II型味蕾細胞においてシグナル伝達カスケードが活性化する1)(図1).Gタンパク共役受容体の下流においてホスホリパーゼCβ2が活性化してイノシトールトリスリン酸が産生され,これが小胞体膜に存在するCa2+チャネルを活性化してCa2+が細胞質に放出される.つづいて,細胞膜に存在するカチオンチャネルTRPM5がCa2+に依存的に活性化してII型味蕾細胞は脱分極する.この受容体ポテンシャルにより活性化した電位依存性のNa+チャネルが活動電位を惹起し,神経伝達物質であるATPがP2X受容体を発現する求心性の味神経へむけ放出される.II型味蕾細胞からの神経伝達物質の放出はシナプス小胞ではなくチャネルを介するという点できわめて特殊である.II型味蕾細胞はシナプス構造をもたず,また,シナプス関連遺伝子の発現もみられない.
筆者らは,先行研究において,CALHM1はII型味蕾細胞の電位依存性のATPチャネルについて,必須のタンパク質であることを報告した2,3)(文献2)は 新着論文レビュー でも掲載).CALHM1ノックアウトマウスにおいて味刺激により誘発されるATPの放出およびGタンパク共役受容体に依存性の味覚の認識が消失した.しかし,ホモ六量体からなるCALHM1チャネルとII型味蕾細胞のATPチャネルでは活性化速度および薬理学的な性質が大きく異なった.強制発現系において測定された脱分極によるCALHM1チャネルの活性化速度は活動電位に対し遅すぎた一方4),II型味蕾細胞のATPチャネルの活性化ははるかに速く5),活動電位により十分に活性化されうる速度であった.さらに,II型味蕾細胞からのATPの放出はカルベノオキソロンにより阻害された一方6),CALHM1チャネルは阻害されなかった4).このように,CALHM1が単独ではII型味蕾細胞の電位依存性のATPチャネルの性質は説明されず,その分子実体は未解明であった.
CALHM1はホモ六量体として選択性をもたない電位依存性のチャネルを形成し,Pannexin/Innexin/LRRC8やコネクシンと機能的および構造的な特徴を共有しており,大きなポアをとおしたATPの透過性をもつことが特徴である7).脊椎動物においてCALHMファミリーは6つの遺伝子から構成されるが8),CALHM1以外のメンバーの機能は未知であった.
CALHM1チャネルは活性化速度が遅く,活動電位により活性化されるような活性化速度の速いATPチャネルを形成するには未知のタンパク質が必要と考え,CALHM1ファミリーのほかのメンバーに着目した.味蕾細胞に発現するCALHM2およびCALHM3のうち,CALHM3は舌上皮細胞には発現せず味蕾細胞に特異的に発現した.アフリカツメガエルの卵母細胞およびマウスの神経芽細胞腫に由来するN2a細胞に発現させ膜電位固定法により電流を記録したところ,CALHM2およびCALHM3はともに膜コンダクタンスを発生させず,単独ではチャネルとしての機能を示さなかった.しかし,CALHM3はCALHM1と共発現させるとCALHM1のチャネル電流を大きく変化させた.脱分極による活性化速度が格段に速くなり,活性化の電位依存性はより過分極側にシフトし,電流の密度も大きくなった.一方で,CALHM2を共発現させてもCALHM1のチャネル電流に変化はみられなかった.さらに,CALHM3を共発現させてもCALHM1チャネルの選択性は変化せず,また,ATPの透過性も維持したままであった.このことから,CALHM3はCALHM1チャネルのポアの性質を変えることなく,電位依存性のゲート機構を促進することがわかった.
CALHM3とCALHM1がひとつのチャネル複合体を形成するかどうかを明らかにすることを試みた.N2a細胞に発現させるとCALHM3とCALHM1は共局在を示し,一方を免疫沈降するともう一方も共沈した.これらの結果から,CALHM3とCALHM1は細胞において相互作用することが示唆された.CALHM1は単独で発現させるとおもに細胞質に局在するが,CALHM3と共発現させると細胞膜へと移行することが見い出され,CALHM3がCALHM1の細胞膜への輸送を促進する作用をもつことも明らかにされた.さらに,ネイティブポリアクリルアミドゲル電気泳動法および単一分子イメージング法による解析の結果,CALHM3とCALHM1はヘテロ六量体を形成することが示唆された.また,CALHM1とCALHM3をさまざまな組合せでつないだコンカテマーを用いた実験からも,CALHM3とCALHM1がヘテロ六量体を形成することが示唆された.これら独立した実験系における結果の一致から,CALHM3とCALHM1はヘテロ六量体からなる新規のチャネルCALHM1-CALHM3複合体を形成すると結論づけた.
CALHM1-CALHM3複合体の活性化速度は活動電位に対応できるほど速かった.しかも,味蕾においてCALHM3はCALHM1と同じくII型味蕾細胞に選択的に発現した.すなわち,生体にてCALHM1とCALHM3はII型味蕾細胞において共発現した.これらの事実から,CALHM1-CALHM3複合体がII型味蕾細胞の内在性のATPチャネルである可能性が示唆された.この可能性を検証するため,II型味蕾細胞のATPチャネルおよびN2a細胞に強制発現させたCALHM1-CALHM3複合体の機能を全細胞電流記録法により測定し,その性質を詳細に比較した.II型味蕾細胞のマーカー遺伝子であるTRPM5遺伝子のプロモーターによりGFPを発現するトランスジェニックマウスを用い,味蕾からGFP陽性の細胞を単離することでII型味蕾細胞を同定した.その結果,II型味蕾細胞のATPチャネルとCALHM1-CALHM3複合体はまったく同じ活性化速度および脱活性化速度を示し,さらに,どちらも薬理学的にカルベノオキソロンに対する感受性を示した.さらに,II型味蕾細胞のATPチャネルのチャネル電流および味蕾からの味刺激により誘発されるATPの放出は,CALHM1ノックアウトマウスおよびCALHM3ノックアウトマウスのどちらにおいても消失した.このようなゲート機構および薬理学的な性質の類似性,さらに,おのおののサブユニット遺伝子への依存性から,II型味蕾細胞のATPチャネルの分子実体はCALHM1-CALHM3複合体であると結論づけた.
CALHM1-CALHM3複合体がII型味蕾細胞における神経伝達物質の放出に機能するチャネルであるなら,CALHM3ノックアウトマウスにおいて味覚の認識は異常をきたすに違いない.そこで,2瓶法およびリック法により味覚の嗜好性について調べた.その結果,野生型のマウスと比較して,CALHM3ノックアウトマウスは甘味,苦味,うま味などGタンパク共役受容体に依存性の味覚に対する応答が消失あるいは強く減弱することが判明した.さらに,求心性の味神経のひとつである鼓索神経の舌への味刺激に対する応答を解析したところ,CALHM3ノックアウトマウスにおいてGタンパク共役受容体に依存性の味覚に対する応答が消失した.これらの結果から,CALHM3ノックアウトマウスにおいて,末梢すなわち味蕾のレベルでGタンパク共役受容体に依存性の味覚に対する応答が損なわれることが示され,それはII型味蕾細胞からATPが放出されなくなったためと考えられた.
甘味,苦味,うま味などGタンパク共役受容体に依存性の味覚はII型味蕾細胞により受容され,神経伝達物質であるATPが求心性の味神経にむけ活動電位に依存してチャネルをとおり放出される.II型味蕾細胞に選択的に発現するCALHM1はこの応答における必須のタンパク質であるが2),活性化速度の遅いホモ六量体からなるCALHM1チャネルは活動電位に依存したATPの放出を担うことはできない.この研究において,筆者らは,II型味蕾細胞においてCALHMファミリーのメンバーのひとつであるCALHM3がCALHM1とともに活性化速度の速いヘテロ六量体からなるCALHM1-CALHM3複合体を形成し活動電位に依存した神経伝達を担うことを解明した(図1).しかし,CALHM1-CALHM3複合体はその大きなポアをとおしてATPのみならずCa2+やアミノ酸などの小分子も容易2に透過させるため,その活性は本質的に細胞毒性をもつ9).そのため,生体におけるCALHM1-CALHM3複合体の活性は精密に制御される必要がある.CALHM1-CALHM3複合体はほかの分子を透過させずATPのみをとおすように制御されているかもしれないし,あるいは,発現量を抑えて必要な部分にのみ局在させることにより細胞毒性を最小化しているのかもしれない.また,神経伝達物質として使用されるATPは細胞のエネルギー源でもある.細胞質のATPが枯渇しないように神経伝達を維持するATPの産生および供給の機構も興味深い.こうした問題は,今後の研究課題である.
また,これまで中枢神経や末梢神経において報告されているように,速い活動電位に依存的なATPの放出はCa2+に依存的なシナプス放出のみと考えられてきた10).CALHM1チャネル,パネキシン1チャネル,コネキシンヘミチャネル,容積感受性Cl-チャネル,マキシアニオンチャネルなど,これまでに知られていたチャネルはどれも活動電位に依存したATPの放出を担うのに十分な性質をもたなかった10).一方,CALHM1-CALHM3複合体は脱分極による活性化速度がきわめて速く,活動電位に依存したATPの放出を担うことのできる,現在では唯一のチャネルである.全身において多くの生理機能を担うプリン作動性の神経伝達のまったく新しい分子基盤を明らかにしたこの研究は,神経科学分野において広範な示唆をあたえるかもしれない.CALHMファミリーによる神経伝達が味覚の情報に特有のものであるのか,それとも,多くの系において利用されているのか,今後の研究が待たれる.
略歴:2010年 京都府立医科大学大学院医学研究科 修了,同年 米国Pennsylvania大学Perelman School of Medicine博士研究員,2013年 京都府立医科大学大学院医学研究科 助教を経て,2014年より同 講師.
研究テーマ:化学感覚およびチャネルの生理物理学.
関心事:CALHMファミリーの担うさらなる生理現象を明らかにしたい.
Zhongming Ma
米国Pennsylvania大学Perelman School of Medicine研究員.
J. Kevin Foskett
米国Pennsylvania大学Perelman School of Medicine教授.
© 2018 樽野陽幸・Zhongming Ma・J. Kevin Foskett Licensed under CC 表示 2.1 日本
(1京都府立医科大学大学院医学研究科 細胞生理学,2米国Pennsylvania大学Perelman School of Medicine,Department of Physiology)
email:樽野陽幸
DOI: 10.7875/first.author.2018.050
CALHM3 is essential for rapid ion channel-mediated purinergic neurotransmission of GPCR-mediated tastes.
Zhongming Ma, Akiyuki Taruno, Makoto Ohmoto, Masafumi Jyotaki, Jason C. Lim, Hiroaki Miyazaki, Naomi Niisato, Yoshinori Marunaka, Robert J. Lee, Henry Hoff, Riley Payne, Angelo Demuro, Ian Parker, Claire H. Mitchell, Jorge Henao-Mejia, Jessica E. Tanis, Ichiro Matsumoto, Michael G. Tordoff, J. Kevin Foskett
Neuron, 98, 547-561.e10 (2018)
要 約
甘味,苦味,うま味を呈する物質はII型味蕾細胞の細胞膜に局在するGタンパク質共役受容体と結合し活動電位を惹起する.この活動電位は電位依存性のATPチャネルを活性化し,味覚の認識を担う味神経にむけ神経伝達物質であるATPが放出される.このATPの放出にはCALHM1が必須であるが,II型味蕾細胞における電位依存性のATPチャネルの分子実体は未解明であった.この研究において,筆者らは,CALHM3がCALHM1と相互作用し,II型味蕾細胞のATPチャネルと同じ速い活性化速度をもつ,ヘテロ六量体からなるATPチャネルCALHM1-CALHM3複合体を形成することを発見した.さらに,味蕾においてCALHM3およびCALHM1はII型味蕾細胞に選択的に共発現し,CALHM3ノックアウトマウスにおいて,II型味蕾細胞のATPチャネル電流,味蕾からの味刺激により誘発されるATPの放出,Gタンパク質共役受容体に依存性の味覚の認識が消失した.以上より,CALHM1-CALHM3複合体がGタンパク質共役受容体に依存性の味覚の認識において必須の電位依存性のATPチャネルの分子実体であると結論された.
はじめに
舌や口蓋に存在する味蕾は食べ物や飲み物に含まれる化学物質の検出器としてはたらき,味覚の情報を求心性の味神経を介して脳へと伝達する.ほとんどの哺乳類は甘味,苦味,うま味,塩味,酸味を基本味として検出するが,味覚の受容の機構はイオンチャネルを介するものとGタンパク共役受容体を介するものとに分類される.塩味および酸味はイオンチャネルを介して受容される一方,甘味,苦味,うま味はII型味蕾細胞の細胞膜に発現するGタンパク共役受容体により受容される.甘味,苦味,うま味を呈する物質がGタンパク共役受容体と結合すると,II型味蕾細胞においてシグナル伝達カスケードが活性化する1)(図1).Gタンパク共役受容体の下流においてホスホリパーゼCβ2が活性化してイノシトールトリスリン酸が産生され,これが小胞体膜に存在するCa2+チャネルを活性化してCa2+が細胞質に放出される.つづいて,細胞膜に存在するカチオンチャネルTRPM5がCa2+に依存的に活性化してII型味蕾細胞は脱分極する.この受容体ポテンシャルにより活性化した電位依存性のNa+チャネルが活動電位を惹起し,神経伝達物質であるATPがP2X受容体を発現する求心性の味神経へむけ放出される.II型味蕾細胞からの神経伝達物質の放出はシナプス小胞ではなくチャネルを介するという点できわめて特殊である.II型味蕾細胞はシナプス構造をもたず,また,シナプス関連遺伝子の発現もみられない.
筆者らは,先行研究において,CALHM1はII型味蕾細胞の電位依存性のATPチャネルについて,必須のタンパク質であることを報告した2,3)(文献2)は 新着論文レビュー でも掲載).CALHM1ノックアウトマウスにおいて味刺激により誘発されるATPの放出およびGタンパク共役受容体に依存性の味覚の認識が消失した.しかし,ホモ六量体からなるCALHM1チャネルとII型味蕾細胞のATPチャネルでは活性化速度および薬理学的な性質が大きく異なった.強制発現系において測定された脱分極によるCALHM1チャネルの活性化速度は活動電位に対し遅すぎた一方4),II型味蕾細胞のATPチャネルの活性化ははるかに速く5),活動電位により十分に活性化されうる速度であった.さらに,II型味蕾細胞からのATPの放出はカルベノオキソロンにより阻害された一方6),CALHM1チャネルは阻害されなかった4).このように,CALHM1が単独ではII型味蕾細胞の電位依存性のATPチャネルの性質は説明されず,その分子実体は未解明であった.
CALHM1はホモ六量体として選択性をもたない電位依存性のチャネルを形成し,Pannexin/Innexin/LRRC8やコネクシンと機能的および構造的な特徴を共有しており,大きなポアをとおしたATPの透過性をもつことが特徴である7).脊椎動物においてCALHMファミリーは6つの遺伝子から構成されるが8),CALHM1以外のメンバーの機能は未知であった.
1.CALHM3はCALHM1チャネルの電位依存性のゲート機構を促進する
CALHM1チャネルは活性化速度が遅く,活動電位により活性化されるような活性化速度の速いATPチャネルを形成するには未知のタンパク質が必要と考え,CALHM1ファミリーのほかのメンバーに着目した.味蕾細胞に発現するCALHM2およびCALHM3のうち,CALHM3は舌上皮細胞には発現せず味蕾細胞に特異的に発現した.アフリカツメガエルの卵母細胞およびマウスの神経芽細胞腫に由来するN2a細胞に発現させ膜電位固定法により電流を記録したところ,CALHM2およびCALHM3はともに膜コンダクタンスを発生させず,単独ではチャネルとしての機能を示さなかった.しかし,CALHM3はCALHM1と共発現させるとCALHM1のチャネル電流を大きく変化させた.脱分極による活性化速度が格段に速くなり,活性化の電位依存性はより過分極側にシフトし,電流の密度も大きくなった.一方で,CALHM2を共発現させてもCALHM1のチャネル電流に変化はみられなかった.さらに,CALHM3を共発現させてもCALHM1チャネルの選択性は変化せず,また,ATPの透過性も維持したままであった.このことから,CALHM3はCALHM1チャネルのポアの性質を変えることなく,電位依存性のゲート機構を促進することがわかった.
2.CALHM3はCALHM1とヘテロ六量体からなるチャネルを形成する
CALHM3とCALHM1がひとつのチャネル複合体を形成するかどうかを明らかにすることを試みた.N2a細胞に発現させるとCALHM3とCALHM1は共局在を示し,一方を免疫沈降するともう一方も共沈した.これらの結果から,CALHM3とCALHM1は細胞において相互作用することが示唆された.CALHM1は単独で発現させるとおもに細胞質に局在するが,CALHM3と共発現させると細胞膜へと移行することが見い出され,CALHM3がCALHM1の細胞膜への輸送を促進する作用をもつことも明らかにされた.さらに,ネイティブポリアクリルアミドゲル電気泳動法および単一分子イメージング法による解析の結果,CALHM3とCALHM1はヘテロ六量体を形成することが示唆された.また,CALHM1とCALHM3をさまざまな組合せでつないだコンカテマーを用いた実験からも,CALHM3とCALHM1がヘテロ六量体を形成することが示唆された.これら独立した実験系における結果の一致から,CALHM3とCALHM1はヘテロ六量体からなる新規のチャネルCALHM1-CALHM3複合体を形成すると結論づけた.
3.CALHM1-CALHM3複合体はII型味蕾細胞のもつATPチャネルの分子実体である
CALHM1-CALHM3複合体の活性化速度は活動電位に対応できるほど速かった.しかも,味蕾においてCALHM3はCALHM1と同じくII型味蕾細胞に選択的に発現した.すなわち,生体にてCALHM1とCALHM3はII型味蕾細胞において共発現した.これらの事実から,CALHM1-CALHM3複合体がII型味蕾細胞の内在性のATPチャネルである可能性が示唆された.この可能性を検証するため,II型味蕾細胞のATPチャネルおよびN2a細胞に強制発現させたCALHM1-CALHM3複合体の機能を全細胞電流記録法により測定し,その性質を詳細に比較した.II型味蕾細胞のマーカー遺伝子であるTRPM5遺伝子のプロモーターによりGFPを発現するトランスジェニックマウスを用い,味蕾からGFP陽性の細胞を単離することでII型味蕾細胞を同定した.その結果,II型味蕾細胞のATPチャネルとCALHM1-CALHM3複合体はまったく同じ活性化速度および脱活性化速度を示し,さらに,どちらも薬理学的にカルベノオキソロンに対する感受性を示した.さらに,II型味蕾細胞のATPチャネルのチャネル電流および味蕾からの味刺激により誘発されるATPの放出は,CALHM1ノックアウトマウスおよびCALHM3ノックアウトマウスのどちらにおいても消失した.このようなゲート機構および薬理学的な性質の類似性,さらに,おのおののサブユニット遺伝子への依存性から,II型味蕾細胞のATPチャネルの分子実体はCALHM1-CALHM3複合体であると結論づけた.
4.CALHM3はGタンパク共役受容体に依存性の味覚の受容に必須である
CALHM1-CALHM3複合体がII型味蕾細胞における神経伝達物質の放出に機能するチャネルであるなら,CALHM3ノックアウトマウスにおいて味覚の認識は異常をきたすに違いない.そこで,2瓶法およびリック法により味覚の嗜好性について調べた.その結果,野生型のマウスと比較して,CALHM3ノックアウトマウスは甘味,苦味,うま味などGタンパク共役受容体に依存性の味覚に対する応答が消失あるいは強く減弱することが判明した.さらに,求心性の味神経のひとつである鼓索神経の舌への味刺激に対する応答を解析したところ,CALHM3ノックアウトマウスにおいてGタンパク共役受容体に依存性の味覚に対する応答が消失した.これらの結果から,CALHM3ノックアウトマウスにおいて,末梢すなわち味蕾のレベルでGタンパク共役受容体に依存性の味覚に対する応答が損なわれることが示され,それはII型味蕾細胞からATPが放出されなくなったためと考えられた.
おわりに
甘味,苦味,うま味などGタンパク共役受容体に依存性の味覚はII型味蕾細胞により受容され,神経伝達物質であるATPが求心性の味神経にむけ活動電位に依存してチャネルをとおり放出される.II型味蕾細胞に選択的に発現するCALHM1はこの応答における必須のタンパク質であるが2),活性化速度の遅いホモ六量体からなるCALHM1チャネルは活動電位に依存したATPの放出を担うことはできない.この研究において,筆者らは,II型味蕾細胞においてCALHMファミリーのメンバーのひとつであるCALHM3がCALHM1とともに活性化速度の速いヘテロ六量体からなるCALHM1-CALHM3複合体を形成し活動電位に依存した神経伝達を担うことを解明した(図1).しかし,CALHM1-CALHM3複合体はその大きなポアをとおしてATPのみならずCa2+やアミノ酸などの小分子も容易2に透過させるため,その活性は本質的に細胞毒性をもつ9).そのため,生体におけるCALHM1-CALHM3複合体の活性は精密に制御される必要がある.CALHM1-CALHM3複合体はほかの分子を透過させずATPのみをとおすように制御されているかもしれないし,あるいは,発現量を抑えて必要な部分にのみ局在させることにより細胞毒性を最小化しているのかもしれない.また,神経伝達物質として使用されるATPは細胞のエネルギー源でもある.細胞質のATPが枯渇しないように神経伝達を維持するATPの産生および供給の機構も興味深い.こうした問題は,今後の研究課題である.
また,これまで中枢神経や末梢神経において報告されているように,速い活動電位に依存的なATPの放出はCa2+に依存的なシナプス放出のみと考えられてきた10).CALHM1チャネル,パネキシン1チャネル,コネキシンヘミチャネル,容積感受性Cl-チャネル,マキシアニオンチャネルなど,これまでに知られていたチャネルはどれも活動電位に依存したATPの放出を担うのに十分な性質をもたなかった10).一方,CALHM1-CALHM3複合体は脱分極による活性化速度がきわめて速く,活動電位に依存したATPの放出を担うことのできる,現在では唯一のチャネルである.全身において多くの生理機能を担うプリン作動性の神経伝達のまったく新しい分子基盤を明らかにしたこの研究は,神経科学分野において広範な示唆をあたえるかもしれない.CALHMファミリーによる神経伝達が味覚の情報に特有のものであるのか,それとも,多くの系において利用されているのか,今後の研究が待たれる.
文 献
- Liman, E. R., Zhang, Y. V. & Montell, C.: Peripheral coding of taste. Neuron, 81, 984-1000 (2014)[PubMed]
- Taruno, A., Vingtdeux, V., Ohmoto, M. et al.: CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature, 495, 223-226 (2013)[PubMed] [新着論文レビュー]
- Taruno, A., Matsumoto, I., Ma, Z. et al.: How do taste cells lacking synapses mediate neurotransmission? CALHM1, a voltage-gated ATP channel. Bioessays, 35, 1111-1118 (2013)[PubMed]
- Ma, Z., Siebert, A. P., Cheung, K. H. et al.: Calcium homeostasis modulator 1 (CALHM1) is the pore-forming subunit of an ion channel that mediates extracellular Ca2+ regulation of neuronal excitability. Proc. Natl. Acad. Sci. USA, 109, E1963-E1971 (2012)[PubMed]
- Romanov, R. A., Rogachevskaja, O. A., Khokhlov, A. A. et al.: Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol., 132, 731-744 (2008)[PubMed]
- Huang, Y. J., Maruyama, Y., Dvoryanchikov, G. et al.: The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. Proc. Natl. Acad. Sci. USA, 104, 6436-6441 (2007)[PubMed]
- Ma, Z., Tanis, J. E., Taruno, A. et al.: Calcium homeostasis modulator (CALHM) ion channels. Pflugers Arch., 468, 395-403 (2016)[PubMed]
- Dreses-Werringloer, U., Lambert, J. C., Vingtdeux, V. et al.: A polymorphism in CALHM1 influences Ca2+ homeostasis, Aβ levels, and Alzheimer's disease risk. Cell, 133, 1149-1161 (2008)[PubMed]
- Taruno, A., Sun, H., Nakajo, K. et al.: Post-translational palmitoylation controls the voltage gating and lipid raft association of CALHM1 channel. J. Physiol., 595, 6121-6145 (2017)[PubMed]
- Taruno, A.: ATP release channels. Int. J. Mol. Sci., 19, 808 (2018)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 京都府立医科大学大学院医学研究科 修了,同年 米国Pennsylvania大学Perelman School of Medicine博士研究員,2013年 京都府立医科大学大学院医学研究科 助教を経て,2014年より同 講師.
研究テーマ:化学感覚およびチャネルの生理物理学.
関心事:CALHMファミリーの担うさらなる生理現象を明らかにしたい.
Zhongming Ma
米国Pennsylvania大学Perelman School of Medicine研究員.
J. Kevin Foskett
米国Pennsylvania大学Perelman School of Medicine教授.
© 2018 樽野陽幸・Zhongming Ma・J. Kevin Foskett Licensed under CC 表示 2.1 日本