ATP透過性イオンチャネルCALHM1は味蕾における甘味,苦味,うま味の受容に必須である
樽野陽幸・J. Kevin Foskett
(米国Pennsylvania大学Department of Physiology)
email:樽野陽幸
DOI: 10.7875/first.author.2013.041
CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes.
Akiyuki Taruno, Valérie Vingtdeux, Makoto Ohmoto, Zhongming Ma, Gennady Dvoryanchikov, Ang Li, Leslie Adrien, Haitian Zhao, Sze Leung, Maria Abernethy, Jeremy Koppel, Peter Davies, Mortimer M. Civan, Nirupa Chaudhari, Ichiro Matsumoto, Göran Hellekant, Michael G. Tordoff, Philippe Marambaud, J. Kevin Foskett
Nature, 495, 223-226 (2013)
甘味,苦味,塩味,酸味,うま味からなる5つの基本味のうち,甘味,苦味,うま味の認識は,舌の味覚受容器官である味蕾の味細胞が味物質を受容して興奮し,神経伝達物質であるATPを非小胞性に放出することにより求心性味神経へと味覚情報を伝達することで行われていることが知られている.しかしこれまで,味覚情報を舌から脳へと伝達するしくみである味細胞からのATPの放出機構の分子実体は明らかになっていなかった.今回,筆者らは,近年になり発見されたCALHM1という電位依存性イオンチャネルが,味蕾における甘味,苦味,うま味を受容する細胞からのATPの放出に必須のタンパク質であることを発見した.CALHM1ノックアウトマウスにおいて,野生型マウスで観察される甘味,苦味,うま味に対する味神経の応答および嗜好性の著しい低下がみられた一方,塩味および酸味に対する応答にほとんど変化はなかった.このことに合致するように,CALHM1は味蕾において甘味,苦味,うま味を受容する細胞に特異的に発現していた.また,培養細胞にCALHM1を発現させたところATPの透過性が付与され,さらには,CALHM1ノックアウトマウスの味蕾において味覚刺激によるATPの放出が消失した.これらの結果より,CAHLM1は甘味,苦味,うま味の受容に必須の,新規の電位依存性ATP透過性イオンチャネルであると結論づけた.
食べ物の“味”は食行動の制御に深くかかわり,動物は五感のひとつとして味覚を発達させてきた.ヒトやマウスを含め多くの哺乳類は5つの基本味として甘味,苦味,塩味,酸味,うま味を認識する.それぞれの味は味蕾において別々の味細胞により感受される.味蕾の味細胞はI型,II型,III型の3つのタイプからなる.このうち,酸味を受容するIII型細胞のみが神経伝達物質の生合成酵素やシナプス小胞といったニューロンに特有の性質をもち,味神経の終末とシナプスを形成している1).甘味,苦味,うま味を受容する細胞は共通の細胞内シグナル伝達系をもちII型細胞に分類される.II型細胞は古典的なシナプス構造をもたず,神経伝達物質であるATPを非小胞性に放出することにより味覚情報を味神経の終末へと伝達することが知られている2,3).しかし,II型細胞からのATPの放出機構の分子実体,すなわち,甘味,苦味,うま味の情報を舌から脳へと伝える分子機構は解明されていなかった.
近年,筆者らの研究室では,遅発性アルツハイマー病の発症にかかわる遺伝子としてCALHM1(calcium homeostasis modulator 1)遺伝子を発見し,部分的な機能喪失型のCALHM1遺伝子の保有がアルツハイマー病の発症年齢を早めることを示した4).CALHM1は細胞膜に局在する346アミノ酸残基からなる4回膜貫通型タンパク質であり,細胞膜にCa2+透過性をあたえ細胞内のCa2+濃度を制御しうることから名づけられた.ヒトにはCALHM1遺伝子~CALHM6遺伝子の5つのホモログが存在し,また,線虫からヒトまで広く保存されていたことから,重要な生理機能をもつことが示唆された.のちの研究により5,6),CALHM1の構造および機能の一端が明らかになった.CALHM1は六量体からなる電位依存性イオンチャネルであり,その開閉は膜電位のほか細胞外のCa2+濃度によっても負の制御をうける.CALHM1のイオン選択性は弱く,一価および二価の陽イオン,また,陰イオンも透過する.この弱いイオン選択性から予想されるとおりポア(孔)の直径は大きく,およそ14Åと推定された.一般的なイオン選択性をもつイオンチャネルのポアの直径は3~6Åであるので,CALHM1のポアは非常に大きい.その直径から,ATPやグルタミン酸といった電荷をもつ比較的大きな分子も透過しうることが予想されていた.
霊長類の味蕾においてCALHM1の発現がみられたことから7),味覚における役割が示唆されていた.そこで,in situハイブリダイゼーション法によりマウスの味蕾におけるCALHM1の発現を解析した.CALHM1の発現は味蕾の領域にはっきりと観察され,周囲の筋組織や上皮組織において発現はみられなかった.さらに,甘味,苦味,うま味を受容するII型細胞をもたないSkn-1aノックアウトマウス8) においては味蕾におけるCALHM1のシグナルは消失したこと,くわえて,CALHM1のシグナルはII型細胞のマーカー遺伝子であるTrpm5遺伝子のシグナルと完全に共発現していたことから,CALHM1は味蕾においてII型細胞に特異的に発現していることが明らかになった.同時に,CALHM1はI型細胞およびIII型細胞には発現していないことも示された.また,異なる手法として,単離した味細胞を用いた単細胞RT-PCR法によっても同じ結果が得られた.これらの結果は,5つの基本味のうちでもとくに,甘味,苦味,うま味の認識におけるCALHM1の役割を示唆した.
味覚嗜好性試験によりCALHM1の欠損がマウスの個体レベルでの味物質の摂取行動にどのような影響をあたえるかを解析した.野生型マウスは水と比較して甘味,うま味,低濃度の塩味に対し嗜好性を示し,苦味および酸味を忌避する.一方,CALHM1ノックアウトマウスは甘味,苦味,うま味に対し水と同じ程度の嗜好性を示した.いい換えると,CALHM1ノックアウトマウスは甘味,苦味,うま味をまったく感じることができず,これらの味のついた溶液を水と同じように飲んだのである.また,CALHM1ノックアウトマウスにおいて塩味および酸味に対する応答はほとんど正常であった.さらに,電気生理学的に味神経の応答を測定したところ,味覚嗜好性試験の結果と同じく,CALHM1ノックアウトマウスにおいて甘味,苦味,うま味に対する神経応答のみが特異的に消失または減弱していた.CALHM1ノックアウトマウスにおける味神経の応答の消失は味蕾から味神経への味覚情報の伝達の消失を示唆しており,CALHM1は味蕾にて甘味,苦味,うま味を受容するII型細胞における味覚情報の処理において重要な役割を担っていることが示唆された.
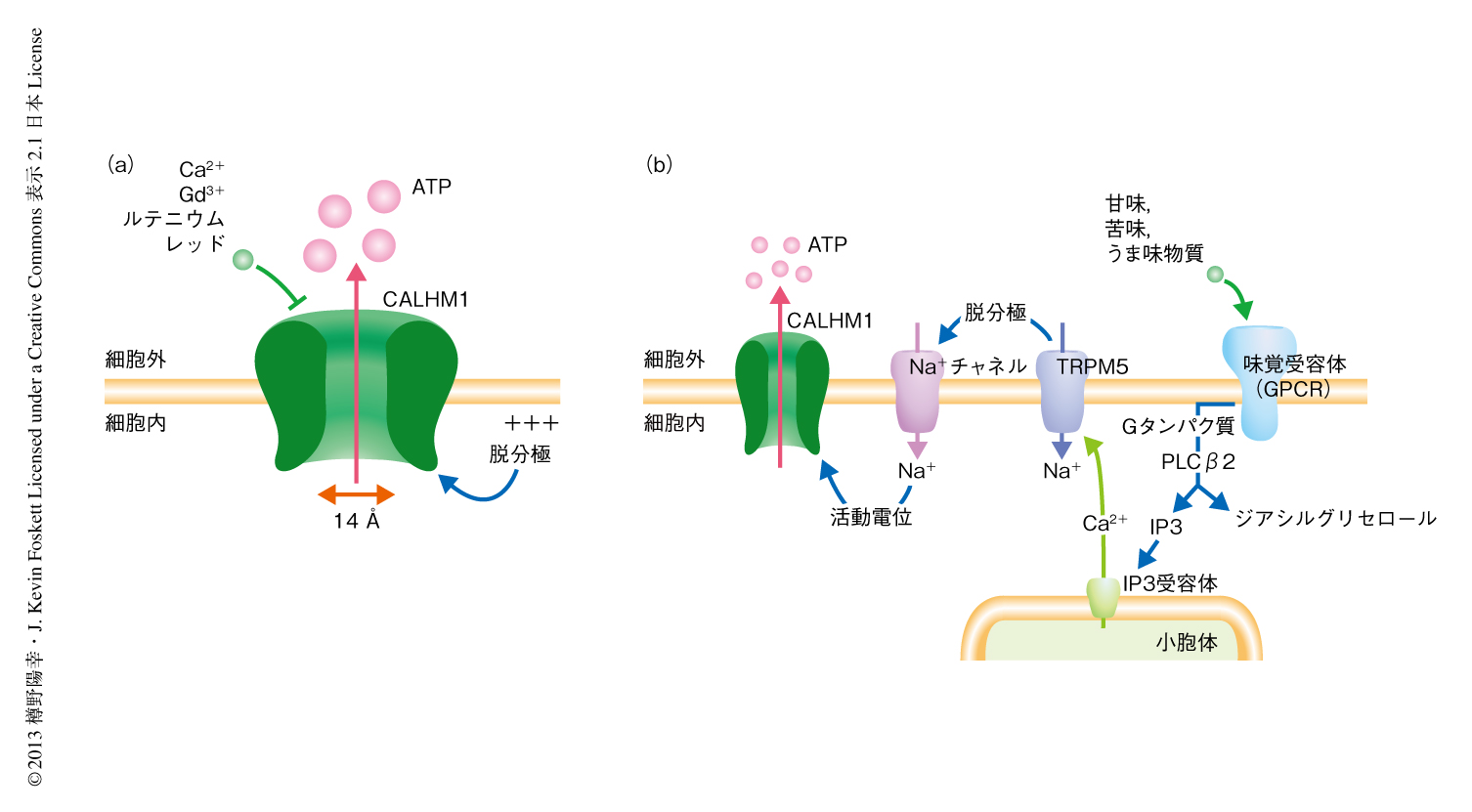
甘味,苦味,うま味を受容するII型細胞は非小胞性にATPを放出して近傍の求心性味神経へと味覚情報を伝達する.これまで,Connexinヘミチャネル9) やPannexin 1チャネル10) がATPの放出機構の分子実体として提案されてきたが,依然として未解明のままであった.II型細胞に特異的に発現するCALHM1は,陰イオンの透過性にくわえ,14ÅというATPよりも大きなポアをもちATP透過性をもつイオンチャネルであると予想された.そこで,培養細胞を用いた実験により,CALHM1が細胞にATP透過性を付与するかどうかを解析した.方法として,CALHM1遺伝子のcDNAをトランスフェクションしたHela細胞にCALHM1が開くような刺激をあたえ外液におけるATPの濃度を測定した.その結果,CALHM1を活性化させる細胞外の低Ca2+濃度および脱分極といった刺激によりCALHM1を発現した細胞からのATPの放出が観察され,このATP放出はCALHM1のチャネル機能の阻害剤であるルテニウムレッドにより消失した.対照となる細胞では刺激によるATPの放出はほとんどみられなかった.このように,ATPの放出とCALHM1のチャネル開口の活性化機構および薬理学的な性質との一致により,CALHM1のポアがATP放出の通路となっていることが示された.したがって,CALHM1は新規のATP透過性イオンチャネルであると結論づけた(図1a).
CALHM1が甘味,苦味,うま味を受容するII型細胞における味覚情報の処理1) においてどのような役割を担っているかを解析した.II型細胞は甘味,苦味,うま味を細胞膜に存在するGタンパク質共役型受容体である味覚受容体により感受する.活性化した味覚受容体は小胞体からのCa2+の放出を誘導し,細胞におけるCa2+濃度を上昇させる.つぎに,このCa2+濃度の上昇が細胞膜に存在するTRPM5チャネルを活性化し脱分極をひき起こし,活動電位の引き金となる.最後に,活動電位のバーストがATP放出機構を活性化する.まず,単離したII型細胞を用いて味刺激による細胞内Ca2+応答を解析したところ,基底状態での細胞内Ca2+濃度,および,味刺激によるCa2+濃度の上昇の程度は,野生型マウスとCALHM1ノックアウトマウスとで同等であった.さらに,CALHM1ノックアウトマウスのII型細胞におけるTRPM5のタンパク質レベルでの発現も正常で,活動電位を担うテトロドトキシン感受性電位依存性Na+チャネルの活性も野生型マウスと同等であった.にもかかわらず,CALHM1ノックアウトマウスでは味刺激による味蕾からのATPの放出はほとんど消失していた.すなわち,CALHM1の欠損は味刺激によるII型細胞の興奮性には影響をあたえず,ATPの放出のみを特異的に阻害していることが示された.この結果は,CALHM1が甘味,苦味,うま味を受容するII型細胞におけるATPの放出機構を形成していることを強く示唆した(図1b).
今回,筆者らは,新規のATP透過性イオンチャネルを発見し,味蕾から味神経へ味覚情報を伝達するためのATPの放出機構を解明した.甘味,苦味,うま味を受容するII型細胞において,ATP放出よりまえの細胞内シグナル伝達系はこれまでにも詳細に研究されており,最後の謎であった神経伝達物質の放出機構が解明されたことにより,味蕾における甘味,苦味,うま味の感受機構の一応の全容が明らかになったといえる.一方で,味蕾にはほかのCALHMアイソフォームやConnexin,Pannexin 1も発現しており,これらがCALHM1と協同あるいは独立して,味覚情報の処理にかかわっている可能性については検討の必要がある.臨床への応用としては,CALHM1を標的にした薬剤が開発されれば味覚を制御することができるかもしれない.たとえば,甘味やうま味を増強したり,苦味を感じにくくしたりすることができるだろう.将来は,食品の開発や医療における服薬コンプライアンスの改善という面での応用も期待できる.さらに,細胞外のATPによるシグナル伝達は神経伝達や細胞間コミュニケーション,血管の緊張など生理現象において広く用いられている.CALHM1は味覚のほかにも生理的に重要なATPの放出に関与している可能性があり,これは新しい研究領域である.
略歴:2010年 京都府立医科大学大学院医学研究科 修了,同年 米国Pennsylvania大学 博士研究員を経て,2013年より京都府立医科大学大学院医学研究科 助教.
研究テーマ:味覚およびイオンチャネルの生理学.
関心事:個々の分子が協同してひとつの生理現象をなしとげるさまを,ひとつでも多く見たい.
J. Kevin Foskett
米国Pennsylvania大学 教授.
© 2013 樽野陽幸・J. Kevin Foskett Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学Department of Physiology)
email:樽野陽幸
DOI: 10.7875/first.author.2013.041
CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes.
Akiyuki Taruno, Valérie Vingtdeux, Makoto Ohmoto, Zhongming Ma, Gennady Dvoryanchikov, Ang Li, Leslie Adrien, Haitian Zhao, Sze Leung, Maria Abernethy, Jeremy Koppel, Peter Davies, Mortimer M. Civan, Nirupa Chaudhari, Ichiro Matsumoto, Göran Hellekant, Michael G. Tordoff, Philippe Marambaud, J. Kevin Foskett
Nature, 495, 223-226 (2013)
要 約
甘味,苦味,塩味,酸味,うま味からなる5つの基本味のうち,甘味,苦味,うま味の認識は,舌の味覚受容器官である味蕾の味細胞が味物質を受容して興奮し,神経伝達物質であるATPを非小胞性に放出することにより求心性味神経へと味覚情報を伝達することで行われていることが知られている.しかしこれまで,味覚情報を舌から脳へと伝達するしくみである味細胞からのATPの放出機構の分子実体は明らかになっていなかった.今回,筆者らは,近年になり発見されたCALHM1という電位依存性イオンチャネルが,味蕾における甘味,苦味,うま味を受容する細胞からのATPの放出に必須のタンパク質であることを発見した.CALHM1ノックアウトマウスにおいて,野生型マウスで観察される甘味,苦味,うま味に対する味神経の応答および嗜好性の著しい低下がみられた一方,塩味および酸味に対する応答にほとんど変化はなかった.このことに合致するように,CALHM1は味蕾において甘味,苦味,うま味を受容する細胞に特異的に発現していた.また,培養細胞にCALHM1を発現させたところATPの透過性が付与され,さらには,CALHM1ノックアウトマウスの味蕾において味覚刺激によるATPの放出が消失した.これらの結果より,CAHLM1は甘味,苦味,うま味の受容に必須の,新規の電位依存性ATP透過性イオンチャネルであると結論づけた.
はじめに
食べ物の“味”は食行動の制御に深くかかわり,動物は五感のひとつとして味覚を発達させてきた.ヒトやマウスを含め多くの哺乳類は5つの基本味として甘味,苦味,塩味,酸味,うま味を認識する.それぞれの味は味蕾において別々の味細胞により感受される.味蕾の味細胞はI型,II型,III型の3つのタイプからなる.このうち,酸味を受容するIII型細胞のみが神経伝達物質の生合成酵素やシナプス小胞といったニューロンに特有の性質をもち,味神経の終末とシナプスを形成している1).甘味,苦味,うま味を受容する細胞は共通の細胞内シグナル伝達系をもちII型細胞に分類される.II型細胞は古典的なシナプス構造をもたず,神経伝達物質であるATPを非小胞性に放出することにより味覚情報を味神経の終末へと伝達することが知られている2,3).しかし,II型細胞からのATPの放出機構の分子実体,すなわち,甘味,苦味,うま味の情報を舌から脳へと伝える分子機構は解明されていなかった.
近年,筆者らの研究室では,遅発性アルツハイマー病の発症にかかわる遺伝子としてCALHM1(calcium homeostasis modulator 1)遺伝子を発見し,部分的な機能喪失型のCALHM1遺伝子の保有がアルツハイマー病の発症年齢を早めることを示した4).CALHM1は細胞膜に局在する346アミノ酸残基からなる4回膜貫通型タンパク質であり,細胞膜にCa2+透過性をあたえ細胞内のCa2+濃度を制御しうることから名づけられた.ヒトにはCALHM1遺伝子~CALHM6遺伝子の5つのホモログが存在し,また,線虫からヒトまで広く保存されていたことから,重要な生理機能をもつことが示唆された.のちの研究により5,6),CALHM1の構造および機能の一端が明らかになった.CALHM1は六量体からなる電位依存性イオンチャネルであり,その開閉は膜電位のほか細胞外のCa2+濃度によっても負の制御をうける.CALHM1のイオン選択性は弱く,一価および二価の陽イオン,また,陰イオンも透過する.この弱いイオン選択性から予想されるとおりポア(孔)の直径は大きく,およそ14Åと推定された.一般的なイオン選択性をもつイオンチャネルのポアの直径は3~6Åであるので,CALHM1のポアは非常に大きい.その直径から,ATPやグルタミン酸といった電荷をもつ比較的大きな分子も透過しうることが予想されていた.
1.CALHM1は味蕾において甘味,苦味,うま味を受容する細胞に特異的に発現する
霊長類の味蕾においてCALHM1の発現がみられたことから7),味覚における役割が示唆されていた.そこで,in situハイブリダイゼーション法によりマウスの味蕾におけるCALHM1の発現を解析した.CALHM1の発現は味蕾の領域にはっきりと観察され,周囲の筋組織や上皮組織において発現はみられなかった.さらに,甘味,苦味,うま味を受容するII型細胞をもたないSkn-1aノックアウトマウス8) においては味蕾におけるCALHM1のシグナルは消失したこと,くわえて,CALHM1のシグナルはII型細胞のマーカー遺伝子であるTrpm5遺伝子のシグナルと完全に共発現していたことから,CALHM1は味蕾においてII型細胞に特異的に発現していることが明らかになった.同時に,CALHM1はI型細胞およびIII型細胞には発現していないことも示された.また,異なる手法として,単離した味細胞を用いた単細胞RT-PCR法によっても同じ結果が得られた.これらの結果は,5つの基本味のうちでもとくに,甘味,苦味,うま味の認識におけるCALHM1の役割を示唆した.
2.CALHM1は甘味,苦味,うま味の認識に必須のタンパク質である
味覚嗜好性試験によりCALHM1の欠損がマウスの個体レベルでの味物質の摂取行動にどのような影響をあたえるかを解析した.野生型マウスは水と比較して甘味,うま味,低濃度の塩味に対し嗜好性を示し,苦味および酸味を忌避する.一方,CALHM1ノックアウトマウスは甘味,苦味,うま味に対し水と同じ程度の嗜好性を示した.いい換えると,CALHM1ノックアウトマウスは甘味,苦味,うま味をまったく感じることができず,これらの味のついた溶液を水と同じように飲んだのである.また,CALHM1ノックアウトマウスにおいて塩味および酸味に対する応答はほとんど正常であった.さらに,電気生理学的に味神経の応答を測定したところ,味覚嗜好性試験の結果と同じく,CALHM1ノックアウトマウスにおいて甘味,苦味,うま味に対する神経応答のみが特異的に消失または減弱していた.CALHM1ノックアウトマウスにおける味神経の応答の消失は味蕾から味神経への味覚情報の伝達の消失を示唆しており,CALHM1は味蕾にて甘味,苦味,うま味を受容するII型細胞における味覚情報の処理において重要な役割を担っていることが示唆された.
3.CALHM1はATP透過性イオンチャネルである
甘味,苦味,うま味を受容するII型細胞は非小胞性にATPを放出して近傍の求心性味神経へと味覚情報を伝達する.これまで,Connexinヘミチャネル9) やPannexin 1チャネル10) がATPの放出機構の分子実体として提案されてきたが,依然として未解明のままであった.II型細胞に特異的に発現するCALHM1は,陰イオンの透過性にくわえ,14ÅというATPよりも大きなポアをもちATP透過性をもつイオンチャネルであると予想された.そこで,培養細胞を用いた実験により,CALHM1が細胞にATP透過性を付与するかどうかを解析した.方法として,CALHM1遺伝子のcDNAをトランスフェクションしたHela細胞にCALHM1が開くような刺激をあたえ外液におけるATPの濃度を測定した.その結果,CALHM1を活性化させる細胞外の低Ca2+濃度および脱分極といった刺激によりCALHM1を発現した細胞からのATPの放出が観察され,このATP放出はCALHM1のチャネル機能の阻害剤であるルテニウムレッドにより消失した.対照となる細胞では刺激によるATPの放出はほとんどみられなかった.このように,ATPの放出とCALHM1のチャネル開口の活性化機構および薬理学的な性質との一致により,CALHM1のポアがATP放出の通路となっていることが示された.したがって,CALHM1は新規のATP透過性イオンチャネルであると結論づけた(図1a).
4.CALHM1は甘味,苦味,うま味を受容する細胞からの味刺激によるATPの放出に必須のタンパク質である
CALHM1が甘味,苦味,うま味を受容するII型細胞における味覚情報の処理1) においてどのような役割を担っているかを解析した.II型細胞は甘味,苦味,うま味を細胞膜に存在するGタンパク質共役型受容体である味覚受容体により感受する.活性化した味覚受容体は小胞体からのCa2+の放出を誘導し,細胞におけるCa2+濃度を上昇させる.つぎに,このCa2+濃度の上昇が細胞膜に存在するTRPM5チャネルを活性化し脱分極をひき起こし,活動電位の引き金となる.最後に,活動電位のバーストがATP放出機構を活性化する.まず,単離したII型細胞を用いて味刺激による細胞内Ca2+応答を解析したところ,基底状態での細胞内Ca2+濃度,および,味刺激によるCa2+濃度の上昇の程度は,野生型マウスとCALHM1ノックアウトマウスとで同等であった.さらに,CALHM1ノックアウトマウスのII型細胞におけるTRPM5のタンパク質レベルでの発現も正常で,活動電位を担うテトロドトキシン感受性電位依存性Na+チャネルの活性も野生型マウスと同等であった.にもかかわらず,CALHM1ノックアウトマウスでは味刺激による味蕾からのATPの放出はほとんど消失していた.すなわち,CALHM1の欠損は味刺激によるII型細胞の興奮性には影響をあたえず,ATPの放出のみを特異的に阻害していることが示された.この結果は,CALHM1が甘味,苦味,うま味を受容するII型細胞におけるATPの放出機構を形成していることを強く示唆した(図1b).
おわりに
今回,筆者らは,新規のATP透過性イオンチャネルを発見し,味蕾から味神経へ味覚情報を伝達するためのATPの放出機構を解明した.甘味,苦味,うま味を受容するII型細胞において,ATP放出よりまえの細胞内シグナル伝達系はこれまでにも詳細に研究されており,最後の謎であった神経伝達物質の放出機構が解明されたことにより,味蕾における甘味,苦味,うま味の感受機構の一応の全容が明らかになったといえる.一方で,味蕾にはほかのCALHMアイソフォームやConnexin,Pannexin 1も発現しており,これらがCALHM1と協同あるいは独立して,味覚情報の処理にかかわっている可能性については検討の必要がある.臨床への応用としては,CALHM1を標的にした薬剤が開発されれば味覚を制御することができるかもしれない.たとえば,甘味やうま味を増強したり,苦味を感じにくくしたりすることができるだろう.将来は,食品の開発や医療における服薬コンプライアンスの改善という面での応用も期待できる.さらに,細胞外のATPによるシグナル伝達は神経伝達や細胞間コミュニケーション,血管の緊張など生理現象において広く用いられている.CALHM1は味覚のほかにも生理的に重要なATPの放出に関与している可能性があり,これは新しい研究領域である.
文 献
- Chaudhari, N. & Roper, S. D.: The cell biology of taste. J. Cell Biol., 190, 285-296 (2010)[PubMed]
- Chandrashekar, J., Hoon, M. A., Ryba, N. J. et al.: The receptors and cells for mammalian taste. Nature, 444, 288-294 (2006)[PubMed]
- Finger, T. E., Danilova, V., Barrows, J. et al.: ATP signaling is crucial for communication from taste buds to gustatory nerves. Science, 310, 1495-1499 (2005)[PubMed]
- Dreses-Werringloer, U., Lambert, J. C., Vingtdeux, V. et al.: A polymorphism in CALHM1 influences Ca2+ homeostasis, Aβ levels, and Alzheimer's disease risk. Cell, 133, 1149-1161 (2008)[PubMed]
- Ma, Z., Siebert, A. P., Cheung, K. H. et al.: Calcium homeostasis modulator 1 (CALHM1) is the pore-forming subunit of an ion channel that mediates extracellular Ca2+ regulation of neuronal excitability. Proc. Natl. Acad. Sci. USA, 109, E1963-E1971 (2012)[PubMed]
- Siebert, A. P., Ma, Z., Grevet, J. D. et al.: Structural and functional similarities of calcium homeostasis modulator 1 (CALHM1) ion channel with connexins, pannexins, and innexins. J. Biol. Chem., 288, 6140-6153 (2013)[PubMed]
- Moyer, B. D., Hevezi, P., Gao, N. et al.: Expression of genes encoding multi-transmembrane proteins in specific primate taste cell populations. PLoS One, 4, e7682 (2009)[PubMed]
- Matsumoto, I., Ohmoto, M., Narukawa, M. et al.: Skn-1a (Pou2f3) specifies taste receptor cell lineage. Nat. Neurosci., 14, 685-687 (2011)[PubMed]
- Romanov, R. A., Rogachevskaja, O. A., Bystrova, M. F. et al.: Afferent neurotransmission mediated by hemichannels in mammalian taste cells. EMBO J., 26, 657-667 (2007)[PubMed]
- Huang, Y. J., Maruyama, Y., Dvoryanchikov, G. et al.: The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds. Proc. Natl. Acad. Sci. USA, 104, 6436-6441 (2007)[PubMed]
著者プロフィール
略歴:2010年 京都府立医科大学大学院医学研究科 修了,同年 米国Pennsylvania大学 博士研究員を経て,2013年より京都府立医科大学大学院医学研究科 助教.
研究テーマ:味覚およびイオンチャネルの生理学.
関心事:個々の分子が協同してひとつの生理現象をなしとげるさまを,ひとつでも多く見たい.
J. Kevin Foskett
米国Pennsylvania大学 教授.
© 2013 樽野陽幸・J. Kevin Foskett Licensed under CC 表示 2.1 日本