リング構造をとるコヒーシンはDNAとDNAとをつなぎとめる
村山 泰斗
(国立遺伝学研究所 新分野創造センター染色体生化学研究室)
email:村山泰斗
DOI: 10.7875/first.author.2018.012
Establishment of DNA-DNA interactions by the cohesin ring.
Yasuto Murayama, Catarina P. Samora, Yumiko Kurokawa, Hiroshi Iwasaki, Frank Uhlmann
Cell, 172, 465-477.e15 (2018)
ゲノムDNAはクロマチン構造を基本としていっけん不規則に,しかし,正確な遺伝子の発現や染色体の分配が可能なようにさまざまな高次構造を形成して核のなかに収納されている.SMC複合体は巨大なリング状の構造をとりATPase活性をもつタンパク質複合体であり,そのリングの内側をとおすかたちでDNAとトポロジカルに結合する.この特殊なDNAとの結合により,SMC複合体は2本以上のDNAをつなぎとめて染色体の高次構造の形成を制御すると考えられている.この研究において,筆者らは,SMC1とSMC3を中核とするSMC複合体であるコヒーシンについて,すでにDNAとトポロジカルに結合しているコヒーシンが2本目のDNAともトポロジカルに結合することを見い出した.ただし,2本目のDNAは1本鎖DNAでなければならなかった.2本目の1本鎖DNAとの結合は不安定であったが,DNAの合成をへて,これら2本のDNAはコヒーシンにより安定につなぎとめられた.この研究において,コヒーシンは2本目のDNAとトポロジカルに結合する活性をもつことが示され,コヒーシンによる姉妹染色分体のあいだの接着の形成について新たな分子モデルが提唱された.
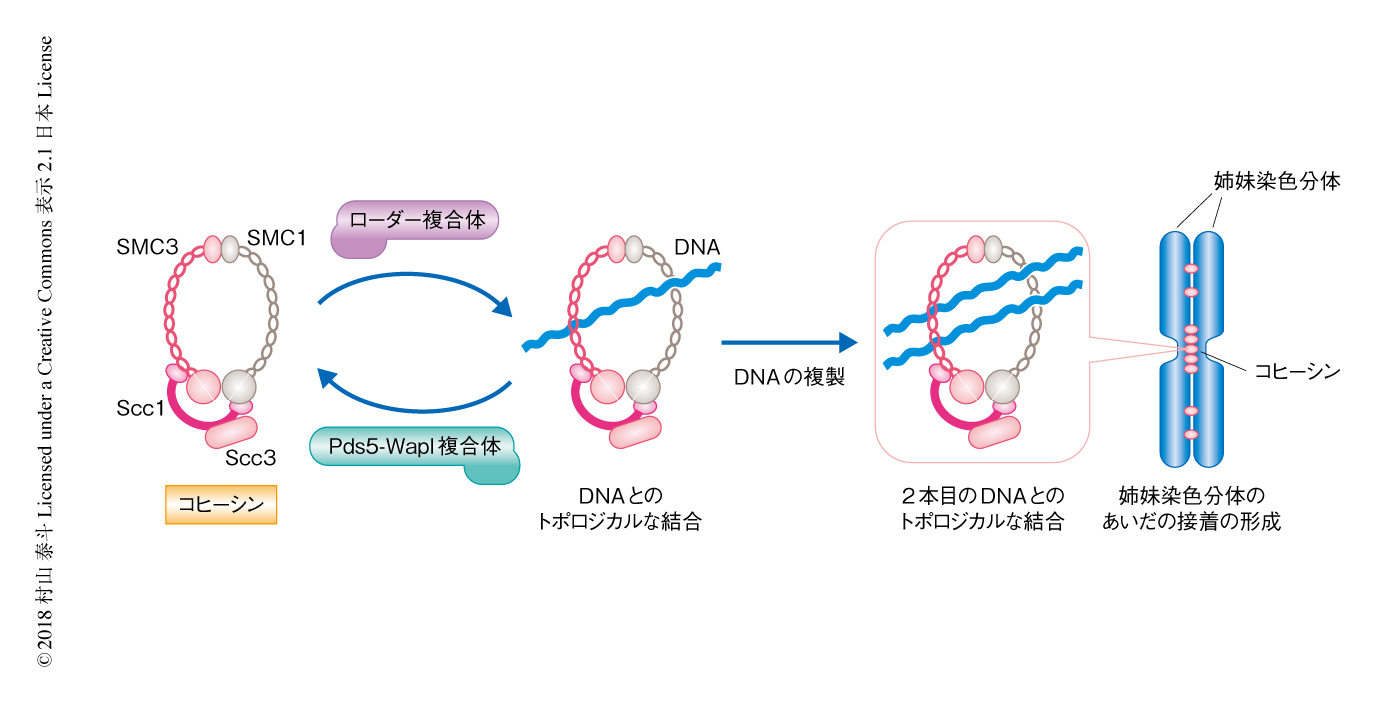
その莫大な情報量を反映してゲノムDNAは非常に長く,少なくとも細胞の長さの数千倍もある.生命が子々孫々に継承されていくためには,ゲノムDNAをただ核に押し込めておくだけでなく,必要なときに必要な遺伝子を発現し,正確に複製し,全セットの染色体をまちがえることなく2つの娘細胞に分配しなくてはならない.この緻密さを可能にするため,ゲノムDNAはヒストンをはじめとするさまざまなタンパク質との結合により可塑性のある高次構造を形成する.SMC複合体は染色体の構造の形成における中心的な制御タンパク質で,細菌からヒトまで進化的に保存されている1).真核生物においては,姉妹染色体のあいだの接着の形成に必要なコヒーシン,体細胞分裂期の染色体の凝縮を制御するコンデンシン,DNAの修復に機能するSMC5-SMC6複合体の,少なくとも3つの必須なSMC複合体が存在する.これらのSMC複合体は,ABC型ATPaseドメインをもつSMCサブユニットを中核としてリング状の構造をとり,そのリング構造の内側をとおすかたちでDNAとトポロジカルに結合することが知られている.少なくとも,コヒーシンおよびコンデンシンは染色体の構造を形成するためにDNAとのトポロジカルな結合が必須であるらしい2,3).このことから,SMC複合体が染色体を折りたたんでいくための素反応は,DNAとのトポロジカルな結合により2本以上のDNAを直接につなぎとめることであると予想される4)(図1).これは非常にシンプルで合理的な分子モデルである.しかし依然として,SMC複合体がどのようにDNAと結合するのか,そして,本当に直接にDNAをつなぎとめるのか,については未解明であった.
コヒーシンはSMC1とSMC3を中核とするSMC複合体で,姉妹染色体のあいだの接着を形成する本体と考えられている.姉妹染色体のあいだの接着とは,文字どおり,複製された染色体のあいだに形成される物理的な接着である.姉妹染色体は紡錘体から伸びる微小管により細胞の両極に引っ張られ娘細胞に分配されるが,姉妹染色体のあいだには接着があるため張力が発生する.この張力のつり合いを指標として,細胞は全セットの染色体を2つの娘細胞に正確に分配する.一方で,姉妹染色体のあいだの接着は2本鎖DNA切断などの重篤なDNAの損傷の修復のために必須のプラットフォームでもあり,遺伝情報の維持および継承のためなくてはならないものである.
コヒーシンはどのように姉妹染色体のあいだの接着を形成するのだろうか? さきのモデルにしたがえば,コヒーシンはDNAとのトポロジカルな結合により,姉妹DNAどうしを直接につなぎとめると考えられる.以前に,筆者らの研究グループは,コヒーシンとDNAとの結合の詳細を理解するため,分裂酵母のコヒーシンおよび補助タンパク質を精製し,コヒーシンとDNAとがトポロジカルに結合する反応,および,逆に,コヒーシンのリング構造のなかにあったDNAが放出される反応を試験管内で再構成し,精製したコヒーシンはATPの存在下において2本鎖DNAとトポロジカルに結合すること,また,ローダー複合体はコヒーシンとDNAとの結合を,Pds5-Wapl複合体はコヒーシンとDNAとの解離を促進することを報告した5,6)(文献5) は 新着論文レビュー でも掲載,文献6) は 新着論文レビュー でも掲載).そこで,すでに2本鎖DNAとトポロジカルに結合しているコヒーシンを用意し,“2本目”のDNAをくわえて反応させたところ,コヒーシンはたしかに2本目のDNAとトポロジカルに結合した.この2本目のDNAとの結合は,ATP,ローダー複合体,DNAのセンサーとして機能するSMC3のATPaseドメインにある保存されたLysを必要とした.これらはすべて,1本目の2本鎖DNAとの結合に必要なものとまったく同じであったことから,2本目のDNAとの結合は,1本目のDNAとの結合と同じ反応であることが示唆された.ただし,1本目のDNAとの結合は異なり,2本目のDNAは1本鎖DNAである必要があった.
2本目のDNAはなぜ1本鎖DNAである必要があるのかを理解するため,コヒーシンと1本鎖DNAとの結合を詳細に調べた.コヒーシンはトポロジカルな結合とは別に,DNAと静電的に相互作用する.コヒーシンはこの静電的な相互作用を利用して,DNAとトポロジカルに結合すると考えらえる.しかし,1本鎖DNAと2本鎖DNAとで,コヒーシンとの静電的な相互作用に大きな差はみられなかった.そこで,コヒーシンとDNAとをトポロジカルに結合させたのち,この結合の安定性について調べた.その結果,コヒーシンと2本鎖DNAとの結合は非常に安定で,EDTAや高い塩濃度により処理しても結合は保持された.しかし,コヒーシンのリング構造をプロテアーゼにより1箇所だけ切断する,あるいは,Pds5-Wapl複合体と反応させてコヒーシンのリング構造を一時的に開環させると,2本鎖DNAはコヒーシンから解離した.一方,1本鎖DNAの場合,EDTAや生理的な塩濃度で処理するだけでコヒーシンから解離した.このことから,コヒーシンと1本鎖DNAとの結合は不安定であることが示唆された.
結合の安定性に大きな違いがあったものの,1本鎖DNAは2本鎖DNAと同様に,コヒーシンのもつATPase活性を促進した.コヒーシンの単体によるATPの加水分解は低いレベルにとどまるが,ローダー複合体および2本鎖DNAの存在下においてはいちじるしく上昇する.1本鎖DNAについても,2本鎖DNAと同等かそれ以上にコヒーシンのもつATPase活性を促進した.このことから,1本鎖DNAはコヒーシンの生理的な基質であることが示唆された.
コヒーシンと1本鎖DNAあるいは2本鎖DNAとの静電的な相互作用はほぼ同じ程度であったことから,コヒーシンと2本目の1本鎖DNAとの結合は,同時に2本鎖DNAをくわえることにより競争的に阻害されると考えられた.しかし,過剰量の2本鎖DNAをくわえてもコヒーシンと2本目の1本鎖DNAとの結合は阻害されなかった.その分子機構の詳細は今後の課題であるが,1本目の2本鎖DNAとトポロジカルに結合しているコヒーシンは,1本鎖DNAと選択的に結合するようであった.
コヒーシンと1本鎖DNAとの結合は不安定であったことから,コヒーシンによる1本鎖DNAと2本鎖DNAとのつなぎとめも不安定で壊れやすいことが予想された.そこで,コヒーシンと2本目の1本鎖DNAとの結合の直後にATPを枯渇させたところ,1本鎖DNAと2本鎖DNAとのつなぎとめはすみやかに崩壊した.逆に,ATP再生系をくわえることにより2本鎖DNAと1本鎖DNAとのつなぎとめはより長時間にわたり保持された.このことから,コヒーシンと2本目の1本鎖DNAとの結合を保持するためには,コヒーシンとATPとの結合が重要であることが示唆された.
姉妹染色体のあいだの接着は非常に安定な構造である.たとえば,哺乳類の卵母細胞においては姉妹染色体のあいだの接着は数年ないし数十年の単位で維持される.よって,コヒーシンによる2本鎖DNAと1本鎖DNAのつなぎとめの不安定さは姉妹染色体のあいだの接着の特性にそぐわない.一方で,コヒーシンと2本鎖DNAとのトポロジカルな結合は非常に安定であった.であるなら,2本目のDNAとして結合した1本鎖DNAが2本鎖DNAに変換されれば,DNAとDNAとの安定したつなぎとめが形成されるはずである.実際に,2本目のDNAとして結合した1本鎖DNAをDNAポリメラーゼにより2本鎖DNAに変換したところ,EDTAにより処理しても2本目のDNAは安定に保持された.一方,2本鎖DNAと1本鎖DNAとのつなぎとめは同じ処理により崩壊した.以上から,DNAの合成を介して,コヒーシンはDNAとDNAとの安定なつなぎとめを形成することが判明した.
生体においては,ゲノムDNAに形成された1本鎖DNAにはすぐさま1本鎖DNA結合タンパク質であるRPAが結合する.よって,1本鎖DNA領域はつねにRPAが結合して保護された状態にあると考えられる.そこで,精製したRPAを用いてコヒーシンと2本目の1本鎖DNAとの結合に対する影響について調べたところ,結合はRPAの濃度に依存的に阻害された.1本鎖DNAに対する結合が減弱したRPA変異体を用いたところ,結合の阻害の効果は野生型のRPAに比べ低下した.このことから,RPAは1本鎖DNAと結合することによりコヒーシンと2本目の1本鎖DNAとの結合を阻害することが示唆された.
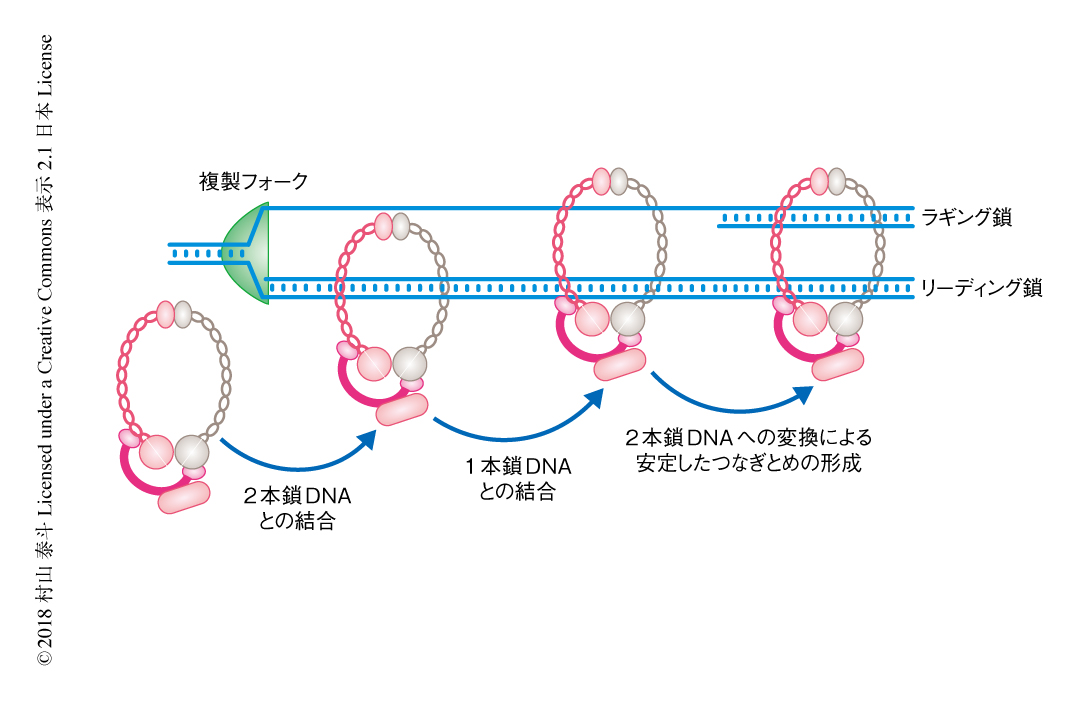
姉妹染色体のあいだの接着はDNAの複製と共役して形成される7).複製フォークにおいてはDNAヘリカーゼにより2本鎖DNAが開裂し1本鎖DNA領域が形成される.リーディング鎖の側では連続的にDNA鎖が合成されるため,1本鎖DNAはすぐさま2本鎖DNAに変換される.一方,ラギング鎖の側ではDNA鎖の合成は不連続であり,一時的に1本鎖DNA領域が残る.この複製フォークにみられる2本鎖DNA(リーディング鎖)と1本鎖DNA(ラギング鎖)との位置の関係は,コヒーシンが2本目のDNAとの結合により姉妹DNAのあいだでつなぎとめを形成するのに適した状況だと考えられた.すなわち,コヒーシンは,1本目のDNAとして2本鎖DNAであるリーディング鎖とトポロジカルに結合し,2本目のDNAとしてラギング鎖の1本鎖DNA領域とトポロジカルに結合する.最終的に,ラギング鎖はDNAの合成により2本鎖DNAに変換され,コヒーシンによるDNAとDNAとの安定したつなぎとめが形成される(図2).
実際に,複製フォークにおいて1本鎖DNA領域が2本目のDNAとしてコヒーシンと結合するのであれば,RPAは姉妹染色体のあいだの接着の形成に影響をおよぼすことが予想される.すなわち,RPAの1本鎖DNAに対する結合を減弱させれば姉妹染色体のあいだに接着が形成されやすくなり,逆に,RPAを増加させれば姉妹染色体のあいだの接着の形成は阻害されるだろう.この可能性について調べるため,出芽酵母において生存は可能であるが姉妹染色体のあいだの接着の形成に欠損をもつctf18破壊株を利用した.ctf18破壊株に1本鎖DNAに対する結合が減弱するRPA変異体を発現させたところ,姉妹染色体のあいだの接着の形成の欠損は部分的に改善された.さらに,セントロメアにおける姉妹染色体のあいだの接着の形成に欠損のあるchl4破壊株においても,同様に,1本鎖DNAに対する結合が減弱するRPA変異体を発現させることにより抑圧がみられた.反対に,RPAを過剰に発現させることにより,それだけで姉妹染色体のあいだの接着の形成の欠損が起こり,ctf18破壊株においてはこの欠損はさらに悪化した.これらの遺伝的な解析により,1本鎖DNAは姉妹染色体のあいだの接着を形成するための生理的な基質であることが支持された.
この研究においては,SMC1とSMC3を中核とするSMC複合体であるコヒーシンが2本目のDNAと結合する活性をもつことが示された.この1本鎖DNAに依存的な2本目のDNAとの結合は,複製フォークにおいて姉妹染色体のあいだの接着を形成するために仕立てあげられたようにみえる.細菌のSMCは1本鎖DNAに対し高い親和性を示すことが報告されている8,9).また,この研究において用いたRPA変異体であるが,もともと,分裂酵母のSMC2-SMC4複合体におけるコンデンシン変異株のサプレッサー解析から単離されたものである10).このことから,コンデンシンもRPAと1本鎖DNAとの結合において競合することが示唆され,また実際に,コンデンシンのクロマチンへの結合が1本鎖DNAの形成と関連のあることが示されている11).もしかしたら,コヒーシンにおいてみられたように,2本目のDNAとの結合は染色体のほかの構造やべつのSMC複合体にもみられるものなのかもしれない.
SMC複合体が最初に同定されたのは25年前であり,今日,SMC複合体が染色体の構造の形成において中心的な役割をはたすことに疑いはないが,依然として,タンパク質としての機能は未開である.このリング構造をもつSMC複合体のダイナミズムの理解をつうじて,100年の長きにわたる染色体の研究の深淵にせまっていきたい.
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,英国Cancer Research UK London Research Institute博士研究員,東京工業大学大学院生命理工学研究科 助教を経て,2017年より国立遺伝学研究所 テニュアトラック准教授.
研究テーマ:SMC複合体の機能の解析を中心とした染色体のダイナミズムの解明.
関心事:最近,研究室を立ち上げました.ポスドクおよび学生を募集しています.ぜひご連絡ください.
© 2018 村山 泰斗 Licensed under CC 表示 2.1 日本
(国立遺伝学研究所 新分野創造センター染色体生化学研究室)
email:村山泰斗
DOI: 10.7875/first.author.2018.012
Establishment of DNA-DNA interactions by the cohesin ring.
Yasuto Murayama, Catarina P. Samora, Yumiko Kurokawa, Hiroshi Iwasaki, Frank Uhlmann
Cell, 172, 465-477.e15 (2018)
この論文に出現する遺伝子・タンパク質のUniprot ID
コヒーシン, cohesin, SMC, ATPase, SMC1(P32908), SMC3(P47037), ヒストン, コンデンシン, SMC5(Q08204), SMC6(Q12749), Pds5(Q9HFF5), Wapl(O94364), RPA(P22336), DNAヘリカーゼ, ctf18(P49956), chl4(P38907), SMC2(P41003), SMC4(P41004), Psm1(O94383), Psm3(O42649), Scc1(Q12158), Rad21(P30776), Scc3(P40541), Psc3(O13816)
要 約
ゲノムDNAはクロマチン構造を基本としていっけん不規則に,しかし,正確な遺伝子の発現や染色体の分配が可能なようにさまざまな高次構造を形成して核のなかに収納されている.SMC複合体は巨大なリング状の構造をとりATPase活性をもつタンパク質複合体であり,そのリングの内側をとおすかたちでDNAとトポロジカルに結合する.この特殊なDNAとの結合により,SMC複合体は2本以上のDNAをつなぎとめて染色体の高次構造の形成を制御すると考えられている.この研究において,筆者らは,SMC1とSMC3を中核とするSMC複合体であるコヒーシンについて,すでにDNAとトポロジカルに結合しているコヒーシンが2本目のDNAともトポロジカルに結合することを見い出した.ただし,2本目のDNAは1本鎖DNAでなければならなかった.2本目の1本鎖DNAとの結合は不安定であったが,DNAの合成をへて,これら2本のDNAはコヒーシンにより安定につなぎとめられた.この研究において,コヒーシンは2本目のDNAとトポロジカルに結合する活性をもつことが示され,コヒーシンによる姉妹染色分体のあいだの接着の形成について新たな分子モデルが提唱された.
はじめに
その莫大な情報量を反映してゲノムDNAは非常に長く,少なくとも細胞の長さの数千倍もある.生命が子々孫々に継承されていくためには,ゲノムDNAをただ核に押し込めておくだけでなく,必要なときに必要な遺伝子を発現し,正確に複製し,全セットの染色体をまちがえることなく2つの娘細胞に分配しなくてはならない.この緻密さを可能にするため,ゲノムDNAはヒストンをはじめとするさまざまなタンパク質との結合により可塑性のある高次構造を形成する.SMC複合体は染色体の構造の形成における中心的な制御タンパク質で,細菌からヒトまで進化的に保存されている1).真核生物においては,姉妹染色体のあいだの接着の形成に必要なコヒーシン,体細胞分裂期の染色体の凝縮を制御するコンデンシン,DNAの修復に機能するSMC5-SMC6複合体の,少なくとも3つの必須なSMC複合体が存在する.これらのSMC複合体は,ABC型ATPaseドメインをもつSMCサブユニットを中核としてリング状の構造をとり,そのリング構造の内側をとおすかたちでDNAとトポロジカルに結合することが知られている.少なくとも,コヒーシンおよびコンデンシンは染色体の構造を形成するためにDNAとのトポロジカルな結合が必須であるらしい2,3).このことから,SMC複合体が染色体を折りたたんでいくための素反応は,DNAとのトポロジカルな結合により2本以上のDNAを直接につなぎとめることであると予想される4)(図1).これは非常にシンプルで合理的な分子モデルである.しかし依然として,SMC複合体がどのようにDNAと結合するのか,そして,本当に直接にDNAをつなぎとめるのか,については未解明であった.
1.コヒーシンと2本目のDNAとのトポロジカルな結合
コヒーシンはSMC1とSMC3を中核とするSMC複合体で,姉妹染色体のあいだの接着を形成する本体と考えられている.姉妹染色体のあいだの接着とは,文字どおり,複製された染色体のあいだに形成される物理的な接着である.姉妹染色体は紡錘体から伸びる微小管により細胞の両極に引っ張られ娘細胞に分配されるが,姉妹染色体のあいだには接着があるため張力が発生する.この張力のつり合いを指標として,細胞は全セットの染色体を2つの娘細胞に正確に分配する.一方で,姉妹染色体のあいだの接着は2本鎖DNA切断などの重篤なDNAの損傷の修復のために必須のプラットフォームでもあり,遺伝情報の維持および継承のためなくてはならないものである.
コヒーシンはどのように姉妹染色体のあいだの接着を形成するのだろうか? さきのモデルにしたがえば,コヒーシンはDNAとのトポロジカルな結合により,姉妹DNAどうしを直接につなぎとめると考えられる.以前に,筆者らの研究グループは,コヒーシンとDNAとの結合の詳細を理解するため,分裂酵母のコヒーシンおよび補助タンパク質を精製し,コヒーシンとDNAとがトポロジカルに結合する反応,および,逆に,コヒーシンのリング構造のなかにあったDNAが放出される反応を試験管内で再構成し,精製したコヒーシンはATPの存在下において2本鎖DNAとトポロジカルに結合すること,また,ローダー複合体はコヒーシンとDNAとの結合を,Pds5-Wapl複合体はコヒーシンとDNAとの解離を促進することを報告した5,6)(文献5) は 新着論文レビュー でも掲載,文献6) は 新着論文レビュー でも掲載).そこで,すでに2本鎖DNAとトポロジカルに結合しているコヒーシンを用意し,“2本目”のDNAをくわえて反応させたところ,コヒーシンはたしかに2本目のDNAとトポロジカルに結合した.この2本目のDNAとの結合は,ATP,ローダー複合体,DNAのセンサーとして機能するSMC3のATPaseドメインにある保存されたLysを必要とした.これらはすべて,1本目の2本鎖DNAとの結合に必要なものとまったく同じであったことから,2本目のDNAとの結合は,1本目のDNAとの結合と同じ反応であることが示唆された.ただし,1本目のDNAとの結合は異なり,2本目のDNAは1本鎖DNAである必要があった.
2.コヒーシンと1本鎖DNAとの結合は不安定である
2本目のDNAはなぜ1本鎖DNAである必要があるのかを理解するため,コヒーシンと1本鎖DNAとの結合を詳細に調べた.コヒーシンはトポロジカルな結合とは別に,DNAと静電的に相互作用する.コヒーシンはこの静電的な相互作用を利用して,DNAとトポロジカルに結合すると考えらえる.しかし,1本鎖DNAと2本鎖DNAとで,コヒーシンとの静電的な相互作用に大きな差はみられなかった.そこで,コヒーシンとDNAとをトポロジカルに結合させたのち,この結合の安定性について調べた.その結果,コヒーシンと2本鎖DNAとの結合は非常に安定で,EDTAや高い塩濃度により処理しても結合は保持された.しかし,コヒーシンのリング構造をプロテアーゼにより1箇所だけ切断する,あるいは,Pds5-Wapl複合体と反応させてコヒーシンのリング構造を一時的に開環させると,2本鎖DNAはコヒーシンから解離した.一方,1本鎖DNAの場合,EDTAや生理的な塩濃度で処理するだけでコヒーシンから解離した.このことから,コヒーシンと1本鎖DNAとの結合は不安定であることが示唆された.
結合の安定性に大きな違いがあったものの,1本鎖DNAは2本鎖DNAと同様に,コヒーシンのもつATPase活性を促進した.コヒーシンの単体によるATPの加水分解は低いレベルにとどまるが,ローダー複合体および2本鎖DNAの存在下においてはいちじるしく上昇する.1本鎖DNAについても,2本鎖DNAと同等かそれ以上にコヒーシンのもつATPase活性を促進した.このことから,1本鎖DNAはコヒーシンの生理的な基質であることが示唆された.
コヒーシンと1本鎖DNAあるいは2本鎖DNAとの静電的な相互作用はほぼ同じ程度であったことから,コヒーシンと2本目の1本鎖DNAとの結合は,同時に2本鎖DNAをくわえることにより競争的に阻害されると考えられた.しかし,過剰量の2本鎖DNAをくわえてもコヒーシンと2本目の1本鎖DNAとの結合は阻害されなかった.その分子機構の詳細は今後の課題であるが,1本目の2本鎖DNAとトポロジカルに結合しているコヒーシンは,1本鎖DNAと選択的に結合するようであった.
3.1本鎖DNAから2本鎖DNAへの変換によりDNAとDNAとは安定につなぎとめられる
コヒーシンと1本鎖DNAとの結合は不安定であったことから,コヒーシンによる1本鎖DNAと2本鎖DNAとのつなぎとめも不安定で壊れやすいことが予想された.そこで,コヒーシンと2本目の1本鎖DNAとの結合の直後にATPを枯渇させたところ,1本鎖DNAと2本鎖DNAとのつなぎとめはすみやかに崩壊した.逆に,ATP再生系をくわえることにより2本鎖DNAと1本鎖DNAとのつなぎとめはより長時間にわたり保持された.このことから,コヒーシンと2本目の1本鎖DNAとの結合を保持するためには,コヒーシンとATPとの結合が重要であることが示唆された.
姉妹染色体のあいだの接着は非常に安定な構造である.たとえば,哺乳類の卵母細胞においては姉妹染色体のあいだの接着は数年ないし数十年の単位で維持される.よって,コヒーシンによる2本鎖DNAと1本鎖DNAのつなぎとめの不安定さは姉妹染色体のあいだの接着の特性にそぐわない.一方で,コヒーシンと2本鎖DNAとのトポロジカルな結合は非常に安定であった.であるなら,2本目のDNAとして結合した1本鎖DNAが2本鎖DNAに変換されれば,DNAとDNAとの安定したつなぎとめが形成されるはずである.実際に,2本目のDNAとして結合した1本鎖DNAをDNAポリメラーゼにより2本鎖DNAに変換したところ,EDTAにより処理しても2本目のDNAは安定に保持された.一方,2本鎖DNAと1本鎖DNAとのつなぎとめは同じ処理により崩壊した.以上から,DNAの合成を介して,コヒーシンはDNAとDNAとの安定なつなぎとめを形成することが判明した.
4.RPAはコヒーシンと2本目の1本鎖DNAとの結合を阻害する
生体においては,ゲノムDNAに形成された1本鎖DNAにはすぐさま1本鎖DNA結合タンパク質であるRPAが結合する.よって,1本鎖DNA領域はつねにRPAが結合して保護された状態にあると考えられる.そこで,精製したRPAを用いてコヒーシンと2本目の1本鎖DNAとの結合に対する影響について調べたところ,結合はRPAの濃度に依存的に阻害された.1本鎖DNAに対する結合が減弱したRPA変異体を用いたところ,結合の阻害の効果は野生型のRPAに比べ低下した.このことから,RPAは1本鎖DNAと結合することによりコヒーシンと2本目の1本鎖DNAとの結合を阻害することが示唆された.
5.コヒーシンと2本目のDNAとの結合と姉妹染色体のあいだに接着が形成されるモデル
姉妹染色体のあいだの接着はDNAの複製と共役して形成される7).複製フォークにおいてはDNAヘリカーゼにより2本鎖DNAが開裂し1本鎖DNA領域が形成される.リーディング鎖の側では連続的にDNA鎖が合成されるため,1本鎖DNAはすぐさま2本鎖DNAに変換される.一方,ラギング鎖の側ではDNA鎖の合成は不連続であり,一時的に1本鎖DNA領域が残る.この複製フォークにみられる2本鎖DNA(リーディング鎖)と1本鎖DNA(ラギング鎖)との位置の関係は,コヒーシンが2本目のDNAとの結合により姉妹DNAのあいだでつなぎとめを形成するのに適した状況だと考えられた.すなわち,コヒーシンは,1本目のDNAとして2本鎖DNAであるリーディング鎖とトポロジカルに結合し,2本目のDNAとしてラギング鎖の1本鎖DNA領域とトポロジカルに結合する.最終的に,ラギング鎖はDNAの合成により2本鎖DNAに変換され,コヒーシンによるDNAとDNAとの安定したつなぎとめが形成される(図2).
実際に,複製フォークにおいて1本鎖DNA領域が2本目のDNAとしてコヒーシンと結合するのであれば,RPAは姉妹染色体のあいだの接着の形成に影響をおよぼすことが予想される.すなわち,RPAの1本鎖DNAに対する結合を減弱させれば姉妹染色体のあいだに接着が形成されやすくなり,逆に,RPAを増加させれば姉妹染色体のあいだの接着の形成は阻害されるだろう.この可能性について調べるため,出芽酵母において生存は可能であるが姉妹染色体のあいだの接着の形成に欠損をもつctf18破壊株を利用した.ctf18破壊株に1本鎖DNAに対する結合が減弱するRPA変異体を発現させたところ,姉妹染色体のあいだの接着の形成の欠損は部分的に改善された.さらに,セントロメアにおける姉妹染色体のあいだの接着の形成に欠損のあるchl4破壊株においても,同様に,1本鎖DNAに対する結合が減弱するRPA変異体を発現させることにより抑圧がみられた.反対に,RPAを過剰に発現させることにより,それだけで姉妹染色体のあいだの接着の形成の欠損が起こり,ctf18破壊株においてはこの欠損はさらに悪化した.これらの遺伝的な解析により,1本鎖DNAは姉妹染色体のあいだの接着を形成するための生理的な基質であることが支持された.
おわりに
この研究においては,SMC1とSMC3を中核とするSMC複合体であるコヒーシンが2本目のDNAと結合する活性をもつことが示された.この1本鎖DNAに依存的な2本目のDNAとの結合は,複製フォークにおいて姉妹染色体のあいだの接着を形成するために仕立てあげられたようにみえる.細菌のSMCは1本鎖DNAに対し高い親和性を示すことが報告されている8,9).また,この研究において用いたRPA変異体であるが,もともと,分裂酵母のSMC2-SMC4複合体におけるコンデンシン変異株のサプレッサー解析から単離されたものである10).このことから,コンデンシンもRPAと1本鎖DNAとの結合において競合することが示唆され,また実際に,コンデンシンのクロマチンへの結合が1本鎖DNAの形成と関連のあることが示されている11).もしかしたら,コヒーシンにおいてみられたように,2本目のDNAとの結合は染色体のほかの構造やべつのSMC複合体にもみられるものなのかもしれない.
SMC複合体が最初に同定されたのは25年前であり,今日,SMC複合体が染色体の構造の形成において中心的な役割をはたすことに疑いはないが,依然として,タンパク質としての機能は未開である.このリング構造をもつSMC複合体のダイナミズムの理解をつうじて,100年の長きにわたる染色体の研究の深淵にせまっていきたい.
文 献
- Uhlmann, F.: SMC complexes: from DNA to chromosomes. Nat. Rev. Mol. Cell Biol., 17, 399-412 (2016)[PubMed]
- Haering, C. H., Farcas, A. M., Arumugam, P. et al.: The cohesin ring concatenates sister DNA molecules. Nature, 454, 297-301 (2008)[PubMed]
- Cuylen, S., Metz, J. & Haering, C. H.: Condensin structures chromosomal DNA through topological links. Nat. Struct. Mol. Biol., 18, 894-901 (2011)[PubMed]
- Nasmyth, K.: Cohesin: a catenase with separate entry and exit gates? Nat. Cell Biol., 13, 1170-1177 (2011)[PubMed]
- Murayama, Y. & Uhlmann, F.: Biochemical reconstitution of topological DNA binding by the cohesin ring. Nature, 505, 367-371 (2014)[PubMed] [新着論文レビュー]
- Murayama, Y. & Uhlmann, F.: DNA entry into and exit out of the cohesin ring by an interlocking gate mechanism. Cell, 163, 1628-1640 (2015)[PubMed] [新着論文レビュー]
- Uhlmann, F. & Nasmyth, K.: Cohesion between sister chromatids must be established during DNA replication. Curr. Biol., 8, 1095-1101 (1998)[PubMed]
- Hirano, M. & Hirano, T.: ATP-dependent aggregation of single-stranded DNA by a bacterial SMC homodimer. EMBO J., 17, 7139-7148 (1998)[PubMed]
- Niki, H. & Yano, K.: In vitro topological loading of bacterial condensin MukB on DNA, preferentially single-stranded DNA rather than double-stranded DNA. Sci. Rep., 6, 29469 (2016)[PubMed]
- Akai, Y., Kurokawa, Y., Nakazawa, N. et al.: Opposing role of condensin hinge against replication protein A in mitosis and interphase through promoting DNA annealing. Open Biol., 1, 110023 (2011)[PubMed]
- Sutani, T., Sakata, T., Nakato, R. et al.: Condensin targets and reduces unwound DNA structures associated with transcription in mitotic chromosome condensation. Nat. Commun., 6, 7815 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,英国Cancer Research UK London Research Institute博士研究員,東京工業大学大学院生命理工学研究科 助教を経て,2017年より国立遺伝学研究所 テニュアトラック准教授.
研究テーマ:SMC複合体の機能の解析を中心とした染色体のダイナミズムの解明.
関心事:最近,研究室を立ち上げました.ポスドクおよび学生を募集しています.ぜひご連絡ください.
© 2018 村山 泰斗 Licensed under CC 表示 2.1 日本