HDAC5およびその標的であるNpas4遺伝子は側坐核においてコカインの報酬に関連する行動を制御する
谷口 誠・Maria B. Carreira・Christopher W. Cowan
(米国Medical University of South Carolina,Department of Neuroscience)
email:谷口 誠
DOI: 10.7875/first.author.2017.123
HDAC5 and its target gene, Npas4, function in the nucleus accumbens to regulate cocaine-conditioned behaviors.
Makoto Taniguchi, Maria B. Carreira, Yonatan A. Cooper, Ana-Clara Bobadilla, Jasper A. Heinsbroek, Nobuya Koike, Erin B. Larson, Evan A. Balmuth, Brandon W. Hughes, Rachel D. Penrod, Jaswinder Kumar, Laura N. Smith, Daniel Guzman, Joseph S. Takahashi, Tae-Kyung Kim, Peter W. Kalivas, David W. Self, Yingxi Lin, Christopher W. Cowan
Neuron, 96, 130-144.e6 (2017)
薬物の乱用により,薬物によりひき起こされる快楽とその薬物を使用した状況とが強い関連性をもって記憶される.過去に薬物を使用した場所や道具などの薬物の快楽に関連づいた状況が刺激となり,薬物への渇望や摂取行動が再燃する強いきっかけになる.今回の研究において,脳の報酬系の回路の中心である側坐核において,ヒストン脱アセチル化酵素HDAC5がコカインによりひき起こされる快楽とコカインを使用した環境とが関連づいた記憶の形成を抑制し,コカインへの渇望の再燃を抑制することが示された.HDAC5は転写因子をコードするNpas4遺伝子の神経活動に依存的なエンハンサー領域と結合しその発現を抑制した.コカインの摂取や新規の環境の探索などの刺激により,NPAS4は側坐核のごく少数のニューロンにおいて強くかつ一時的に発現した.この側坐核におけるNPAS4の発現はコカインの摂取による快楽と関連づいた場所の記憶および学習に関与したが,コカインへの渇望や摂取行動の再燃には影響しなかった.これらの結果から,側坐核においてHDAC5およびNPAS4はコカインによる快楽とコカインを使用した状況とを関連づける記憶および学習に大きく寄与すること,また,HDAC5はほかの遺伝子の発現を制御することにより薬物への渇望や摂取行動を抑制することが示唆された.
コカインやヘロインなどの薬物の乱用により薬物依存症におちいると,健康にも社会的にもさまざまな悪い結果がひき起こされることを理解しながらも,強迫的な薬物の渇望により摂取をくり返してしまう.長期にわたり薬物の摂取を中止した場合においても,過去に薬物を使用した場所や道具が刺激となり薬物への渇望が再燃し乱用がくり返される1).この非常に高い再燃率は薬物依存症の予防あるいは治療を考える際に非常に大きな問題である.
これまでの研究により,コカインなどの薬物の摂取によりヒストンのアセチル化を含むエピジェネティックな遺伝子発現の制御機構が強く影響されることが報告されている2-6)(文献6) は 新着論文レビュー でも掲載).エピジェネティックな遺伝子発現の制御機構の変化による異常な遺伝子発現が神経ネットワークの病的な再構築を起こし,薬物依存症の脆弱性につながるさまざまな症状をひき起こす.エピジェネティックな遺伝子発現を制御するヒストン脱アセチル化酵素のひとつであるHDAC5は,Ca2+シグナルやcAMPシグナルによるリン酸化の制御により細胞における局在が制御されることが報告されている7,8).コカインは側坐核における神経伝達物質であるドーパミンを介したcAMPシグナルの活性を大きく変化させる.コカインの常習的な投与によりHDAC5のリン酸化は一時的に亢進し細胞質へと局在するようになる7).また,それとは逆に,コカインにより活性化されたドーパミン-ドーパミン受容体1-cAMP-PP2aシグナル伝達系により,HDAC5はすみやかに脱リン酸化され核への移行が進行する6).リン酸化部位を脱リン酸化型のアミノ酸と置換したHDAC5変異体を側坐核に発現させたマウスは,コカインの摂取による快楽と関連づいた場所の記憶および学習が阻害される6).これらの結果から,コカインにより脱リン酸化し核へと移行したHDAC5は,コカインの摂取が刺激になって誘導された遺伝子発現を抑制し,その結果,コカインの摂取の快楽と関連づいた記憶および学習を抑制する負のフィードバックに関与すると考えられた.この研究においては,これらの研究をさらに進め,HDAC5が薬物依存症の症状である薬物への渇望や摂取行動に対しどのように影響するのか,また,その薬物に関連した記憶および学習をつかさどるHDAC5の標的となる遺伝子を探索した.
これまでに,コカインを摂取すると側坐核においてHDAC5は脱リン酸化され核へと移行することが報告されている.そこで,リン酸化部位を脱リン酸化型のアミノ酸と置換し核に移行するようにしたHDAC5変異体を作製し,ラットの側坐核に発現させコカインの自己投与の行動実験を実施することにより,薬物の報酬に関連する行動に対しHDAC5がどのように影響するかについて調べた.その結果,核に移行するようにしたHDAC5変異体は薬物の摂取量,感受性,薬物の摂取行動の消失には影響しなかったが,コカインの摂取による快楽と関連づいた刺激や実験者によるコカインの投与などにより再燃する薬物への渇望および摂取行動がいちじるしく抑制された.
核に移行するようにしたHDAC5変異体がコカインの快楽に関連した学習および行動を制御したこと,また,細胞質に局在するようにしたHDAC5変異体やヒストン脱アセチル化酵素活性を欠損させたHDAC5変異体では影響がみられなかったことから,HDAC5は核において遺伝子発現を制御することによりコカインの摂取による報酬に関連した記憶および行動を制御するとの仮説をたてた.そこで,ChIP-seq法を用いてHDAC5の標的となる遺伝子を探索した.その結果,HDAC5が結合するゲノム領域として,神経活動に依存的な転写因子をコードするNpas4遺伝子を含む約1000箇所が同定された.ほかのヒストン脱アセチル化酵素とは異なり,HDAC5はイントロンや遺伝子非コード領域と多く結合した.HDAC5は転写因子MEF2との結合を介してゲノムDNAと結合し遺伝子発現を制御することが報告されている8,9).予想されたとおり,HDAC5が結合するゲノム領域の70~80%はMEF2結合配列を含んでおり,HDAC5はMEF2を介してゲノムDNAと結合することがあらためて示唆された.また,HDAC5の結合するゲノム領域の約30%は転写因子AP1との結合配列を含んでおり,AP1が核においてHDAC5が形成する新規のタンパク質複合体の構成タンパク質である可能性が示された.HDAC5はNpas4遺伝子の神経活動に依存的なエンハンサー領域10) と強く結合し,また,HDAC5ノックアウトマウスは野生型のマウスと比べmRNAレベルにおいてNPAS4を高く発現していた.in vitroおよびin vivoにおいてHDAC5はNpas4遺伝子のエンハンサー領域に結合しその発現を抑制することが示された.
HDAC5が神経活動に依存的なNPAS4の発現を抑制すること,また,NPAS4は神経活動に依存的に神経ネットワークを制御する機能をもつことから11-13),側坐核におけるNPAS4の発現およびその役割に注目した.その結果,コカインの摂取や新規の環境の探索により側坐核においてNPAS4が一時的に発現することが見い出された.NPAS4はニューロンの種類により異なる遺伝子の転写を制御し,特異的なシナプスの形成を制御することが報告されていることから13),NPAS4の役割を考える際には,発現するニューロンの種類を同定することが非常に重要であった.側坐核におけるニューロンの構成は非常にユニークであり,90~95%は中型有棘ニューロン,0.5~1%はコリン作動性の介在ニューロン,3~4%はGABA作動性の介在ニューロンがしめる.NPAS4を発現するニューロンのうち15%は中型有棘ニューロンであり,コリン作動性の介在ニューロンには発現していなかった.NPAS4の発現はGABA作動性の介在ニューロンにおいても観察され,なかでもパルブアルブミン陽性ニューロンやソマトスタチン陽性ニューロンにおいて発現が確認された.残念ながら,NPAS4を発現するニューロンの大部分は同定されておらず,詳細な解析は今後の重要な研究テーマのひとつである.
NPAS4の発現を解析した結果,マウスが新規の環境を探索した際あるいはコカインを投与された際,つまり,コカインの報酬とそのコカインを摂取した環境とが関連づいた記憶が形成される際に発現することが観察された.このときのNPAS4の役割について検証するため,側坐核においてNPAS4をノックアウトしたマウスを作製して行動実験を実施した.その結果,側坐核においてNPAS4をノックアウトしたマウスでは,コカインにより条件づけられた場所に対する嗜好性がいちじるしく低下したが,コカインに対する感受性,コカインの投与による活動,スクロースなどの報酬に対する嗜好性については変化がみられなかった.また,恐怖条件づけされた場所に対する記憶や,コカインの嗜好性に対し大きな影響がある不安レベルも影響されなかった.これらの結果から,側坐核におけるNPAS4の発現はコカインの投与により生じた報酬とそのコカインを摂取した場所とを関連づけた記憶および学習に必要であることが示された.
核に移行するようにしたHDAC5変異体を側坐核に発現させると,コカインの報酬に関連づいた刺激により再燃する薬物への探索行動がいちじるしく抑制された.そこで,HDAC5の標的であるNpas4遺伝子が薬物の自己投与の学習や薬物への渇望の再燃にどのように影響するのか検証した.その結果,側坐核においてNPAS4をノックアウトしたマウスは野生型のマウスに比べ,コカインの投与やスクロースの報酬に関連づいた行動の学習が阻害されていたが,報酬に関連づいた刺激によりひき起こされる渇望および摂取行動の再燃には影響はみられなかった.HDAC5とその標的であるNpas4遺伝子はコカインあるいはスクロースによる報酬とそれに関連した場所や行動の記憶の形成および学習に重要な役割をもつと考えられた.さらに,HDAC5はNpas4遺伝子ではなくほかの標的となる遺伝子の発現を制御することにより,薬物への渇望の再燃に影響をおよぼすことが示唆された.
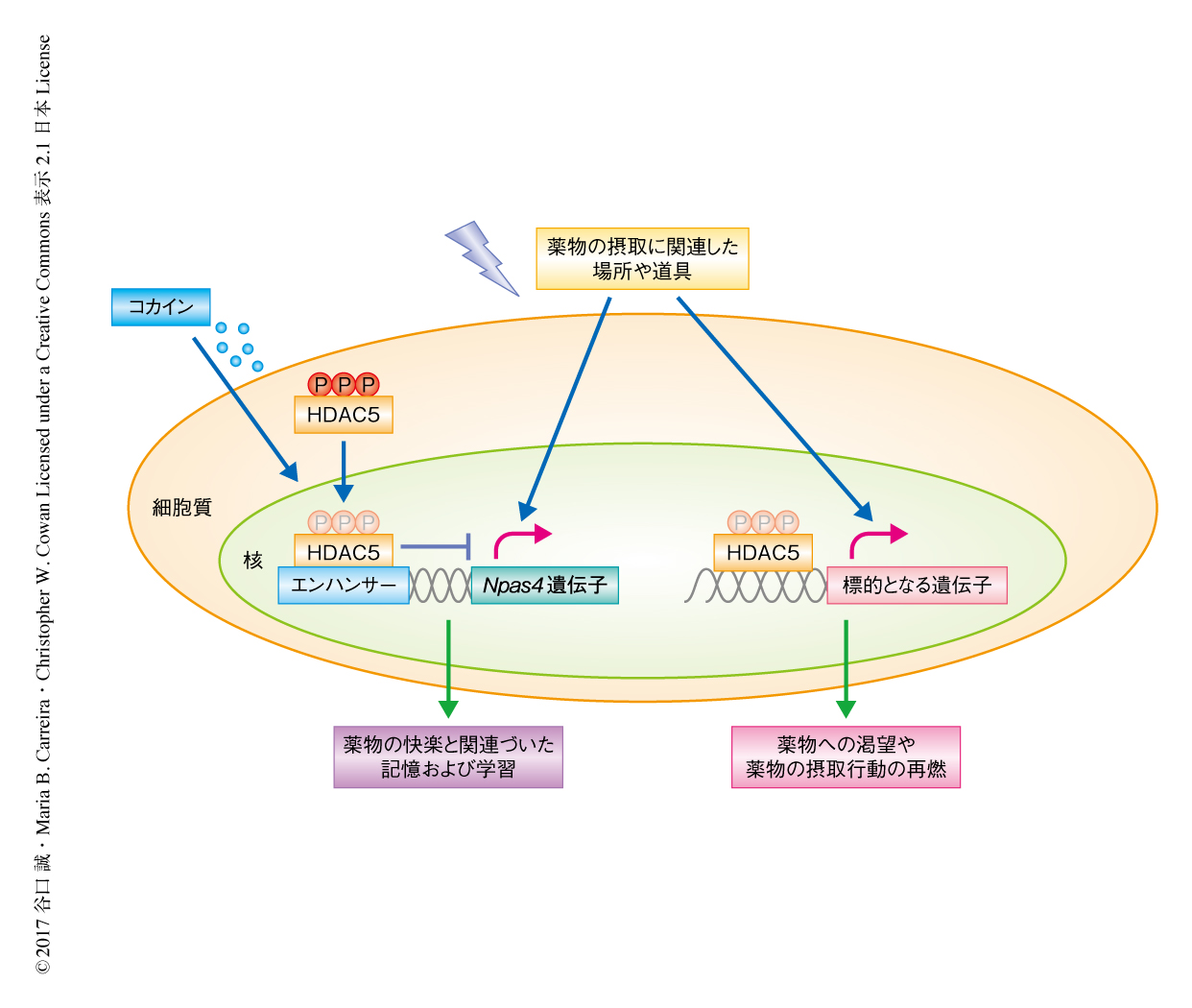
この研究により,薬物の摂取による快楽とそれに関連した場所などの記憶の形成および学習,また,薬物への渇望と摂取行動の再燃をつかさどる分子機構の一部が明らかにされた(図1).コカインを摂取すると,脳の報酬系の回路の中心である側坐核においてHDAC5の脱リン酸化がひき起こされ核へと移行する.HDAC5は核においてNpas4遺伝子のエンハンサー領域と結合しその神経活動に依存的な発現を抑制する.コカインの摂取や新規の環境の探索により側坐核においてNPAS4が発現する.NPAS4の発現はコカインやスクロースなどの報酬とその報酬に関連づいた場所の記憶の形成および学習に必須である.HDAC5やNPAS4,および,それらの標的は,薬物依存症に対する治療薬の標的となる可能性がある.
略歴:2007年 東京都立大学大学院理学研究科 修了,同年 米国Texas大学Southwestern Medical Center博士研究員,米国Harvard Medical School講師を経て,米国Medical University of South CarolinaにてResearch Assistant Professor.
研究テーマ:脳の報酬系の回路における行動制御の基盤分子機構.
抱負:多くの研究者や科学に関心をもつ人たちと幅広く意見をかわすことで研究を楽しく発展させていきたいと思います.
Maria B. Carreira
パナマInstitute for Scientific Research and High Technology Services博士研究員.
Christopher W. Cowan
米国Medical University of South CarolinaにてProfessor.
© 2017 谷口 誠・Maria B. Carreira・Christopher W. Cowan Licensed under CC 表示 2.1 日本
(米国Medical University of South Carolina,Department of Neuroscience)
email:谷口 誠
DOI: 10.7875/first.author.2017.123
HDAC5 and its target gene, Npas4, function in the nucleus accumbens to regulate cocaine-conditioned behaviors.
Makoto Taniguchi, Maria B. Carreira, Yonatan A. Cooper, Ana-Clara Bobadilla, Jasper A. Heinsbroek, Nobuya Koike, Erin B. Larson, Evan A. Balmuth, Brandon W. Hughes, Rachel D. Penrod, Jaswinder Kumar, Laura N. Smith, Daniel Guzman, Joseph S. Takahashi, Tae-Kyung Kim, Peter W. Kalivas, David W. Self, Yingxi Lin, Christopher W. Cowan
Neuron, 96, 130-144.e6 (2017)
要 約
薬物の乱用により,薬物によりひき起こされる快楽とその薬物を使用した状況とが強い関連性をもって記憶される.過去に薬物を使用した場所や道具などの薬物の快楽に関連づいた状況が刺激となり,薬物への渇望や摂取行動が再燃する強いきっかけになる.今回の研究において,脳の報酬系の回路の中心である側坐核において,ヒストン脱アセチル化酵素HDAC5がコカインによりひき起こされる快楽とコカインを使用した環境とが関連づいた記憶の形成を抑制し,コカインへの渇望の再燃を抑制することが示された.HDAC5は転写因子をコードするNpas4遺伝子の神経活動に依存的なエンハンサー領域と結合しその発現を抑制した.コカインの摂取や新規の環境の探索などの刺激により,NPAS4は側坐核のごく少数のニューロンにおいて強くかつ一時的に発現した.この側坐核におけるNPAS4の発現はコカインの摂取による快楽と関連づいた場所の記憶および学習に関与したが,コカインへの渇望や摂取行動の再燃には影響しなかった.これらの結果から,側坐核においてHDAC5およびNPAS4はコカインによる快楽とコカインを使用した状況とを関連づける記憶および学習に大きく寄与すること,また,HDAC5はほかの遺伝子の発現を制御することにより薬物への渇望や摂取行動を抑制することが示唆された.
はじめに
コカインやヘロインなどの薬物の乱用により薬物依存症におちいると,健康にも社会的にもさまざまな悪い結果がひき起こされることを理解しながらも,強迫的な薬物の渇望により摂取をくり返してしまう.長期にわたり薬物の摂取を中止した場合においても,過去に薬物を使用した場所や道具が刺激となり薬物への渇望が再燃し乱用がくり返される1).この非常に高い再燃率は薬物依存症の予防あるいは治療を考える際に非常に大きな問題である.
これまでの研究により,コカインなどの薬物の摂取によりヒストンのアセチル化を含むエピジェネティックな遺伝子発現の制御機構が強く影響されることが報告されている2-6)(文献6) は 新着論文レビュー でも掲載).エピジェネティックな遺伝子発現の制御機構の変化による異常な遺伝子発現が神経ネットワークの病的な再構築を起こし,薬物依存症の脆弱性につながるさまざまな症状をひき起こす.エピジェネティックな遺伝子発現を制御するヒストン脱アセチル化酵素のひとつであるHDAC5は,Ca2+シグナルやcAMPシグナルによるリン酸化の制御により細胞における局在が制御されることが報告されている7,8).コカインは側坐核における神経伝達物質であるドーパミンを介したcAMPシグナルの活性を大きく変化させる.コカインの常習的な投与によりHDAC5のリン酸化は一時的に亢進し細胞質へと局在するようになる7).また,それとは逆に,コカインにより活性化されたドーパミン-ドーパミン受容体1-cAMP-PP2aシグナル伝達系により,HDAC5はすみやかに脱リン酸化され核への移行が進行する6).リン酸化部位を脱リン酸化型のアミノ酸と置換したHDAC5変異体を側坐核に発現させたマウスは,コカインの摂取による快楽と関連づいた場所の記憶および学習が阻害される6).これらの結果から,コカインにより脱リン酸化し核へと移行したHDAC5は,コカインの摂取が刺激になって誘導された遺伝子発現を抑制し,その結果,コカインの摂取の快楽と関連づいた記憶および学習を抑制する負のフィードバックに関与すると考えられた.この研究においては,これらの研究をさらに進め,HDAC5が薬物依存症の症状である薬物への渇望や摂取行動に対しどのように影響するのか,また,その薬物に関連した記憶および学習をつかさどるHDAC5の標的となる遺伝子を探索した.
1.HDAC5は側坐核においてコカインへの渇望および摂取行動の再発を抑制する
これまでに,コカインを摂取すると側坐核においてHDAC5は脱リン酸化され核へと移行することが報告されている.そこで,リン酸化部位を脱リン酸化型のアミノ酸と置換し核に移行するようにしたHDAC5変異体を作製し,ラットの側坐核に発現させコカインの自己投与の行動実験を実施することにより,薬物の報酬に関連する行動に対しHDAC5がどのように影響するかについて調べた.その結果,核に移行するようにしたHDAC5変異体は薬物の摂取量,感受性,薬物の摂取行動の消失には影響しなかったが,コカインの摂取による快楽と関連づいた刺激や実験者によるコカインの投与などにより再燃する薬物への渇望および摂取行動がいちじるしく抑制された.
2.HDAC5はNpas4遺伝子のエンハンサー領域と結合して発現を抑制する
核に移行するようにしたHDAC5変異体がコカインの快楽に関連した学習および行動を制御したこと,また,細胞質に局在するようにしたHDAC5変異体やヒストン脱アセチル化酵素活性を欠損させたHDAC5変異体では影響がみられなかったことから,HDAC5は核において遺伝子発現を制御することによりコカインの摂取による報酬に関連した記憶および行動を制御するとの仮説をたてた.そこで,ChIP-seq法を用いてHDAC5の標的となる遺伝子を探索した.その結果,HDAC5が結合するゲノム領域として,神経活動に依存的な転写因子をコードするNpas4遺伝子を含む約1000箇所が同定された.ほかのヒストン脱アセチル化酵素とは異なり,HDAC5はイントロンや遺伝子非コード領域と多く結合した.HDAC5は転写因子MEF2との結合を介してゲノムDNAと結合し遺伝子発現を制御することが報告されている8,9).予想されたとおり,HDAC5が結合するゲノム領域の70~80%はMEF2結合配列を含んでおり,HDAC5はMEF2を介してゲノムDNAと結合することがあらためて示唆された.また,HDAC5の結合するゲノム領域の約30%は転写因子AP1との結合配列を含んでおり,AP1が核においてHDAC5が形成する新規のタンパク質複合体の構成タンパク質である可能性が示された.HDAC5はNpas4遺伝子の神経活動に依存的なエンハンサー領域10) と強く結合し,また,HDAC5ノックアウトマウスは野生型のマウスと比べmRNAレベルにおいてNPAS4を高く発現していた.in vitroおよびin vivoにおいてHDAC5はNpas4遺伝子のエンハンサー領域に結合しその発現を抑制することが示された.
3.コカインの摂取や新規の環境の探索により側坐核においてNPAS4が発現する
HDAC5が神経活動に依存的なNPAS4の発現を抑制すること,また,NPAS4は神経活動に依存的に神経ネットワークを制御する機能をもつことから11-13),側坐核におけるNPAS4の発現およびその役割に注目した.その結果,コカインの摂取や新規の環境の探索により側坐核においてNPAS4が一時的に発現することが見い出された.NPAS4はニューロンの種類により異なる遺伝子の転写を制御し,特異的なシナプスの形成を制御することが報告されていることから13),NPAS4の役割を考える際には,発現するニューロンの種類を同定することが非常に重要であった.側坐核におけるニューロンの構成は非常にユニークであり,90~95%は中型有棘ニューロン,0.5~1%はコリン作動性の介在ニューロン,3~4%はGABA作動性の介在ニューロンがしめる.NPAS4を発現するニューロンのうち15%は中型有棘ニューロンであり,コリン作動性の介在ニューロンには発現していなかった.NPAS4の発現はGABA作動性の介在ニューロンにおいても観察され,なかでもパルブアルブミン陽性ニューロンやソマトスタチン陽性ニューロンにおいて発現が確認された.残念ながら,NPAS4を発現するニューロンの大部分は同定されておらず,詳細な解析は今後の重要な研究テーマのひとつである.
4.側坐核におけるNPAS4の発現はコカインの報酬に関連した記憶および学習に必要である
NPAS4の発現を解析した結果,マウスが新規の環境を探索した際あるいはコカインを投与された際,つまり,コカインの報酬とそのコカインを摂取した環境とが関連づいた記憶が形成される際に発現することが観察された.このときのNPAS4の役割について検証するため,側坐核においてNPAS4をノックアウトしたマウスを作製して行動実験を実施した.その結果,側坐核においてNPAS4をノックアウトしたマウスでは,コカインにより条件づけられた場所に対する嗜好性がいちじるしく低下したが,コカインに対する感受性,コカインの投与による活動,スクロースなどの報酬に対する嗜好性については変化がみられなかった.また,恐怖条件づけされた場所に対する記憶や,コカインの嗜好性に対し大きな影響がある不安レベルも影響されなかった.これらの結果から,側坐核におけるNPAS4の発現はコカインの投与により生じた報酬とそのコカインを摂取した場所とを関連づけた記憶および学習に必要であることが示された.
5.NPAS4は報酬に関連する行動の学習に必須である
核に移行するようにしたHDAC5変異体を側坐核に発現させると,コカインの報酬に関連づいた刺激により再燃する薬物への探索行動がいちじるしく抑制された.そこで,HDAC5の標的であるNpas4遺伝子が薬物の自己投与の学習や薬物への渇望の再燃にどのように影響するのか検証した.その結果,側坐核においてNPAS4をノックアウトしたマウスは野生型のマウスに比べ,コカインの投与やスクロースの報酬に関連づいた行動の学習が阻害されていたが,報酬に関連づいた刺激によりひき起こされる渇望および摂取行動の再燃には影響はみられなかった.HDAC5とその標的であるNpas4遺伝子はコカインあるいはスクロースによる報酬とそれに関連した場所や行動の記憶の形成および学習に重要な役割をもつと考えられた.さらに,HDAC5はNpas4遺伝子ではなくほかの標的となる遺伝子の発現を制御することにより,薬物への渇望の再燃に影響をおよぼすことが示唆された.
おわりに
この研究により,薬物の摂取による快楽とそれに関連した場所などの記憶の形成および学習,また,薬物への渇望と摂取行動の再燃をつかさどる分子機構の一部が明らかにされた(図1).コカインを摂取すると,脳の報酬系の回路の中心である側坐核においてHDAC5の脱リン酸化がひき起こされ核へと移行する.HDAC5は核においてNpas4遺伝子のエンハンサー領域と結合しその神経活動に依存的な発現を抑制する.コカインの摂取や新規の環境の探索により側坐核においてNPAS4が発現する.NPAS4の発現はコカインやスクロースなどの報酬とその報酬に関連づいた場所の記憶の形成および学習に必須である.HDAC5やNPAS4,および,それらの標的は,薬物依存症に対する治療薬の標的となる可能性がある.
文 献
- Koob, G. F. & Volkow, N. D.: Neurocircuitry of addiction. Neuropsychopharmacology, 35, 217-238 (2010)[PubMed]
- Kenny, P. J.: Epigenetics, microRNA, and addiction. Dialogues Clin. Neurosci., 16, 335-344 (2014)[PubMed]
- Nestler, E. J.: Epigenetic mechanisms of drug addiction. Neuropharmacology, 76 Pt B, 259-268 (2014)[PubMed]
- Renthal, W., Kumar, A., Xiao, G. et al.: Genome-wide analysis of chromatin regulation by cocaine reveals a role for sirtuins. Neuron, 62, 335-348 (2009)[PubMed]
- Renthal, W., Maze, I., Krishnan, V. et al.: Histone deacetylase 5 epigenetically controls behavioral adaptations to chronic emotional stimuli. Neuron, 56, 517-529 (2007)[PubMed]
- Taniguchi, M., Carreira, M. B., Smith, L. N. et al.: Histone deacetylase 5 limits cocaine reward through cAMP-induced nuclear import. Neuron, 73, 108-120 (2012)[PubMed] [新着論文レビュー]
- Chawla, S., Vanhoutte, P., Arnold, F. J. et al.: Neuronal activity-dependent nucleocytoplasmic shuttling of HDAC4 and HDAC5. J. Neurochem., 85, 151-159 (2003)[PubMed]
- McKinsey, T. A., Zhang, C. L., Lu, J. et al.: Signal-dependent nuclear export of a histone deacetylase regulates muscle differentiation. Nature, 408, 106-111 (2000)[PubMed]
- McKinsey, T. A., Zhang, C. L. & Olson, E. N.: Activation of the myocyte enhancer factor-2 transcription factor by calcium/calmodulin-dependent protein kinase-stimulated binding of 14-3-3 to histone deacetylase 5. Proc. Natl. Acad. Sci. USA, 97, 14400-14405 (2000)[PubMed]
- Kim, T. K., Hemberg, M., Gray, J. M. et al.: Widespread transcription at neuronal activity-regulated enhancers. Nature, 465, 182-187 (2010)[PubMed]
- Bloodgood, B. L., Sharma, N., Browne, H. A. et al.: The activity-dependent transcription factor NPAS4 regulates domain-specific inhibition. Nature, 503, 121-125 (2013)[PubMed]
- Lin, Y., Bloodgood, B. L., Hauser, J. L. et al.: Activity-dependent regulation of inhibitory synapse development by Npas4. Nature, 455, 1198-1204 (2008)[PubMed]
- Spiegel, I., Mardinly, A. R., Gabel, H. W. et al.: Npas4 regulates excitatory-inhibitory balance within neural circuits through cell-type-specific gene programs. Cell, 157, 1216-1229 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 東京都立大学大学院理学研究科 修了,同年 米国Texas大学Southwestern Medical Center博士研究員,米国Harvard Medical School講師を経て,米国Medical University of South CarolinaにてResearch Assistant Professor.
研究テーマ:脳の報酬系の回路における行動制御の基盤分子機構.
抱負:多くの研究者や科学に関心をもつ人たちと幅広く意見をかわすことで研究を楽しく発展させていきたいと思います.
Maria B. Carreira
パナマInstitute for Scientific Research and High Technology Services博士研究員.
Christopher W. Cowan
米国Medical University of South CarolinaにてProfessor.
© 2017 谷口 誠・Maria B. Carreira・Christopher W. Cowan Licensed under CC 表示 2.1 日本