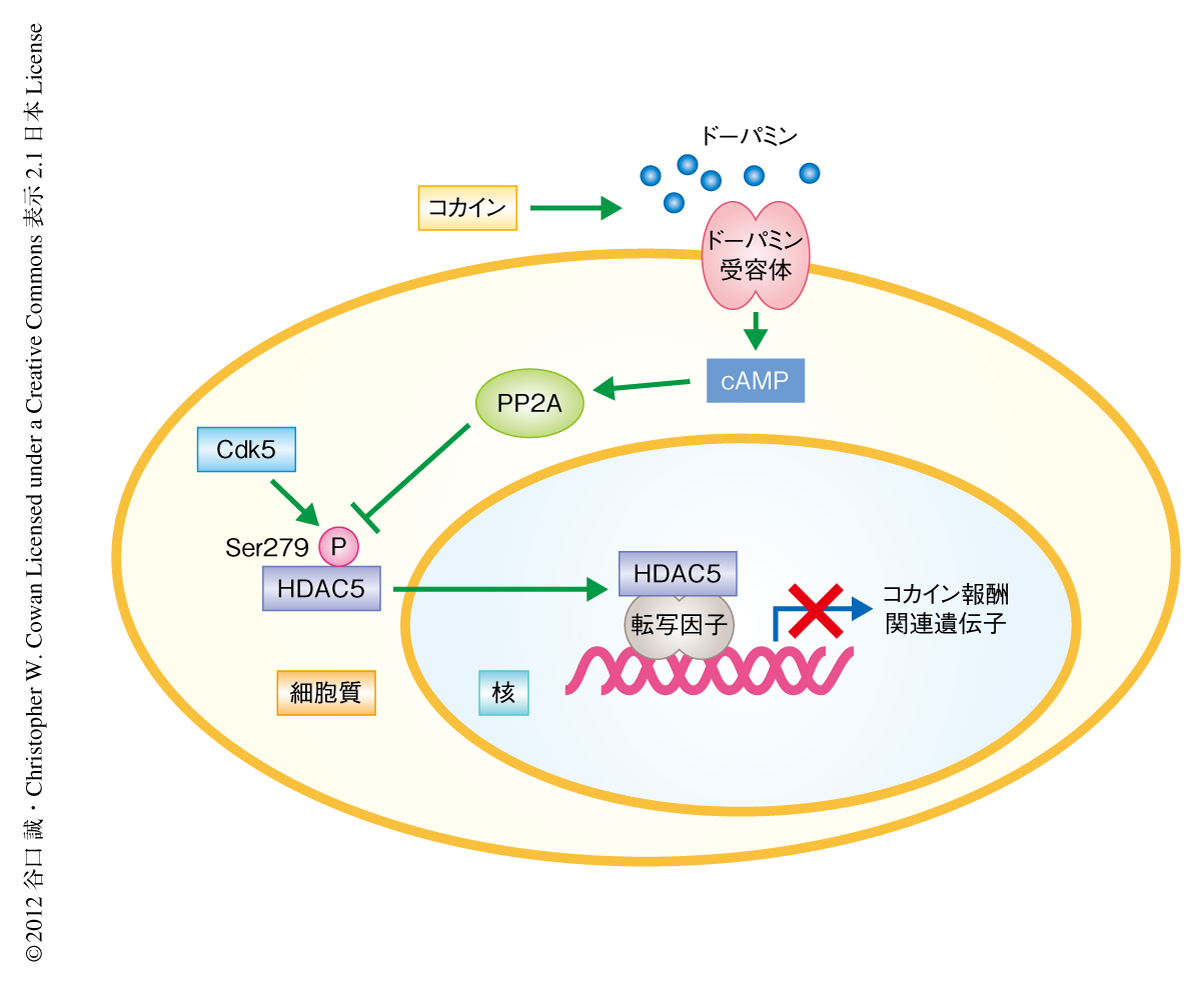
ヒストン脱アセチル化酵素5はcAMPに依存的に核へと移行しコカインによる報酬を制限する
谷口 誠・Christopher W. Cowan
(米国Texas大学Southwestern Medical Center,Departments of Psychiatry and Ophthalmology)
email:谷口 誠
DOI: 10.7875/first.author.2012.027
Histone deacetylase 5 limits cocaine reward through cAMP-induced nuclear import.
Makoto Taniguchi, Maria B. Carreira, Laura N. Smith, Benjamin C. Zirlin, Rachael L. Neve, Christopher W. Cowan
Neuron, 73, 108-120 (2012)
コカインの乱用によりひき起こされる異常行動は,薬物の作用によりエピジェネティックな遺伝子発現の制御機構が狂い脳の報酬系の回路が乱れることが原因となっている.これまで,エピジェネティックな遺伝子発現の制御に機能するタンパク質のコカインによる機能制御における分子機構はほとんどわかっていなかったが,今回,筆者らは,ヒストン脱アセチル化酵素5がコカインにより誘発されたcAMPシグナル伝達系により核へと移行し,コカインにより誘発される報酬を抑制する分子機構を明らかにした.cAMPに依存的なヒストン脱アセチル化酵素5の核への移行には,新たに見い出されたCdk5によるリン酸化残基がタンパク質脱リン酸化酵素PP2Aにより脱リン酸化されることが必須であった.この核移行シグナルドメインにおける脱リン酸化により核への移行および核外への輸送の速度がシフトし,その結果,ヒストン脱アセチル化酵素5は核において凝集した.脱リン酸化したヒストン脱アセチル化酵素5は脳の報酬系の回路で中心的な役割を担う側坐核においてコカインにより誘発される報酬の獲得を制限した.今回の結果から,コカインにより報酬に関連した遺伝子の発現が誘発されるものと考えられたが,同時に,ヒストン脱アセチル化酵素5の脱リン酸化をつうじその遺伝子発現にブレーキをかける,コカイン報酬獲得に対する抑制の分子機構が明らかになった.
コカインなどの精神刺激薬を長期にわたりくり返し使用すると,目眩,睡眠障害,不安神経症,幻覚,鬱状態など,健康上の問題をひき起こす.さらに,コカインやヘロインは法律により使用が禁止されているため社会的な問題も生じる.使用により健康的にも社会的にも問題のもたらされることはわかっているはずだが,薬物への依存症が進むと薬物摂取の制御ができなくなり薬物中心の生活となってしまう.
コカインなどを長期にわたり乱用すると,脳の報酬系のニューロンにおいてエピジェネティックな遺伝子発現の制御機構が狂い,神経回路が乱され,それが原因となり薬物依存による異常行動がひき起こされる1,2).これまで,薬理学的および遺伝学的な手法を用いて,ヒストン脱アセチル化酵素(histone deacetylase:HDAC)やヒストンアセチル化酵素(histone acetyltransferase:HAT)などによるエピジェネティックな遺伝子発現の制御が薬物中毒においても重要な役割をもつことが明らかになってきた3,4).
既知の11種類のヒストン脱アセチル化酵素は,機能的および構造的に4つのグループ,クラスI,クラスIIa,クラスIIb,クラスIVに分けることができる.ヒストン脱アセチル化酵素は核においてヒストンを脱アセチル化することにより遺伝子の発現を抑制する.今回,注目したクラスIIaに属するヒストン脱アセチル化酵素,HDAC4,HDAC5,HDAC7,HDAC9は,細胞への刺激により核と細胞質とのあいだを行き来し,細胞刺激に依存して遺伝子発現の抑制機能が制御されている5,6).2007年,脳の報酬系の回路に重要な役割をもつ腹側線条体の側坐核にHDAC5を発現させるとコカインにより誘発される報酬の効果が減少することが報告された3).また,HDAC5ノックアウトマウスではコカインの長期使用ののちコカインにより誘発される報酬の効果が著しく上昇することが報告され,HDAC5がコカイン報酬を抑制する非常に重要な役割をもつことが示唆された.しかしながら,コカインなどの薬物がどのようにヒストン脱アセチル化酵素の機能を調節しているのかという新たな疑問が生じた.
この研究では,コカインにより誘発されたcAMPシグナル伝達系によりHDAC5がリン酸化および細胞内局在の制御をうけることを見い出した.また,そのHDAC5の制御機構は側坐核においてコカイン報酬の獲得に大きな役割をもつことを明らかにした.
コカインはドーパミンシグナル伝達系を乱すことが知られている.腹側被蓋野のドーパミン作動性ニューロンは線条体,側坐核,前頭前皮質に投射しドーパミンを放出している.コカインはシナプスに放出されたドーパミンの再取り込みを阻害し,シナプス間隙におけるドーパミンの量を上昇させ,その結果,下流のドーパミンシグナル伝達系,すなわち,cAMPシグナル伝達系を活性化させる.初代培養した線条体ニューロンをcAMPにより刺激すると,刺激のまえには細胞質に広く局在していたHDAC5がcAMPに依存的に核へと移行することが観察された.核においてHDAC5は転写因子MEF2との強い共局在が観察され,HDAC5はcAMPに依存的にDNAおよび転写因子と複合体を形成することが示唆された.
これまでの研究から,HDAC5の細胞内局在はリン酸化により制御されていることが明らかになっている5).種間をつうじ高度に保存されているHDAC5のアミノ酸残基Ser279がリン酸化されていることが質量分析により同定された.Ser279は塩基性アミノ酸残基を多く含む配列である核移行シグナルドメインに位置しており,リン酸化による負の電荷が核移行シグナルドメインの機能を乱している可能性が考えられた.また,このSer279は核と細胞質とのあいだを行き来するクラスIIaのヒストン脱アセチル化酵素(HDAC4,HDAC5,HDAC9)には保存されているがほかのクラスには保存されておらず,核への移行に重要な役割をもつ可能性が考えられた.in vitroキナーゼアッセイやCdk5の阻害剤を用いた実験から,線条体ニューロンにおいてCdk5がHDAC5のSer279のリン酸化酵素であることが示唆された.
cAMPの濃度を上昇させるとHDAC5の核への移行がみられるとともに,Ser279のリン酸化の著しい減少が観察された.cAMPの刺激ののち20分で脱リン酸化が観察され,そののち3時間まで脱リン酸化状態はつづいた.このcAMPによるSer279の脱リン酸化はタンパク質脱リン酸化酵素であるPP2Aの阻害剤の存在下ではみられず,また,in vitroでの実験においてPP2AによるSer279の脱リン酸化が観察された.これらの結果から,PP2AはcAMPの刺激によるHDAC5の脱リン酸化に必要かつ十分であると考えられた.この反応は,線条体ニューロンにおけるcAMPの刺激によるPP2Aの活性化の報告と一致した7).
PP2Aの阻害剤の存在下では,Ser279の脱リン酸化と同様に,cAMPに依存的なHDAC5の核への移行は観察できなかった.また,cAMPの刺激まえの線条体ニューロンをPP2A阻害剤により処理するとHDAC5の局在は細胞質へとシフトした.これらの結果から,PP2Aの活性がHDAC5の脱リン酸化および細胞内局在に重要な役割をもつことが明らかになった.
Ser279のリン酸化がHDAC5の細胞内局在にあたえる影響を調べるため,非リン酸型変異体および疑似リン酸化型変異体を用いてcAMPの刺激の前後のHDAC5の局在を観察した.疑似リン酸化型変異HDAC5の局在は細胞質へと移っており,また,cAMPの刺激による核への移行はみられなかった.PP2A阻害剤の実験とあわせて考えると,Ser279の脱リン酸化がcAMPによるHDAC5の核移行に必須であることが示唆された.非リン酸化型変異HDAC5は野生型HDAC5と同様にcAMPの刺激による核への移行がみられ,刺激まえにも野生型HDAC5との局在の違いはみられなかったことから,S279の脱リン酸化のみではHDAC5の核への移行に十分ではないことがわかった.
これまで,HDAC5のほかのリン酸化残基Ser259およびSer498のリン酸化が細胞質に局在するタンパク質14-3-3と転写因子MEF2との結合の調節をつうじ,HDAC5の細胞内局在に重要な役割をもつことが報告されている8).cAMPの刺激によりそれらのリン酸化残基もSer279と同様に脱リン酸化される.過去の報告と同様に,非リン酸化変異体を用いた実験から,線条体ニューロンにおいてもSer259およびSer498のリン酸化がHDAC5の細胞内局在に大きな影響をあたえていることが観察された.Ser259およびSer498の非リン酸化型変異にS279の疑似リン酸化変異を付加したHDAC5変異体を用いた実験においては,S279の疑似リン酸化変異のみをもつHDAC5変異体と同様にcAMPの刺激による核への移行がみられないことからも,あらためてSer279の脱リン酸化の重要性が示唆された.
HDAC5の局在は核への移行と核外への輸送のバランスからなる定常状態の結果である.cAMPによるHDAC5の核移行はそのバランスが乱れたことに起因すると考えられた.核外輸送の阻害剤を用いてHDAC5の核移行と核外輸送の速度を別々に検証した.cAMPの刺激により野生型HDAC5の核移行は著しく促進され,20分間でほぼすべてが核へと移行した.その反応速度はさきのSer279の脱リン酸化の速度と非常に似ていた.S279疑似リン酸化変異HDAC5では野生型HDAC5と比べて遅い核移行が観察された.この変異HDAC5においても核への移行が観察されたことから,Ser279のリン酸化は単に核移行シグナルドメインの機能を破壊しているわけではないと考えられた.また,野生型HDAC5に比べS279疑似リン酸化変異HDAC5では核外輸送の速度が有意に促進されていた.これらの結果から,cAMPの刺激によりSer279は脱リン酸化され核への移行を促進し核外の輸送を遅延させることによりHDAC5は核に凝集しているものと考えられた.また,野生型HDAC5と比べS279疑似リン酸化変異HDAC5では14-3-3との強い結合がみられた.しかし,この結合はSer259およびSer498の非リン酸化型変異にS279の疑似リン酸化変異を付加したHDAC5変異体ではまったく観察されなかったため,少なくともSer279のリン酸化は14-3-3との結合以外の分子機構でも細胞内局在を調節しているものと考えられた.
コカインはドーパミンシグナル伝達系を乱し線条体ニューロンにおいてcAMPの濃度を変化させることが知られている.コカインを毎日一度7日間投与しつづけコカイン中毒を模したマウスと,コカインをはじめて投与したマウス,生理食塩水を投与した対照のマウスとを比較し,コカインがHDAC5にどのような影響をあたえるのかin vivoでの検証を行なった.コカイン投与の1~4時間後にはS279のリン酸化の減少が観察され,同様に,S259およびS498のリン酸化の減少も観察された.コカインをはじめて投与したマウスと7日間投与しつづけたマウスとを比べたが,HDAC5のリン酸化に違いはみられなかった.コカイン投与の24時間後ではリン酸化の減少はみられず,Ser279の脱リン酸化はコカイン投与後の一時的な反応であるものと考えられた.線条体の組織を生化学的に分画しHDAC5の局在を検証したところ,リン酸化状態と同様に,コカイン投与の4時間後に核への移行が観察された.しかし,コカイン投与の24時間後では対照のマウスとの違いはみられなかった.これらの結果から,コカインの使用は線条体においてHDAC5の脱リン酸化をひき起こし核への移行を促進させることが示唆された.
野生型HDAC5,S279非リン酸化型変異HDAC5,S279疑似リン酸化型変異HDAC5を側坐核に発現させることで,コカイン報酬の効果の獲得におけるHDAC5の機能をコカイン条件づけ場所嗜好試験により検証した9).対照としてGFPを発現させたマウスはコカインに条件づけされた部屋により長く滞在し,コカインの投与による快楽および報酬を獲得したことを示した.野生型HDAC5を発現させたマウスはコカイン条件付けした部屋への滞在時間は少ない傾向にあったが有意な差はみられなかった.S279非リン酸化型変異HDAC5を発現させたマウスではコカイン条件付けした部屋での滞在時間が有意に減少した.しかしながら,S279疑似リン酸化型変異HDAC5を発現させたマウスでは滞在時間に対照のマウスとの違いはみられなかった.一方,コカイン条件づけをおえたあとにHDAC5を発現させた場合には,コカインによる報酬の効果に対する抑制効果はみられなかった.これらの結果から,コカインにより脱リン酸化のひき起こされたHDAC5はコカイン報酬の獲得を制限することが示唆され,報酬効果による行動の発現には影響のないことが示唆された.また,スクロースを用いて自然報酬に対するHDAC5の役割を検証したが,HDAC5による抑制効果はみられなかった.以上の結果から,マウスの側坐核において脱リン酸化されたHDAC5は,コカインによる異常な快楽および報酬の獲得を制限する可能性が示唆された.
今回の研究により,これまで解明されていなかった,コカインによるエピジェネティックな制御に機能するタンパク質HDAC5の機能を制御する分子機構が明らかになった(図1).cAMPの濃度の上昇によりHDAC5の核移行シグナルドメインに位置するCdk5によるリン酸化残基Ser279がPP2Aに依存して脱リン酸化される.この脱リン酸化により核移行と核外輸送とのバランスがシフトし,その結果,HDAC5は核に凝集する.線条体のHDAC5はコカイン投与のち脱リン酸化されて核へと移行する.脳の報酬系の回路にある側坐核において,脱リン酸化したHDAC5はコカインにより誘発される報酬効果の獲得を抑制する.コカインの作用により遺伝子の転写制御が崩壊し異常な報酬あるいは快楽が生じるとともに,HDAC5によるコカイン報酬の抑制機能も同時にはたらいていることが明らかになった.報酬に対する抑制機能を失ったHDAC5ノックアウトマウスではコカインにより誘発される報酬効果の著しい上昇を示す.また,コカイン報酬の抑制においてHDAC5のヒストン脱アセチル化酵素活性が必須であることが報告されており3),HDAC5はコカインにより誘導された遺伝子発現をエピジェネティックに抑制することでコカイン快楽の獲得を制御しているものと考えられた.今後,コカインにより脱リン酸化がひき起こされたHDAC5がどのような遺伝子の発現を調節しているのかを明らかにすることが,コカイン報酬の分子機構を理解し,薬物依存に対する創薬を進めるうえで非常に重要だと考えられる.
略歴:2007年 東京都立大学大学院理学研究科 修了,同年より米国Texas大学Southwestern Medical Center博士研究員.
研究テーマ:脳の報酬系の回路における転写活性の制御と行動制御の機構を明らかにする.
抱負:多くの研究者や科学に関心をもつ人たちと幅広く意見をかわすことで研究を楽しく発展させていきたいと思います.
Christopher W. Cowan
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www3.utsouthwestern.edu/psychlab/cowan/
© 2012 谷口 誠・Christopher W. Cowan Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Departments of Psychiatry and Ophthalmology)
email:谷口 誠
DOI: 10.7875/first.author.2012.027
Histone deacetylase 5 limits cocaine reward through cAMP-induced nuclear import.
Makoto Taniguchi, Maria B. Carreira, Laura N. Smith, Benjamin C. Zirlin, Rachael L. Neve, Christopher W. Cowan
Neuron, 73, 108-120 (2012)
要 約
コカインの乱用によりひき起こされる異常行動は,薬物の作用によりエピジェネティックな遺伝子発現の制御機構が狂い脳の報酬系の回路が乱れることが原因となっている.これまで,エピジェネティックな遺伝子発現の制御に機能するタンパク質のコカインによる機能制御における分子機構はほとんどわかっていなかったが,今回,筆者らは,ヒストン脱アセチル化酵素5がコカインにより誘発されたcAMPシグナル伝達系により核へと移行し,コカインにより誘発される報酬を抑制する分子機構を明らかにした.cAMPに依存的なヒストン脱アセチル化酵素5の核への移行には,新たに見い出されたCdk5によるリン酸化残基がタンパク質脱リン酸化酵素PP2Aにより脱リン酸化されることが必須であった.この核移行シグナルドメインにおける脱リン酸化により核への移行および核外への輸送の速度がシフトし,その結果,ヒストン脱アセチル化酵素5は核において凝集した.脱リン酸化したヒストン脱アセチル化酵素5は脳の報酬系の回路で中心的な役割を担う側坐核においてコカインにより誘発される報酬の獲得を制限した.今回の結果から,コカインにより報酬に関連した遺伝子の発現が誘発されるものと考えられたが,同時に,ヒストン脱アセチル化酵素5の脱リン酸化をつうじその遺伝子発現にブレーキをかける,コカイン報酬獲得に対する抑制の分子機構が明らかになった.
はじめに
コカインなどの精神刺激薬を長期にわたりくり返し使用すると,目眩,睡眠障害,不安神経症,幻覚,鬱状態など,健康上の問題をひき起こす.さらに,コカインやヘロインは法律により使用が禁止されているため社会的な問題も生じる.使用により健康的にも社会的にも問題のもたらされることはわかっているはずだが,薬物への依存症が進むと薬物摂取の制御ができなくなり薬物中心の生活となってしまう.
コカインなどを長期にわたり乱用すると,脳の報酬系のニューロンにおいてエピジェネティックな遺伝子発現の制御機構が狂い,神経回路が乱され,それが原因となり薬物依存による異常行動がひき起こされる1,2).これまで,薬理学的および遺伝学的な手法を用いて,ヒストン脱アセチル化酵素(histone deacetylase:HDAC)やヒストンアセチル化酵素(histone acetyltransferase:HAT)などによるエピジェネティックな遺伝子発現の制御が薬物中毒においても重要な役割をもつことが明らかになってきた3,4).
既知の11種類のヒストン脱アセチル化酵素は,機能的および構造的に4つのグループ,クラスI,クラスIIa,クラスIIb,クラスIVに分けることができる.ヒストン脱アセチル化酵素は核においてヒストンを脱アセチル化することにより遺伝子の発現を抑制する.今回,注目したクラスIIaに属するヒストン脱アセチル化酵素,HDAC4,HDAC5,HDAC7,HDAC9は,細胞への刺激により核と細胞質とのあいだを行き来し,細胞刺激に依存して遺伝子発現の抑制機能が制御されている5,6).2007年,脳の報酬系の回路に重要な役割をもつ腹側線条体の側坐核にHDAC5を発現させるとコカインにより誘発される報酬の効果が減少することが報告された3).また,HDAC5ノックアウトマウスではコカインの長期使用ののちコカインにより誘発される報酬の効果が著しく上昇することが報告され,HDAC5がコカイン報酬を抑制する非常に重要な役割をもつことが示唆された.しかしながら,コカインなどの薬物がどのようにヒストン脱アセチル化酵素の機能を調節しているのかという新たな疑問が生じた.
この研究では,コカインにより誘発されたcAMPシグナル伝達系によりHDAC5がリン酸化および細胞内局在の制御をうけることを見い出した.また,そのHDAC5の制御機構は側坐核においてコカイン報酬の獲得に大きな役割をもつことを明らかにした.
1.線条体ニューロンにおいてHDAC5はcAMPの刺激により核へと移行する
コカインはドーパミンシグナル伝達系を乱すことが知られている.腹側被蓋野のドーパミン作動性ニューロンは線条体,側坐核,前頭前皮質に投射しドーパミンを放出している.コカインはシナプスに放出されたドーパミンの再取り込みを阻害し,シナプス間隙におけるドーパミンの量を上昇させ,その結果,下流のドーパミンシグナル伝達系,すなわち,cAMPシグナル伝達系を活性化させる.初代培養した線条体ニューロンをcAMPにより刺激すると,刺激のまえには細胞質に広く局在していたHDAC5がcAMPに依存的に核へと移行することが観察された.核においてHDAC5は転写因子MEF2との強い共局在が観察され,HDAC5はcAMPに依存的にDNAおよび転写因子と複合体を形成することが示唆された.
2.Cdk5によるHDAC5の核移行シグナルドメインにおけるリン酸化
これまでの研究から,HDAC5の細胞内局在はリン酸化により制御されていることが明らかになっている5).種間をつうじ高度に保存されているHDAC5のアミノ酸残基Ser279がリン酸化されていることが質量分析により同定された.Ser279は塩基性アミノ酸残基を多く含む配列である核移行シグナルドメインに位置しており,リン酸化による負の電荷が核移行シグナルドメインの機能を乱している可能性が考えられた.また,このSer279は核と細胞質とのあいだを行き来するクラスIIaのヒストン脱アセチル化酵素(HDAC4,HDAC5,HDAC9)には保存されているがほかのクラスには保存されておらず,核への移行に重要な役割をもつ可能性が考えられた.in vitroキナーゼアッセイやCdk5の阻害剤を用いた実験から,線条体ニューロンにおいてCdk5がHDAC5のSer279のリン酸化酵素であることが示唆された.
3.cAMPの刺激によるHDAC5の脱リン酸化にはPP2Aの活性が必須である
cAMPの濃度を上昇させるとHDAC5の核への移行がみられるとともに,Ser279のリン酸化の著しい減少が観察された.cAMPの刺激ののち20分で脱リン酸化が観察され,そののち3時間まで脱リン酸化状態はつづいた.このcAMPによるSer279の脱リン酸化はタンパク質脱リン酸化酵素であるPP2Aの阻害剤の存在下ではみられず,また,in vitroでの実験においてPP2AによるSer279の脱リン酸化が観察された.これらの結果から,PP2AはcAMPの刺激によるHDAC5の脱リン酸化に必要かつ十分であると考えられた.この反応は,線条体ニューロンにおけるcAMPの刺激によるPP2Aの活性化の報告と一致した7).
4.Ser279の脱リン酸化はHDAC5の核への移行に必須である
PP2Aの阻害剤の存在下では,Ser279の脱リン酸化と同様に,cAMPに依存的なHDAC5の核への移行は観察できなかった.また,cAMPの刺激まえの線条体ニューロンをPP2A阻害剤により処理するとHDAC5の局在は細胞質へとシフトした.これらの結果から,PP2Aの活性がHDAC5の脱リン酸化および細胞内局在に重要な役割をもつことが明らかになった.
Ser279のリン酸化がHDAC5の細胞内局在にあたえる影響を調べるため,非リン酸型変異体および疑似リン酸化型変異体を用いてcAMPの刺激の前後のHDAC5の局在を観察した.疑似リン酸化型変異HDAC5の局在は細胞質へと移っており,また,cAMPの刺激による核への移行はみられなかった.PP2A阻害剤の実験とあわせて考えると,Ser279の脱リン酸化がcAMPによるHDAC5の核移行に必須であることが示唆された.非リン酸化型変異HDAC5は野生型HDAC5と同様にcAMPの刺激による核への移行がみられ,刺激まえにも野生型HDAC5との局在の違いはみられなかったことから,S279の脱リン酸化のみではHDAC5の核への移行に十分ではないことがわかった.
これまで,HDAC5のほかのリン酸化残基Ser259およびSer498のリン酸化が細胞質に局在するタンパク質14-3-3と転写因子MEF2との結合の調節をつうじ,HDAC5の細胞内局在に重要な役割をもつことが報告されている8).cAMPの刺激によりそれらのリン酸化残基もSer279と同様に脱リン酸化される.過去の報告と同様に,非リン酸化変異体を用いた実験から,線条体ニューロンにおいてもSer259およびSer498のリン酸化がHDAC5の細胞内局在に大きな影響をあたえていることが観察された.Ser259およびSer498の非リン酸化型変異にS279の疑似リン酸化変異を付加したHDAC5変異体を用いた実験においては,S279の疑似リン酸化変異のみをもつHDAC5変異体と同様にcAMPの刺激による核への移行がみられないことからも,あらためてSer279の脱リン酸化の重要性が示唆された.
5.Ser279の脱リン酸化は核への移行速度を促進する
HDAC5の局在は核への移行と核外への輸送のバランスからなる定常状態の結果である.cAMPによるHDAC5の核移行はそのバランスが乱れたことに起因すると考えられた.核外輸送の阻害剤を用いてHDAC5の核移行と核外輸送の速度を別々に検証した.cAMPの刺激により野生型HDAC5の核移行は著しく促進され,20分間でほぼすべてが核へと移行した.その反応速度はさきのSer279の脱リン酸化の速度と非常に似ていた.S279疑似リン酸化変異HDAC5では野生型HDAC5と比べて遅い核移行が観察された.この変異HDAC5においても核への移行が観察されたことから,Ser279のリン酸化は単に核移行シグナルドメインの機能を破壊しているわけではないと考えられた.また,野生型HDAC5に比べS279疑似リン酸化変異HDAC5では核外輸送の速度が有意に促進されていた.これらの結果から,cAMPの刺激によりSer279は脱リン酸化され核への移行を促進し核外の輸送を遅延させることによりHDAC5は核に凝集しているものと考えられた.また,野生型HDAC5と比べS279疑似リン酸化変異HDAC5では14-3-3との強い結合がみられた.しかし,この結合はSer259およびSer498の非リン酸化型変異にS279の疑似リン酸化変異を付加したHDAC5変異体ではまったく観察されなかったため,少なくともSer279のリン酸化は14-3-3との結合以外の分子機構でも細胞内局在を調節しているものと考えられた.
6.コカインはHDAC5の一時的な脱リン酸化と核への移行をひき起こす
コカインはドーパミンシグナル伝達系を乱し線条体ニューロンにおいてcAMPの濃度を変化させることが知られている.コカインを毎日一度7日間投与しつづけコカイン中毒を模したマウスと,コカインをはじめて投与したマウス,生理食塩水を投与した対照のマウスとを比較し,コカインがHDAC5にどのような影響をあたえるのかin vivoでの検証を行なった.コカイン投与の1~4時間後にはS279のリン酸化の減少が観察され,同様に,S259およびS498のリン酸化の減少も観察された.コカインをはじめて投与したマウスと7日間投与しつづけたマウスとを比べたが,HDAC5のリン酸化に違いはみられなかった.コカイン投与の24時間後ではリン酸化の減少はみられず,Ser279の脱リン酸化はコカイン投与後の一時的な反応であるものと考えられた.線条体の組織を生化学的に分画しHDAC5の局在を検証したところ,リン酸化状態と同様に,コカイン投与の4時間後に核への移行が観察された.しかし,コカイン投与の24時間後では対照のマウスとの違いはみられなかった.これらの結果から,コカインの使用は線条体においてHDAC5の脱リン酸化をひき起こし核への移行を促進させることが示唆された.
7.脱リン酸化されたHDAC5はコカインによる快楽の獲得を防ぐ
野生型HDAC5,S279非リン酸化型変異HDAC5,S279疑似リン酸化型変異HDAC5を側坐核に発現させることで,コカイン報酬の効果の獲得におけるHDAC5の機能をコカイン条件づけ場所嗜好試験により検証した9).対照としてGFPを発現させたマウスはコカインに条件づけされた部屋により長く滞在し,コカインの投与による快楽および報酬を獲得したことを示した.野生型HDAC5を発現させたマウスはコカイン条件付けした部屋への滞在時間は少ない傾向にあったが有意な差はみられなかった.S279非リン酸化型変異HDAC5を発現させたマウスではコカイン条件付けした部屋での滞在時間が有意に減少した.しかしながら,S279疑似リン酸化型変異HDAC5を発現させたマウスでは滞在時間に対照のマウスとの違いはみられなかった.一方,コカイン条件づけをおえたあとにHDAC5を発現させた場合には,コカインによる報酬の効果に対する抑制効果はみられなかった.これらの結果から,コカインにより脱リン酸化のひき起こされたHDAC5はコカイン報酬の獲得を制限することが示唆され,報酬効果による行動の発現には影響のないことが示唆された.また,スクロースを用いて自然報酬に対するHDAC5の役割を検証したが,HDAC5による抑制効果はみられなかった.以上の結果から,マウスの側坐核において脱リン酸化されたHDAC5は,コカインによる異常な快楽および報酬の獲得を制限する可能性が示唆された.
おわりに
今回の研究により,これまで解明されていなかった,コカインによるエピジェネティックな制御に機能するタンパク質HDAC5の機能を制御する分子機構が明らかになった(図1).cAMPの濃度の上昇によりHDAC5の核移行シグナルドメインに位置するCdk5によるリン酸化残基Ser279がPP2Aに依存して脱リン酸化される.この脱リン酸化により核移行と核外輸送とのバランスがシフトし,その結果,HDAC5は核に凝集する.線条体のHDAC5はコカイン投与のち脱リン酸化されて核へと移行する.脳の報酬系の回路にある側坐核において,脱リン酸化したHDAC5はコカインにより誘発される報酬効果の獲得を抑制する.コカインの作用により遺伝子の転写制御が崩壊し異常な報酬あるいは快楽が生じるとともに,HDAC5によるコカイン報酬の抑制機能も同時にはたらいていることが明らかになった.報酬に対する抑制機能を失ったHDAC5ノックアウトマウスではコカインにより誘発される報酬効果の著しい上昇を示す.また,コカイン報酬の抑制においてHDAC5のヒストン脱アセチル化酵素活性が必須であることが報告されており3),HDAC5はコカインにより誘導された遺伝子発現をエピジェネティックに抑制することでコカイン快楽の獲得を制御しているものと考えられた.今後,コカインにより脱リン酸化がひき起こされたHDAC5がどのような遺伝子の発現を調節しているのかを明らかにすることが,コカイン報酬の分子機構を理解し,薬物依存に対する創薬を進めるうえで非常に重要だと考えられる.
文 献
- Hyman, S. E., Malenka, R. C. & Nestler, E. J.: Neural mechanisms of addiction: the role of reward-related learning and memory. Annu. Rev. Neurosci., 29, 565-598 (2006)[PubMed]
- Kalivas, P. W.: Recent understanding in the mechanisms of addiction. Curr. Psychiatry Rep., 6, 347-351 (2004)[PubMed]
- Renthal, W., Maze, I., Krishnan, V. et al.: Histone deacetylase 5 epigenetically controls behavioral adaptations to chronic emotional stimuli. Neuron, 56, 517-529 (2007)[PubMed]
- Kumar, A., Choi, K. H., Renthal, W. et al.: Chromatin remodeling is a key mechanism underlying cocaine-induced plas- ticity in striatum. Neuron, 48, 303-314 (2005)[PubMed]
- McKinsey, T. A., Zhang, C. L., Lu, J. et al.: Signal-dependent nuclear export of a histone deacetylase regulates muscle differentiation. Nature, 408, 106-111 (2000)[PubMed]
- Belfield, J. L., Whittaker, C., Cader, M. Z. et al.: Differential effects of Ca2+ and cAMP on transcription mediated by MEF2D and cAMP- response element-binding protein in hippocampal neurons. J. Biol. Chem., 281, 27724-27732 (2006)[PubMed]
- Ahn, J. H., McAvoy, T., Rakhilin, S. V. et al.: Protein kinase A activates protein phosphatase 2A by phosphorylation of the B56δ subunit. Proc. Natl. Acad. Sci. USA, 104, 2979-2984 (2007)[PubMed]
- McKinsey, T. A., Zhang, C. L. & Olson, E. N.: Activation of the myocyte enhancer factor-2 transcription factor by calcium/calmodulin-dependent protein kinase-stimulated binding of 14-3-3 to histone deacetylase 5. Proc. Natl. Acad. Sci. USA, 97, 14400-14405 (2000)[PubMed]
- Barrot, M., Olivier, J. D., Perrotti, L. I. et al.: CREB activity in the nucleus accumbens shell controls gating of behavioral responses to emotional stimuli. Proc. Natl. Acad. Sci. USA, 99, 11435-11440 (2002)[PubMed]
著者プロフィール
略歴:2007年 東京都立大学大学院理学研究科 修了,同年より米国Texas大学Southwestern Medical Center博士研究員.
研究テーマ:脳の報酬系の回路における転写活性の制御と行動制御の機構を明らかにする.
抱負:多くの研究者や科学に関心をもつ人たちと幅広く意見をかわすことで研究を楽しく発展させていきたいと思います.
Christopher W. Cowan
米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究室URL:http://www3.utsouthwestern.edu/psychlab/cowan/
© 2012 谷口 誠・Christopher W. Cowan Licensed under CC 表示 2.1 日本