抗HIV-1中和抗体による早期の治療におけるウイルスに対する長期にわたる免疫応答の誘導
西村 佳哲
(米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Microbiology)
email:西村佳哲
DOI: 10.7875/first.author.2017.032
Early antibody therapy can induce long-lasting immunity to SHIV.
Yoshiaki Nishimura, Rajeev Gautam, Tae-Wook Chun, Reza Sadjadpour, Kathryn E. Foulds, Masashi Shingai, Florian Klein, Anna Gazumyan, Jovana Golijanin, Mitzi Donaldson, Olivia K. Donau, Ronald J. Plishka, Alicia Buckler-White, Michael S. Seaman, Jeffrey D. Lifson, Richard A. Koup, Anthony S. Fauci, Michel C. Nussenzweig, Malcolm A. Martin
Nature, 543, 559-563 (2017)
今回の研究において,抗HIV-1中和抗体による早期の治療により感染の初期のウイルス量を抑制し長期にわたるT細胞による免疫応答を誘導することにより,サルにおいて長期間にわたりウイルスの感染を制御することに成功した.感染の早期に2種の抗HIV-1中和抗体により治療をうけたサルは,56日~117日ものあいだ血中のウイルス量が抑制され,血中の抗HIV-1中和抗体の濃度の低下にともないウイルスのリバウンドが認められたが,13頭のうち6頭においては血中のウイルス量が検出限界以下にまで抑制された.それにくわえ,4頭のサルにおいても感染から2年以上ものあいだ末梢血においてCD4陽性T細胞の数が減少せず,血中のウイルス量も治療をうけていないサルに比べ非常に低い状態が保たれた.ウイルスが完全に抑制された6頭のサルにおいては,複製能のあるウイルスをもつ感染細胞の数はCD4陽性T細胞の百万個に1個以下と非常に低い値であった.これらのサルにCD8陽性T細胞を選択的に除去する抗体を投与したところ,CD8陽性T細胞の減少とともに血中のウイルス量がいちじるしく増加した.それに対し,抗レトロウイルス剤による早期の治療をうけたサルにおいてウイルスの抑制は認められなかった.今回の研究により,抗HIV-1中和抗体による早期の治療は,抗レトロウイルス剤による治療とは異なり,長期にわたりT細胞による免疫応答を誘導しウイルスを抑制しうることが示唆された.
一連の幅広いHIV-1株に対し高い中和活性を示す抗HIV-1中和抗体がウイルスの感染の防御および治療に高い効果をもつことがサルおよびヒト化マウスにおいて示されており,ヒトにおける臨床試験においてもその有用性が認められている1-5)(文献3) は新着論文レビュー でも掲載).以前に,筆者らは,HIV-1とSIVとのキメラウイルスであるSHIVを用いた長期にわたりウイルスに感染したサルにおいて,抗HIV-1中和抗体の投与により血中のウイルス量が顕著に減少したことを報告した1).しかし,これらのサルにおいては,血中の抗HIV-1中和抗体の濃度の低下にともない血中のウイルスは治療するまえの量にまで増加し,将来的にAIDSを発症した.
感染の最初期におけるHIV-1の爆発的な増加にひきつづき,それにより誘導されたCD8陽性T細胞による免疫応答によるウイルスの抑制は部分的なものにとどまり,慢性感染が成立してウイルスが体内から完全に除去されることはない.ウイルスはそれ自体のDNAを宿主のゲノムに組み込み,それがウイルスの複製のもととなり長期間にわたる抗レトロウイルス剤による治療の際にも細胞にとどまり,投薬を中断するとウイルスの感染は顕著に進行する.このウイルスリザーバーは生涯にわたり患者に存在しつづける.
感染ののち6カ月以内に抗レトロウイルス剤の併用による治療を開始することにより,免疫系の損傷およびウイルスリザーバーの規模は抑制されることが示唆されている.感染の最初期に抗レトロウイルス剤の併用による治療をうけた際には,治療を中断したのちにもまれに血中のウイルス量が持続的に減少することが報告されている6).サルのSIV感染モデルにおいては,感染ののち24時間から72時間に抗レトロウイルス剤による治療を開始した場合,同様のウイルス量の減少が認められている7).
抗HIV-1中和抗体は血中のウイルス量を減少させるとともに血中のウイルス粒子の除去を促進して患者の免疫系を保存することから,患者におけるウイルスの害を軽減し長期にわたり臨床の経過を改善する可能性が示唆されている.この仮説と一致して,ヒト化マウスを用いた実験において,抗HIV-1中和抗体による早期の治療が,抗レトロウイルス剤による治療よりもウイルスリザーバーの確立を防止するうえでより効果的であることを示されているが,ヒト化マウスは完全な免疫系をもたず,3~4カ月をこえて感染は維持されない.
これまでに,筆者らは,抗HIV-1中和抗体の単剤による治療をウイルスの接種ののち12週間において開始すると,ウイルス血症は1~2週間にわたり抑制されるが,そののち,抵抗性のウイルス変異体が出現することを報告した2).しかし,複数の抗HIV-1中和抗体による早期の治療によりウイルス血症が持続的に抑制されるかどうかは不明である.今回,ウイルスの感染が確認される最初期に,異なるウイルスのEnv部位を標的とする3BNC117および10-1074の2種の抗HIV-1中和抗体1) より治療し,ウイルスの感染の抑制について解析した.
実験に用いた高病原性のウイルスSHIVAD8EOはHIVAD8株に由来するEnvをSIVに組み込んだキメラウイルスで,このウイルスに感染したサルにおいてはHIV-1の患者と同様の持続性のウイルス血症およびCD4陽性T細胞の不可逆的な減少がみられ,抗HIV-1中和抗体の単体あるいは抗レトロウイルス剤を投与されたサルにおいては抵抗性のウイルス変異体が生じ,そののち,2~3年以内に日和見感染をはじめとしてAIDSを発症する8-10).
急性感染期における抗HIV-1中和抗体の効力について評価するため,高量のSHIVAD8EOを6匹のサルの腸管に接種し,感染ののち3日目,10日目,17日目に2種の抗HIV-1中和抗体を静脈に投与した.感染ののち30日間において,2頭には治療をうけていない対照のサルと比較して血中にきわめて低い量のウイルスが検出されたが,ほかの4匹において血中のウイルス量は通常のRT-PCR法を用いた解析では検出限界以下であった.すべてのサルは56~177日のあいだウイルス血症が抑制されたが,そののち,5頭においてウイルスのリバウンドが認められた.残る1頭のサルにおいては感染ののち150日間にわたりウイルスのリバウンドはみられなかった.ウイルスのリバウンドまでの期間は血中の抗HIV-1中和抗体の濃度と相関し,ある一定の量より減少した時期にウイルスのリバウンドが認められた.血中のウイルス量を超高感度なRT-PCR法により定量したところ,血液1 ml中に約2~10コピーのウイルスRNAが検出された.これにより,抗HIV-1中和抗体を投与されたサルは,治療の際にも低レベルのウイルスが持続的に産生されていることが明らかにされた.6頭のサルを長期にわたり観察したところ,ウイルスのリバウンドののちの血中のウイルス量をもとに2群に分けられた.コントローラー群においては,ウイルスのリバウンドののち血中のウイルス量は最長で20週間のちに検出限界以下の量にもどり,ウイルスの抑制はそののちも持続した.非コントローラー群においては,ウイルスのリバウンドののちもウイルスの増殖は継続して観察され,ウイルスの完全な抑制は認められなかった.
抗HIV-1中和抗体による早期の治療が異なる経路から感染したサルにおいても効果を示すかどうかを確認するため,同量あるいは1/10量のSHIVAD8EOを静脈に接種し,そののち3日目から抗HIV-1中和抗体の投与を開始した.その結果,高量のウイルスの接種をうけたサルは抗HIV-1中和抗体の投与ののち2週間でウイルス血症を示したが,1/10量のウイルスを接種されたサル3頭のうち1頭にはウイルスの増殖は検出されなかった.すべてのサルにおいて,血中のウイルス量は抗HIV-1中和抗体の投与ののち30日以内に検出限界以下に低下し,感染ののち48~110日間にわたりウイルスは抑制された.また,ウイルスを静脈に接種されたサルにおけるウイルスのリバウンドも,血中の抗HIV-1中和抗体の濃度の低下と相関した.しかし,2頭においてはウイルスのリバウンドの際に抗HIV-1中和抗体のうちの一方10-1074の血中の濃度は依然として高値を示していたため,血中のウイルスを遺伝子解析したところ10-1074に対し抵抗性をひき起こす遺伝子変異が認められた.また,一部においてウイルスのリバウンドののちに持続的なウイルスの抑制が認められた.7頭のうち3頭のコントローラー群においては,ウイルスのリバウンドののち42~90週間にわたり血中のウイルス量は検出限界以下にまで抑制され,CD4陽性T細胞のいちじるしい減少も認められなかった.残る4頭の非コントローラー群においては,ウイルスのリバウンドののちにウイルス血症は完全に抑制されず,それにともなうCD4陽性T細胞の減少が認められ,1頭においてはAIDSを発症した.
抗HIV-1中和抗体による早期の治療ののち認められる持続性のウイルスの抑制の機序について明らかにするため,ウイルスのリバウンドの前後において体液性および細胞性の免疫応答とそのウイルスの抑制との関連について解析した.その結果,コントローラー群のサルにおいては非常に低量の抗ウイルス結合抗体のみが検出され,その抗体価とウイルスの抑制との相関は認められなかった.抗ウイルスCD8陽性T細胞による免疫応答はウイルスのリバウンドの前後において検出されたが,コントローラー群と非コントローラー群とのあいだに大きな違いは認められなかった.CD8陽性T細胞による免疫応答とウイルスの増殖の持続的な抑制との関連について明らかにするため,血中のCD8陽性細胞を除去する抗CD8α抗体をコントローラー群のサルに投与した.その結果,すべてのサルにおいて血中のCD8陽性細胞が減少するとともに,ウイルスが爆発的に増加した.そののち,1頭を除くすべてのサルにおいて血中のCD8陽性細胞の増加とおよびそれにともなうウイルスの減少が認められ,抗CD8α抗体を投与するよりまえのウイルスの抑制された状態を回復した.これらのサルにおいて,感染性のウイルスを保有するCD4陽性T細胞の割合は,抗CD8α抗体を投与するまえには百万個のCD4陽性T細胞のうち1個未満と非常に低い状態であったが,投与ののちウイルスの抑制された状態を回復したサルにおいてもその比率は同様に百万分の1個にまで低下した.
抗CD8α抗体はCD8陽性T細胞のみならず,NK細胞,NKT細胞,γδT細胞といったすべてのCD8α陽性細胞を枯渇させるため,CD8陽性T細胞を特異的に標的にする抗CD8β抗体をコントローラー群に投与したところ,CD8陽性T細胞は選択的に減少し,NK細胞をはじめとするCD3陰性CD8陽性細胞の数に変化は認められなかった.それにともない,血中のウイルス量がいちじるしく増加した.これらの結果より,コントローラー群のサルにおけるウイルスの持続的な抑制とCD8陽性T細胞による免疫応答との関連が示唆された.
非コントローラー群のサルにおいて血中のウイルス量は検出限界以下までは抑制されなかったが,7頭のうち4頭においては有意に低い血中のウイルス量が持続して観察され,感染から2~3年のちの末梢血中のCD4陽性T細胞の数のいちじるしい減少も認められなかった.これらの結果をまとめると,総数13頭のサルのうち10頭,コントローラー群6頭および非コントローラー群4頭に抗HIV-1中和抗体による早期の治療により効果が認められた.
抗HIV-1中和抗体による早期の治療をうけたサルの対照として,3頭のサルに対しSHIVAD8EOを直腸に接種したのち3日目から15週間にわたり3種の抗レトロウイルス剤により治療した.15週間の治療の期間は,抗HIV-1中和抗体による早期の治療をうけたサルにおいてウイルスのリバウンドが認められるまえの,ウイルスの増殖が抑制された平均の期間に相当する.抗レトロウイルス剤により治療されたサルは検出限界以下の血中のウイルス量を維持したが,すべてのサルにおいて治療を中断したのち持続的なウイルス血症が認められ,抗HIV-1中和抗体を投与したサルにみられたコントローラー群に相当するものは認められなかった.
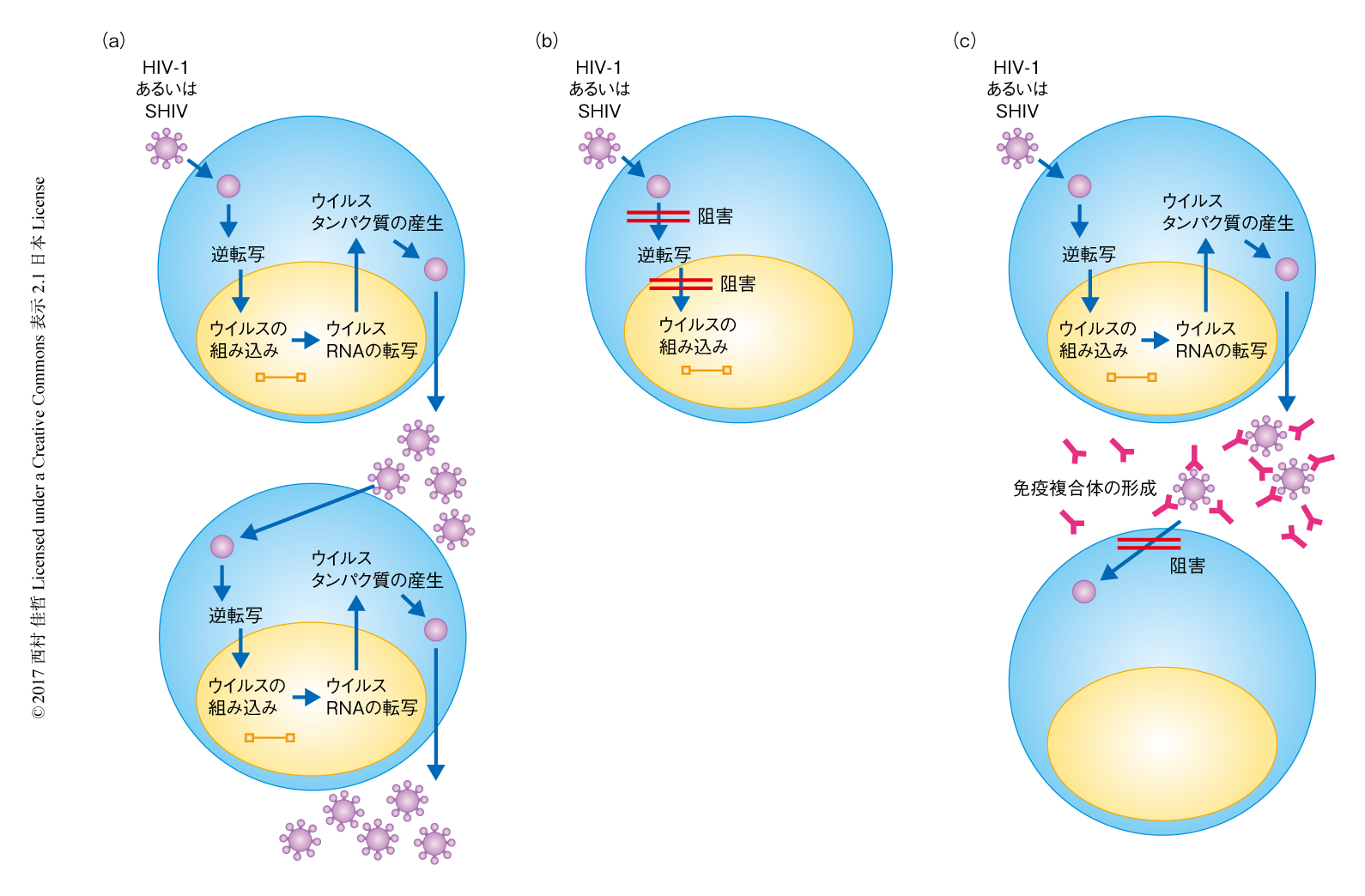
この研究より導かれる仮説として,抗HIV-1中和抗体による早期の治療をうけたサルにおいて,ウイルスのリバウンドよりまえの期間に認められる低量のウイルス粒子の連続的な産生が免疫複合体の形成を促進し,活性化Fc受容体を発現する抗原提示樹状細胞がこれらの免疫複合体と結合することにより,CD4陽性T細胞およびCD8陽性T細胞へと抗原が効率的に提示される可能性が推測された.対照的に,抗レトロウイルス剤による治療は,ウイルスをほぼ完全に阻害して免疫応答の誘導に利用の可能なウイルス抗原の量を制限すると考えられた(図1).
ウイルスの抑制には,CD4陽性T細胞の保存,ウイルスリザーバーの大きさおよび安定性,CD8陽性T細胞による免疫応答の誘導のための抗原の持続的な産生など,さまざまな要因のあいだの微妙な均衡が存在すると考えられる.サルのSHIV感染モデルは,ヒトにおけるHIV-1の感染とはいくつか異なる点があるが,抗HIV-1中和抗体による早期の治療法はウイルスの全身的な増殖を抑制しCD4陽性T細胞への損傷を制御するだけでなく強力な免疫応答を誘導することにより,ヒトにおいてもHIV-1の感染を制御する可能性のあることが示唆された.
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,米国NIH National Institute of Allergy and Infectious DiseasesにてVisiting Fellowを経て,2006年より同Staff Scientist.
研究テーマ:サルを用いたHIV-1の感染の治療法の確立およびワクチンの開発.
© 2017 西村 佳哲 Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Microbiology)
email:西村佳哲
DOI: 10.7875/first.author.2017.032
Early antibody therapy can induce long-lasting immunity to SHIV.
Yoshiaki Nishimura, Rajeev Gautam, Tae-Wook Chun, Reza Sadjadpour, Kathryn E. Foulds, Masashi Shingai, Florian Klein, Anna Gazumyan, Jovana Golijanin, Mitzi Donaldson, Olivia K. Donau, Ronald J. Plishka, Alicia Buckler-White, Michael S. Seaman, Jeffrey D. Lifson, Richard A. Koup, Anthony S. Fauci, Michel C. Nussenzweig, Malcolm A. Martin
Nature, 543, 559-563 (2017)
要 約
今回の研究において,抗HIV-1中和抗体による早期の治療により感染の初期のウイルス量を抑制し長期にわたるT細胞による免疫応答を誘導することにより,サルにおいて長期間にわたりウイルスの感染を制御することに成功した.感染の早期に2種の抗HIV-1中和抗体により治療をうけたサルは,56日~117日ものあいだ血中のウイルス量が抑制され,血中の抗HIV-1中和抗体の濃度の低下にともないウイルスのリバウンドが認められたが,13頭のうち6頭においては血中のウイルス量が検出限界以下にまで抑制された.それにくわえ,4頭のサルにおいても感染から2年以上ものあいだ末梢血においてCD4陽性T細胞の数が減少せず,血中のウイルス量も治療をうけていないサルに比べ非常に低い状態が保たれた.ウイルスが完全に抑制された6頭のサルにおいては,複製能のあるウイルスをもつ感染細胞の数はCD4陽性T細胞の百万個に1個以下と非常に低い値であった.これらのサルにCD8陽性T細胞を選択的に除去する抗体を投与したところ,CD8陽性T細胞の減少とともに血中のウイルス量がいちじるしく増加した.それに対し,抗レトロウイルス剤による早期の治療をうけたサルにおいてウイルスの抑制は認められなかった.今回の研究により,抗HIV-1中和抗体による早期の治療は,抗レトロウイルス剤による治療とは異なり,長期にわたりT細胞による免疫応答を誘導しウイルスを抑制しうることが示唆された.
はじめに
一連の幅広いHIV-1株に対し高い中和活性を示す抗HIV-1中和抗体がウイルスの感染の防御および治療に高い効果をもつことがサルおよびヒト化マウスにおいて示されており,ヒトにおける臨床試験においてもその有用性が認められている1-5)(文献3) は新着論文レビュー でも掲載).以前に,筆者らは,HIV-1とSIVとのキメラウイルスであるSHIVを用いた長期にわたりウイルスに感染したサルにおいて,抗HIV-1中和抗体の投与により血中のウイルス量が顕著に減少したことを報告した1).しかし,これらのサルにおいては,血中の抗HIV-1中和抗体の濃度の低下にともない血中のウイルスは治療するまえの量にまで増加し,将来的にAIDSを発症した.
感染の最初期におけるHIV-1の爆発的な増加にひきつづき,それにより誘導されたCD8陽性T細胞による免疫応答によるウイルスの抑制は部分的なものにとどまり,慢性感染が成立してウイルスが体内から完全に除去されることはない.ウイルスはそれ自体のDNAを宿主のゲノムに組み込み,それがウイルスの複製のもととなり長期間にわたる抗レトロウイルス剤による治療の際にも細胞にとどまり,投薬を中断するとウイルスの感染は顕著に進行する.このウイルスリザーバーは生涯にわたり患者に存在しつづける.
感染ののち6カ月以内に抗レトロウイルス剤の併用による治療を開始することにより,免疫系の損傷およびウイルスリザーバーの規模は抑制されることが示唆されている.感染の最初期に抗レトロウイルス剤の併用による治療をうけた際には,治療を中断したのちにもまれに血中のウイルス量が持続的に減少することが報告されている6).サルのSIV感染モデルにおいては,感染ののち24時間から72時間に抗レトロウイルス剤による治療を開始した場合,同様のウイルス量の減少が認められている7).
抗HIV-1中和抗体は血中のウイルス量を減少させるとともに血中のウイルス粒子の除去を促進して患者の免疫系を保存することから,患者におけるウイルスの害を軽減し長期にわたり臨床の経過を改善する可能性が示唆されている.この仮説と一致して,ヒト化マウスを用いた実験において,抗HIV-1中和抗体による早期の治療が,抗レトロウイルス剤による治療よりもウイルスリザーバーの確立を防止するうえでより効果的であることを示されているが,ヒト化マウスは完全な免疫系をもたず,3~4カ月をこえて感染は維持されない.
これまでに,筆者らは,抗HIV-1中和抗体の単剤による治療をウイルスの接種ののち12週間において開始すると,ウイルス血症は1~2週間にわたり抑制されるが,そののち,抵抗性のウイルス変異体が出現することを報告した2).しかし,複数の抗HIV-1中和抗体による早期の治療によりウイルス血症が持続的に抑制されるかどうかは不明である.今回,ウイルスの感染が確認される最初期に,異なるウイルスのEnv部位を標的とする3BNC117および10-1074の2種の抗HIV-1中和抗体1) より治療し,ウイルスの感染の抑制について解析した.
1.抗HIV-1中和抗体による早期の治療によりウイルスを腸管に接種されたサルの血中のウイルスは持続的に抑制される
実験に用いた高病原性のウイルスSHIVAD8EOはHIVAD8株に由来するEnvをSIVに組み込んだキメラウイルスで,このウイルスに感染したサルにおいてはHIV-1の患者と同様の持続性のウイルス血症およびCD4陽性T細胞の不可逆的な減少がみられ,抗HIV-1中和抗体の単体あるいは抗レトロウイルス剤を投与されたサルにおいては抵抗性のウイルス変異体が生じ,そののち,2~3年以内に日和見感染をはじめとしてAIDSを発症する8-10).
急性感染期における抗HIV-1中和抗体の効力について評価するため,高量のSHIVAD8EOを6匹のサルの腸管に接種し,感染ののち3日目,10日目,17日目に2種の抗HIV-1中和抗体を静脈に投与した.感染ののち30日間において,2頭には治療をうけていない対照のサルと比較して血中にきわめて低い量のウイルスが検出されたが,ほかの4匹において血中のウイルス量は通常のRT-PCR法を用いた解析では検出限界以下であった.すべてのサルは56~177日のあいだウイルス血症が抑制されたが,そののち,5頭においてウイルスのリバウンドが認められた.残る1頭のサルにおいては感染ののち150日間にわたりウイルスのリバウンドはみられなかった.ウイルスのリバウンドまでの期間は血中の抗HIV-1中和抗体の濃度と相関し,ある一定の量より減少した時期にウイルスのリバウンドが認められた.血中のウイルス量を超高感度なRT-PCR法により定量したところ,血液1 ml中に約2~10コピーのウイルスRNAが検出された.これにより,抗HIV-1中和抗体を投与されたサルは,治療の際にも低レベルのウイルスが持続的に産生されていることが明らかにされた.6頭のサルを長期にわたり観察したところ,ウイルスのリバウンドののちの血中のウイルス量をもとに2群に分けられた.コントローラー群においては,ウイルスのリバウンドののち血中のウイルス量は最長で20週間のちに検出限界以下の量にもどり,ウイルスの抑制はそののちも持続した.非コントローラー群においては,ウイルスのリバウンドののちもウイルスの増殖は継続して観察され,ウイルスの完全な抑制は認められなかった.
2.抗HIV-1中和抗体による早期の治療によりウイルスを静脈に接種されたサルにおいてウイルスは抑制される
抗HIV-1中和抗体による早期の治療が異なる経路から感染したサルにおいても効果を示すかどうかを確認するため,同量あるいは1/10量のSHIVAD8EOを静脈に接種し,そののち3日目から抗HIV-1中和抗体の投与を開始した.その結果,高量のウイルスの接種をうけたサルは抗HIV-1中和抗体の投与ののち2週間でウイルス血症を示したが,1/10量のウイルスを接種されたサル3頭のうち1頭にはウイルスの増殖は検出されなかった.すべてのサルにおいて,血中のウイルス量は抗HIV-1中和抗体の投与ののち30日以内に検出限界以下に低下し,感染ののち48~110日間にわたりウイルスは抑制された.また,ウイルスを静脈に接種されたサルにおけるウイルスのリバウンドも,血中の抗HIV-1中和抗体の濃度の低下と相関した.しかし,2頭においてはウイルスのリバウンドの際に抗HIV-1中和抗体のうちの一方10-1074の血中の濃度は依然として高値を示していたため,血中のウイルスを遺伝子解析したところ10-1074に対し抵抗性をひき起こす遺伝子変異が認められた.また,一部においてウイルスのリバウンドののちに持続的なウイルスの抑制が認められた.7頭のうち3頭のコントローラー群においては,ウイルスのリバウンドののち42~90週間にわたり血中のウイルス量は検出限界以下にまで抑制され,CD4陽性T細胞のいちじるしい減少も認められなかった.残る4頭の非コントローラー群においては,ウイルスのリバウンドののちにウイルス血症は完全に抑制されず,それにともなうCD4陽性T細胞の減少が認められ,1頭においてはAIDSを発症した.
3.抗HIV-1中和抗体による早期の治療により誘導されるCD8陽性T細胞による免疫応答は血中のウイルスを効率的に抑制する
抗HIV-1中和抗体による早期の治療ののち認められる持続性のウイルスの抑制の機序について明らかにするため,ウイルスのリバウンドの前後において体液性および細胞性の免疫応答とそのウイルスの抑制との関連について解析した.その結果,コントローラー群のサルにおいては非常に低量の抗ウイルス結合抗体のみが検出され,その抗体価とウイルスの抑制との相関は認められなかった.抗ウイルスCD8陽性T細胞による免疫応答はウイルスのリバウンドの前後において検出されたが,コントローラー群と非コントローラー群とのあいだに大きな違いは認められなかった.CD8陽性T細胞による免疫応答とウイルスの増殖の持続的な抑制との関連について明らかにするため,血中のCD8陽性細胞を除去する抗CD8α抗体をコントローラー群のサルに投与した.その結果,すべてのサルにおいて血中のCD8陽性細胞が減少するとともに,ウイルスが爆発的に増加した.そののち,1頭を除くすべてのサルにおいて血中のCD8陽性細胞の増加とおよびそれにともなうウイルスの減少が認められ,抗CD8α抗体を投与するよりまえのウイルスの抑制された状態を回復した.これらのサルにおいて,感染性のウイルスを保有するCD4陽性T細胞の割合は,抗CD8α抗体を投与するまえには百万個のCD4陽性T細胞のうち1個未満と非常に低い状態であったが,投与ののちウイルスの抑制された状態を回復したサルにおいてもその比率は同様に百万分の1個にまで低下した.
抗CD8α抗体はCD8陽性T細胞のみならず,NK細胞,NKT細胞,γδT細胞といったすべてのCD8α陽性細胞を枯渇させるため,CD8陽性T細胞を特異的に標的にする抗CD8β抗体をコントローラー群に投与したところ,CD8陽性T細胞は選択的に減少し,NK細胞をはじめとするCD3陰性CD8陽性細胞の数に変化は認められなかった.それにともない,血中のウイルス量がいちじるしく増加した.これらの結果より,コントローラー群のサルにおけるウイルスの持続的な抑制とCD8陽性T細胞による免疫応答との関連が示唆された.
非コントローラー群のサルにおいて血中のウイルス量は検出限界以下までは抑制されなかったが,7頭のうち4頭においては有意に低い血中のウイルス量が持続して観察され,感染から2~3年のちの末梢血中のCD4陽性T細胞の数のいちじるしい減少も認められなかった.これらの結果をまとめると,総数13頭のサルのうち10頭,コントローラー群6頭および非コントローラー群4頭に抗HIV-1中和抗体による早期の治療により効果が認められた.
抗HIV-1中和抗体による早期の治療をうけたサルの対照として,3頭のサルに対しSHIVAD8EOを直腸に接種したのち3日目から15週間にわたり3種の抗レトロウイルス剤により治療した.15週間の治療の期間は,抗HIV-1中和抗体による早期の治療をうけたサルにおいてウイルスのリバウンドが認められるまえの,ウイルスの増殖が抑制された平均の期間に相当する.抗レトロウイルス剤により治療されたサルは検出限界以下の血中のウイルス量を維持したが,すべてのサルにおいて治療を中断したのち持続的なウイルス血症が認められ,抗HIV-1中和抗体を投与したサルにみられたコントローラー群に相当するものは認められなかった.
おわりに
この研究より導かれる仮説として,抗HIV-1中和抗体による早期の治療をうけたサルにおいて,ウイルスのリバウンドよりまえの期間に認められる低量のウイルス粒子の連続的な産生が免疫複合体の形成を促進し,活性化Fc受容体を発現する抗原提示樹状細胞がこれらの免疫複合体と結合することにより,CD4陽性T細胞およびCD8陽性T細胞へと抗原が効率的に提示される可能性が推測された.対照的に,抗レトロウイルス剤による治療は,ウイルスをほぼ完全に阻害して免疫応答の誘導に利用の可能なウイルス抗原の量を制限すると考えられた(図1).
ウイルスの抑制には,CD4陽性T細胞の保存,ウイルスリザーバーの大きさおよび安定性,CD8陽性T細胞による免疫応答の誘導のための抗原の持続的な産生など,さまざまな要因のあいだの微妙な均衡が存在すると考えられる.サルのSHIV感染モデルは,ヒトにおけるHIV-1の感染とはいくつか異なる点があるが,抗HIV-1中和抗体による早期の治療法はウイルスの全身的な増殖を抑制しCD4陽性T細胞への損傷を制御するだけでなく強力な免疫応答を誘導することにより,ヒトにおいてもHIV-1の感染を制御する可能性のあることが示唆された.
文 献
- Shingai, M., Donau, O. K., Plishka, R. J. et al.: Passive transfer of modest titers of potent and broadly neutralizing anti-HIV monoclonal antibodies block SHIV infection in macaques. J. Exp. Med., 211, 2061-2074 (2014)[PubMed]
- Shingai, M., Nishimura, Y., Klein, F. et al.: Antibody-mediated immunotherapy of macaques chronically infected with SHIV suppresses viraemia. Nature, 503, 277-280 (2013)[PubMed]
- Gautam, R., Nishimura, Y., Pegu, A. et al.: A single injection of anti-HIV-1 antibodies protects against repeated SHIV challenges. Nature, 533, 105-109 (2016)[PubMed] [新着論文レビュー]
- Klein, F., Halper-Stromberg, A., Horwitz, J. A. et al.: HIV therapy by a combination of broadly neutralizing antibodies in humanized mice. Nature, 492, 118-122 (2012)[PubMed]
- Caskey, M., Klein, F., Lorenzi, J. C. et al.: Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature, 522, 487-491 (2015)[PubMed]
- Saez-Cirion, A., Bacchus, C., Hocqueloux, L. et al.: Post-treatment HIV-1 controllers with a long-term virological remission after the interruption of early initiated antiretroviral therapy ANRS VISCONTI Study. PLoS Pathog., 9, e1003211 (2013)[PubMed]
- Lifson, J. D., Rossio, J. L., Arnaout, R. et al.: Containment of simian immunodeficiency virus infection: cellular immune responses and protection from rechallenge following transient postinoculation antiretroviral treatment. J. Virol., 74, 2584-2593 (2000)[PubMed]
- Shingai, M., Donau, O. K., Schmidt, S. D. et al.: Most rhesus macaques infected with the CCR5-tropic SHIVAD8 generate cross-reactive antibodies that neutralize multiple HIV-1 strains. Proc. Natl. Acad. Sci. USA, 109, 19769-19774 (2012)[PubMed]
- Nishimura, Y., Shingai, M., Willey, R. et al.: Generation of the pathogenic R5-tropic simian/human immunodeficiency virus SHIVAD8 by serial passaging in rhesus macaques. J. Virol., 84, 4769-4781 (2010)[PubMed]
- Gautam, R., Nishimura, Y., Lee, W. R. et al.: Pathogenicity and mucosal transmissibility of the R5-tropic simian/human immunodeficiency virus SHIVAD8 in rhesus macaques: implications for use in vaccine studies. J. Virol., 86, 8516-8526 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,米国NIH National Institute of Allergy and Infectious DiseasesにてVisiting Fellowを経て,2006年より同Staff Scientist.
研究テーマ:サルを用いたHIV-1の感染の治療法の確立およびワクチンの開発.
© 2017 西村 佳哲 Licensed under CC 表示 2.1 日本