抗HIV-1中和抗体の投与によるウイルスに対する長期にわたる感染防御
西村 佳哲
(米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Microbiology)
email:西村佳哲
DOI: 10.7875/first.author.2016.041
A single injection of anti-HIV-1 antibodies protects against repeated SHIV challenges.
Rajeev Gautam, Yoshiaki Nishimura, Amarendra Pegu, Martha C. Nason, Florian Klein, Anna Gazumyan, Jovana Golijanin, Alicia Buckler-White, Reza Sadjadpour, Keyun Wang, Zachary Mankoff, Stephen D. Schmidt, Jeffrey D. Lifson, John R. Mascola, Michel C. Nussenzweig, Malcolm A. Martin
Nature, 533, 105-109 (2016)
今日では,HIV-1の感染を臨床的に制御する多々の抗レトロウイルス剤が開発され十分な効果を示しているが,感染防御を目標とするワクチンの開発はまだなされていない.ウイルスに対する中和効果の高い抗HIV-1抗体による受動免疫によりHIV-1の感染を実験的に防御できることはサルおよびヒト化マウスを用いて示されているが,その長期にわたる効果に関してはまだ明らかにされていない.今回の研究においては,サルに対する4種類の抗HIV-1中和抗体の単回の静脈投与により,腸管への低量のウイルスの反復接種に対し,最長でおよそ6カ月にわたる感染防御の効果が確認された.その効果はおのおのの中和抗体のウイルスに対する中和効果の強さおよび血中における半減期により違いが認められ,中和抗体を投与していないサルにおいては約3回の反復接種より感染が認められたのに対し,中和抗体の投与により約4倍の期間にわたる長期の感染防御能が確認された.さらに,比較的効力の弱い中和抗体のFcドメインに血中における半減期を延長するような変異を導入したところ,その防御期間に大幅な改善が認められた.HIV-1に対する効果的なワクチンがない現在,HIV-1の感染のリスクの高い集団に用いる受動的な免疫防御として,抗HIV-1中和抗体の予防的な投与はウイルスの伝播に大きな影響を及ぼすことができると考えられた.
現在まで,さまざまなウイルスに対するワクチンが開発されており,それらのワクチンは感染ののちの体内におけるウイルスの増殖を抑え深刻な症状にいたることを防御することにより多大な効果をあげている.一方,HIV-1(human immunodeficiency virus 1,ヒト免疫不全ウイルス1)に関しては,現在のところ,いったん感染が成立するとウイルスを体内から完全に除去することは不可能であるため,HIV-1のワクチンはウイルスの曝露から非常に短期間のあいだに感染それ自体を防御することが必要である.実際,動物実験により中和抗体を用いた受動免疫による感染防御は可能であることが示されているが,そのような効果的な中和抗体の産生を誘導するHIV-1のワクチンはいまだ開発されていない.
近年の抗体の分離における技術革新により,一連の幅広いHIV-1株に対し高い中和活性を示す新世代中和抗体とよばれる抗体がHIV-1の患者から分離されてきた.これらを用いたサルまたはヒト化マウスにおけるウイルスの接種のまえの受動免疫の実験においては,抗HIV-1中和抗体の単回の投与から24~48時間のちに高量のウイルスを接種しても,その感染を防御できることが示されている1,2).しかし,ヒトのあいだでのウイルスの伝播は,それに比べいちじるしく低量のウイルスの曝露でも起こることが知られており,1回のウイルスの曝露における感染の成立率もいちじるしく低い.
A型肝炎ウイルスワクチンが開発される以前には,流行の発生地に渡航する場合,ウイルスへの曝露のまえの受動免疫として免疫グロブリンが投与されており,その効果は3~5カ月間にわたり持続した.そのほかの病原体においても,免疫グロブリンの投与は有効な予防手段として用いられており,この着想にもとづき,今回の研究においては,抗HIV-1中和抗体の単回の投与がサルにおいて腸管への低量のウイルスの反復接種による感染を防御できるかどうか調べた.
筆者らは,以前に,HIVとSIV(サル免疫不全ウイルス)とのキメラウイルスであるSHIVについて,60頭のサルを用いた高量での接種に対する受動免疫においてさまざまな抗HIV-1中和抗体の防御効果について解析したが1),その知見にもとづき,今回の実験に使用する3種類の抗HIV-1中和抗体を選択した.VRC01および3BNC117はHIV-1のEnvのCD4結合部位を標的とする中和抗体,10-1074はEnvのN332糖鎖を認識する中和抗体である3-5).実験に用いた高病原性のウイルスSHIVAD8EOは,HIVAD8株に由来するEnvをSIVに組み込んだキメラウイルスで,このウイルスに感染したサルにおいてはHIV-1の患者と同様な持続性の高ウイルス血症およびCD4陽性T細胞の減少がみられ,2~3年以内にAIDSの発症が認められる6-8).in vitroにおいて,3BNC117および10-1074の中和活性の効力はVRC01に比べ10倍ほど高かった.
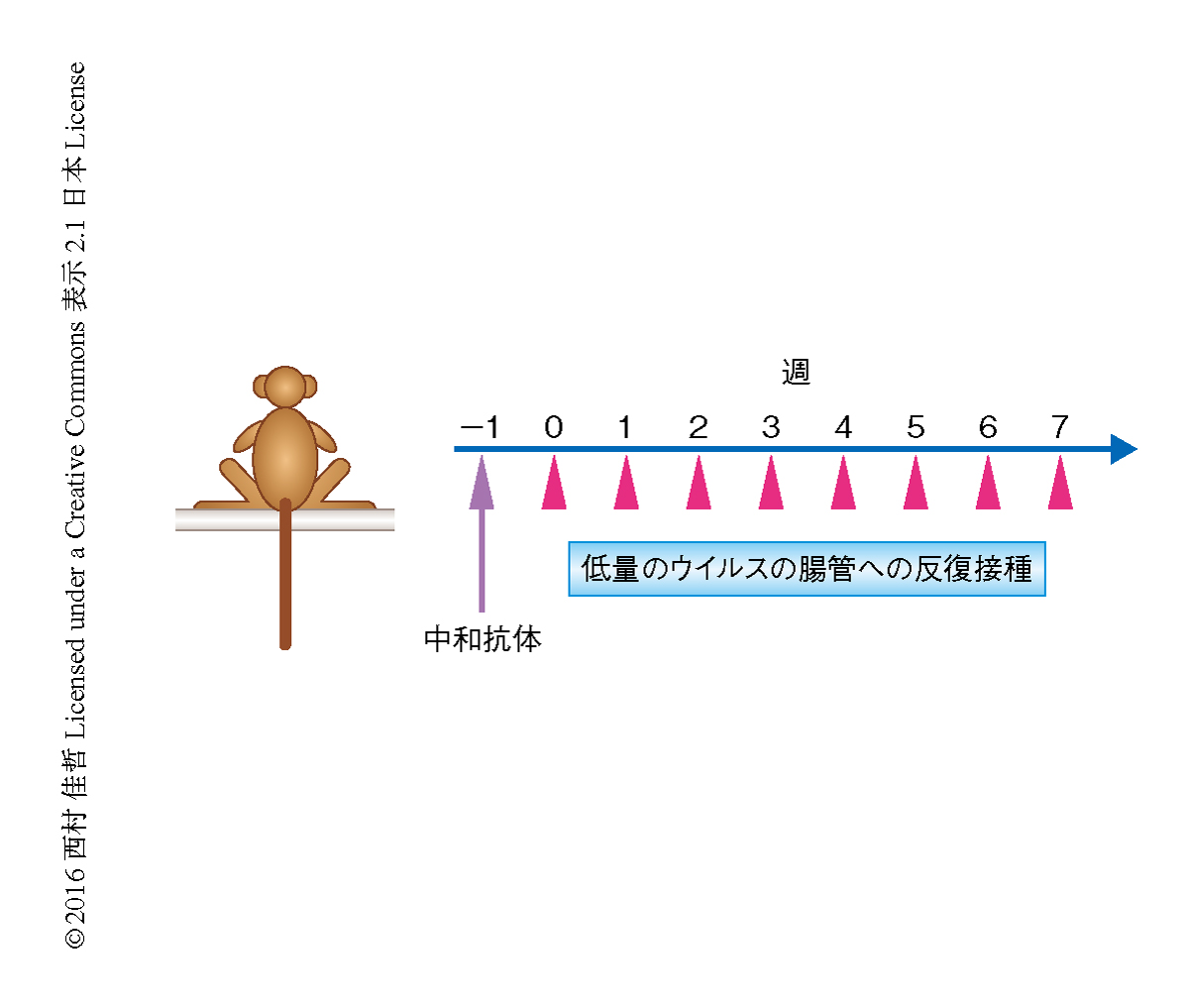
対照の中和抗体を投与していない9頭のサルにSHIVを低量で腸管へ反復接種したところ,2~6週間ですべてのサルにウイルスの感染が認められた.3種類の中和抗体をそれぞれ6頭のサルに単回,静脈投与し,その1週間のちより週1回,低量のSHIVを腸管へ反復接種し,感染の成立までにかかったSHIVの接種の回数をRT-PCR法による血中のウイルスの検出により分析した(図1).中和抗体を投与したすべてのサルにおいて感染の成立の遅延が認められた.VRC01を投与したサルでは感染の確認まで4~12週間を要し,3BNC117では7~20週間,10-1074でも6~23週間という長期間にわたる感染防御が,対照に対し統計学的に有意な差をもって確認された.
3種類の抗HIV-1中和抗体のうちもっとも短期間の防御能しか示されなかったVRC01であったが,そのFcドメインに2つのアミノ酸変異を導入したVRC01-LSは,その血中および組織における半減期が大きく延長することが報告されている9).VRC01の血中における半減期は約5日であるのに対し,VRC01-LSは約12日と2.5倍の差があるにもかかわらず,そのin vitroにおける中和活性は同等である.このVRC01-LSを同じく6頭のサルに単回,静脈投与した結果,9~18週間とVRC01に比べ長期間にわたる感染防御が認められた.
感染防御の際および感染の成立の際の血中における抗HIV-1中和抗体の濃度を確認するため,中和抗体を投与してから1週間のちより継続的にその量を解析したところ,3BNC117および10-1074について感染が確認されたときの濃度は比較的低く,それに対し,VRC-01およびVRC01-LSの濃度はそれより10~20倍も高い値であった.これらの中和抗体はヒトの免疫グロブリンGであるため,サルの体内においては抗ヒト免疫グロブリンG抗体が産生され中和抗体がすみやかに除去される可能性があった.そのことから,中和抗体を投与したサルにおいて血中の抗ヒト免疫グロブリンG抗体について解析したところ,約半数において,抗ヒト免疫グロブリンG抗体の存在および投与した中和抗体の血中からの早期の除去が認められた.抗ヒト免疫グロブリンG抗体を産生していないサルに注目した場合,約1.5倍の防御期間の延長が認められた.通常,ヒトに抗HIV-1中和抗体を投与した場合にはこれらの抗ヒト免疫グロブリンG抗体の産生は認められず,ヒトにおいては,サルにおける防御期間よりも長期間にわたる効果が期待された.
抗HIV-1中和抗体を投与されたサルの血中における中和抗体価を継時的に解析したところ,感染が確認された際の3BNC117および10-1074の中和抗体価は非常に低く,VRC01およびVRC01-LSに関しても低量のウイルスの曝露に関しては比較的低い抗体価でも感染を防御できることが明らかにされた.
今回の研究において,抗HIV-1中和抗体の単回の静脈投与によりウイルスの反復接種による感染を数カ月にわたり防御することができ,その防御期間は抗体の効果の高さおよび血中における半減期により決定されることが明らかにされた.HIV-1の蔓延する地域において,抗HIV-1中和抗体の単回の投与により感染防御に必要な値をうわまわる血中の抗体量および抗体価が数カ月間にわたり維持できるのであれば,HIV-1の伝播において多大な影響をあたえると思われる.サルではその約半数において抗ヒト免疫グロブリンG抗体がすみやかに産生され体内から中和抗体が除去されたのに対し,現在まで,今回の抗HIV-1中和抗体を投与されたヒトにおいては抗ヒト免疫グロブリンG抗体の存在が認められていないため6),ヒトに投与された場合にはより長い効果が期待される.また,中和抗体VRC01においてはFcドメインに導入した2つのアミノ酸変異により血中における半減期の約2~3倍の延長が認められたため,VRC01よりより中和効力の高い中和抗体である3BNC117および10-1074にも同様の変異を導入し実験を進めている.今後,数種類の中和抗体を混合したカクテルを用いることにより,より広範囲のHIV-1の感染防御に寄与できると思われる.現在も,さまざまな研究グループがより中和効果が高く広範囲のHIV-1株から防御の可能な抗体の分離をつづけている.効果的なワクチンのないHIV-1の感染に対し,半減期が長く効力の高い中和抗体を投与することにより半年から1年にわたる感染防御が期待できるのであれば,受動免疫がウイルスの蔓延を食い止めるひとつの重要な手段になるであろうと考えられる.
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,米国NIH National Institute of Allergy and Infectious DiseasesにてVisiting Fellowを経て,2006年より同Staff Scientist.
研究テーマ:サルを用いたHIV-1の感染に対する治療法の確立,および,ワクチンあるいは代替ワクチンの開発.
抱負:これまでかかわってきたHIV-1の感染に対する抗体治療および受動免疫による感染防御のデータをもとに,現在,ヒトにおける臨床試験がはじまっています.サルにおいて得られた知見を,いち早く臨床にフィードバックしていきたいと思っています.
© 2016 西村 佳哲 Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Microbiology)
email:西村佳哲
DOI: 10.7875/first.author.2016.041
A single injection of anti-HIV-1 antibodies protects against repeated SHIV challenges.
Rajeev Gautam, Yoshiaki Nishimura, Amarendra Pegu, Martha C. Nason, Florian Klein, Anna Gazumyan, Jovana Golijanin, Alicia Buckler-White, Reza Sadjadpour, Keyun Wang, Zachary Mankoff, Stephen D. Schmidt, Jeffrey D. Lifson, John R. Mascola, Michel C. Nussenzweig, Malcolm A. Martin
Nature, 533, 105-109 (2016)
要 約
今日では,HIV-1の感染を臨床的に制御する多々の抗レトロウイルス剤が開発され十分な効果を示しているが,感染防御を目標とするワクチンの開発はまだなされていない.ウイルスに対する中和効果の高い抗HIV-1抗体による受動免疫によりHIV-1の感染を実験的に防御できることはサルおよびヒト化マウスを用いて示されているが,その長期にわたる効果に関してはまだ明らかにされていない.今回の研究においては,サルに対する4種類の抗HIV-1中和抗体の単回の静脈投与により,腸管への低量のウイルスの反復接種に対し,最長でおよそ6カ月にわたる感染防御の効果が確認された.その効果はおのおのの中和抗体のウイルスに対する中和効果の強さおよび血中における半減期により違いが認められ,中和抗体を投与していないサルにおいては約3回の反復接種より感染が認められたのに対し,中和抗体の投与により約4倍の期間にわたる長期の感染防御能が確認された.さらに,比較的効力の弱い中和抗体のFcドメインに血中における半減期を延長するような変異を導入したところ,その防御期間に大幅な改善が認められた.HIV-1に対する効果的なワクチンがない現在,HIV-1の感染のリスクの高い集団に用いる受動的な免疫防御として,抗HIV-1中和抗体の予防的な投与はウイルスの伝播に大きな影響を及ぼすことができると考えられた.
はじめに
現在まで,さまざまなウイルスに対するワクチンが開発されており,それらのワクチンは感染ののちの体内におけるウイルスの増殖を抑え深刻な症状にいたることを防御することにより多大な効果をあげている.一方,HIV-1(human immunodeficiency virus 1,ヒト免疫不全ウイルス1)に関しては,現在のところ,いったん感染が成立するとウイルスを体内から完全に除去することは不可能であるため,HIV-1のワクチンはウイルスの曝露から非常に短期間のあいだに感染それ自体を防御することが必要である.実際,動物実験により中和抗体を用いた受動免疫による感染防御は可能であることが示されているが,そのような効果的な中和抗体の産生を誘導するHIV-1のワクチンはいまだ開発されていない.
近年の抗体の分離における技術革新により,一連の幅広いHIV-1株に対し高い中和活性を示す新世代中和抗体とよばれる抗体がHIV-1の患者から分離されてきた.これらを用いたサルまたはヒト化マウスにおけるウイルスの接種のまえの受動免疫の実験においては,抗HIV-1中和抗体の単回の投与から24~48時間のちに高量のウイルスを接種しても,その感染を防御できることが示されている1,2).しかし,ヒトのあいだでのウイルスの伝播は,それに比べいちじるしく低量のウイルスの曝露でも起こることが知られており,1回のウイルスの曝露における感染の成立率もいちじるしく低い.
A型肝炎ウイルスワクチンが開発される以前には,流行の発生地に渡航する場合,ウイルスへの曝露のまえの受動免疫として免疫グロブリンが投与されており,その効果は3~5カ月間にわたり持続した.そのほかの病原体においても,免疫グロブリンの投与は有効な予防手段として用いられており,この着想にもとづき,今回の研究においては,抗HIV-1中和抗体の単回の投与がサルにおいて腸管への低量のウイルスの反復接種による感染を防御できるかどうか調べた.
1.抗HIV-1中和抗体はサルにおいてウイルスの反復接種による感染の成立を遅延させる
筆者らは,以前に,HIVとSIV(サル免疫不全ウイルス)とのキメラウイルスであるSHIVについて,60頭のサルを用いた高量での接種に対する受動免疫においてさまざまな抗HIV-1中和抗体の防御効果について解析したが1),その知見にもとづき,今回の実験に使用する3種類の抗HIV-1中和抗体を選択した.VRC01および3BNC117はHIV-1のEnvのCD4結合部位を標的とする中和抗体,10-1074はEnvのN332糖鎖を認識する中和抗体である3-5).実験に用いた高病原性のウイルスSHIVAD8EOは,HIVAD8株に由来するEnvをSIVに組み込んだキメラウイルスで,このウイルスに感染したサルにおいてはHIV-1の患者と同様な持続性の高ウイルス血症およびCD4陽性T細胞の減少がみられ,2~3年以内にAIDSの発症が認められる6-8).in vitroにおいて,3BNC117および10-1074の中和活性の効力はVRC01に比べ10倍ほど高かった.
対照の中和抗体を投与していない9頭のサルにSHIVを低量で腸管へ反復接種したところ,2~6週間ですべてのサルにウイルスの感染が認められた.3種類の中和抗体をそれぞれ6頭のサルに単回,静脈投与し,その1週間のちより週1回,低量のSHIVを腸管へ反復接種し,感染の成立までにかかったSHIVの接種の回数をRT-PCR法による血中のウイルスの検出により分析した(図1).中和抗体を投与したすべてのサルにおいて感染の成立の遅延が認められた.VRC01を投与したサルでは感染の確認まで4~12週間を要し,3BNC117では7~20週間,10-1074でも6~23週間という長期間にわたる感染防御が,対照に対し統計学的に有意な差をもって確認された.
2.抗HIV-1中和抗体の防御能は中和の効率だけでなく血中における半減期により規定される
3種類の抗HIV-1中和抗体のうちもっとも短期間の防御能しか示されなかったVRC01であったが,そのFcドメインに2つのアミノ酸変異を導入したVRC01-LSは,その血中および組織における半減期が大きく延長することが報告されている9).VRC01の血中における半減期は約5日であるのに対し,VRC01-LSは約12日と2.5倍の差があるにもかかわらず,そのin vitroにおける中和活性は同等である.このVRC01-LSを同じく6頭のサルに単回,静脈投与した結果,9~18週間とVRC01に比べ長期間にわたる感染防御が認められた.
3.低量のウイルスに対する感染防御に必要な抗HIV-1中和抗体の濃度および中和抗体価は比較的低い
感染防御の際および感染の成立の際の血中における抗HIV-1中和抗体の濃度を確認するため,中和抗体を投与してから1週間のちより継続的にその量を解析したところ,3BNC117および10-1074について感染が確認されたときの濃度は比較的低く,それに対し,VRC-01およびVRC01-LSの濃度はそれより10~20倍も高い値であった.これらの中和抗体はヒトの免疫グロブリンGであるため,サルの体内においては抗ヒト免疫グロブリンG抗体が産生され中和抗体がすみやかに除去される可能性があった.そのことから,中和抗体を投与したサルにおいて血中の抗ヒト免疫グロブリンG抗体について解析したところ,約半数において,抗ヒト免疫グロブリンG抗体の存在および投与した中和抗体の血中からの早期の除去が認められた.抗ヒト免疫グロブリンG抗体を産生していないサルに注目した場合,約1.5倍の防御期間の延長が認められた.通常,ヒトに抗HIV-1中和抗体を投与した場合にはこれらの抗ヒト免疫グロブリンG抗体の産生は認められず,ヒトにおいては,サルにおける防御期間よりも長期間にわたる効果が期待された.
抗HIV-1中和抗体を投与されたサルの血中における中和抗体価を継時的に解析したところ,感染が確認された際の3BNC117および10-1074の中和抗体価は非常に低く,VRC01およびVRC01-LSに関しても低量のウイルスの曝露に関しては比較的低い抗体価でも感染を防御できることが明らかにされた.
おわりに
今回の研究において,抗HIV-1中和抗体の単回の静脈投与によりウイルスの反復接種による感染を数カ月にわたり防御することができ,その防御期間は抗体の効果の高さおよび血中における半減期により決定されることが明らかにされた.HIV-1の蔓延する地域において,抗HIV-1中和抗体の単回の投与により感染防御に必要な値をうわまわる血中の抗体量および抗体価が数カ月間にわたり維持できるのであれば,HIV-1の伝播において多大な影響をあたえると思われる.サルではその約半数において抗ヒト免疫グロブリンG抗体がすみやかに産生され体内から中和抗体が除去されたのに対し,現在まで,今回の抗HIV-1中和抗体を投与されたヒトにおいては抗ヒト免疫グロブリンG抗体の存在が認められていないため6),ヒトに投与された場合にはより長い効果が期待される.また,中和抗体VRC01においてはFcドメインに導入した2つのアミノ酸変異により血中における半減期の約2~3倍の延長が認められたため,VRC01よりより中和効力の高い中和抗体である3BNC117および10-1074にも同様の変異を導入し実験を進めている.今後,数種類の中和抗体を混合したカクテルを用いることにより,より広範囲のHIV-1の感染防御に寄与できると思われる.現在も,さまざまな研究グループがより中和効果が高く広範囲のHIV-1株から防御の可能な抗体の分離をつづけている.効果的なワクチンのないHIV-1の感染に対し,半減期が長く効力の高い中和抗体を投与することにより半年から1年にわたる感染防御が期待できるのであれば,受動免疫がウイルスの蔓延を食い止めるひとつの重要な手段になるであろうと考えられる.
文 献
- Shingai, M., Donau, O. K., Plishka, R. J. et al.: Passive transfer of modest titers of potent and broadly neutralizing anti-HIV monoclonal antibodies block SHIV infection in macaques. J. Exp. Med., 211, 2061-2074 (2014)[PubMed]
- Klein, F. Halper-Stromberg, A., Horwitz, J. A. et al.: HIV therapy by a combination of broadly neutralizing antibodies in humanized mice. Nature, 492, 118-122 (2012)[PubMed]
- Mouquet, H., Scharf, L., Euler, Z. et al.: Complex-type N-glycan recognition by potent broadly neutralizing HIV antibodies. Proc. Natl Acad. Sci. USA, 109, E3268-E3277 (2012)[PubMed]
- Scheid, J. F. Mouquet, H., Ueberheide, B. et al.: Sequence and structural convergence of broad and potent HIV antibodies that mimic CD4 binding. Science, 333, 1633-1637 (2011)[PubMed]
- Zhou, T. Georgiev, I., Wu, X. et al.: Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01. Science, 329, 811-817 (2010)[PubMed]
- Shingai, M., Donau, O. K., Schmidt, S. D. et al.: Most rhesus macaques infected with the CCR5-tropic SHIVAD8 generate cross-reactive antibodies that neutralize multiple HIV-1 strains. Proc. Natl Acad. Sci. USA, 109, 19769-19774 (2012)[PubMed]
- Nishimura, Y., Shingai, M., Willey, R. et al.: Generation of the pathogenic R5-tropic simian/human immunodeficiency virus SHIVAD8 by serial passaging in rhesus macaques. J. Virol., 84, 4769-4781 (2010)[PubMed]
- Gautam, R., Nishimura, Y., Lee, W. R. et al.: Pathogenicity and mucosal transmissibility of the R5-tropic simian/human immunodeficiency virus SHIVAD8 in rhesus macaques: implications for use in vaccine studies. J. Virol., 86, 8516-8526 (2012)[PubMed]
- Ko, S. Y., Pegu, A., Rudicell, R. S. et al.: Enhanced neonatal Fc receptor function improves protection against primate SHIV infection. Nature, 514, 642-645 (2014)[PubMed]
著者プロフィール
略歴:1999年 東京大学大学院農学生命科学研究科にて博士号取得,米国NIH National Institute of Allergy and Infectious DiseasesにてVisiting Fellowを経て,2006年より同Staff Scientist.
研究テーマ:サルを用いたHIV-1の感染に対する治療法の確立,および,ワクチンあるいは代替ワクチンの開発.
抱負:これまでかかわってきたHIV-1の感染に対する抗体治療および受動免疫による感染防御のデータをもとに,現在,ヒトにおける臨床試験がはじまっています.サルにおいて得られた知見を,いち早く臨床にフィードバックしていきたいと思っています.
© 2016 西村 佳哲 Licensed under CC 表示 2.1 日本