減数分裂期におけるテロメアの分子構造
澁谷大輝・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:澁谷大輝
DOI: 10.7875/first.author.2015.137
MAJIN links telomeric DNA to the nuclear membrane by exchanging telomere cap.
Hiroki Shibuya, Abrahan Hernández-Hernández, Akihiro Morimoto, Lumi Negishi, Christer Höög, Yoshinori Watanabe
Cell, 163, 1252-1266 (2015)
真核生物のテロメアは反復DNA配列およびそこに恒常的に結合するタンパク質複合体Shelterinから構成される.ShelterinはDNAの末端をDNA損傷応答から保護することにより細胞をがん化や老化から守る.一方,テロメアは減数分裂期においては核膜を構成する脂質二重膜と融合しアタッチメントプレートとよばれる特殊な構造を形成する.そして,核膜にそった染色体の運動を牽引することにより,相同染色体の対合および組換えを促進する.しかし,テロメアが保護構造から運動装置へと機能的そして構造的に分化する分子機構については明らかにされていない.この研究において,筆者らは,減数分裂期のテロメアタンパク質であるTERB1の相互作用因子を探索し,核膜とテロメアとの融合構造を形成する新規のタンパク質TERB2およびMAJINを同定した.TERB1-TERB2-MAJIN三者複合体は膜タンパク質であるMAJINのはたらきにより核膜に局在化された.そして,減数第1分裂前期の初期にテロメアが核膜に近接すると,この三者複合体はShelterinと安定的なキメラ複合体を形成することによりテロメアと核膜との結合を確立した.さらに,減数第1分裂前期の進行にともない,このキメラ複合体はShelterinを遊離させテロメアと核膜とが直接に結合した構造へと成熟した.テロメアキャップ交換と名づけられたこの機構はテロメアと核膜との安定的な結合,すなわち,アタッチメントプレートの形成を指揮する分子機構であると結論された.
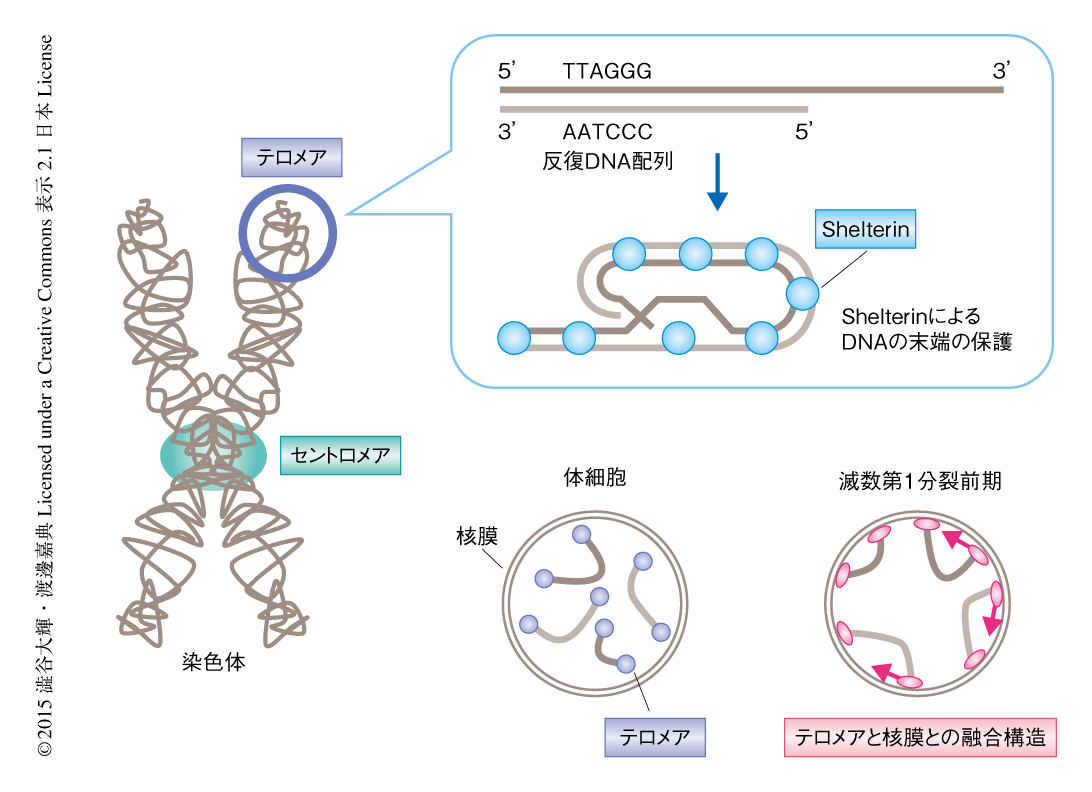
染色体の末端の構造であるテロメアはTTAGGGを基本単位とする6塩基の反復DNA配列から構成される(図1).この反復DNA配列にはその配列に特異的な結合能をもつタンパク質複合体Shelterinが結合し,DNAの末端を保護することにより細胞のがん化,細胞死,早期の老化をふせぐ.これらの機能からテロメアは染色体の保護構造と称される1).
テロメアのもうひとつの基本的な機能として,減数分裂期における染色体の運動の制御がある2).減数分裂は真核生物における配偶子の形成に特化した細胞分裂であり,1回の複製につづく2回の分裂により染色体の数が半減した配偶子が産生される.とくに,減数第1分裂においては父方および母方に由来する2本1組の相同染色体が分配される特殊な還元分配が起こる.その準備段階にあたる減数第1分裂前期においては,すべての染色体がテロメアを介して核膜に連結され,核膜にそって敏速に運動することが知られている(図1).この運動は相同染色体が正しいペアを認識し近接する過程を促進すると考えられている.また,ヒトにおけるこれらの過程の異常は不妊症,ダウン症,ターナー症といった先天性の遺伝子疾患の主要な原因にもなる3).
50年以上もまえに報告されたヒトおよびマウスの精母細胞の電子顕微鏡による観察から,減数分裂期のテロメアは核膜を構成する脂質二重膜と物理的に融合した特殊な構造であるアタッチメントプレートを形成することが報告されていた4-6).この構造はテロメアが染色体の運動装置として機能するために必須であると考えられたが,その構成タンパク質は同定されておらず,その形成や機能に関する分子機構の多くは未解明であった.
筆者らは,マウスを用いた先行研究において,テロメアが主導する染色体の運動をつかさどる減数分裂期に特異的なテロメア結合タンパク質としてTERB1を同定していた7)(新着論文レビュー でも掲載).この研究において,核膜とテロメアとの融合構造を形成するタンパク質を特定するため,マウスの精巣の抽出液からTERB1を免疫沈降し,質量分析法によりその相互作用因子を解析した.その結果,TRF1,SUN1,KASH5といった既知のTERB1との相互作用タンパク質にくわえ,減数分裂期に特異的な新規のタンパク質としてTERB2およびMAJINが同定された.TERB2およびMAJINは減数第1分裂前期をつうじテロメアに局在した.MAJINは疎水性ヘリックスからなる膜貫通ドメインをもち,核膜と結合した.また,TERB2はTERB1およびMAJINと結合し,その橋渡しを担うことが明らかにされた.
TERB2およびMAJINの機能を明らかにするため,遺伝子トラップ法によりノックアウトマウスを作製した.TERB2ノックアウトマウスおよびMAJINノックアウトマウスは雌雄ともに減数分裂の異常による配偶子の形成不全および不妊の表現型を示した.また,その生殖細胞においては,テロメアが核膜と連結せず,染色体の運動に必須なSUN1-KASH5複合体のテロメアへの集積が消失していた.実際に,生殖細胞を生細胞観察したところ,野生型マウスにおいて観察されるテロメアが主導する染色体の運動が,TERB2ノックアウトマウスおよびMAJINノックアウトマウスではほぼ完全に停止していた.以上の結果から,TERB2およびMAJINはテロメアと核膜との結合,および,SUN1-KASH5複合体のテロメアへの集積を介した染色体の運動に必須な機能をもつと結論された.
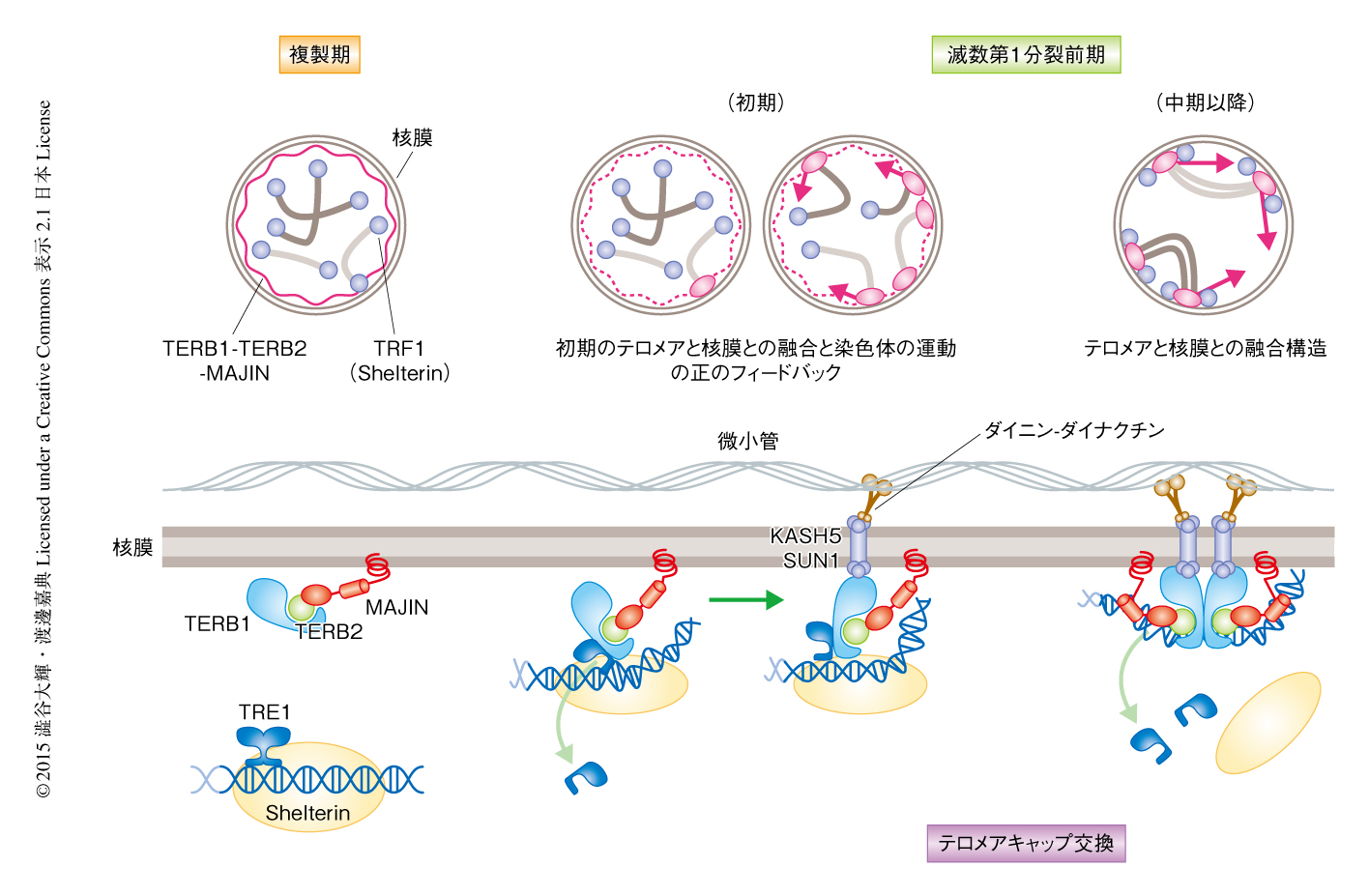
ノックアウトマウスを用いた局在の解析により,TERB2およびMAJINはTERB1との結合を介してテロメアに局在することが明らかにされた.また同時に,MAJINは膜貫通ドメインを介して核膜に結合することにより,TERB1-TERB2複合体を核膜に局在化することが示された.これら2つの制御が協調することにより,TERB1-TERB2-MAJIN三者複合体はまず核膜に均一に局在し,テロメアが核膜に近接するとTERB1とTRF1との結合を介して核膜に存在するテロメアへと集合するという,段階的な局在の過程をへることが明らかにされた.
TERB1-TERB2-MAJIN三者複合体の生化学的な性質を明らかにするため,大腸菌タンパク質発現系を用いた組換えタンパク質の精製およびin vitroにおけるDNA結合アッセイを行った.その結果,TERB1,TERB2,MAJINはin vitroにおいて安定的な三者複合体を形成することが明らかにされた.TERB1-TERB2-MAJIN三者複合体のDNAとの結合能は微弱であったが,反応系にTRF1を徐々に添加するとテロメアDNAとの非常に特異的かつ強い結合能を示した.詳細な解析により,本来はホモ二量体として安定に存在するTRF1が,過剰量のTERB1-TERB2-MAJIN三者複合体の存在のもとでは,より安定なTRF1,TERB1,TERB2,MAJINからなるキメラ複合体へと変換され,配列に特異的な強いDNA結合能を獲得することが明らかにされた.この敏速で安定な複合体の置換こそが,細胞においてテロメアと核膜との結合を担う分子機構であると考えられた(図2).
さらに種々の生化学的な解析により,in vitroにおいて精製したMAJINは塩基配列に非依存的なDNA結合能をもつことが判明した.MAJINは膜貫通ドメインの近傍の領域に塩基性アミノ酸残基からなるクラスターをもち,この塩基性アミノ酸残基の帯びる陽電荷がDNAの陰電荷と親和すると考えられた.そこで,塩基性クラスターを構成する5つのLysおよびArgを電荷をもたないAlaと置換したMAJIN変異体を作製したところ,in vitroにおけるDNA結合能はいちじるしく減少した.さらに,MAJINノックアウトマウスにこのDNAと結合しないMAJIN変異体を発現させると,野生型のMAJINを発現させた場合と比べ,テロメアと核膜との結合に顕著な異常が誘発された.したがって,キメラ複合体の形成にくわえ,MAJINのもつDNA結合能がテロメアと核膜との安定的な結合に寄与すると結論された.
生殖細胞におけるテロメア複合体の局在の詳細な解析により,減数第1分裂前期の初期にTRF1-TERB1-TERB2-MAJINキメラ複合体が形成されたのち,Shelterinが周辺の部位へと遊離する現象が観察された.このとき,テロメアDNAは核膜においてTERB1-TERB2-MAJIN三者複合体と共局在していた(図2).したがって,テロメアDNAはTRF1-TERB1-TERB2-MAJINキメラ複合体をへることにより,最終的にShelterinからTERB1-TERB2-MAJIN三者複合体へとひきわたされると考えられた.テロメアキャップ交換と名づけられたこの現象は,減数第1分裂前期の進行にともない顕在化するサイクリン依存性キナーゼのリン酸化活性およびMAJINのDNA結合能の制御に依存した(図2).
以上の結果から,TERB1-TERB2-MAJIN三者複合体がテロメアと核膜との結合に必須な機能をもつことが示された.したがって,先行研究において報告のあるテロメアと核膜との融合構造であるアタッチメントプレートが,TERB1-TERB2-MAJIN三者複合体に依存的に形成される可能性が考えられた.マウスの精巣を電子顕微鏡により観察したところ,野生型マウスにおいて観察されるアタッチメントプレートは,TERB1ノックアウトマウス,TERB2ノックアウトマウス,MAJINノックアウトマウスにおいて完全に消失した.さらに,SUN1ノックアウトマウスにおいてはTERB1-TERB2-MAJIN三者複合体のテロメアへの局在およびアタッチメントプレートの形成は正常であった.これらのことから,TERB1-TERB2-MAJIN三者複合体が,SUN1およびKASH5に非依存的にテロメアと核膜との融合構造を形成することが示された(図2).
これまで,SUN1ノックアウトマウスにおいて一部のテロメアが核膜から離脱する表現型が報告されている8).これはいっけん,さきの結論とはあいいれなかった.そこで,テロメアと核膜との融合の下流において誘起されるSUN1およびKASH5に依存的な染色体の運動が,さらに別の染色体におけるテロメアと核膜との融合を促進するという正のフィードバック仮説を考えた.高等真核生物のテロメアは体細胞期には核質に分散して局在しており,テロメアと核膜との融合は減数分裂のまえの複製期から減数第1分裂前期の初期にかけて確立される.そこで,この時期に微小管重合阻害剤を添加しテロメアに主導される染色体の運動を阻害すると,SUN1ノックアウトマウスと同様にテロメアと核膜の融合が顕著に阻害されることが明らかにされた.一方,いったんテロメアと核膜の融合が確立されたのちに染色体の運動を阻害してもテロメアと核膜の融合は維持されていた.以上の結果から,減数第1分裂期前期の初期にテロメアと核膜の融合が確立される過程において,テロメアと核膜の融合と染色体の運動の正のフィードバックによる制御がはたらいていることが証明された.
この研究により,減数分裂期においてテロメアが保護構造から運動装置へと分化する分子機構が解明された(図2).とくに,Shelterinがテロメアから遊離するテロメアキャップ交換が特徴的であった.サイクリン依存性キナーゼを含む分裂期リン酸化酵素のはたらきによりShelterinとDNAとの結合が減弱する現象は体細胞期においても報告があり9,10),また,TERB1とTRF1との結合もサイクリン依存性キナーゼによるTERB1のリン酸化により負に制御されることが示唆されている4).MAJINに依存的なDNA結合能が必要なことを考えあわせると,テロメアキャップ交換はサイクリン依存性キナーゼによるリン酸化の制御にくわえ,テロメアが疎水性の脂質二重膜に近接することにより生じる静電反発により,複合的に誘起される現象であると考えられた.また,電子顕微鏡により観察されるアタッチメントプレートはテロメアキャップ交換が誘起されたのち観察されることから,テロメアキャップ交換がアタッチメントプレートの形成と共役している可能性が考えられた.
また,テロメアキャップ交換により遊離したShelterinは,TERB1-TERB2-MAJIN三者複合体をかこむ周辺の領域に詳細は不明のリング様の構造を形成した.この構造に関しては,その足場や機能の詳細は不明である.減数第1分裂前期のおわりにテロメアと再結合するためなんらかのタンパク質あるいはDNAとの結合を介して一時的にプールされている可能性,それ自体が機能構造体としてテロメアと核膜との融合構造の安定化にはたらいている可能性,あるいは,配偶子の形成の過程におけるテロメアの伸張のための足場としてのはたらきなど,まったく別の機能を担っている可能性も考えられる.今後の発展的な研究が期待される.
略歴:2014年 東京大学大学院農学生命科学研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助教を経て,2015年より米国Harvard大学 博士研究員.
研究テーマ:染色体分配とエピジェネティクスの統合的な理解.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 澁谷大輝・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:澁谷大輝
DOI: 10.7875/first.author.2015.137
MAJIN links telomeric DNA to the nuclear membrane by exchanging telomere cap.
Hiroki Shibuya, Abrahan Hernández-Hernández, Akihiro Morimoto, Lumi Negishi, Christer Höög, Yoshinori Watanabe
Cell, 163, 1252-1266 (2015)
要 約
真核生物のテロメアは反復DNA配列およびそこに恒常的に結合するタンパク質複合体Shelterinから構成される.ShelterinはDNAの末端をDNA損傷応答から保護することにより細胞をがん化や老化から守る.一方,テロメアは減数分裂期においては核膜を構成する脂質二重膜と融合しアタッチメントプレートとよばれる特殊な構造を形成する.そして,核膜にそった染色体の運動を牽引することにより,相同染色体の対合および組換えを促進する.しかし,テロメアが保護構造から運動装置へと機能的そして構造的に分化する分子機構については明らかにされていない.この研究において,筆者らは,減数分裂期のテロメアタンパク質であるTERB1の相互作用因子を探索し,核膜とテロメアとの融合構造を形成する新規のタンパク質TERB2およびMAJINを同定した.TERB1-TERB2-MAJIN三者複合体は膜タンパク質であるMAJINのはたらきにより核膜に局在化された.そして,減数第1分裂前期の初期にテロメアが核膜に近接すると,この三者複合体はShelterinと安定的なキメラ複合体を形成することによりテロメアと核膜との結合を確立した.さらに,減数第1分裂前期の進行にともない,このキメラ複合体はShelterinを遊離させテロメアと核膜とが直接に結合した構造へと成熟した.テロメアキャップ交換と名づけられたこの機構はテロメアと核膜との安定的な結合,すなわち,アタッチメントプレートの形成を指揮する分子機構であると結論された.
はじめに
染色体の末端の構造であるテロメアはTTAGGGを基本単位とする6塩基の反復DNA配列から構成される(図1).この反復DNA配列にはその配列に特異的な結合能をもつタンパク質複合体Shelterinが結合し,DNAの末端を保護することにより細胞のがん化,細胞死,早期の老化をふせぐ.これらの機能からテロメアは染色体の保護構造と称される1).
テロメアのもうひとつの基本的な機能として,減数分裂期における染色体の運動の制御がある2).減数分裂は真核生物における配偶子の形成に特化した細胞分裂であり,1回の複製につづく2回の分裂により染色体の数が半減した配偶子が産生される.とくに,減数第1分裂においては父方および母方に由来する2本1組の相同染色体が分配される特殊な還元分配が起こる.その準備段階にあたる減数第1分裂前期においては,すべての染色体がテロメアを介して核膜に連結され,核膜にそって敏速に運動することが知られている(図1).この運動は相同染色体が正しいペアを認識し近接する過程を促進すると考えられている.また,ヒトにおけるこれらの過程の異常は不妊症,ダウン症,ターナー症といった先天性の遺伝子疾患の主要な原因にもなる3).
50年以上もまえに報告されたヒトおよびマウスの精母細胞の電子顕微鏡による観察から,減数分裂期のテロメアは核膜を構成する脂質二重膜と物理的に融合した特殊な構造であるアタッチメントプレートを形成することが報告されていた4-6).この構造はテロメアが染色体の運動装置として機能するために必須であると考えられたが,その構成タンパク質は同定されておらず,その形成や機能に関する分子機構の多くは未解明であった.
1.TERB2およびMAJINの発見
筆者らは,マウスを用いた先行研究において,テロメアが主導する染色体の運動をつかさどる減数分裂期に特異的なテロメア結合タンパク質としてTERB1を同定していた7)(新着論文レビュー でも掲載).この研究において,核膜とテロメアとの融合構造を形成するタンパク質を特定するため,マウスの精巣の抽出液からTERB1を免疫沈降し,質量分析法によりその相互作用因子を解析した.その結果,TRF1,SUN1,KASH5といった既知のTERB1との相互作用タンパク質にくわえ,減数分裂期に特異的な新規のタンパク質としてTERB2およびMAJINが同定された.TERB2およびMAJINは減数第1分裂前期をつうじテロメアに局在した.MAJINは疎水性ヘリックスからなる膜貫通ドメインをもち,核膜と結合した.また,TERB2はTERB1およびMAJINと結合し,その橋渡しを担うことが明らかにされた.
2.TERB2およびMAJINはテロメアと核膜との結合および染色体の運動を制御する
TERB2およびMAJINの機能を明らかにするため,遺伝子トラップ法によりノックアウトマウスを作製した.TERB2ノックアウトマウスおよびMAJINノックアウトマウスは雌雄ともに減数分裂の異常による配偶子の形成不全および不妊の表現型を示した.また,その生殖細胞においては,テロメアが核膜と連結せず,染色体の運動に必須なSUN1-KASH5複合体のテロメアへの集積が消失していた.実際に,生殖細胞を生細胞観察したところ,野生型マウスにおいて観察されるテロメアが主導する染色体の運動が,TERB2ノックアウトマウスおよびMAJINノックアウトマウスではほぼ完全に停止していた.以上の結果から,TERB2およびMAJINはテロメアと核膜との結合,および,SUN1-KASH5複合体のテロメアへの集積を介した染色体の運動に必須な機能をもつと結論された.
3.TERB1,TERB2,MAJINは核膜において集合しテロメアを捕捉する
ノックアウトマウスを用いた局在の解析により,TERB2およびMAJINはTERB1との結合を介してテロメアに局在することが明らかにされた.また同時に,MAJINは膜貫通ドメインを介して核膜に結合することにより,TERB1-TERB2複合体を核膜に局在化することが示された.これら2つの制御が協調することにより,TERB1-TERB2-MAJIN三者複合体はまず核膜に均一に局在し,テロメアが核膜に近接するとTERB1とTRF1との結合を介して核膜に存在するテロメアへと集合するという,段階的な局在の過程をへることが明らかにされた.
4.in vitroにおけるキメラ複合体の形成
TERB1-TERB2-MAJIN三者複合体の生化学的な性質を明らかにするため,大腸菌タンパク質発現系を用いた組換えタンパク質の精製およびin vitroにおけるDNA結合アッセイを行った.その結果,TERB1,TERB2,MAJINはin vitroにおいて安定的な三者複合体を形成することが明らかにされた.TERB1-TERB2-MAJIN三者複合体のDNAとの結合能は微弱であったが,反応系にTRF1を徐々に添加するとテロメアDNAとの非常に特異的かつ強い結合能を示した.詳細な解析により,本来はホモ二量体として安定に存在するTRF1が,過剰量のTERB1-TERB2-MAJIN三者複合体の存在のもとでは,より安定なTRF1,TERB1,TERB2,MAJINからなるキメラ複合体へと変換され,配列に特異的な強いDNA結合能を獲得することが明らかにされた.この敏速で安定な複合体の置換こそが,細胞においてテロメアと核膜との結合を担う分子機構であると考えられた(図2).
5.MAJINはDNAとの結合によりテロメアと核膜との結合を安定化させる
さらに種々の生化学的な解析により,in vitroにおいて精製したMAJINは塩基配列に非依存的なDNA結合能をもつことが判明した.MAJINは膜貫通ドメインの近傍の領域に塩基性アミノ酸残基からなるクラスターをもち,この塩基性アミノ酸残基の帯びる陽電荷がDNAの陰電荷と親和すると考えられた.そこで,塩基性クラスターを構成する5つのLysおよびArgを電荷をもたないAlaと置換したMAJIN変異体を作製したところ,in vitroにおけるDNA結合能はいちじるしく減少した.さらに,MAJINノックアウトマウスにこのDNAと結合しないMAJIN変異体を発現させると,野生型のMAJINを発現させた場合と比べ,テロメアと核膜との結合に顕著な異常が誘発された.したがって,キメラ複合体の形成にくわえ,MAJINのもつDNA結合能がテロメアと核膜との安定的な結合に寄与すると結論された.
6.テロメアキャップ交換
生殖細胞におけるテロメア複合体の局在の詳細な解析により,減数第1分裂前期の初期にTRF1-TERB1-TERB2-MAJINキメラ複合体が形成されたのち,Shelterinが周辺の部位へと遊離する現象が観察された.このとき,テロメアDNAは核膜においてTERB1-TERB2-MAJIN三者複合体と共局在していた(図2).したがって,テロメアDNAはTRF1-TERB1-TERB2-MAJINキメラ複合体をへることにより,最終的にShelterinからTERB1-TERB2-MAJIN三者複合体へとひきわたされると考えられた.テロメアキャップ交換と名づけられたこの現象は,減数第1分裂前期の進行にともない顕在化するサイクリン依存性キナーゼのリン酸化活性およびMAJINのDNA結合能の制御に依存した(図2).
7.テロメアと核膜との融合構造の形成
以上の結果から,TERB1-TERB2-MAJIN三者複合体がテロメアと核膜との結合に必須な機能をもつことが示された.したがって,先行研究において報告のあるテロメアと核膜との融合構造であるアタッチメントプレートが,TERB1-TERB2-MAJIN三者複合体に依存的に形成される可能性が考えられた.マウスの精巣を電子顕微鏡により観察したところ,野生型マウスにおいて観察されるアタッチメントプレートは,TERB1ノックアウトマウス,TERB2ノックアウトマウス,MAJINノックアウトマウスにおいて完全に消失した.さらに,SUN1ノックアウトマウスにおいてはTERB1-TERB2-MAJIN三者複合体のテロメアへの局在およびアタッチメントプレートの形成は正常であった.これらのことから,TERB1-TERB2-MAJIN三者複合体が,SUN1およびKASH5に非依存的にテロメアと核膜との融合構造を形成することが示された(図2).
8.テロメアと核膜との融合および染色体の運動の正のフィードバックによる制御
これまで,SUN1ノックアウトマウスにおいて一部のテロメアが核膜から離脱する表現型が報告されている8).これはいっけん,さきの結論とはあいいれなかった.そこで,テロメアと核膜との融合の下流において誘起されるSUN1およびKASH5に依存的な染色体の運動が,さらに別の染色体におけるテロメアと核膜との融合を促進するという正のフィードバック仮説を考えた.高等真核生物のテロメアは体細胞期には核質に分散して局在しており,テロメアと核膜との融合は減数分裂のまえの複製期から減数第1分裂前期の初期にかけて確立される.そこで,この時期に微小管重合阻害剤を添加しテロメアに主導される染色体の運動を阻害すると,SUN1ノックアウトマウスと同様にテロメアと核膜の融合が顕著に阻害されることが明らかにされた.一方,いったんテロメアと核膜の融合が確立されたのちに染色体の運動を阻害してもテロメアと核膜の融合は維持されていた.以上の結果から,減数第1分裂期前期の初期にテロメアと核膜の融合が確立される過程において,テロメアと核膜の融合と染色体の運動の正のフィードバックによる制御がはたらいていることが証明された.
おわりに
この研究により,減数分裂期においてテロメアが保護構造から運動装置へと分化する分子機構が解明された(図2).とくに,Shelterinがテロメアから遊離するテロメアキャップ交換が特徴的であった.サイクリン依存性キナーゼを含む分裂期リン酸化酵素のはたらきによりShelterinとDNAとの結合が減弱する現象は体細胞期においても報告があり9,10),また,TERB1とTRF1との結合もサイクリン依存性キナーゼによるTERB1のリン酸化により負に制御されることが示唆されている4).MAJINに依存的なDNA結合能が必要なことを考えあわせると,テロメアキャップ交換はサイクリン依存性キナーゼによるリン酸化の制御にくわえ,テロメアが疎水性の脂質二重膜に近接することにより生じる静電反発により,複合的に誘起される現象であると考えられた.また,電子顕微鏡により観察されるアタッチメントプレートはテロメアキャップ交換が誘起されたのち観察されることから,テロメアキャップ交換がアタッチメントプレートの形成と共役している可能性が考えられた.
また,テロメアキャップ交換により遊離したShelterinは,TERB1-TERB2-MAJIN三者複合体をかこむ周辺の領域に詳細は不明のリング様の構造を形成した.この構造に関しては,その足場や機能の詳細は不明である.減数第1分裂前期のおわりにテロメアと再結合するためなんらかのタンパク質あるいはDNAとの結合を介して一時的にプールされている可能性,それ自体が機能構造体としてテロメアと核膜との融合構造の安定化にはたらいている可能性,あるいは,配偶子の形成の過程におけるテロメアの伸張のための足場としてのはたらきなど,まったく別の機能を担っている可能性も考えられる.今後の発展的な研究が期待される.
文 献
- Palm, W. & de Lange, T.: How shelterin protects mammalian telomeres. Annu. Rev. Genet., 42, 301-334 (2008)[PubMed]
- Hiraoka, Y. & Dernburg, A. F.: The SUN rises on meiotic chromosome dynamics. Dev. Cell, 17, 598-605 (2009)[PubMed]
- Hassold, T. & Hunt, P.: To err (meiotically) is human: the genesis of human aneuploidy. Nat. Rev. Genet., 2, 280-291 (2001)[PubMed]
- Esponda, P. & Gimenez-Martin, G.: The attachment of the synaptonemal complex to the nuclear envelope. An ultrastructural and cytochemical analysis. Chromosoma, 38, 405-417 (1972)[PubMed]
- Holm, P. B. & Rasmussen S. W.: Human meiosis I. The human pachytene karyotype analyzed by three dimensional reconstruction of the synaptonemal complex. Carlsberg Res. Commun., 42, 283-323 (1977)
- Woollam, D. H., Millen, J. W. & Ford, E. H.: Points of attachment of pachytene chromosomes to the nuclear membrane in mouse spermatocytes. Nature, 213, 298-299 (1967)[PubMed]
- Shibuya, H., Ishiguro, K. & Watanabe, Y.: The TRF1-binding protein TERB1 promotes chromosome movement and telomere rigidity in meiosis. Nat. Cell Biol., 16, 145-156 (2014)[PubMed] [新着論文レビュー]
- Ding, X., Xu, R., Yu, J. et al.: SUN1 is required for telomere attachment to nuclear envelope and gametogenesis in mice. Dev. Cell, 12, 863-872 (2007)[PubMed]
- McKerlie, M. & Zhu, X. D.: Cyclin B-dependent kinase 1 regulates human TRF1 to modulate the resolution of sister telomeres. Nat. Commun., 2, 371 (2011)[PubMed]
- Hayashi, M. T., Cesare, A. J., Fitzpatrick, J. A. et al.: A telomere-dependent DNA damage checkpoint induced by prolonged mitotic arrest. Nat. Struct. Mol. Biol., 19, 387-394 (2012)[PubMed]
著者プロフィール
略歴:2014年 東京大学大学院農学生命科学研究科博士課程 修了,同年 東京大学分子細胞生物学研究所 助教を経て,2015年より米国Harvard大学 博士研究員.
研究テーマ:染色体分配とエピジェネティクスの統合的な理解.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2015 澁谷大輝・渡邊嘉典 Licensed under CC 表示 2.1 日本