哺乳動物の新規のテロメア結合タンパク質TERB1による減数分裂期における染色体の運動の制御
澁谷大輝・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:澁谷大輝
DOI: 10.7875/first.author.2014.013
The TRF1-binding protein TERB1 promotes chromosome movement and telomere rigidity in meiosis.
Hiroki Shibuya, Kei-ichiro Ishiguro, Yoshinori Watanabe
Nature Cell Biology, 16, 145-156 (2014)
生物は細胞分裂の際に染色体を正確に複製し分配することにより遺伝情報を次世代へと伝えており,染色体の分配の異常はさまざまな遺伝子疾患の原因となることが知られている.したがって,その分子機構の解明は医学的な観点からも早急な課題である.筆者らは,電気穿孔法を用いたマウスの減数分裂組織への一過的な外来遺伝子の導入法を確立した.さらに,この方法により染色体タンパク質と蛍光タンパク質との融合タンパク質を生きた生殖細胞において発現させ,減数分裂期における染色体の運動を可視化することに成功した.その結果,分裂酵母における観察と同様に,哺乳動物の減数分裂期においても,核膜に連結された染色体の末端構造であるテロメアを起点として染色体が核膜にそって運動していることが明らかになった.また,この運動を制御する新規のテロメア結合タンパク質を同定しTERB1と命名した.TERB1ノックアウトマウスでは,テロメアに主導される染色体の運動が抑制され,減数分裂が異常に停止することにより不妊の表現型が観察された.さらに,TERB1は染色体の軸構造の形成にはたらくコヒーシンタンパク質SA3と結合し,そのテロメアへの局在を促進することにより染色体の運動に耐えうる強固なテロメア構造の形成に機能していることが明らかになった.TERB1遺伝子はヒトを含む脊椎動物のあいだで広く保存されており,この研究により得られた知見は,減数分裂の異常に起因するヒトの先天的な遺伝子疾患の原因の解明につながる可能性がある.
生物のからだはDNAにコードされた遺伝情報とその緻密な発現制御のもとに形成され維持されている.細胞分裂の際には種々のタンパク質がDNAに結合することにより染色体とよばれる構造体が形成される.生物はこの染色体を正確に複製し分配することにより遺伝情報を次世代へと伝えており,染色体の分配の異常はさまざまな遺伝子疾患の原因となることが知られている.とくに,配偶子の形成に特化した細胞分裂である減数分裂においては,染色体の分配の異常は,不妊症,Down症候群,Turner症候群など,重度の先天的な遺伝子疾患をひき起こすことが知られており,医学的な観点からもその分子機構の解明は早急な課題である.
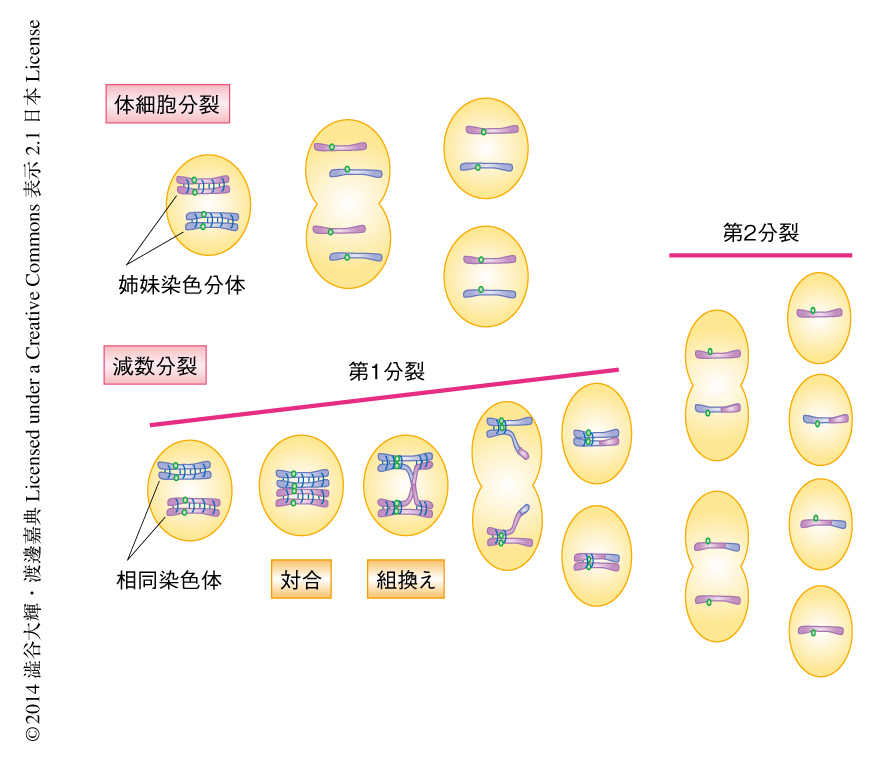
減数分裂は生命が進化の過程において有性生殖の誕生とともに獲得した特殊な細胞分裂の様式であり,通常の体細胞分裂とは異なり,1回のDNA複製ののち2回の連続した細胞分裂が起こる(図1).その結果,DNAの量および染色体の数が半減された配偶子(精子および卵)が形成される.とくに減数第1分裂においては体細胞分裂とは異なり,相同染色体どうしが対となり別の細胞へと分配される還元分裂が起こる.たとえば,ヒトには23対46本の染色体があり,それぞれの染色体はそれ自体を除く残り45本の染色体のなかから正しい相同染色体を認識して対合し,最終的に別の細胞へと振り分けられる.この相同染色体どうしが正しい相手を認識し対合する分子機構は,近年までまったくの謎であった.
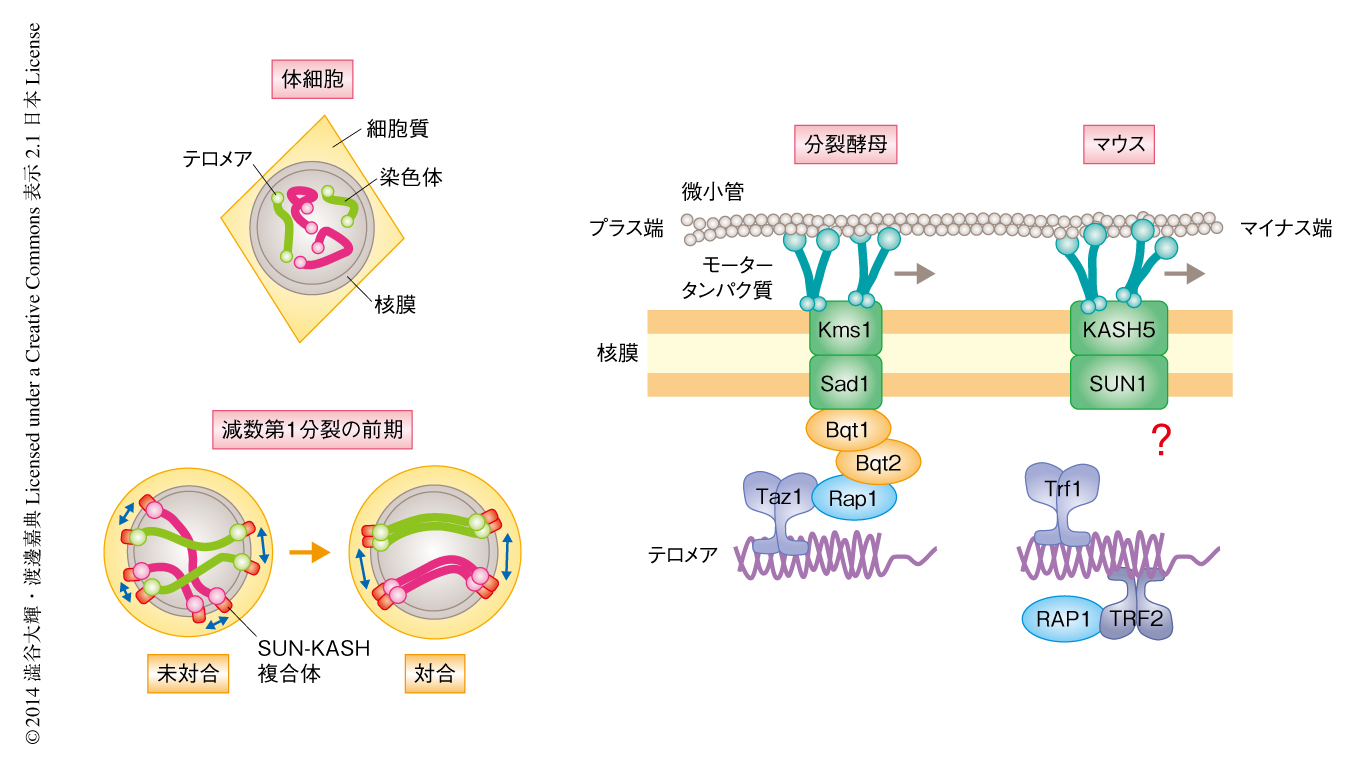
これまで,分裂酵母を用いた研究により染色体の末端構造であるテロメアが減数分裂のときの染色体の運動において重要な機能をもつことが明らかにされてきた1).通常,染色体の分配の際には染色体のセントロメア領域が動きの起点(動原体)としてはたらくが,減数第1分裂の前期にはテロメアが起点となり,染色体は核膜にそって運動する.分裂酵母においては,減数分裂期に特異的に発現するテロメアタンパク質Bqt1およびBqt2が,核膜タンパク質複合体であるSUN-KASH複合体と結合することによりこの染色体の運動を促進している.SUN-KASH複合体は核膜を貫通し,その核質の側でテロメアと,細胞質の側でダイニンやダイナクチンなどのモータータンパク質と結合する.この橋渡しにより細胞質のモータータンパク質による駆動力は核に存在する染色体へと伝達される.この運動は最終的に相同染色体の対合および組換えを促進することにより,減数第1分裂における正常な染色体の分配を保証している(図2).
筆者らを含むいくつかの研究グループにより,哺乳動物であるマウスにおいても,保存されたSUN1-KASH5複合体が正常な減数分裂の進行に必須であることが明らかにされていたが2-4),これらと相互作用する分裂酵母のBqt1あるいはBqt2のようなテロメアタンパク質は知られていなかった5).また,細胞において実際にテロメアを起点とした染色体の運動を観察した例もなく,その制御機構は現象の存否も含め不明であった.分裂酵母などと比較してマウスにおける遺伝学的な研究が遅れているおもな要因は,その遺伝子操作の困難さにあるといえる.哺乳動物における減数分裂の前期の進行には組織において隣接してはたらく支持細胞が必要であり,酵母などの単細胞生物やヒト培養細胞などで用いられるin vitroにおける簡便な遺伝子操作は適用できない.したがって,その解析にはトランスジェニックマウスやノックアウトマウスの作製など個体レベルでの遺伝子操作が必要となる.
筆者らは,この研究において,電気穿孔法によるマウスの減数分裂組織への一過的な外来遺伝子の導入法を適用し,条件検討の結果,マウスの精母細胞において効率よく外来遺伝子を発現させることに成功した.さらに,GFPと融合したテロメアタンパク質の発現により,生きた生殖細胞における染色体の運動を観察することにより,哺乳動物においても核膜に連結されたテロメアを起点としたダイナミックな染色体の運動が起こっていることを明らかにした.また,電気穿孔法を用いた遺伝子スクリーニングにより,この染色体の運動を制御する新規のテロメア結合タンパク質を同定しTERB1と命名した.そして,TERB1ノックアウトマウスの表現型の解析により,哺乳動物の減数分裂期においてテロメアのもつユニークな分子機能を明らかにした.
生体内電気穿孔(in vivo electroporation)法は,脳神経科学の分野などにおいてマウスの脳組織へ遺伝子を導入する技術として確立された手法であるが6),この手法を減数分裂組織に応用した例は少なく7,8),発現効率が低いことから実際の解析に応用した報告はこれまでになかった.今回,DNAの濃度,マウスの週齢,パルスの電圧などパラメーターの至適化により,外来遺伝子をコードした組換えプラスミドDNAをマウスの精母細胞へと効率よく導入することに成功した.そこで,DNAマイクロアレイ法などによる遺伝子発現データベースから減数分裂組織(精巣あるいは卵巣)における発現の高いことが予測されていた遺伝子9) に着目し,電気穿孔法によりこれらの遺伝子がコードするタンパク質とGFPとの融合タンパク質を一過的にマウスの精母細胞において発現させることにより,その局在の網羅的な解析を試みた.その結果,新規の遺伝子であるCcdc79遺伝子のコードするタンパク質がテロメアに局在することが明らかになった.CCDC79はヒトを含む脊椎動物のあいだで広く保存されており,既知のテロメアタンパク質TRF1あるいはTRF2と高い相同性をもつMyb-DNA結合ドメインをもっていた.のちの解析から,CCDC79はTRF1と複合体を形成することによりテロメアに局在することが判明した.そこで,この新規のタンパク質をTERB1(telomere repeat-binding bouquet formation protein 1)と命名した.
遺伝子トラップ法によりTERB1のノックアウトマウスを作製し,その表現型を解析した.その結果,TERB1ノックアウトマウスは雌雄ともいっけん正常な発育を示したが,減数分裂の進行の異常により配偶子が形成されず,不妊の表現型が観察された.減数分裂のどの過程で異常が生じているかについて免疫染色法により検証した.テロメアの動態を観察すると,野生型のマウスではTERB1が局在する減数第1分裂の前期をつうじテロメアが核膜に連結されていたのに対し,TERB1ノックアウトマウスでは多くのテロメアが核膜から離脱しているようすが観察された.
電気穿孔法によりテロメアに局在するGFP-TRF1融合タンパク質と染色体軸に局在するGFP-SCP3融合タンパク質とを共発現させることにより,生きた精母細胞における染色体の運動の可視化を試みた.その結果,野生型マウスの精母細胞では,核膜にそったテロメアのランダムな運動や染色体全体の激しい回転運動が微小管に依存して起こっていることがわかった.これに対し,TERB1ノックアウトマウスではこれらの運動がいちじるしく抑制されていた.同様の異常はSUN1のノックアウトマウスにおいても観察された.さらに,SUN1-KASH5複合体や細胞質モータータンパク質であるダイナクチンの局在を調べたところ,いずれも野生型マウスではテロメアに局在していたのに対し,TERB1ノックアウトマウスではそれらの局在が完全に消失していた.以上の結果から,TERB1がSUN1-KASH5複合体およびダイナクチンのテロメアへの局在を介し,テロメアと核膜との結合と,それにつづく染色体の運動を制御していることが示された.また,TERB1を欠損した精母細胞および卵母細胞では染色体の運動が損なわれた結果,相同染色体の対合と,それにつづく相同組換えが正常に進行せず,減数分裂の異常な停止による細胞死が観察された.
酵母ツーハイブリッド法によりTERB1と相互作用するタンパク質を探索したところ,減数分裂期において染色体の軸構造の形成にはたらくことの知られているコヒーシン複合体の構成タンパク質のひとつSA3が同定された.のちの解析により,TERB1のMybドメインを含むC末端側の領域がSA3と結合することが明らかになった.免疫染色法によりコヒーシンの局在を観察したところ,野生型のマウスでは染色体の軸構造が形成されるまえの段階からテロメアに集積し,染色体軸を形成したのちもその末端においてテロメアと共局在していたのに対し,TERB1ノックアウトマウスではコヒーシンのテロメアへの局在は顕著に減少しており,テロメアのあいだの異常な連結や伸張が頻繁に観察された10).これらの表現型は,電気穿孔法によりTERB1ノックアウトマウスの精巣に野生型TERB1を発現させることにより有意に抑圧されたが,Mybドメインを欠損したTERB1の発現では抑圧されなかった.以上の結果から,TERB1のMybドメインがin vivoにおけるコヒーシンのテロメアへの集積に特化した機能をもち,それにより,染色体の運動のときの駆動力に耐えうる強固なテロメア構造の形成に機能していることが示唆された.
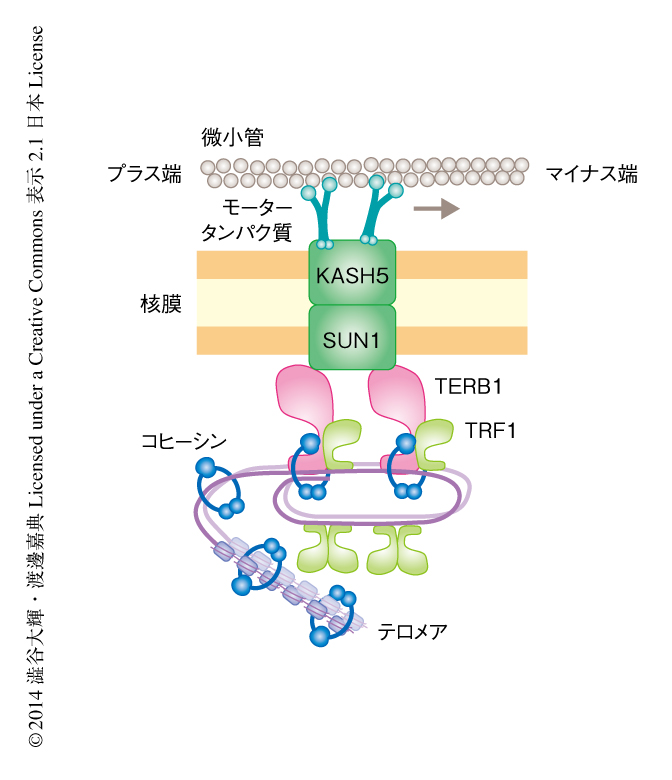
この研究により,高等動物であるマウスにおいても,染色体のテロメアが減数第1分裂の前期に特異的な染色体の運動の起点“テロメア動原体”として重要なはたらきを担うことが明らかになった.また,その分子機構は,SUN1-KASH5複合体との協調的な作用など分裂酵母で示された枠組みと類似した点がみられた一方で,コヒーシンを介したテロメア構造の補強など,進化の過程で獲得されたと考えられる,より高度な制御がはたらいていることも同時に明らかになった(図3).コヒーシンは染色体の分配の際にその起点としてはたらくセントロメアにおいてもその構造の維持にはたらくことが知られており,共通した制御が“テロメア動原体”においても観察されたことはたいへんに興味深い.また,この研究において導入された電気穿孔法は,哺乳動物の減数分裂を制御する分子機構の解析において有用なツールになるとともに,ノックアウトマウスに対する表現型の相補にも応用が可能であることがわかった.したがって,将来的には,ヒトの不妊症の患者に対する遺伝子治療への応用も期待される.
略歴:東京大学大学院農学生命科学研究科博士課程 在学中.
研究テーマ:哺乳類の減数分裂期にテロメアにおいて形成される新規のタンパク質複合体の同定と機能の解析.
抱負:かぎられた実験手法を駆使し,目先のストーリーにとらわれず,実際に“何が細胞において起こっているのか”を真摯に見つめ,考え,明らかにしていく,そんな研究を志したい.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2014 澁谷大輝・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:澁谷大輝
DOI: 10.7875/first.author.2014.013
The TRF1-binding protein TERB1 promotes chromosome movement and telomere rigidity in meiosis.
Hiroki Shibuya, Kei-ichiro Ishiguro, Yoshinori Watanabe
Nature Cell Biology, 16, 145-156 (2014)
要 約
生物は細胞分裂の際に染色体を正確に複製し分配することにより遺伝情報を次世代へと伝えており,染色体の分配の異常はさまざまな遺伝子疾患の原因となることが知られている.したがって,その分子機構の解明は医学的な観点からも早急な課題である.筆者らは,電気穿孔法を用いたマウスの減数分裂組織への一過的な外来遺伝子の導入法を確立した.さらに,この方法により染色体タンパク質と蛍光タンパク質との融合タンパク質を生きた生殖細胞において発現させ,減数分裂期における染色体の運動を可視化することに成功した.その結果,分裂酵母における観察と同様に,哺乳動物の減数分裂期においても,核膜に連結された染色体の末端構造であるテロメアを起点として染色体が核膜にそって運動していることが明らかになった.また,この運動を制御する新規のテロメア結合タンパク質を同定しTERB1と命名した.TERB1ノックアウトマウスでは,テロメアに主導される染色体の運動が抑制され,減数分裂が異常に停止することにより不妊の表現型が観察された.さらに,TERB1は染色体の軸構造の形成にはたらくコヒーシンタンパク質SA3と結合し,そのテロメアへの局在を促進することにより染色体の運動に耐えうる強固なテロメア構造の形成に機能していることが明らかになった.TERB1遺伝子はヒトを含む脊椎動物のあいだで広く保存されており,この研究により得られた知見は,減数分裂の異常に起因するヒトの先天的な遺伝子疾患の原因の解明につながる可能性がある.
はじめに
生物のからだはDNAにコードされた遺伝情報とその緻密な発現制御のもとに形成され維持されている.細胞分裂の際には種々のタンパク質がDNAに結合することにより染色体とよばれる構造体が形成される.生物はこの染色体を正確に複製し分配することにより遺伝情報を次世代へと伝えており,染色体の分配の異常はさまざまな遺伝子疾患の原因となることが知られている.とくに,配偶子の形成に特化した細胞分裂である減数分裂においては,染色体の分配の異常は,不妊症,Down症候群,Turner症候群など,重度の先天的な遺伝子疾患をひき起こすことが知られており,医学的な観点からもその分子機構の解明は早急な課題である.
減数分裂は生命が進化の過程において有性生殖の誕生とともに獲得した特殊な細胞分裂の様式であり,通常の体細胞分裂とは異なり,1回のDNA複製ののち2回の連続した細胞分裂が起こる(図1).その結果,DNAの量および染色体の数が半減された配偶子(精子および卵)が形成される.とくに減数第1分裂においては体細胞分裂とは異なり,相同染色体どうしが対となり別の細胞へと分配される還元分裂が起こる.たとえば,ヒトには23対46本の染色体があり,それぞれの染色体はそれ自体を除く残り45本の染色体のなかから正しい相同染色体を認識して対合し,最終的に別の細胞へと振り分けられる.この相同染色体どうしが正しい相手を認識し対合する分子機構は,近年までまったくの謎であった.
これまで,分裂酵母を用いた研究により染色体の末端構造であるテロメアが減数分裂のときの染色体の運動において重要な機能をもつことが明らかにされてきた1).通常,染色体の分配の際には染色体のセントロメア領域が動きの起点(動原体)としてはたらくが,減数第1分裂の前期にはテロメアが起点となり,染色体は核膜にそって運動する.分裂酵母においては,減数分裂期に特異的に発現するテロメアタンパク質Bqt1およびBqt2が,核膜タンパク質複合体であるSUN-KASH複合体と結合することによりこの染色体の運動を促進している.SUN-KASH複合体は核膜を貫通し,その核質の側でテロメアと,細胞質の側でダイニンやダイナクチンなどのモータータンパク質と結合する.この橋渡しにより細胞質のモータータンパク質による駆動力は核に存在する染色体へと伝達される.この運動は最終的に相同染色体の対合および組換えを促進することにより,減数第1分裂における正常な染色体の分配を保証している(図2).
筆者らを含むいくつかの研究グループにより,哺乳動物であるマウスにおいても,保存されたSUN1-KASH5複合体が正常な減数分裂の進行に必須であることが明らかにされていたが2-4),これらと相互作用する分裂酵母のBqt1あるいはBqt2のようなテロメアタンパク質は知られていなかった5).また,細胞において実際にテロメアを起点とした染色体の運動を観察した例もなく,その制御機構は現象の存否も含め不明であった.分裂酵母などと比較してマウスにおける遺伝学的な研究が遅れているおもな要因は,その遺伝子操作の困難さにあるといえる.哺乳動物における減数分裂の前期の進行には組織において隣接してはたらく支持細胞が必要であり,酵母などの単細胞生物やヒト培養細胞などで用いられるin vitroにおける簡便な遺伝子操作は適用できない.したがって,その解析にはトランスジェニックマウスやノックアウトマウスの作製など個体レベルでの遺伝子操作が必要となる.
筆者らは,この研究において,電気穿孔法によるマウスの減数分裂組織への一過的な外来遺伝子の導入法を適用し,条件検討の結果,マウスの精母細胞において効率よく外来遺伝子を発現させることに成功した.さらに,GFPと融合したテロメアタンパク質の発現により,生きた生殖細胞における染色体の運動を観察することにより,哺乳動物においても核膜に連結されたテロメアを起点としたダイナミックな染色体の運動が起こっていることを明らかにした.また,電気穿孔法を用いた遺伝子スクリーニングにより,この染色体の運動を制御する新規のテロメア結合タンパク質を同定しTERB1と命名した.そして,TERB1ノックアウトマウスの表現型の解析により,哺乳動物の減数分裂期においてテロメアのもつユニークな分子機能を明らかにした.
1.新規のテロメア結合タンパク質TERB1の発見
生体内電気穿孔(in vivo electroporation)法は,脳神経科学の分野などにおいてマウスの脳組織へ遺伝子を導入する技術として確立された手法であるが6),この手法を減数分裂組織に応用した例は少なく7,8),発現効率が低いことから実際の解析に応用した報告はこれまでになかった.今回,DNAの濃度,マウスの週齢,パルスの電圧などパラメーターの至適化により,外来遺伝子をコードした組換えプラスミドDNAをマウスの精母細胞へと効率よく導入することに成功した.そこで,DNAマイクロアレイ法などによる遺伝子発現データベースから減数分裂組織(精巣あるいは卵巣)における発現の高いことが予測されていた遺伝子9) に着目し,電気穿孔法によりこれらの遺伝子がコードするタンパク質とGFPとの融合タンパク質を一過的にマウスの精母細胞において発現させることにより,その局在の網羅的な解析を試みた.その結果,新規の遺伝子であるCcdc79遺伝子のコードするタンパク質がテロメアに局在することが明らかになった.CCDC79はヒトを含む脊椎動物のあいだで広く保存されており,既知のテロメアタンパク質TRF1あるいはTRF2と高い相同性をもつMyb-DNA結合ドメインをもっていた.のちの解析から,CCDC79はTRF1と複合体を形成することによりテロメアに局在することが判明した.そこで,この新規のタンパク質をTERB1(telomere repeat-binding bouquet formation protein 1)と命名した.
2.TERB1はテロメアを起点とした染色体の運動を促進する
遺伝子トラップ法によりTERB1のノックアウトマウスを作製し,その表現型を解析した.その結果,TERB1ノックアウトマウスは雌雄ともいっけん正常な発育を示したが,減数分裂の進行の異常により配偶子が形成されず,不妊の表現型が観察された.減数分裂のどの過程で異常が生じているかについて免疫染色法により検証した.テロメアの動態を観察すると,野生型のマウスではTERB1が局在する減数第1分裂の前期をつうじテロメアが核膜に連結されていたのに対し,TERB1ノックアウトマウスでは多くのテロメアが核膜から離脱しているようすが観察された.
電気穿孔法によりテロメアに局在するGFP-TRF1融合タンパク質と染色体軸に局在するGFP-SCP3融合タンパク質とを共発現させることにより,生きた精母細胞における染色体の運動の可視化を試みた.その結果,野生型マウスの精母細胞では,核膜にそったテロメアのランダムな運動や染色体全体の激しい回転運動が微小管に依存して起こっていることがわかった.これに対し,TERB1ノックアウトマウスではこれらの運動がいちじるしく抑制されていた.同様の異常はSUN1のノックアウトマウスにおいても観察された.さらに,SUN1-KASH5複合体や細胞質モータータンパク質であるダイナクチンの局在を調べたところ,いずれも野生型マウスではテロメアに局在していたのに対し,TERB1ノックアウトマウスではそれらの局在が完全に消失していた.以上の結果から,TERB1がSUN1-KASH5複合体およびダイナクチンのテロメアへの局在を介し,テロメアと核膜との結合と,それにつづく染色体の運動を制御していることが示された.また,TERB1を欠損した精母細胞および卵母細胞では染色体の運動が損なわれた結果,相同染色体の対合と,それにつづく相同組換えが正常に進行せず,減数分裂の異常な停止による細胞死が観察された.
3.コヒーシンの局在を介したテロメア構造の補強
酵母ツーハイブリッド法によりTERB1と相互作用するタンパク質を探索したところ,減数分裂期において染色体の軸構造の形成にはたらくことの知られているコヒーシン複合体の構成タンパク質のひとつSA3が同定された.のちの解析により,TERB1のMybドメインを含むC末端側の領域がSA3と結合することが明らかになった.免疫染色法によりコヒーシンの局在を観察したところ,野生型のマウスでは染色体の軸構造が形成されるまえの段階からテロメアに集積し,染色体軸を形成したのちもその末端においてテロメアと共局在していたのに対し,TERB1ノックアウトマウスではコヒーシンのテロメアへの局在は顕著に減少しており,テロメアのあいだの異常な連結や伸張が頻繁に観察された10).これらの表現型は,電気穿孔法によりTERB1ノックアウトマウスの精巣に野生型TERB1を発現させることにより有意に抑圧されたが,Mybドメインを欠損したTERB1の発現では抑圧されなかった.以上の結果から,TERB1のMybドメインがin vivoにおけるコヒーシンのテロメアへの集積に特化した機能をもち,それにより,染色体の運動のときの駆動力に耐えうる強固なテロメア構造の形成に機能していることが示唆された.
おわりに
この研究により,高等動物であるマウスにおいても,染色体のテロメアが減数第1分裂の前期に特異的な染色体の運動の起点“テロメア動原体”として重要なはたらきを担うことが明らかになった.また,その分子機構は,SUN1-KASH5複合体との協調的な作用など分裂酵母で示された枠組みと類似した点がみられた一方で,コヒーシンを介したテロメア構造の補強など,進化の過程で獲得されたと考えられる,より高度な制御がはたらいていることも同時に明らかになった(図3).コヒーシンは染色体の分配の際にその起点としてはたらくセントロメアにおいてもその構造の維持にはたらくことが知られており,共通した制御が“テロメア動原体”においても観察されたことはたいへんに興味深い.また,この研究において導入された電気穿孔法は,哺乳動物の減数分裂を制御する分子機構の解析において有用なツールになるとともに,ノックアウトマウスに対する表現型の相補にも応用が可能であることがわかった.したがって,将来的には,ヒトの不妊症の患者に対する遺伝子治療への応用も期待される.
文 献
- Chikashige, Y., Tsutsumi, C., Yamane, M. et al.: Meiotic proteins bqt1 and bqt2 tether telomeres to form the bouquet arrangement of chromosomes. Cell, 125, 59-69 (2006)[PubMed]
- Ding, X., Xu, R., Yu, J. et al.: SUN1 is required for telomere attachment to nuclear envelope and gametogenesis in mice. Dev. Cell, 12, 863-872 (2007)[PubMed]
- Horn, H. F., Kim, D. I., Wright, G. D. et al.: A mammalian KASH domain protein coupling meiotic chromosomes to the cytoskeleton. J. Cell Biol., 202, 1023-1039 (2013)[PubMed]
- Morimoto, A., Shibuya, H., Zhu, X. et al.: A conserved KASH domain protein associates with telomeres, SUN1, and dynactin during mammalian meiosis. J. Cell Biol., 198, 165-172 (2012)[PubMed]
- Hiraoka, Y. & Dernburg, A. F.: The SUN rises on meiotic chromosome dynamics. Dev. Cell, 17, 598-605 (2009)[PubMed]
- Saito, T.: In vivo electroporation in the embryonic mouse central nervous system. Nat. Protoc., 1, 1552-1558 (2006)[PubMed]
- Ogawa, T., Arechaga, J. M., Avarbock, M. R. et al.: Transplantation of testis germinal cells into mouse seminiferous tubules. Int. J. Dev. Biol., 41, 111-122 (1997)[PubMed]
- Matsuda, T. & Cepko, C. L.: Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc. Natl. Acad. Sci. USA, 101, 16-22 (2004)[PubMed]
- Gallardo, T. D., John, G. B., Shirley, L. et al.: Genomewide discovery and classification of candidate ovarian fertility genes in the mouse. Genetics, 177, 179-194 (2007)[PubMed]
- Adelfalk, C., Janschek, J., Revenkova, E. et al.: Cohesin SMC1β protects telomeres in meiocytes. J. Cell Biol., 187, 185-199 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院農学生命科学研究科博士課程 在学中.
研究テーマ:哺乳類の減数分裂期にテロメアにおいて形成される新規のタンパク質複合体の同定と機能の解析.
抱負:かぎられた実験手法を駆使し,目先のストーリーにとらわれず,実際に“何が細胞において起こっているのか”を真摯に見つめ,考え,明らかにしていく,そんな研究を志したい.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2014 澁谷大輝・渡邊嘉典 Licensed under CC 表示 2.1 日本