神経回路の入力と出力の関係を可視化するTRIO法の開発
宮道 和成
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物化学研究室)
email:宮道和成
DOI: 10.7875/first.author.2015.082
Viral-genetic tracing of the input-output organization of a central noradrenaline circuit.
Lindsay A. Schwarz, Kazunari Miyamichi, Xiaojing J. Gao, Kevin T. Beier, Brandon Weissbourd, Katherine E. DeLoach, Jing Ren, Sandy Ibanes, Robert C. Malenka, Eric J. Kremer, Liqun Luo
Nature, 524, 88-92 (2015)
従来の神経回路の解剖学においては,研究の対象となるニューロンXがどこから情報をうけるか(入力)と,ニューロンXがどこに情報を送るか(出力)は別々に扱われ,入力源→ニューロンX→出力先という3者の関係を一体としてとらえることはできなかった.このため,脳における情報処理のしくみを理解するうえで重要な神経回路の入力と出力の関係はほとんど未解明であった.筆者らは,経路を選択できる操作系とトランスシナプス標識とを組み合わせ,マウスにおいて遺伝学的に特定することの可能な任意のニューロンXについて入力と出力の関係を網羅的に解析できる汎用的な手法としてTRIO法を開発した.このTRIO法を用いることにより運動野第5層の錐体細胞において特異的な情報伝達経路を見い出し,さらに,創薬の標的として重要性の高い青班核ノルアドレナリン系の入力と出力の関係を解析した.TRIO法は複雑な脳において特異的に情報を処理する神経回路の構造を探索するのに有用であり,マウスにおいては脳のほかの領域に適用できるほか,ほかの哺乳類にも拡張が可能である.
情報伝達の経路を考える場合,発信源がどこから情報を集めどこに情報を伝えるのか,情報のソース(入力)とターゲット(出力)をセットで理解することが重要である.研究者の日常を例に考えると,われわれはさまざまな情報を集めさまざまな場面において発信するが,その際,ターゲットに応じて適切なソースを選んでいることがわかる.たとえば,学会発表の内容のためには自身の研究や専門誌から情報を得るのに対し,友人どうしの酒席における気楽な話題ならニュースや噂話から情報を得ることが多い.さて,脳のなかで研究の対象となるニューロンXは,さまざまな領域のシナプス前細胞から入力を集め,さまざまな領域のシナプス後細胞へと出力するので,ここで一般的な問題がたてられる.ニューロンXの出力先がひとつあたえられたとき,ニューロンXを介してこの出力先に情報を伝達する入力源を特定できるだろうか? もし可能なら,ニューロンXの出力先を変えたとき,入力源のパターンはどのように変化するだろうか? すなわち,ニューロンXについて入力源と出力先とのあいだにはどのような関係性が成立するのだろうか?
標的となるニューロンの入力と出力の関係を分析する考え方の有用性は,ドーパミンニューロンの研究に学ぶことができる.マウスにおける実験から,腹側被覆野に存在するドーパミンニューロンには,側坐核の外側シェルに出力し報酬情報を伝達するサブタイプと,前頭前皮質に出力し懲罰情報を伝達するサブタイプの少なくとも2種類が存在し,それぞれ脳の異なる領域からの入力をうけることが知られている1).ドーパミンニューロンは薬物依存に深くかかわり,パーキンソン病などの治療の標的でもあるため,異なる入力と出力の関係をもつサブタイプがまったく異なる機能を担うという知見は,より効果的な治療戦略や副作用の少ない創薬標的の存在を示唆するものである.しかし,多数あるドーパミンニューロンの出力先について網羅的に入力源を解析するためにはスループットおよび分解能の高い手法が必要とされていた.また,ほかの神経修飾系や機能的に重要なニューロンの入力と出力の関係についても,一般的に解析できる汎用的な手法が望まれていた.筆者らは,この要請にこたえるべく,狂犬病ウイルスの変異体2) を用いたトランスシナプス標識法3,4) を拡張し,入力源→ニューロンX→出力先という3段階の情報伝達経路を分析できる汎用的な手法としてTRIO(tracing the relationship between input and output)法を開発した.
狂犬病ウイルスによるトランスシナプス標識法3) は,シナプスをこえて逆行性に感染する狂犬病ウイルスを遺伝子工学的に制御することにより,標的となるニューロンXから1段階だけ上流のシナプス前細胞を標識する手法である.この方法は,変異型の狂犬病ウイルスの取り込みに必要なTVA受容体と,変異型の狂犬病ウイルスの相補に必要な糖タンパク質RGとを同時に発現させた出発細胞を起点として,その1段階だけ上流のシナプス前細胞を脳のすべての領域において標識できる.現在の標準的な手法では,組換え酵素Creを発現するトランスジェニックマウスにCreに依存型のアデノ随伴ウイルスを感染させることにより,脳の領域およびニューロンの種類を限定して出発細胞を作製する4)(図1a).筆者らは,入力源→ニューロンX→出力先という3段階の接続を可視化するためには,出力先を指定して出発細胞を作製することが必要だと考えた.そこで,軸索の末端から効率よく感染し細胞体にCreを発現させるようなベクターを探索したところ,イヌ科アデノウイルス2型5) を用いることにより経路を選択して効率よく出発細胞を作製できることがわかった.TRIO法は,Creをコードするイヌ科アデノウイルス2型ベクターを注入した箇所に出力するニューロンにおいてCreを発現させることにより,その1段階だけ上流のシナプス前細胞を可視化する(図1b).注入の箇所を体系的に変えることにより出発細胞の入力と出力の関係を解析できる.このように,TRIO法は3種類のウイルスを効果的に利用し,3段階の領域あるいはニューロンのあいだに成立する接続の関係を可視化する手法である.
TRIO法では出発細胞の存在する領域に遺伝学的に区別の可能なニューロンが混在していて,いずれも同じ領域に出力を送っている場合,出発細胞となるニューロンの種類を限定することができない.たとえば,腹側被蓋野にはドーパミンニューロンのほかにも多数のGABAニューロンが存在し,長距離の軸索投射をしていることが知られていた.TRIO法をドーパミンニューロンに限定するにはどうしたらよいだろう? 筆者らは,Creトランスジェニックマウスと投射経路の選択系の共集合(ANDゲート)をとることによりこの問題を解決した.このcTRIO(cell type specific TRIO)法は,標的となる領域の特定のニューロンにおいてCreを発現するトランスジェニックマウスを用い,出力先を指定するのにCreに依存型のFlpをコードするイヌ科アデノウイルス2型ベクターを導入する(図1c).FlpはCreと同様の組換え酵素で,出発細胞を作製するためにFlpに依存型のアデノ随伴ウイルスを用いることを可能にする.
以上をまとめると,TRIO法は特別な遺伝子改変動物を要求しないのでマウスのほかにもさまざまな哺乳類の神経回路における入力と出力の関係を分析できるが,標的となる領域のニューロンに存在する遺伝学的な多様性を分離できない.cTRIO法はCreトランスジェニック動物を要求するが,遺伝学的に特定のタイプのニューロンの入力と出力の関係を限定的に分析することができる.
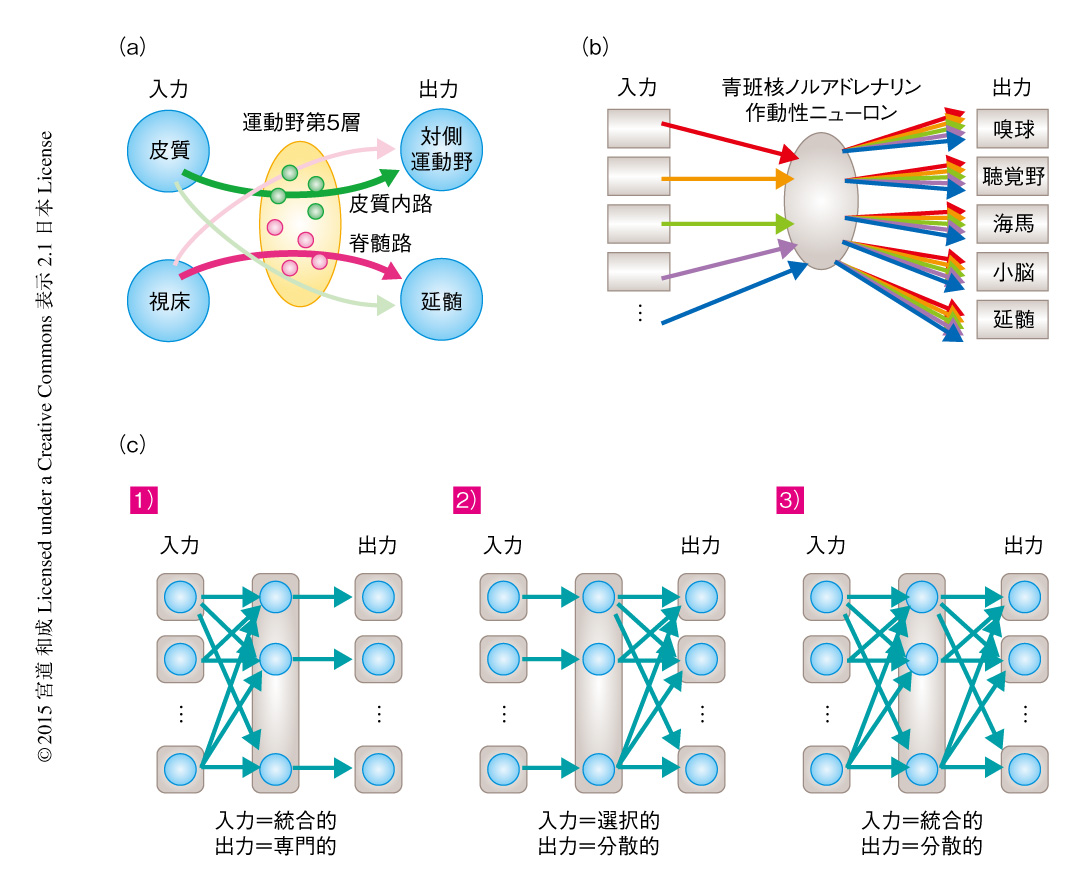
TRIO法の原理の証明として,運動の計画と実行を担う大脳の運動野を解析した.運動野の出力として,第5層の錐体細胞が延髄をへる脊髄路と,対側の運動野や同側の体性感覚野に投射する皮質内路が存在する.TRIO法により対側の運動野へ出力を送るニューロンを解析したところ,出発細胞は第2層から第6層まで幅広く分布していた.そこで,第5層の錐体細胞の大部分にCreを限局的に発現するCreトランスジェニックマウス6) を用いて,cTRIO法により第5層に限局的に脊髄路と皮質内路を形成するニューロンを解析した.その結果,脊髄路に出力する運動野の第5層の錐体細胞は視床からの入力を有意に多くうけとっていたのに対し,皮質内路に出力する第5層の錐体細胞は体性感覚野などの皮質内の入力を多くうけとることが明らかにされた(図2a).この結果から,運動野第5層のなかに出力先に応じて異なる入力を集める少なくとも2種類のサブタイプが存在し,視床からの入力は脊髄路に直接的な影響を強くあたえるよう特別に配線されていることが示された.また,技術的な面に目をむけると,cTRIO法によりCreを発現する遺伝学的に限局したニューロンに対しTRIO法による解析を適用できることが実証された.また,別の実験においては,TRIO法がマウスのほかの哺乳類に拡張が可能であることの証左として,TRIO法をラットの運動野に適用し,線条体路と皮質内路を形成するニューロンの入力を可視化できることも示された.
ノルアドレナリンはドーパミンやセロトニンとともにモノアミン神経修飾系を構成する神経伝達物質で,睡眠,覚醒,注意,気分など脳の状態を制御するのに重要な役割をはたす.脳のほぼすべてのノルアドレナリンは脳幹の青班核を起始核とするノルアドレナリンニューロンによりもたらされる.非常に広範な出力先があるにもかかわらず,脳の特定の領域に出力するノルアドレナリンニューロンのサブタイプが存在するのか,そして,出力先に応じて入力源は異なるのか,という基本的な構造についてすら,現在まで,研究者のあいだで意見の一致をみていない7).そこで,TRIO法を適用する準備のため,ノルアドレナリンニューロンに入力を送るシナプス前細胞を脳のすべての領域において可視化した.その結果,111の領域から入力が認められ,古典的な軸索のトレース実験により示唆されていた多くの領域が実際にノルアドレナリンニューロンに直接性の入力を送っていることが明らかにされた.さらに,小脳のプルキンエ細胞など,これまで知られていなかった新たなノルアドレナリンニューロンのシナプス前細胞が見い出された.
ノルアドレナリンニューロンの広範な出力先のなかから嗅球,大脳の聴覚野,海馬,小脳,延髄という相互に遠く離れた5か所を選び,TRIO法(出発細胞がノルアドレナリンニューロンに限局しないケースにおいては,ノルアドレナリンニューロンに特異的なCreトランスジェニックマウスマウスを用いたcTRIO法)により解析し,さきに得たノルアドレナリンニューロンの全体に対する入力と定量的に比較した.その結果,まったく異なる5か所の出力先から選んだノルアドレナリンニューロンは,いっけんするとほとんど区別のつかないパターンで入力を集めていることが明らかにされた(図2b).しかし,統計的に分析するとノルアドレナリンニューロンの入力と出力の関係は完全に均質なわけではなく,たとえば,延髄に出力するノルアドレナリンニューロンは扁桃体からの入力が有意に少ないといった局所的な傾向が認められた.扁桃体からノルアドレナリンニューロンへの入力はストレス応答にかかわるとされるが,延髄はこの経路から選択的に外れているのかもしれない.
ノルアドレナリンニューロンが全体として入力と出力の関係に強い特異性をもたないという結果は,個々のニューロンのレベルでみるとどのような構造により成り立つのだろうか? 個々のノルアドレナリンニューロンは,特定の入力源から選択的に情報を集める,多くの入力源からの情報を統合する,特異的な出力先を専門に担当する,多くの出力先に分散的に情報を送る,と,入力と出力の特異性の組合せにより4通りのモデルが考えられる.このうち,入力と出力がともに特異的であるケース(専用回線モデル)はさきの結果とは合致しないため,残りの3通りを考えた.1)入力に関して統合的だが出力は専門化している,2)入力は選択的だが出力は分散的である,3)入力および出力とも特異性なく統合的かつ分散的である,の3通りである(図2c).
出力の構造の特異性を検討するため,出力先をひとつ選んでその領域に投射するノルアドレナリンニューロンがほかのどの領域に軸索を伸長するのかを解析した.この目的のためには,TRIO法あるいはcTRIO法の戦略をそのまま活用し,狂犬病ウイルスによる標識の代わりに蛍光タンパク質mCherryにより標識される出発細胞の軸索を抗mCherry抗体により検出すればよい.嗅球,聴覚野,海馬,延髄という遠く離れた出力先を指定してノルアドレナリンニューロンを標識したところ,すべてのケースについて指定先を含めた8か所の領域すべてに相当量の軸索の側枝が認められた.つまり,ノルアドレナリンニューロンの出力は多くの領域を一手に担当する分散的な要素が強いといえた.個々のノルアドレナリンニューロンに対する入力の選択性については,出発細胞の数が非常に少なかったケースが参考になった.コンピューターシミュレーションによると,観察されたデータを説明するには個々のノルアドレナリンニューロンは少なくとも9以上の異なる領域から情報を統合しなくてはならなかった.したがって,入力に高い選択性をもつケースは一般的ではなく,入力に関しても特異性の低いモデルがノルアドレナリンニューロンの入力および出力の構造を近似的によく説明すると考えられた(図2c).
以上をまとめると,この解析により,ノルアドレナリンニューロンの脳のすべての領域にわたる入力をはじめて網羅的に同定し,ノルアドレナリンニューロンが広範な出力先にもかかわらずおおむね類似した入力パターンをうけることが示された.その背景として,個々のノルアドレナリンニューロンが基本的には多くの入力源からの情報を統合し,多くの出力先に情報を分配する素子としてふるまうことが指摘された.この構造は,ノルアドレナリンニューロンが睡眠と覚醒のサイクルといった脳のすべての領域の状態制御にかかわるという知見に親和するものであった.しかし,全体としては統合的かつ分散的でありながら,統計的に分析すると局所的にいくつかの特筆すべき特異性のみられたことも事実であった.ノルアドレナリンニューロンがこれらの特異性を利用して特定の標的だけを選択的に制御しているのかという問題については将来の研究が必要である.
TRIO法は2011年に狂犬病ウイルスによるトランスシナプス標識法3) の拡張版として開発をはじめ,2012年の前半には原理証明が得られていたが,そののち,狂犬病ウイルスによるトランスシナプス標識系の改良8) やCreをコードするイヌ科アデノウイルス2型ベクターを用いた経路を選択できる操作系が受け入れられてきた状況をうけて改善を重ねた.とくにcTRIO法,すなわち,Creトランスジェニックマウスとイヌ科アデノウイルス2型ベクターによる経路の選択系とのANDゲートの構築は難航し,相当数のウイルスを永久凍結の刑に処した.最終的に確立された手法は汎用性が高く,神経回路の入力と出力の構造を調べるほかにも,指定先に出力する特定のタイプのニューロンの活動を記録したり操作したりするのにも利用できると考えられる.また,マウスのほかラットにおいてもTRIO法が成立したことから,今後は,マーモセットなどほかの哺乳類への応用も視野に入るだろう.
最初に述べたように,出力先にもとづいて入力を分析するというアイデアの原型はドーパミンニューロンのサブタイプに関する知見に由来している.今回,解析したノルアドレナリンニューロンは,(残念ながら)入力と出力の関係に高い特異性を示すことがなかったが,それでは,TRIO法あるいはcTRIO法を用いることによりドーパミンニューロンのサブタイプを高分解能で網羅的に分析できるのだろうか? 答えはもちろんYESだが,これは米国Stanford大学の元同僚たちが鋭意取り組んでいるトピックなので,筆者からは乞うご期待とだけ申し上げたい.今後は,ドーパミンニューロンを含め広範に出力するさまざまな機能的に重要なニューロンの特異的な出力を担うサブタイプの同定とその入力や機能の解析を進めることにより,脳において情報が適切に分配されて下流に伝達されるしくみの理解が進むのみならず,効果の高く副作用の少ない神経疾患の創薬標的に関する基礎的な知見が蓄積することを期待したい.
略歴:2006年 東京大学大学院理学系研究科修了,同年 米国Stanford大学 博士研究員を経て,2013年より東京大学大学院農学生命科学研究科 特任准教授.
研究テーマ:高次の脳神経回路の構造および機能.
抱負:留学から帰国して約2年,ようやく米国での研究をおおむね収穫することができました.つぎは,現在,日本で蒔いている種から世界に届く研究を発信していきたい.
© 2015 宮道 和成 Licensed under CC 表示 2.1 日本
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物化学研究室)
email:宮道和成
DOI: 10.7875/first.author.2015.082
Viral-genetic tracing of the input-output organization of a central noradrenaline circuit.
Lindsay A. Schwarz, Kazunari Miyamichi, Xiaojing J. Gao, Kevin T. Beier, Brandon Weissbourd, Katherine E. DeLoach, Jing Ren, Sandy Ibanes, Robert C. Malenka, Eric J. Kremer, Liqun Luo
Nature, 524, 88-92 (2015)
要 約
従来の神経回路の解剖学においては,研究の対象となるニューロンXがどこから情報をうけるか(入力)と,ニューロンXがどこに情報を送るか(出力)は別々に扱われ,入力源→ニューロンX→出力先という3者の関係を一体としてとらえることはできなかった.このため,脳における情報処理のしくみを理解するうえで重要な神経回路の入力と出力の関係はほとんど未解明であった.筆者らは,経路を選択できる操作系とトランスシナプス標識とを組み合わせ,マウスにおいて遺伝学的に特定することの可能な任意のニューロンXについて入力と出力の関係を網羅的に解析できる汎用的な手法としてTRIO法を開発した.このTRIO法を用いることにより運動野第5層の錐体細胞において特異的な情報伝達経路を見い出し,さらに,創薬の標的として重要性の高い青班核ノルアドレナリン系の入力と出力の関係を解析した.TRIO法は複雑な脳において特異的に情報を処理する神経回路の構造を探索するのに有用であり,マウスにおいては脳のほかの領域に適用できるほか,ほかの哺乳類にも拡張が可能である.
はじめに
情報伝達の経路を考える場合,発信源がどこから情報を集めどこに情報を伝えるのか,情報のソース(入力)とターゲット(出力)をセットで理解することが重要である.研究者の日常を例に考えると,われわれはさまざまな情報を集めさまざまな場面において発信するが,その際,ターゲットに応じて適切なソースを選んでいることがわかる.たとえば,学会発表の内容のためには自身の研究や専門誌から情報を得るのに対し,友人どうしの酒席における気楽な話題ならニュースや噂話から情報を得ることが多い.さて,脳のなかで研究の対象となるニューロンXは,さまざまな領域のシナプス前細胞から入力を集め,さまざまな領域のシナプス後細胞へと出力するので,ここで一般的な問題がたてられる.ニューロンXの出力先がひとつあたえられたとき,ニューロンXを介してこの出力先に情報を伝達する入力源を特定できるだろうか? もし可能なら,ニューロンXの出力先を変えたとき,入力源のパターンはどのように変化するだろうか? すなわち,ニューロンXについて入力源と出力先とのあいだにはどのような関係性が成立するのだろうか?
標的となるニューロンの入力と出力の関係を分析する考え方の有用性は,ドーパミンニューロンの研究に学ぶことができる.マウスにおける実験から,腹側被覆野に存在するドーパミンニューロンには,側坐核の外側シェルに出力し報酬情報を伝達するサブタイプと,前頭前皮質に出力し懲罰情報を伝達するサブタイプの少なくとも2種類が存在し,それぞれ脳の異なる領域からの入力をうけることが知られている1).ドーパミンニューロンは薬物依存に深くかかわり,パーキンソン病などの治療の標的でもあるため,異なる入力と出力の関係をもつサブタイプがまったく異なる機能を担うという知見は,より効果的な治療戦略や副作用の少ない創薬標的の存在を示唆するものである.しかし,多数あるドーパミンニューロンの出力先について網羅的に入力源を解析するためにはスループットおよび分解能の高い手法が必要とされていた.また,ほかの神経修飾系や機能的に重要なニューロンの入力と出力の関係についても,一般的に解析できる汎用的な手法が望まれていた.筆者らは,この要請にこたえるべく,狂犬病ウイルスの変異体2) を用いたトランスシナプス標識法3,4) を拡張し,入力源→ニューロンX→出力先という3段階の情報伝達経路を分析できる汎用的な手法としてTRIO(tracing the relationship between input and output)法を開発した.
1.TRIO法およびcTRIO法の原理
狂犬病ウイルスによるトランスシナプス標識法3) は,シナプスをこえて逆行性に感染する狂犬病ウイルスを遺伝子工学的に制御することにより,標的となるニューロンXから1段階だけ上流のシナプス前細胞を標識する手法である.この方法は,変異型の狂犬病ウイルスの取り込みに必要なTVA受容体と,変異型の狂犬病ウイルスの相補に必要な糖タンパク質RGとを同時に発現させた出発細胞を起点として,その1段階だけ上流のシナプス前細胞を脳のすべての領域において標識できる.現在の標準的な手法では,組換え酵素Creを発現するトランスジェニックマウスにCreに依存型のアデノ随伴ウイルスを感染させることにより,脳の領域およびニューロンの種類を限定して出発細胞を作製する4)(図1a).筆者らは,入力源→ニューロンX→出力先という3段階の接続を可視化するためには,出力先を指定して出発細胞を作製することが必要だと考えた.そこで,軸索の末端から効率よく感染し細胞体にCreを発現させるようなベクターを探索したところ,イヌ科アデノウイルス2型5) を用いることにより経路を選択して効率よく出発細胞を作製できることがわかった.TRIO法は,Creをコードするイヌ科アデノウイルス2型ベクターを注入した箇所に出力するニューロンにおいてCreを発現させることにより,その1段階だけ上流のシナプス前細胞を可視化する(図1b).注入の箇所を体系的に変えることにより出発細胞の入力と出力の関係を解析できる.このように,TRIO法は3種類のウイルスを効果的に利用し,3段階の領域あるいはニューロンのあいだに成立する接続の関係を可視化する手法である.
TRIO法では出発細胞の存在する領域に遺伝学的に区別の可能なニューロンが混在していて,いずれも同じ領域に出力を送っている場合,出発細胞となるニューロンの種類を限定することができない.たとえば,腹側被蓋野にはドーパミンニューロンのほかにも多数のGABAニューロンが存在し,長距離の軸索投射をしていることが知られていた.TRIO法をドーパミンニューロンに限定するにはどうしたらよいだろう? 筆者らは,Creトランスジェニックマウスと投射経路の選択系の共集合(ANDゲート)をとることによりこの問題を解決した.このcTRIO(cell type specific TRIO)法は,標的となる領域の特定のニューロンにおいてCreを発現するトランスジェニックマウスを用い,出力先を指定するのにCreに依存型のFlpをコードするイヌ科アデノウイルス2型ベクターを導入する(図1c).FlpはCreと同様の組換え酵素で,出発細胞を作製するためにFlpに依存型のアデノ随伴ウイルスを用いることを可能にする.
以上をまとめると,TRIO法は特別な遺伝子改変動物を要求しないのでマウスのほかにもさまざまな哺乳類の神経回路における入力と出力の関係を分析できるが,標的となる領域のニューロンに存在する遺伝学的な多様性を分離できない.cTRIO法はCreトランスジェニック動物を要求するが,遺伝学的に特定のタイプのニューロンの入力と出力の関係を限定的に分析することができる.
2.マウスの運動野第5層にみつかった特異的な情報伝達経路
TRIO法の原理の証明として,運動の計画と実行を担う大脳の運動野を解析した.運動野の出力として,第5層の錐体細胞が延髄をへる脊髄路と,対側の運動野や同側の体性感覚野に投射する皮質内路が存在する.TRIO法により対側の運動野へ出力を送るニューロンを解析したところ,出発細胞は第2層から第6層まで幅広く分布していた.そこで,第5層の錐体細胞の大部分にCreを限局的に発現するCreトランスジェニックマウス6) を用いて,cTRIO法により第5層に限局的に脊髄路と皮質内路を形成するニューロンを解析した.その結果,脊髄路に出力する運動野の第5層の錐体細胞は視床からの入力を有意に多くうけとっていたのに対し,皮質内路に出力する第5層の錐体細胞は体性感覚野などの皮質内の入力を多くうけとることが明らかにされた(図2a).この結果から,運動野第5層のなかに出力先に応じて異なる入力を集める少なくとも2種類のサブタイプが存在し,視床からの入力は脊髄路に直接的な影響を強くあたえるよう特別に配線されていることが示された.また,技術的な面に目をむけると,cTRIO法によりCreを発現する遺伝学的に限局したニューロンに対しTRIO法による解析を適用できることが実証された.また,別の実験においては,TRIO法がマウスのほかの哺乳類に拡張が可能であることの証左として,TRIO法をラットの運動野に適用し,線条体路と皮質内路を形成するニューロンの入力を可視化できることも示された.
3.ノルアドレナリンニューロンへの入力パターンは出力先によらず類似している
ノルアドレナリンはドーパミンやセロトニンとともにモノアミン神経修飾系を構成する神経伝達物質で,睡眠,覚醒,注意,気分など脳の状態を制御するのに重要な役割をはたす.脳のほぼすべてのノルアドレナリンは脳幹の青班核を起始核とするノルアドレナリンニューロンによりもたらされる.非常に広範な出力先があるにもかかわらず,脳の特定の領域に出力するノルアドレナリンニューロンのサブタイプが存在するのか,そして,出力先に応じて入力源は異なるのか,という基本的な構造についてすら,現在まで,研究者のあいだで意見の一致をみていない7).そこで,TRIO法を適用する準備のため,ノルアドレナリンニューロンに入力を送るシナプス前細胞を脳のすべての領域において可視化した.その結果,111の領域から入力が認められ,古典的な軸索のトレース実験により示唆されていた多くの領域が実際にノルアドレナリンニューロンに直接性の入力を送っていることが明らかにされた.さらに,小脳のプルキンエ細胞など,これまで知られていなかった新たなノルアドレナリンニューロンのシナプス前細胞が見い出された.
ノルアドレナリンニューロンの広範な出力先のなかから嗅球,大脳の聴覚野,海馬,小脳,延髄という相互に遠く離れた5か所を選び,TRIO法(出発細胞がノルアドレナリンニューロンに限局しないケースにおいては,ノルアドレナリンニューロンに特異的なCreトランスジェニックマウスマウスを用いたcTRIO法)により解析し,さきに得たノルアドレナリンニューロンの全体に対する入力と定量的に比較した.その結果,まったく異なる5か所の出力先から選んだノルアドレナリンニューロンは,いっけんするとほとんど区別のつかないパターンで入力を集めていることが明らかにされた(図2b).しかし,統計的に分析するとノルアドレナリンニューロンの入力と出力の関係は完全に均質なわけではなく,たとえば,延髄に出力するノルアドレナリンニューロンは扁桃体からの入力が有意に少ないといった局所的な傾向が認められた.扁桃体からノルアドレナリンニューロンへの入力はストレス応答にかかわるとされるが,延髄はこの経路から選択的に外れているのかもしれない.
4.ノルアドレナリンニューロンは多くの出力先に分散的に投射する
ノルアドレナリンニューロンが全体として入力と出力の関係に強い特異性をもたないという結果は,個々のニューロンのレベルでみるとどのような構造により成り立つのだろうか? 個々のノルアドレナリンニューロンは,特定の入力源から選択的に情報を集める,多くの入力源からの情報を統合する,特異的な出力先を専門に担当する,多くの出力先に分散的に情報を送る,と,入力と出力の特異性の組合せにより4通りのモデルが考えられる.このうち,入力と出力がともに特異的であるケース(専用回線モデル)はさきの結果とは合致しないため,残りの3通りを考えた.1)入力に関して統合的だが出力は専門化している,2)入力は選択的だが出力は分散的である,3)入力および出力とも特異性なく統合的かつ分散的である,の3通りである(図2c).
出力の構造の特異性を検討するため,出力先をひとつ選んでその領域に投射するノルアドレナリンニューロンがほかのどの領域に軸索を伸長するのかを解析した.この目的のためには,TRIO法あるいはcTRIO法の戦略をそのまま活用し,狂犬病ウイルスによる標識の代わりに蛍光タンパク質mCherryにより標識される出発細胞の軸索を抗mCherry抗体により検出すればよい.嗅球,聴覚野,海馬,延髄という遠く離れた出力先を指定してノルアドレナリンニューロンを標識したところ,すべてのケースについて指定先を含めた8か所の領域すべてに相当量の軸索の側枝が認められた.つまり,ノルアドレナリンニューロンの出力は多くの領域を一手に担当する分散的な要素が強いといえた.個々のノルアドレナリンニューロンに対する入力の選択性については,出発細胞の数が非常に少なかったケースが参考になった.コンピューターシミュレーションによると,観察されたデータを説明するには個々のノルアドレナリンニューロンは少なくとも9以上の異なる領域から情報を統合しなくてはならなかった.したがって,入力に高い選択性をもつケースは一般的ではなく,入力に関しても特異性の低いモデルがノルアドレナリンニューロンの入力および出力の構造を近似的によく説明すると考えられた(図2c).
以上をまとめると,この解析により,ノルアドレナリンニューロンの脳のすべての領域にわたる入力をはじめて網羅的に同定し,ノルアドレナリンニューロンが広範な出力先にもかかわらずおおむね類似した入力パターンをうけることが示された.その背景として,個々のノルアドレナリンニューロンが基本的には多くの入力源からの情報を統合し,多くの出力先に情報を分配する素子としてふるまうことが指摘された.この構造は,ノルアドレナリンニューロンが睡眠と覚醒のサイクルといった脳のすべての領域の状態制御にかかわるという知見に親和するものであった.しかし,全体としては統合的かつ分散的でありながら,統計的に分析すると局所的にいくつかの特筆すべき特異性のみられたことも事実であった.ノルアドレナリンニューロンがこれらの特異性を利用して特定の標的だけを選択的に制御しているのかという問題については将来の研究が必要である.
おわりに
TRIO法は2011年に狂犬病ウイルスによるトランスシナプス標識法3) の拡張版として開発をはじめ,2012年の前半には原理証明が得られていたが,そののち,狂犬病ウイルスによるトランスシナプス標識系の改良8) やCreをコードするイヌ科アデノウイルス2型ベクターを用いた経路を選択できる操作系が受け入れられてきた状況をうけて改善を重ねた.とくにcTRIO法,すなわち,Creトランスジェニックマウスとイヌ科アデノウイルス2型ベクターによる経路の選択系とのANDゲートの構築は難航し,相当数のウイルスを永久凍結の刑に処した.最終的に確立された手法は汎用性が高く,神経回路の入力と出力の構造を調べるほかにも,指定先に出力する特定のタイプのニューロンの活動を記録したり操作したりするのにも利用できると考えられる.また,マウスのほかラットにおいてもTRIO法が成立したことから,今後は,マーモセットなどほかの哺乳類への応用も視野に入るだろう.
最初に述べたように,出力先にもとづいて入力を分析するというアイデアの原型はドーパミンニューロンのサブタイプに関する知見に由来している.今回,解析したノルアドレナリンニューロンは,(残念ながら)入力と出力の関係に高い特異性を示すことがなかったが,それでは,TRIO法あるいはcTRIO法を用いることによりドーパミンニューロンのサブタイプを高分解能で網羅的に分析できるのだろうか? 答えはもちろんYESだが,これは米国Stanford大学の元同僚たちが鋭意取り組んでいるトピックなので,筆者からは乞うご期待とだけ申し上げたい.今後は,ドーパミンニューロンを含め広範に出力するさまざまな機能的に重要なニューロンの特異的な出力を担うサブタイプの同定とその入力や機能の解析を進めることにより,脳において情報が適切に分配されて下流に伝達されるしくみの理解が進むのみならず,効果の高く副作用の少ない神経疾患の創薬標的に関する基礎的な知見が蓄積することを期待したい.
文 献
- Lammel, S., Lim, B. K., Ran, C. et al.: Input-specific control of reward and aversion in the ventral tegmental area. Nature, 491, 212-217 (2012)[PubMed]
- Wickersham, I. R., Lyon, D. C., Barnard, R. J. et al.: Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron, 53, 639-647 (2007)[PubMed]
- Miyamichi, K., Amat, F., Moussavi, F. et al.: Cortical representations of olfactory input by trans-synaptic tracing. Nature, 472, 191-196 (2011)[PubMed] [新着論文レビュー]
- Weissbourd, B., Ren, J., DeLoach, K. E. et al.: Presynaptic partners of dorsal raphe serotonergic and GABAergic neurons. Neuron, 83, 645-662 (2014)[PubMed]
- Soudais, C., Laplace-Builhe, C., Kissa, K. et al.: Preferential transduction of neurons by canine adenovirus vectors and their efficient retrograde transport in vivo. FASEB J., 15, 2283-2285 (2001)[PubMed]
- Gerfen, C. R., Paletzki, R. & Heintz, N.: GENSAT BAC cre-recombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron, 80, 1368-1383 (2013)[PubMed]
- Chandler, D. J., Gao, W. J. & Waterhouse, B. D.: Heterogeneous organization of the locus coeruleus projections to prefrontal and motor cortices. Proc. Natl. Acad. Sci. USA, 111, 6816-6821 (2014)[PubMed]
- Miyamichi, K., Shlomai-Fuchs, Y., Shu, M. et al.: Dissecting local circuits: parvalbumin interneurons underlie broad feedback control of olfactory bulb output. Neuron, 80, 1232-1245 (2013)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科修了,同年 米国Stanford大学 博士研究員を経て,2013年より東京大学大学院農学生命科学研究科 特任准教授.
研究テーマ:高次の脳神経回路の構造および機能.
抱負:留学から帰国して約2年,ようやく米国での研究をおおむね収穫することができました.つぎは,現在,日本で蒔いている種から世界に届く研究を発信していきたい.
© 2015 宮道 和成 Licensed under CC 表示 2.1 日本