哺乳類の卵母細胞では微小管と動原体との接続が不安定化されやすい
吉田周平・北島智也
(理化学研究所多細胞システム形成研究センター 染色体分配研究チーム)
email:吉田周平
DOI: 10.7875/first.author.2015.077
Inherent instability of correct kinetochore-microtubule attachments during meiosis I in oocytes.
Shuhei Yoshida, Masako Kaido, Tomoya S. Kitajima
Developmental Cell, 33, 589-602 (2015)
染色体が娘細胞に正しく分配されるには微小管が正しく動原体に接続される必要がある.体細胞分裂において微小管は正しく動原体に接続し,動原体が両側へ引っ張られるとすぐにその接続は安定化されると考えられてきた.しかしながら,染色体分配のあやまりの起こりやすい卵母細胞において,微小管がどのように動原体に接続しているかについては明らかにされていなかった.筆者らは,マウスの卵母細胞の減数第1分裂において,正しい微小管と動原体との接続は不安定化されやすいことを見い出した.Aurora BおよびAurora Cが動原体の近傍に残存するため微小管と動原体との接続はすぐには安定化されず,さらに,Aurora BおよびAurora Cの高い活性が微小管と動原体との正しい接続を不安定化するだけでなく,あやまった接続の形成を増加させていた.そして,動原体が引っ張られたのち,PP2A-B56がAurora BおよびAurora Cと拮抗し微小管と動原体との接続を安定化していた.これらの知見から,卵母細胞の減数第1分裂においては微小管と動原体との接続が不安定化されやすく,この接続は体細胞分裂とは異なる機構により安定化されることが示された.このことは,卵母細胞の減数第1分裂において微小管と動原体との接続にあやまりの多い原因のひとつであると考えられた.
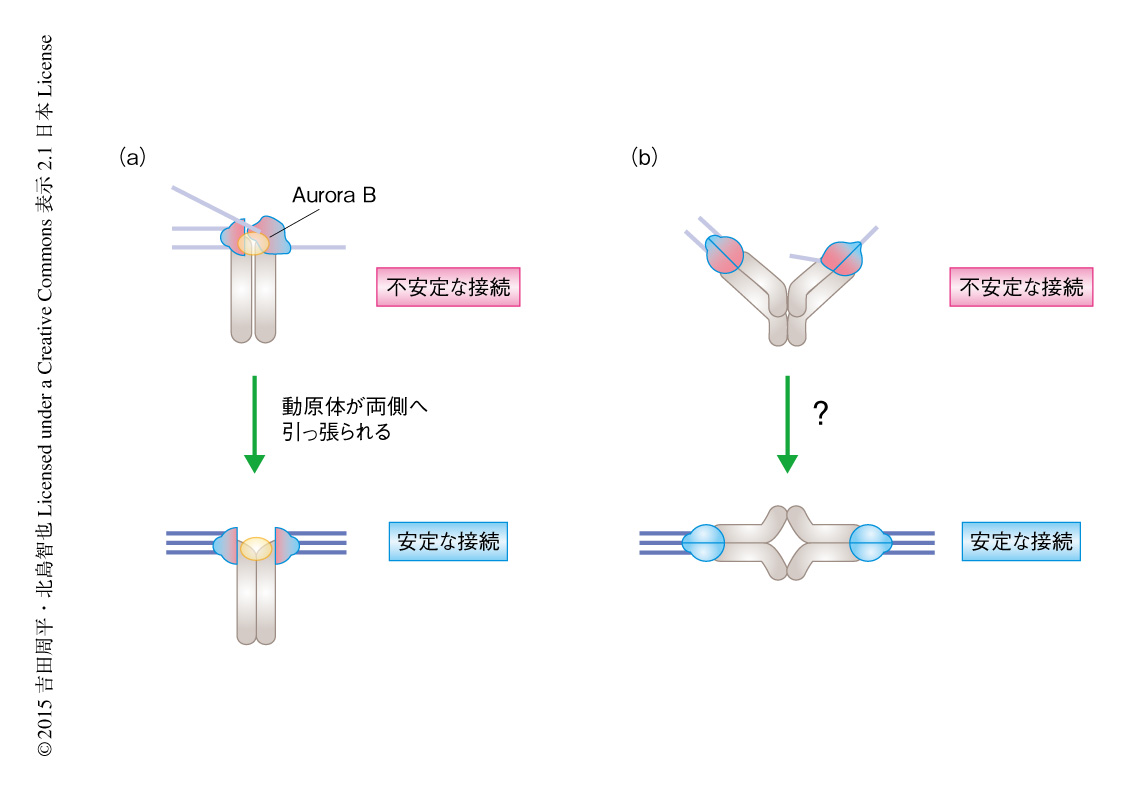
細胞分裂において染色体は娘細胞に正しく分配される必要がある.染色体は動原体に微小管を接続し両側へと引っ張ることにより分配されるため,微小管と動原体とが正しく接続され,その接続が安定化されることが正しい染色体分配に必須である.体細胞分裂では姉妹染色分体の姉妹動原体が微小管により両側へと引っ張られることにより姉妹染色分体は分配される.このとき,姉妹動原体は正しい微小管と動原体との接続により両側へと引っ張られることにより,微小管と動原体との接続を不安定化させるAurora Bキナーゼから空間的に離れ,微小管と動原体との接続は安定化されると考えられている.一方,減数第1分裂では姉妹染色分体が対になった相同染色体が分配される.そのため,姉妹動原体は同じ方向へ,相同染色体の相同動原体は両側へと引っ張られる.哺乳類の卵母細胞の減数第1分裂において,微小管と動原体との接続がどのように安定化されるかについては明らかにされていなかった(図1).
体細胞分裂においては微小管に動原体が引っ張られることと微小管と動原体との接続が安定化されることは共役していると考えられているが1),減数第1分裂においてはその点は明らかではなかった.そこで,卵母細胞の減数第1分裂において動原体が引っ張られる時期および微小管と動原体との接続が安定化される時期について解析した.その結果,動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とは異なり,動原体が引っ張られる時期のあとに,微小管と動原体との接続は安定化されることが明らかにされた.
では,なぜ卵母細胞の減数第1分裂においては動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とが異なるのだろうか.卵母細胞ではAurora BにくわえAurora Cが動原体タンパク質をリン酸化し,微小管と動原体との接続を不安定化させている2).体細胞分裂とは異なり,卵母細胞の減数第1分裂においては動原体が両側に引っ張られていてもAurora BおよびAurora Cが空間的に離れていないのではないかと考え,その局在について解析した.その結果,相同染色体が分配される減数第1分裂においてはAurora BおよびAurora Cは動原体の近傍に残存し,動原体が引っ張られていても動原体タンパク質は高いレベルでリン酸化されたままであることが明らかにされた.この結果は,姉妹染色分体が分配される減数第2分裂においては,動原体が引っ張られたときAurora BおよびAurora Cが動原体から遠く離れていたこととは対照的であった.減数第1分裂を起こしている卵母細胞と減数第2分裂を起こしている卵母細胞とを細胞融合した状態においても同様の結果が得られたことから,これらの性質は減数第1分裂の過程にある染色体が内的にもつ特徴であると考えられた.
では,卵母細胞においてはどのように微小管と動原体との接続は安定化されるのだろうか.Aurora BおよびAurora Cによる動原体タンパク質のリン酸化について解析した結果,卵母細胞の減数第1分裂においては動原体が引っ張られる時期のあと,Aurora BおよびAurora Cによる動原体タンパク質のリン酸化のレベルは低下すること,そして,Aurora BおよびAurora Cに拮抗するホスファターゼPP2A-B56が減数第1分裂の進行にともない動原体にリクルートされることが明らかにされた.体細胞分裂とは異なり,卵母細胞の減数第1分裂においてはその進行にともないCdk1の活性が上昇し3),Cdk1に依存的に微小管と動原体との接続が安定化される4).そして,PP2A-B56はBubR1がCdk1に依存的にリン酸化されることにより動原体にリクルートされる5).卵母細胞の減数第1分裂においてはその進行にともないCdk1によるBubR1のリン酸化が増加すること,また,リン酸化を模倣したBubR1変異体を過剰に発現させると動原体の近傍のPP2A-B56の量が増加して微小管と動原体との接続が安定化され,逆に,脱リン酸化を模倣したBubR1変異体を過剰に発現させると動原体の近傍のPP2A-B56の量が減少して微小管と動原体との接続が不安定化されたことから,Cdk1に依存的なBubR1のリン酸化が動原体の近傍のPP2A-B56の量を決定し,微小管と動原体との接続の安定化を制御していることが明らかにされた.
動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とが異なる卵母細胞の機構は,卵母細胞において有利に機能しているのだろうか.卵母細胞の減数第1分裂においては微小管と動原体との接続にあやまりが多い6).この卵母細胞に特異的な機構があやまった接続の増加する原因ではないかと考え,動原体が引っ張られる時期においてAurora BおよびAurora Cの活性を阻害することにより,動原体が引っ張られると同時に微小管と動原体との接続を安定化させた.その結果,正しい微小管と動原体との接続だけが選択的に安定化され,あやまった接続は減少した.これらの結果から,卵母細胞の減数第1分裂においては正しい接続が不安定化され,あやまった接続が形成されやすくなっていると考えられた.
微小管と動原体との接続を安定化される機構については,体細胞分裂においては接続を不安定化するAurora Bが空間的に制御されているというモデルが広く受け入れられており,減数第1分裂においても同様の空間的な制御のモデルが提唱されてきた.今回の研究により,卵母細胞の減数第1分裂においては空間的な制御のモデルは機能しておらず,動原体が引っ張られていても動原体の近傍に残存するAurora BおよびAurora Cの活性により微小管と動原体との接続が不安定されること,動原体が引っ張られることとは独立した細胞周期による制御によりPP2A-B56が動原体の近傍にリクルートされ微小管と動原体との接続を安定化させていることが明らかにされた(図2).
さらに,この卵母細胞に特異的な機構が,卵母細胞においてあやまった微小管と動原体との接続の多い原因のひとつであると考えられた.では,なぜ哺乳動物の卵母細胞はこのような機構を採用しているのだろうか.哺乳動物の卵母細胞は体細胞とは異なり中心体をもたず,マウスの卵母細胞では多く存在する微小管重合中心が寄り集まって2極性の紡錘体を形成する7).しかしながら,減数第1分裂の開始の直後には微小管重合中心はランダムに分布しており,それから徐々に紡錘体の両極へと分布していくため,早期に形成された微小管と動原体との接続は潜在的にあやまった接続になる可能性がある.Aurora BおよびAurora Cはこれら早期の潜在的なあやまった接続の安定化をさまたげていることが考えられる.一方で,動原体の近傍に残存するAurora BおよびAurora Cは紡錘体の極が定まったのちも微小管と動原体との接続を不安定化し,その結果,動原体が引っ張られる時期においてあやまった接続を増加させる.しかしながら,正常な卵母細胞においてはこれらのあやまった接続は染色体分配までに修正される6).近年,微小管と動原体とのあいだにかかる張力に依存した微小管と動原体との接続の安定化が注目されており8),卵母細胞においてはAurora BおよびAurora Cの空間的な制御よりも,張力に依存的な微小管と動原体との接続の修正が重要であると考えられている.哺乳動物の卵母細胞においては加齢にともない染色体分配のあやまりの頻度が上昇し9),微小管と動原体との接続が弱まるため10),卵母細胞は加齢にともない微小管と動原体との接続のあやまりを修正できなくなっている可能性が考えられる.今後のさらなる研究により,哺乳動物の卵母細胞において高い頻度で起こる染色体分配のあやまりの主要な原因が明らかにされることが期待される.
略歴:2006年 大阪市立大学大学院理学研究科にて博士号取得,大阪市立大学大学院医学研究科 助教を経て,2012年より理化学研究所発生・再生科学総合研究センター(現 同 多細胞システム形成研究センター)研究員.
研究テーマ:哺乳動物の卵母細胞における染色体分配の機構.
関心事:なぜ卵母細胞においては染色体分配のあやまりが高い頻度で起こるのか.
北島 智也(Tomoya S. Kitajima)
理化学研究所多細胞システム形成研究センター チームリーダー.
研究室URL:http://www.cdb.riken.jp/lcs/
© 2015 吉田周平・北島智也 Licensed under CC 表示 2.1 日本
(理化学研究所多細胞システム形成研究センター 染色体分配研究チーム)
email:吉田周平
DOI: 10.7875/first.author.2015.077
Inherent instability of correct kinetochore-microtubule attachments during meiosis I in oocytes.
Shuhei Yoshida, Masako Kaido, Tomoya S. Kitajima
Developmental Cell, 33, 589-602 (2015)
要 約
染色体が娘細胞に正しく分配されるには微小管が正しく動原体に接続される必要がある.体細胞分裂において微小管は正しく動原体に接続し,動原体が両側へ引っ張られるとすぐにその接続は安定化されると考えられてきた.しかしながら,染色体分配のあやまりの起こりやすい卵母細胞において,微小管がどのように動原体に接続しているかについては明らかにされていなかった.筆者らは,マウスの卵母細胞の減数第1分裂において,正しい微小管と動原体との接続は不安定化されやすいことを見い出した.Aurora BおよびAurora Cが動原体の近傍に残存するため微小管と動原体との接続はすぐには安定化されず,さらに,Aurora BおよびAurora Cの高い活性が微小管と動原体との正しい接続を不安定化するだけでなく,あやまった接続の形成を増加させていた.そして,動原体が引っ張られたのち,PP2A-B56がAurora BおよびAurora Cと拮抗し微小管と動原体との接続を安定化していた.これらの知見から,卵母細胞の減数第1分裂においては微小管と動原体との接続が不安定化されやすく,この接続は体細胞分裂とは異なる機構により安定化されることが示された.このことは,卵母細胞の減数第1分裂において微小管と動原体との接続にあやまりの多い原因のひとつであると考えられた.
はじめに
細胞分裂において染色体は娘細胞に正しく分配される必要がある.染色体は動原体に微小管を接続し両側へと引っ張ることにより分配されるため,微小管と動原体とが正しく接続され,その接続が安定化されることが正しい染色体分配に必須である.体細胞分裂では姉妹染色分体の姉妹動原体が微小管により両側へと引っ張られることにより姉妹染色分体は分配される.このとき,姉妹動原体は正しい微小管と動原体との接続により両側へと引っ張られることにより,微小管と動原体との接続を不安定化させるAurora Bキナーゼから空間的に離れ,微小管と動原体との接続は安定化されると考えられている.一方,減数第1分裂では姉妹染色分体が対になった相同染色体が分配される.そのため,姉妹動原体は同じ方向へ,相同染色体の相同動原体は両側へと引っ張られる.哺乳類の卵母細胞の減数第1分裂において,微小管と動原体との接続がどのように安定化されるかについては明らかにされていなかった(図1).
1.卵母細胞の減数第1分裂においては動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とは異なる
体細胞分裂においては微小管に動原体が引っ張られることと微小管と動原体との接続が安定化されることは共役していると考えられているが1),減数第1分裂においてはその点は明らかではなかった.そこで,卵母細胞の減数第1分裂において動原体が引っ張られる時期および微小管と動原体との接続が安定化される時期について解析した.その結果,動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とは異なり,動原体が引っ張られる時期のあとに,微小管と動原体との接続は安定化されることが明らかにされた.
2.卵母細胞の減数第1分裂においてはAurora BおよびAurora Cが動原体の近傍に残存し微小管と動原体との接続を不安定化させる
では,なぜ卵母細胞の減数第1分裂においては動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とが異なるのだろうか.卵母細胞ではAurora BにくわえAurora Cが動原体タンパク質をリン酸化し,微小管と動原体との接続を不安定化させている2).体細胞分裂とは異なり,卵母細胞の減数第1分裂においては動原体が両側に引っ張られていてもAurora BおよびAurora Cが空間的に離れていないのではないかと考え,その局在について解析した.その結果,相同染色体が分配される減数第1分裂においてはAurora BおよびAurora Cは動原体の近傍に残存し,動原体が引っ張られていても動原体タンパク質は高いレベルでリン酸化されたままであることが明らかにされた.この結果は,姉妹染色分体が分配される減数第2分裂においては,動原体が引っ張られたときAurora BおよびAurora Cが動原体から遠く離れていたこととは対照的であった.減数第1分裂を起こしている卵母細胞と減数第2分裂を起こしている卵母細胞とを細胞融合した状態においても同様の結果が得られたことから,これらの性質は減数第1分裂の過程にある染色体が内的にもつ特徴であると考えられた.
3.動原体にリクルートされたPP2A-B56がAurora BおよびAurora Cと拮抗することにより微小管と動原体との接続は安定化される
では,卵母細胞においてはどのように微小管と動原体との接続は安定化されるのだろうか.Aurora BおよびAurora Cによる動原体タンパク質のリン酸化について解析した結果,卵母細胞の減数第1分裂においては動原体が引っ張られる時期のあと,Aurora BおよびAurora Cによる動原体タンパク質のリン酸化のレベルは低下すること,そして,Aurora BおよびAurora Cに拮抗するホスファターゼPP2A-B56が減数第1分裂の進行にともない動原体にリクルートされることが明らかにされた.体細胞分裂とは異なり,卵母細胞の減数第1分裂においてはその進行にともないCdk1の活性が上昇し3),Cdk1に依存的に微小管と動原体との接続が安定化される4).そして,PP2A-B56はBubR1がCdk1に依存的にリン酸化されることにより動原体にリクルートされる5).卵母細胞の減数第1分裂においてはその進行にともないCdk1によるBubR1のリン酸化が増加すること,また,リン酸化を模倣したBubR1変異体を過剰に発現させると動原体の近傍のPP2A-B56の量が増加して微小管と動原体との接続が安定化され,逆に,脱リン酸化を模倣したBubR1変異体を過剰に発現させると動原体の近傍のPP2A-B56の量が減少して微小管と動原体との接続が不安定化されたことから,Cdk1に依存的なBubR1のリン酸化が動原体の近傍のPP2A-B56の量を決定し,微小管と動原体との接続の安定化を制御していることが明らかにされた.
4.卵母細胞における微小管と動原体との接続を安定化する機構は正しい微小管と動原体との接続を不安定化しあやまった接続を増加させる
動原体が引っ張られる時期と微小管と動原体との接続が安定化される時期とが異なる卵母細胞の機構は,卵母細胞において有利に機能しているのだろうか.卵母細胞の減数第1分裂においては微小管と動原体との接続にあやまりが多い6).この卵母細胞に特異的な機構があやまった接続の増加する原因ではないかと考え,動原体が引っ張られる時期においてAurora BおよびAurora Cの活性を阻害することにより,動原体が引っ張られると同時に微小管と動原体との接続を安定化させた.その結果,正しい微小管と動原体との接続だけが選択的に安定化され,あやまった接続は減少した.これらの結果から,卵母細胞の減数第1分裂においては正しい接続が不安定化され,あやまった接続が形成されやすくなっていると考えられた.
おわりに
微小管と動原体との接続を安定化される機構については,体細胞分裂においては接続を不安定化するAurora Bが空間的に制御されているというモデルが広く受け入れられており,減数第1分裂においても同様の空間的な制御のモデルが提唱されてきた.今回の研究により,卵母細胞の減数第1分裂においては空間的な制御のモデルは機能しておらず,動原体が引っ張られていても動原体の近傍に残存するAurora BおよびAurora Cの活性により微小管と動原体との接続が不安定されること,動原体が引っ張られることとは独立した細胞周期による制御によりPP2A-B56が動原体の近傍にリクルートされ微小管と動原体との接続を安定化させていることが明らかにされた(図2).
さらに,この卵母細胞に特異的な機構が,卵母細胞においてあやまった微小管と動原体との接続の多い原因のひとつであると考えられた.では,なぜ哺乳動物の卵母細胞はこのような機構を採用しているのだろうか.哺乳動物の卵母細胞は体細胞とは異なり中心体をもたず,マウスの卵母細胞では多く存在する微小管重合中心が寄り集まって2極性の紡錘体を形成する7).しかしながら,減数第1分裂の開始の直後には微小管重合中心はランダムに分布しており,それから徐々に紡錘体の両極へと分布していくため,早期に形成された微小管と動原体との接続は潜在的にあやまった接続になる可能性がある.Aurora BおよびAurora Cはこれら早期の潜在的なあやまった接続の安定化をさまたげていることが考えられる.一方で,動原体の近傍に残存するAurora BおよびAurora Cは紡錘体の極が定まったのちも微小管と動原体との接続を不安定化し,その結果,動原体が引っ張られる時期においてあやまった接続を増加させる.しかしながら,正常な卵母細胞においてはこれらのあやまった接続は染色体分配までに修正される6).近年,微小管と動原体とのあいだにかかる張力に依存した微小管と動原体との接続の安定化が注目されており8),卵母細胞においてはAurora BおよびAurora Cの空間的な制御よりも,張力に依存的な微小管と動原体との接続の修正が重要であると考えられている.哺乳動物の卵母細胞においては加齢にともない染色体分配のあやまりの頻度が上昇し9),微小管と動原体との接続が弱まるため10),卵母細胞は加齢にともない微小管と動原体との接続のあやまりを修正できなくなっている可能性が考えられる.今後のさらなる研究により,哺乳動物の卵母細胞において高い頻度で起こる染色体分配のあやまりの主要な原因が明らかにされることが期待される.
文 献
- Foley, E. A. & Kapoor, T. M.: Microtubule attachment and spindle assembly checkpoint signalling at the kinetochore. Nat. Rev. Mol. Cell Biol., 14, 25-37 (2013)[PubMed]
- Balboula, A. Z. & Schindler, K.: Selective disruption of aurora C kinase reveals distinct functions from aurora B kinase during meiosis in mouse oocytes. PLoS Genet., 10, e1004194 (2014)[PubMed]
- Choi, T., Aoki, F., Mori, M. et al.: Activation of p34cdc2 protein kinase activity in meiotic and mitotic cell cycles in mouse oocytes and embryos. Development, 113, 789-795 (1991)[PubMed]
- Davydenko, O., Schultz, R. M. & Lampson, M. A.: Increased CDK1 activity determines the timing of kinetochore-microtubule attachments in meiosis I. J. Cell Biol., 202, 221-229 (2013)[PubMed]
- Huang, H., Hittle, J., Zappacosta, F. et al.: Phosphorylation sites in BubR1 that regulate kinetochore attachment, tension, and mitotic exit. J. Cell Biol., 183, 667-680 (2008)[PubMed]
- Kitajima, T. S., Ohsugi, M. & Ellenberg, J.: Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes. Cell, 146, 568-581 (2011)[PubMed] [新着論文レビュー]
- Schuh, M. & Ellenberg, J.: Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell, 130, 484-498 (2007)[PubMed]
- Akiyoshi, B., Sarangapani, K. K., Powers, A. F. et al.: Tension directly stabilizes reconstituted kinetochore-microtubule attachments. Nature, 468, 576-579 (2010)[PubMed] [新着論文レビュー]
- Nagaoka, S. I., Hassold, T. J. & Hunt, P. A.: Human aneuploidy: mechanisms and new insights into an age-old problem. Nat. Rev. Genet., 13, 493-504 (2012)[PubMed]
- Shomper, M., Lappa, C. & FitzHarris, G.: Kinetochore microtubule establishment is defective in oocytes from aged mice. Cell Cycle, 13, 1171-1179 (2014)[PubMed]
著者プロフィール
略歴:2006年 大阪市立大学大学院理学研究科にて博士号取得,大阪市立大学大学院医学研究科 助教を経て,2012年より理化学研究所発生・再生科学総合研究センター(現 同 多細胞システム形成研究センター)研究員.
研究テーマ:哺乳動物の卵母細胞における染色体分配の機構.
関心事:なぜ卵母細胞においては染色体分配のあやまりが高い頻度で起こるのか.
北島 智也(Tomoya S. Kitajima)
理化学研究所多細胞システム形成研究センター チームリーダー.
研究室URL:http://www.cdb.riken.jp/lcs/
© 2015 吉田周平・北島智也 Licensed under CC 表示 2.1 日本