精製した動原体を用いた動原体とスピンドル微小管との結合の再構成
秋吉 文悟
(米国Washington大学Molecular and Cellular Biology Program)
email:秋吉文悟
DOI: 10.7875/first.author.2010.066
Tension directly stabilizes reconstituted kinetochore-microtubule attachments.
Bungo Akiyoshi, Krishna K. Sarangapani, Andrew F. Powers, Christian R. Nelson, Steve L. Reichow, Hugo Arellano-Santoyo, Tamir Gonen, Jeffrey A. Ranish, Charles L. Asbury, Sue Biggins
Nature, 468, 576-579 (2010)
動原体はセントロメアDNAに形成される巨大なタンパク質複合体であり,分裂期において染色体とスピンドル微小管とをつなぐ役割をはたす.体細胞分裂において正常な染色体分配が起こるためには複製した姉妹染色体が両極のスピンドル微小管から引っ張られた状態,つまり,2方向性の結合を形成しなければならない.2方向性の結合ができると動原体に張力が発生し微小管との結合は安定する.しかし,張力がどのように結合の安定化に寄与するのかという分子機構を理解するには,動原体と微小管との結合をin vitroで再構成し生化学的また物理的に調べる必要がある.これまで,動原体はどの生物からも精製されたことがなかったが,今回,筆者らは,出芽酵母の動原体を活性のある状態で精製し微小管との結合を再構成することにはじめて成功した.さらに,光ピンセットを用いて張力が結合に及ぼす効果を調べたところ,張力は動原体と微小管との結合を直接的に安定させているという新しい機構を発見した.
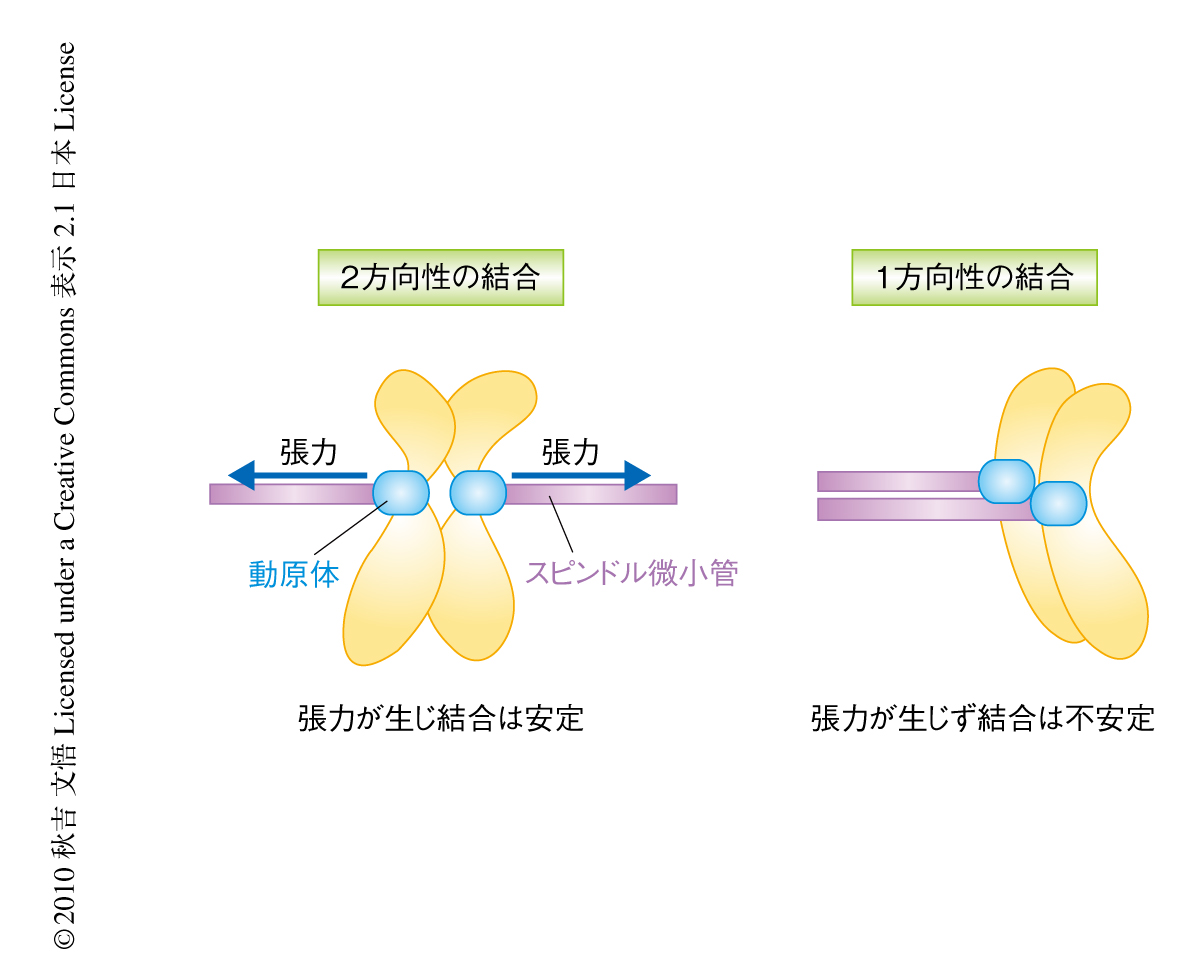
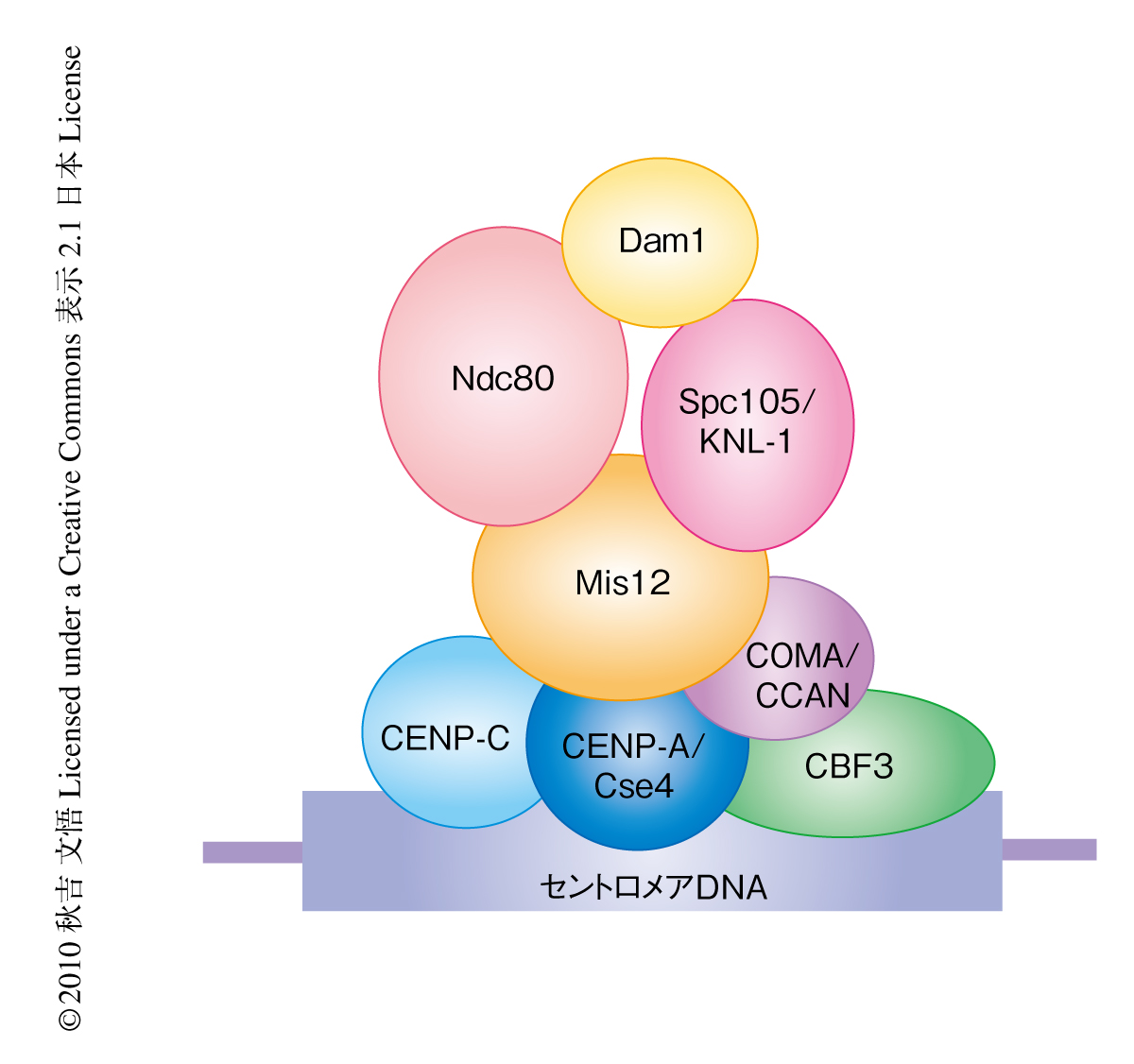
細胞が分裂する際,複製された姉妹染色体は娘細胞に正確に分配されなければならない.染色体分配に問題が起こるとがん化や先天性異常が生じる1).セントロメアDNAに形成される巨大タンパク質複合体である動原体は染色体分配に不可欠な役割をはたす.動原体のもっとも基礎的な役割は,セントロメアDNAに結合すること,スピンドル微小管に結合すること,そして,2方向性の結合を形成し姉妹染色体の1対ずつが娘細胞に均等に分配されるようにすることである(図1).動原体の基本構造は真核生物においてよく保存されていて,約40種類の動原体タンパク質から構成されている2)(図2).これにくわえて,動原体のはたらきを制御するタンパク質がさらに20種類以上も知られており,動原体は非常に複雑な構造をしている.実際,動原体の基本構造だけでも5 MDa以上あると見積もられている3)(リボソームは約3 MDa).
セントロメアに特異的なヒストンH3バリアントであるCENP-A(出芽酵母ではCse4とよばれる)はセントロメアDNAに結合して特異的なクロマチン構造を形成し,ほかの動原体タンパク質のいわば足場づくりのような役割を担う2).微小管はチューブリンサブユニットから構成されるポリマーであり,プラス端とマイナス端において重合と脱重合を起こすことにより伸長と短縮とをダイナミックにくり返す.分裂期において動原体はスピンドル微小管のプラス端に結合する.微小管の結合に必要なタンパク質はNdc80,Spc105/KNL1,Dam1サブ複合体など数多く知られているが(図2),これら個々のタンパク質がどのように微小管に結合するのか,また,動原体という複合体のなかでいかに協調的に結合に寄与するのかという分子機構はまだほとんどわかっていない.さらに,正常な染色体分配のためには正しい結合様式である2方向性の結合を安定化させる一方,間違った結合は不安定化され直されなければならない(図1).2方向性の結合の形成に必要なタンパク質のひとつとしてキナーゼであるAurora Bが知られている4).2つの動原体が同じ極からのスピンドル微小管に結合された状態である1方向性の結合が形成してしまって動原体に十分な張力がかからない場合には,微小管結合タンパク質がAurora Bによってリン酸化されて結合の不安定化を誘導する.これにより間違った結合はリセットされ,次回の結合で2方向性の結合をめざすことになる.2方向性の結合が形成され動原体が両側からスピンドル微小管に引っ張られて張力が生じると,Aurora Bがなんらかの方法で不活性化されて2方向性の結合が安定化し正確な染色体分配が起こるものと考えられている.しかし,張力が生じることで結合がどのように安定化されるのかを理解するには,動原体と微小管との結合をin vitroで再構成し生化学的そして物理的に調べる必要がある.このように,動原体の分子レベルでのはたらきを調べるためには動原体を精製してその基礎的な役割を再構成し分析する必要がある.しかし,これまでさまざまな研究者が動原体の精製を試みたが,その成功は誰もなしえなかった.
先行した研究において,筆者らは,出芽酵母をモデル生物に用いそのミニ染色体を精製することによってセントロメアDNAに形成された動原体を精製することに成功していた5,6).しかし,ミニ染色体は1細胞に1つしか存在しないことから少量の動原体しか精製することができなかった.また,多くのDNA結合タンパク質がミニ染色体と共沈することから精製純度も低いものであった.これらの問題点によりミニ染色体の動原体を用いて微小管との結合を再構成することは困難であった.しかし,精製過程でどのようにすれば動原体複合体を保つことができるかという重要な知見が得られた.この研究結果を応用することにより,今回,新しい方法での動原体の精製に成功することとなった.
Mis12サブ複合体の構成タンパク質である動原体タンパク質Dsn1にエピトープタグをつけて免疫沈降し,共沈するタンパク質を質量分析により調べたところ,CENP-Aや微小管結合タンパク質を含むほとんどの動原体タンパク質がDsn1と共沈することがわかった.しかし,一部のセントロメアDNA結合動原体タンパク質は共沈しなかったことからセントロメアDNAは共沈していないと推測された.さらに,ゲルろ過実験によりこれらのタンパク質が複合体を形成していることもわかった.これらの結果により,Dsn1を精製することでCENP-Aから微小管結合タンパク質までを含有したタンパク質複合体を(比較的)大量かつ純度の高い状態で精製することにはじめて成功したことがわかった.
つぎに,精製動原体が活性を保持しているか,すなわち,微小管に結合することができるかどうかを1分子イメージングの手法を用いて調べた.全反射照明蛍光(total internal reflection fluorescence:TIRF)顕微鏡は,観察領域を限定しバックグラウンドシグナルを減らすことにより1分子レベルの観察を可能にする.CENP-A-GFP融合タンパク質を発現させることで動原体を標識した出芽酵母から動原体を精製した.そして,ローダミンで標識した微小管をin vitroで生成しスライドガラスに付着させた.そこにGFPで標識した精製動原体を混ぜ,動原体が微小管に結合することを示した.CENP-Aは微小管に直接的には結合しないことから,この結合は微小管結合タンパク質に依存していると考えられた.実際,動原体をNdc80やSpc105の突然変異株から精製した場合には微小管への結合能は下がった.
生体において分裂期の動原体は伸長と短縮とをダイナミックにくり返す微小管のプラス端に結合した状態を保ち,なおかつ,染色体を動かすため0.4 pNから8 pNの力をうけるものと推定されている.そこで筆者らは,精製動原体を用いてこれらの現象が再構成できるかどうかを試した.まず,全反射照明蛍光顕微鏡下で微小管を短縮させたところ,動原体は短縮にともないマイナス端にむかって動くことが確認された.つぎに,精製動原体に力学的な仕事ができるかどうか調べるため光ピンセットを用いた実験を行った7).精製動原体をビーズに付着させ,光ピンセットによってそのビーズを微小管のプラス端に近づけた.全反射照明蛍光顕微鏡から得られた実験結果のように,微小管への結合能をもった精製動原体は微小管に結合した.つづいて,微小管と精製動原体との結合のあいだに一定の張力をかけ,結合がどれだけの時間つづくかをテストした.すると,精製動原体はさまざまな強さの張力の存在下においても微小管への結合を持続し,最大で11 pNの張力をかけた状態でも結合が観察された.結合の多くは10分以上もつづき,これは,出芽酵母の分裂期の時間と似た長さであった.さらに,結合の多くは生体で観察される動原体のように微小管の伸長から短縮への移行期および短縮から伸長への移行期でも結合を保つことが確認された.精製動原体と1分子イメージングの手法を用いたこれらの結果により,生体の動原体が行うことのできる基本的な役割をin vitroで再構成できることを示すことができた.
これらの実験において,使用した精製動原体とビーズの濃度比から,少数もしくはひとつひとつの精製動原体がこれらの結合を担っているのではないかと考えた.もし,単独の精製動原体が結合を担っているのであれば2つの予想がたてられる.1)使用する動原体の濃度を下げると,微小管に結合する活性のあるビーズの割合は低下する.2)低濃度の条件下でも結合したビーズについては動原体の濃度を下げても結合の強度は低下しない.実際に,この2つの予想を支持する実験結果が得られた.よって,これらの再構成実験において個々の精製動原体と微小管との結合の調べられていることが強く示唆された.
さきに述べたように,正確な染色体分配を行うには2方向性の結合の形成のときに生まれる張力が動原体とスピンドル微小管との結合を安定化させることが重要であると考えられている8)(図1).この安定化は,これまで,結合の不安定化を誘導する制御タンパク質Aurora Bの活性を下げることにより間接的に起こるものと考えられてきた9).この機構を再構成するための第1ステップとして,まず,張力が結合にあたえる影響について調べた.タンパク質-タンパク質間の結合は通常は張力により不安定化されること,また,精製動原体はAurora Bを共沈しないことから,張力は精製動原体と微小管との結合を不安定化させ結合時間を低下させるであろうと予想した.しかし,驚いたことに結果は予想外のものだった.1 pNから5 pNのあいだでは張力をかけることにより結合時間の増加がみられた.5 pN以上の張力では結合時間はしだいに減少した.これらの結果は,生体で結合にかかる程度の力の強さの範囲では,張力をかけたときのほうがかけないときよりも結合が長くつづき安定化されることを示唆していた.そして,この安定化はAurora Bを必要としなかった.
張力の存在下で結合が強くなるという現象は以前にも報告されており“catch bond”とよばれる10).このcatch bond現象は,強い結合状態と弱い結合状態の2つの異なる状態をとる結合において張力をかけることが強い結合状態を誘導するというモデルで説明のつくことが多い.微小管は伸長と短縮という2つの状態をとることから,類似のモデルで結合の安定化の説明ができるのはないかと考えた.動原体の微小管への結合は4つのパラメーター,すなわち,伸長中の微小管からの動原体の解離,短縮中の微小管からの動原体の解離,伸長から短縮への遷移,短縮から伸長への遷移,で説明される.再構成実験においてこれらのパラメーターを解析したところ,短縮する微小管からの動原体の解離は(伸長する微小管からの解離に比べて)頻度が非常に高い,すなわち,短縮する微小管への結合は不安定な状態であることがわかった.しかし,張力をかけることによりこの頻度は低下し結合の安定化することが判明した.さらに,張力は短縮から伸長への遷移の頻度を上げ伸長から短縮への遷移の頻度を下げることもわかった.これにより,張力の存在下では非存在下と比べ,微小管はより多くの時間にわたって伸長状態下にあり,かつ,動原体の結合の安定な状態にあるといえた.このような効果が生体でも起こるとすると,張力の存在下にある2方向性の結合は張力の発生しない1方向性の結合と比べて安定的であり,Aurora Bに依存しない安定化の機構の存在することを示唆する.
これまで多くの研究者が動原体の精製を試み失敗に終わってきた.筆者らは,出芽酵母をモデル生物に用い,ついに活性を保持した動原体を精製することに成功した.精製条件を手探りで樹立していく過程は決して容易ではなかったが,動原体を精製することができたことによって開けた道は少なくない.たとえば,微小管に結合した状態の精製動原体を電子顕微鏡などで観察することにより,個々の動原体がいかにして伸長・短縮する微小管に結合するのかを原子レベルで調べることが可能となった.また,動原体の重要なはたらきとして微小管が結合していないときに細胞周期の進行を遅らせるスピンドルチェックポイントとよばれる監視機構があり11),この機構にかかわるタンパク質は微小管が結合していない状態の動原体に局在し微小管の結合ののちに離脱する.しかし,これらのタンパク質がどのように動原体に局在するのか,また,微小管の結合によりどのように離脱するのかという分子機構はわかっていない.精製された動原体にはスピンドルチェックポイントに関連するタンパク質も共沈するため,これらの現象を再構成し解析することによって新しい知見を得ることも重要な課題である.
略歴:2010年 米国Washington大学にてPh. D取得ののち,同年より英国Oxford大学 ポスドク研究員.
研究テーマ:Trypanosoma bruceiにおける染色体の分配機構.
関心事:トリパノソーマはCENP-Aをもたず,また,セントロメアのない染色体をもつたいへん興味深い生物である.この奇妙な生物を研究することにより,これまで酵母やヒトなどの真核モデル生物でわかってきた知見がほかの真核生物でどれだけ保存されているのか,または,まったく新しい機構が存在するのか,そして,染色体分配の進化的な起源などについてヒントが得られないか,などと考え中.夢は生きた細胞を試験管内でつくりだすこと.
© 2010 秋吉 文悟 Licensed under CC 表示 2.1 日本
(米国Washington大学Molecular and Cellular Biology Program)
email:秋吉文悟
DOI: 10.7875/first.author.2010.066
Tension directly stabilizes reconstituted kinetochore-microtubule attachments.
Bungo Akiyoshi, Krishna K. Sarangapani, Andrew F. Powers, Christian R. Nelson, Steve L. Reichow, Hugo Arellano-Santoyo, Tamir Gonen, Jeffrey A. Ranish, Charles L. Asbury, Sue Biggins
Nature, 468, 576-579 (2010)
要 約
動原体はセントロメアDNAに形成される巨大なタンパク質複合体であり,分裂期において染色体とスピンドル微小管とをつなぐ役割をはたす.体細胞分裂において正常な染色体分配が起こるためには複製した姉妹染色体が両極のスピンドル微小管から引っ張られた状態,つまり,2方向性の結合を形成しなければならない.2方向性の結合ができると動原体に張力が発生し微小管との結合は安定する.しかし,張力がどのように結合の安定化に寄与するのかという分子機構を理解するには,動原体と微小管との結合をin vitroで再構成し生化学的また物理的に調べる必要がある.これまで,動原体はどの生物からも精製されたことがなかったが,今回,筆者らは,出芽酵母の動原体を活性のある状態で精製し微小管との結合を再構成することにはじめて成功した.さらに,光ピンセットを用いて張力が結合に及ぼす効果を調べたところ,張力は動原体と微小管との結合を直接的に安定させているという新しい機構を発見した.
はじめに
細胞が分裂する際,複製された姉妹染色体は娘細胞に正確に分配されなければならない.染色体分配に問題が起こるとがん化や先天性異常が生じる1).セントロメアDNAに形成される巨大タンパク質複合体である動原体は染色体分配に不可欠な役割をはたす.動原体のもっとも基礎的な役割は,セントロメアDNAに結合すること,スピンドル微小管に結合すること,そして,2方向性の結合を形成し姉妹染色体の1対ずつが娘細胞に均等に分配されるようにすることである(図1).動原体の基本構造は真核生物においてよく保存されていて,約40種類の動原体タンパク質から構成されている2)(図2).これにくわえて,動原体のはたらきを制御するタンパク質がさらに20種類以上も知られており,動原体は非常に複雑な構造をしている.実際,動原体の基本構造だけでも5 MDa以上あると見積もられている3)(リボソームは約3 MDa).
セントロメアに特異的なヒストンH3バリアントであるCENP-A(出芽酵母ではCse4とよばれる)はセントロメアDNAに結合して特異的なクロマチン構造を形成し,ほかの動原体タンパク質のいわば足場づくりのような役割を担う2).微小管はチューブリンサブユニットから構成されるポリマーであり,プラス端とマイナス端において重合と脱重合を起こすことにより伸長と短縮とをダイナミックにくり返す.分裂期において動原体はスピンドル微小管のプラス端に結合する.微小管の結合に必要なタンパク質はNdc80,Spc105/KNL1,Dam1サブ複合体など数多く知られているが(図2),これら個々のタンパク質がどのように微小管に結合するのか,また,動原体という複合体のなかでいかに協調的に結合に寄与するのかという分子機構はまだほとんどわかっていない.さらに,正常な染色体分配のためには正しい結合様式である2方向性の結合を安定化させる一方,間違った結合は不安定化され直されなければならない(図1).2方向性の結合の形成に必要なタンパク質のひとつとしてキナーゼであるAurora Bが知られている4).2つの動原体が同じ極からのスピンドル微小管に結合された状態である1方向性の結合が形成してしまって動原体に十分な張力がかからない場合には,微小管結合タンパク質がAurora Bによってリン酸化されて結合の不安定化を誘導する.これにより間違った結合はリセットされ,次回の結合で2方向性の結合をめざすことになる.2方向性の結合が形成され動原体が両側からスピンドル微小管に引っ張られて張力が生じると,Aurora Bがなんらかの方法で不活性化されて2方向性の結合が安定化し正確な染色体分配が起こるものと考えられている.しかし,張力が生じることで結合がどのように安定化されるのかを理解するには,動原体と微小管との結合をin vitroで再構成し生化学的そして物理的に調べる必要がある.このように,動原体の分子レベルでのはたらきを調べるためには動原体を精製してその基礎的な役割を再構成し分析する必要がある.しかし,これまでさまざまな研究者が動原体の精製を試みたが,その成功は誰もなしえなかった.
1.動原体の精製
先行した研究において,筆者らは,出芽酵母をモデル生物に用いそのミニ染色体を精製することによってセントロメアDNAに形成された動原体を精製することに成功していた5,6).しかし,ミニ染色体は1細胞に1つしか存在しないことから少量の動原体しか精製することができなかった.また,多くのDNA結合タンパク質がミニ染色体と共沈することから精製純度も低いものであった.これらの問題点によりミニ染色体の動原体を用いて微小管との結合を再構成することは困難であった.しかし,精製過程でどのようにすれば動原体複合体を保つことができるかという重要な知見が得られた.この研究結果を応用することにより,今回,新しい方法での動原体の精製に成功することとなった.
Mis12サブ複合体の構成タンパク質である動原体タンパク質Dsn1にエピトープタグをつけて免疫沈降し,共沈するタンパク質を質量分析により調べたところ,CENP-Aや微小管結合タンパク質を含むほとんどの動原体タンパク質がDsn1と共沈することがわかった.しかし,一部のセントロメアDNA結合動原体タンパク質は共沈しなかったことからセントロメアDNAは共沈していないと推測された.さらに,ゲルろ過実験によりこれらのタンパク質が複合体を形成していることもわかった.これらの結果により,Dsn1を精製することでCENP-Aから微小管結合タンパク質までを含有したタンパク質複合体を(比較的)大量かつ純度の高い状態で精製することにはじめて成功したことがわかった.
2.精製動原体は微小管に結合する
つぎに,精製動原体が活性を保持しているか,すなわち,微小管に結合することができるかどうかを1分子イメージングの手法を用いて調べた.全反射照明蛍光(total internal reflection fluorescence:TIRF)顕微鏡は,観察領域を限定しバックグラウンドシグナルを減らすことにより1分子レベルの観察を可能にする.CENP-A-GFP融合タンパク質を発現させることで動原体を標識した出芽酵母から動原体を精製した.そして,ローダミンで標識した微小管をin vitroで生成しスライドガラスに付着させた.そこにGFPで標識した精製動原体を混ぜ,動原体が微小管に結合することを示した.CENP-Aは微小管に直接的には結合しないことから,この結合は微小管結合タンパク質に依存していると考えられた.実際,動原体をNdc80やSpc105の突然変異株から精製した場合には微小管への結合能は下がった.
生体において分裂期の動原体は伸長と短縮とをダイナミックにくり返す微小管のプラス端に結合した状態を保ち,なおかつ,染色体を動かすため0.4 pNから8 pNの力をうけるものと推定されている.そこで筆者らは,精製動原体を用いてこれらの現象が再構成できるかどうかを試した.まず,全反射照明蛍光顕微鏡下で微小管を短縮させたところ,動原体は短縮にともないマイナス端にむかって動くことが確認された.つぎに,精製動原体に力学的な仕事ができるかどうか調べるため光ピンセットを用いた実験を行った7).精製動原体をビーズに付着させ,光ピンセットによってそのビーズを微小管のプラス端に近づけた.全反射照明蛍光顕微鏡から得られた実験結果のように,微小管への結合能をもった精製動原体は微小管に結合した.つづいて,微小管と精製動原体との結合のあいだに一定の張力をかけ,結合がどれだけの時間つづくかをテストした.すると,精製動原体はさまざまな強さの張力の存在下においても微小管への結合を持続し,最大で11 pNの張力をかけた状態でも結合が観察された.結合の多くは10分以上もつづき,これは,出芽酵母の分裂期の時間と似た長さであった.さらに,結合の多くは生体で観察される動原体のように微小管の伸長から短縮への移行期および短縮から伸長への移行期でも結合を保つことが確認された.精製動原体と1分子イメージングの手法を用いたこれらの結果により,生体の動原体が行うことのできる基本的な役割をin vitroで再構成できることを示すことができた.
これらの実験において,使用した精製動原体とビーズの濃度比から,少数もしくはひとつひとつの精製動原体がこれらの結合を担っているのではないかと考えた.もし,単独の精製動原体が結合を担っているのであれば2つの予想がたてられる.1)使用する動原体の濃度を下げると,微小管に結合する活性のあるビーズの割合は低下する.2)低濃度の条件下でも結合したビーズについては動原体の濃度を下げても結合の強度は低下しない.実際に,この2つの予想を支持する実験結果が得られた.よって,これらの再構成実験において個々の精製動原体と微小管との結合の調べられていることが強く示唆された.
3.張力は動原体と微小管とのあいだの結合を直接的に安定化させる
さきに述べたように,正確な染色体分配を行うには2方向性の結合の形成のときに生まれる張力が動原体とスピンドル微小管との結合を安定化させることが重要であると考えられている8)(図1).この安定化は,これまで,結合の不安定化を誘導する制御タンパク質Aurora Bの活性を下げることにより間接的に起こるものと考えられてきた9).この機構を再構成するための第1ステップとして,まず,張力が結合にあたえる影響について調べた.タンパク質-タンパク質間の結合は通常は張力により不安定化されること,また,精製動原体はAurora Bを共沈しないことから,張力は精製動原体と微小管との結合を不安定化させ結合時間を低下させるであろうと予想した.しかし,驚いたことに結果は予想外のものだった.1 pNから5 pNのあいだでは張力をかけることにより結合時間の増加がみられた.5 pN以上の張力では結合時間はしだいに減少した.これらの結果は,生体で結合にかかる程度の力の強さの範囲では,張力をかけたときのほうがかけないときよりも結合が長くつづき安定化されることを示唆していた.そして,この安定化はAurora Bを必要としなかった.
張力の存在下で結合が強くなるという現象は以前にも報告されており“catch bond”とよばれる10).このcatch bond現象は,強い結合状態と弱い結合状態の2つの異なる状態をとる結合において張力をかけることが強い結合状態を誘導するというモデルで説明のつくことが多い.微小管は伸長と短縮という2つの状態をとることから,類似のモデルで結合の安定化の説明ができるのはないかと考えた.動原体の微小管への結合は4つのパラメーター,すなわち,伸長中の微小管からの動原体の解離,短縮中の微小管からの動原体の解離,伸長から短縮への遷移,短縮から伸長への遷移,で説明される.再構成実験においてこれらのパラメーターを解析したところ,短縮する微小管からの動原体の解離は(伸長する微小管からの解離に比べて)頻度が非常に高い,すなわち,短縮する微小管への結合は不安定な状態であることがわかった.しかし,張力をかけることによりこの頻度は低下し結合の安定化することが判明した.さらに,張力は短縮から伸長への遷移の頻度を上げ伸長から短縮への遷移の頻度を下げることもわかった.これにより,張力の存在下では非存在下と比べ,微小管はより多くの時間にわたって伸長状態下にあり,かつ,動原体の結合の安定な状態にあるといえた.このような効果が生体でも起こるとすると,張力の存在下にある2方向性の結合は張力の発生しない1方向性の結合と比べて安定的であり,Aurora Bに依存しない安定化の機構の存在することを示唆する.
おわりに
これまで多くの研究者が動原体の精製を試み失敗に終わってきた.筆者らは,出芽酵母をモデル生物に用い,ついに活性を保持した動原体を精製することに成功した.精製条件を手探りで樹立していく過程は決して容易ではなかったが,動原体を精製することができたことによって開けた道は少なくない.たとえば,微小管に結合した状態の精製動原体を電子顕微鏡などで観察することにより,個々の動原体がいかにして伸長・短縮する微小管に結合するのかを原子レベルで調べることが可能となった.また,動原体の重要なはたらきとして微小管が結合していないときに細胞周期の進行を遅らせるスピンドルチェックポイントとよばれる監視機構があり11),この機構にかかわるタンパク質は微小管が結合していない状態の動原体に局在し微小管の結合ののちに離脱する.しかし,これらのタンパク質がどのように動原体に局在するのか,また,微小管の結合によりどのように離脱するのかという分子機構はわかっていない.精製された動原体にはスピンドルチェックポイントに関連するタンパク質も共沈するため,これらの現象を再構成し解析することによって新しい知見を得ることも重要な課題である.
文 献
- Holland, A. J. & Cleveland, D. W.: Boveri revisited: chromosomal instability, aneuploidy and tumorigenesis. Nat. Rev. Mol. Cell Biol., 10, 478-487 (2009)[PubMed]
- Cheeseman, I. M. & Desai, A.: Molecular architecture of the kinetochore-microtubule interface. Nat. Rev. Mol. Cell Biol., 9, 33-46 (2008)[PubMed]
- De Wulf, P., McAinsh, A. D. & Sorger, P. K.: Hierarchical assembly of the budding yeast kinetochore from multiple subcomplexes. Genes Dev., 17, 2902-2921 (2003)[PubMed]
- Ruchaud, S., Carmena, M. & Earnshaw, W. C.: The chromosomal passenger complex: one for all and all for one. Cell, 131, 230-231 (2007)[PubMed]
- Akiyoshi, B., Nelson, C. R., Ranish, J. A. et al.: Quantitative proteomic analysis of purified yeast kinetochores identifies a PP1 regulatory subunit. Genes Dev., 23, 2887-2899 (2009)[PubMed]
- Akiyoshi, B., Nelson, C. R., Ranish, J. A. et al.: Analysis of Ipl1-mediated phosphorylation of the Ndc80 kinetochore protein in Saccharomyces cerevisiae. Genetics, 183, 1591-1595 (2009)[PubMed]
- Powers, A. F., Franck, A. D., Gestaut, D. R. et al.: The Ndc80 kinetochore complex forms load-bearing attachments to dynamic microtubule tips via biased diffusion. Cell, 136, 865-875 (2009)[PubMed]
- Nicklas, R. B. & Ward, S. C.: Elements of error correction in mitosis: microtubule capture, release, and tension. J. Cell Biol., 126, 1241-1253 (1994)[PubMed]
- Liu, D., Vader, G., Vromans, M. J. et al.: Sensing chromosome bi-orientation by spatial separation of aurora B kinase from kinetochore substrates. Science, 323, 1350-1353 (2009)[PubMed]
- Thomas, W. E., Vogel, V. & Sokurenko, E.: Biophysics of catch bonds. Annu. Rev. Biophys., 37, 399-416 (2008)[PubMed]
- Musacchio, A. & Salmon, E. D.: The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol., 8, 379-393 (2007)[PubMed]
著者プロフィール
略歴:2010年 米国Washington大学にてPh. D取得ののち,同年より英国Oxford大学 ポスドク研究員.
研究テーマ:Trypanosoma bruceiにおける染色体の分配機構.
関心事:トリパノソーマはCENP-Aをもたず,また,セントロメアのない染色体をもつたいへん興味深い生物である.この奇妙な生物を研究することにより,これまで酵母やヒトなどの真核モデル生物でわかってきた知見がほかの真核生物でどれだけ保存されているのか,または,まったく新しい機構が存在するのか,そして,染色体分配の進化的な起源などについてヒントが得られないか,などと考え中.夢は生きた細胞を試験管内でつくりだすこと.
© 2010 秋吉 文悟 Licensed under CC 表示 2.1 日本