生後まもなく発生するAireに依存性の制御性T細胞が自己免疫寛容を維持する
藤門 範行
(米国Harvard Medical School,Department of Microbiology and Immunobiology,Division of Immunology)
email:藤門範行
DOI: 10.7875/first.author.2015.043
Regulatory T cells generated early in life play a distinct role in maintaining self-tolerance.
Siyoung Yang, Noriyuki Fujikado, Dmitriy Kolodin, Christophe Benoist, Diane Mathis
Science, 348, 589-594 (2015)
Aireは胸腺髄質上皮細胞に発現し,末梢組織に特異的な自己抗原の発現を誘導することによりT細胞を選択する,免疫学的な寛容において重要な転写因子である.Aireノックアウトマウスは全身性の自己免疫症状を自然に発症するが,その制御には新生仔期におけるAireの発現が必要十分であることが証明されている.この研究では,新生仔期にAireが特別なFoxp3陽性CD4陽性の制御性T細胞の発生を促進し,これらの制御性T細胞が成体まで安定的に維持されることを発見した.新生仔期に発生した制御性T細胞は自己免疫寛容の維持に必須で,トランスクリプトームやその活性の状態は成体で発生した制御性T細胞とは一線を画していた.また,その発生には,時期特異的かつAireに非依存的な自己抗原の分解および提示の機構の違いが関与し,その結果,成体とは異なるT細胞受容体のレパトアが生み出されることが明らかにされた.これらの発見は,免疫系の階層的な発生の概念を拡充するものであった.
Aire遺伝子は自己免疫性多腺性内分泌不全症の原因遺伝子であり,マウスにおいてもAire遺伝子の欠損はヒトに類似した全身性の自己免疫症状をもたらす1).Aire遺伝子のみの変異により中枢性の自己免疫寛容が破綻し自己免疫症状が惹起されることから,自己免疫性多腺性内分泌不全症は比較的まれな疾患であるにもかかわらず多くの免疫学者にとり最良かつ重要な研究対象になっている.自己免疫寛容の成立には,胸腺における自己反応性T細胞の負の選択(中枢性の免疫寛容)と制御性T細胞による免疫の抑制(末梢性の免疫寛容)が必要であるが,Aireはこの両方の機構に関与している.以前に,筆者らは,生後数週間におけるAireの発現が,Aireの欠損による自己免疫症状の制御に必要かつ十分であることを発見した2).この研究では,自己免疫寛容の成立において新生仔期のAireの発現が重要であるという予想外の発見に対しその分子機構の解明を試みた.
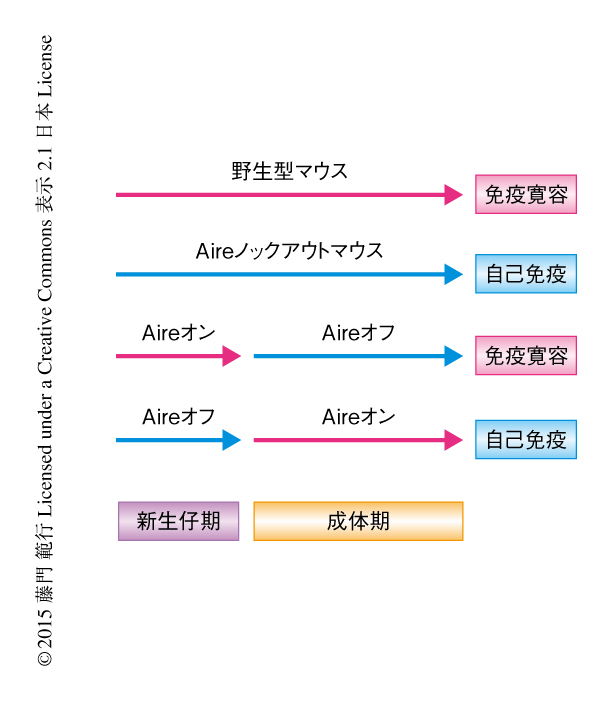
以前に筆者らは,時期特異的なAireの発現制御系を開発し,新生仔期におけるAireの発現がAireの欠損による自己免疫症状の制御に必要十分であり,成体におけるAireの発現はこれを補完できないことを証明した2)(図1).この分子細胞生物学的な機構としてつぎの3つの仮説をたて,新生仔と成体における相違点について検証した.1)新生仔の胸腺において自己反応性T細胞のクローンの消失が効率的に起こる.2)新生仔の胸腺において自己免疫症状の制御に重要な制御性T細胞のレパトアが選択される.3)新生仔の胸腺において成体とは異なる末梢組織に特異的な自己抗原が発現する.
新生仔および成体における負の選択の効率を比較するため,T細胞受容体の遺伝子導入マウスを用いて胸腺細胞のクローンの消失について解析した.その結果,成体あるいは新生仔のどちらの胸腺においても,クロノタイプ陽性細胞の顕著な減少が認められた.とくに,クロノタイプ強陽性の胸腺細胞はどちらにおいてもAireに依存性の負の選択によりほぼ完全に消失しており,その効率に違いはないことが明らかにされた.これらのデータから,新生仔の胸腺において自己反応性T細胞のクローンの消失が効率的に起こるという仮説は棄却された.
胸腺においてFoxp3陽性CD4陽性の制御性T細胞を経時的に計数したところ,生後2日目からFoxp3陽性細胞が認められ,生後4日目には相当数の制御性T細胞が発生し,生後35日目まで漸次的に増加していた.Aireノックアウトマウスにおいても類似した制御性T細胞の発生パターンが観察されたが,Foxp3陽性細胞の生後35日目までの割合および生後10日目までの絶対数は,野生型のマウスと比較して有意に減少していた.
制御性T細胞の自己免疫寛容の維持における相対的な重要性を検証するため,ジフテリア毒素の投与により一時的に制御性T細胞を欠損させることのできる系を用いて解析した.生後0~10日あるいは生後35~45日の期間にジフテリア毒素を投与した結果,生後10日目までに制御性T細胞を欠損させると生後24日目にはすべてのマウスがAireノックアウトマウスと類似した全身性の自己免疫症状を示した.一方,成体において制御性T細胞を欠損させた場合にはこのような変化は認められなかった.また,これらの結果が新生仔に対するジフテリア毒素の毒性によるものである可能性を除外するため,新生仔期に制御性T細胞を欠損させたマウスに若齢のマウスから回収した制御性T細胞を移入したところ自己免疫症状は顕著に回復したが,生後0~10日にジフテリア毒素を投与した若齢のマウスの制御性T細胞の移入では自己免疫症状の回復は認められなかった.
新生仔期に発生する制御性T細胞のAireへの依存性について解析するため,若齢の野生型マウスあるいはAireノックアウトマウスから回収した制御性T細胞を,新生仔期に制御性T細胞を欠損させたマウスあるいはAireノックアウトマウスに移入した.その結果,どちらのマウスに移入した場合でも野生型の制御性T細胞の移入により自己免疫症状の発症は抑制された.これらの結果から,Aireが新生仔期に制御性T細胞の発生を促進し,その欠損はAireノックアウトマウスに類似した自己免疫症状の発症を誘導することが明らかにされた.また,その病態のスペクトラムはFoxp3の構成的な変異や成体における制御性T細胞の欠損によるものとは異なっていた3-5).
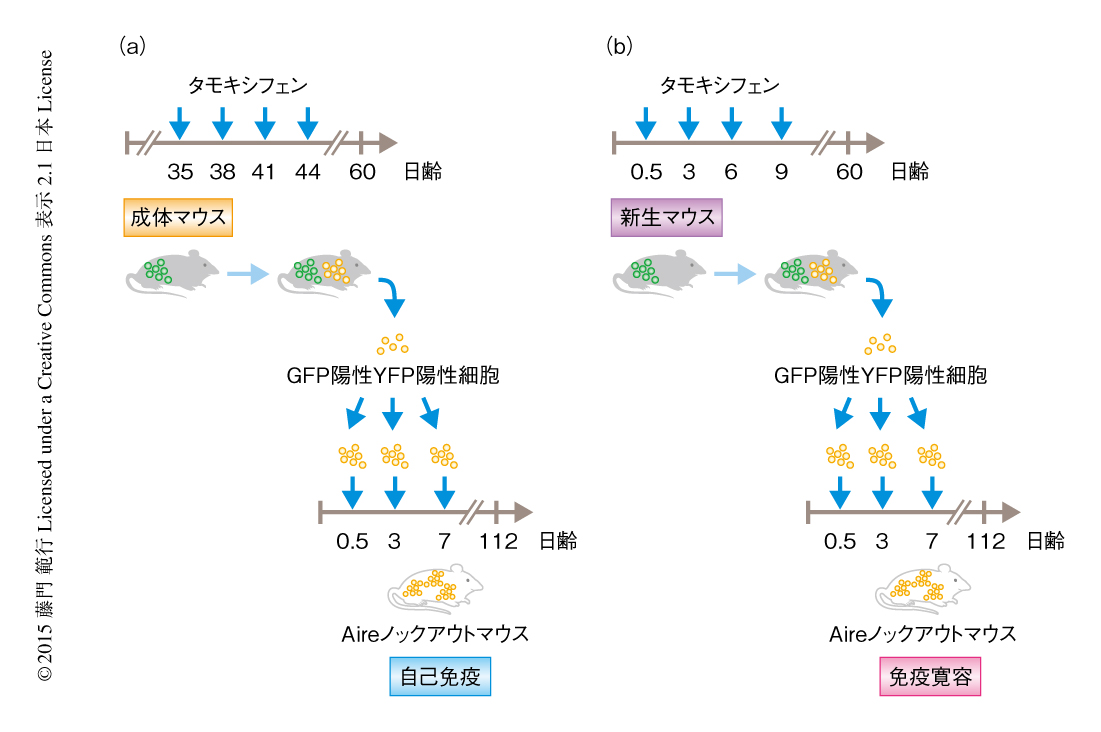
新生仔期に発生する制御性T細胞の特徴をより詳細に解明するため,細胞系譜を追跡する系を用いて解析した.すべての制御性T細胞がGFPを発現するがタモキシフェンの投与により時期特異的にYFPの発現を誘導することのできるマウスを用いることにより,GFPおよびYFPの発現によりある特定の時期に発生した制御性T細胞を半永久的に追跡することが可能になる6).このマウスを用いて,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与し8週間のちまで追跡した結果,どちらの時期に標識された制御性T細胞も非常に安定でその絶対数に変化はなかった.この時期特異的なYFPによる標識の持続性から,新生仔期に発生した制御性T細胞の成体における機能解析が可能であることが明らかにされたので,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与し,生後60日目にGFP陽性YFP陰性の制御性T細胞あるいはGFP陽性YFP陽性の制御性T細胞を回収し,Aireノックアウトマウスの新生仔に移入した.その結果,GFP陽性YFP陰性の制御性T細胞および成体においてYFPにより標識された制御性T細胞を移入した場合にはAireノックアウトマウスにおける自己免疫症状の発症に影響はなかったのに対し,新生仔期にYFPにより標識された制御性T細胞を移入したAireノックアウトマウスにおいては自己免疫症状の発症が顕著に抑制された(図2).これらの結果から,新生仔期に発生した制御性T細胞は明らかな自己免疫の制御機能をもち,その機能は成体の環境においても維持されていることが示唆された.
さきのすべての制御性T細胞がGFPを発現しタモキシフェンの投与により時期特異的にYFPの発現を誘導することのできるマウスを用いて,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与した8~10週齢のマウスからGFP陽性YFP陰性の制御性T細胞およびGFP陽性YFP陽性の制御性T細胞を回収し,これらの遺伝子発現についてマイクロアレイを用いて解析した.その結果,成体においてYFPにより標識された制御性T細胞とGFP陽性YFP陰性の制御性T細胞とのあいだの遺伝子発現には大差はなかったのに対し,新生仔期においてYFPにより標識された制御性T細胞とGFP陽性YFP陰性の制御性T細胞とのあいだには異なる遺伝子の発現が認められた.過去の研究において同定された制御性T細胞を特徴づける遺伝子のデータセットと今回のデータセットとを比較すると,制御性T細胞を特徴づける遺伝子の発現は新生仔期に発生した制御性T細胞における遺伝子発現と有意に類似することが示された.また,新生仔期においてYFPにより標識された制御性T細胞は,GFP陽性YFP陰性の制御性T細胞および成体においてYFPにより標識された制御性T細胞と比較して,Fgl2遺伝子,Ebi3遺伝子,Pdcd1遺伝子,Icos遺伝子などを強く発現し,より高い免疫の抑制活性および増殖能をもつことが明らかにされた.また,遺伝子セットの濃縮解析の結果,新生仔期に発生した制御性T細胞は複製および細胞増殖に関与する遺伝子の発現が有意に高いことが示された.
新生仔期に特別な制御性T細胞が発生する分子細胞生物学的な機構の解明を試みた.胎仔の肝細胞に由来する造血幹細胞が新生仔型の制御性T細胞の由来となっている可能性を検証するため,胎仔の肝細胞と生体の骨髄細胞との混合キメラマウスを作製した.その結果,末梢の制御性T細胞における肝幹細胞および骨髄幹細胞の再構築の割合および遺伝子発現はきわめて同様であり,新生仔型の制御性T細胞が発生する機構はその由来が異なるためであるという可能性は否定された.
新生仔の胸腺においてAireが成体とは異なる遺伝子の発現を誘導している可能性を検証するため,Aire欠損の背景をもつAireレポーターマウスを作製した.このマウスではAire遺伝子のプロモーターおよびエンハンサーの制御のもと胸腺髄質上皮細胞がGFPを発現するため,Aireを発現する胸腺髄質上皮細胞のみを解析することが可能になる.新生仔の胸腺を解析した結果,Aireを発現する胸腺髄質上皮細胞の割合,Aireの発現レベル,Aireに依存性の胸腺髄質上皮細胞の転写産物のレパトアは成体とほぼ同等であった.
しかしながら,末梢組織に特異的な自己抗原の転写産物のレパトアが同じであったとしても,そのプロセシングあるいは抗原提示機構の違いにより,異なる自己抗原のペプチドのレパトアが生じる可能性があることから,胸腺髄質上皮細胞のマイクロアレイのデータをあらためて詳細に解析したところ,ペプチドの産生あるいは制御に重要な役割をもつ遺伝子の発現レベルが新生仔と成体とで異なっていることを発見した.なかでも,新生仔においてH2-O遺伝子の発現が有意に低下していることに注目した.H2-O遺伝子がコードするDOはDMの機能を抑制することによりペプチドのレパトアを制御するMHCクラスII分子のシャペロンタンパク質である.一方,DMはMHCクラスII分子のペプチド結合領域からインバリアント鎖の分解産物であるCLIPを除去しペプチドの結合を促進するタンパク質である7,8).すなわち,DOの発現の低下はCLIPの除去を促進し,多様なペプチドのレパトアを生成する可能性があった.新生仔の胸腺においてDOの発現はAireに非依存的に低下しており,反対に,DMの発現は成体と比較して亢進していた.また,新生仔には単一の細胞のレベルにおいてDMとDOの割合が低下している胸腺髄質上皮細胞のサブセットが存在し,CLIPのペプチドへの交換がより効率的に起こっていることが示唆された.実際に,新生仔ではCLIPの結合したMHCクラスII分子の割合が低下しており,末梢組織に特異的な自己抗原のペプチドのレパトアがより多様性に富んでいると考えられた.また,Aireに依存性の末梢組織に特異的な自己抗原のペプチドはミエロイド系の細胞,とくにCD8α陽性の樹状細胞のサブセットによりクロスプレゼンテーションされることが報告されている9).興味深いことに,これらの樹状細胞のサブセットの数は新生仔においていちじるしく減少しており,新生仔においてはAireに依存性の自己抗原のペプチドがクロスプレゼンテーションされる可能性は低いと考えられた.
これまでの結果から,新生仔における制御性T細胞のレパトアの多様性が示唆されたため,膵臓に由来する自己抗原を認識するエフェクターT細胞のT細胞受容体のトランスジェニックマウスを利用した単一の細胞における塩基配列解析により,T細胞受容体のレパトアを解析した.このマウスにおいて,制御性T細胞は内在性のT細胞受容体α鎖の再編成および2次的な正の選択に依存して発生する.この系ではT細胞受容体β鎖の固定によりT細胞受容体のレパトアが限定されるが,主要な内在性のα鎖であるVα2鎖をもつ制御性T細胞を回収して解析することによりさらにレパトアを制限することができる.解析の結果,新生仔における制御性T細胞のT細胞受容体のレパトアは,成体のものとは異なり重複するT細胞受容体の割合が低下していた.すなわち,制限されたレパトアの解析のなかでも特定のT細胞受容体のクローンの増殖が抑制されており,そのレパトアがより多様性に富むことが示唆された.また,そのCDR3領域は成体のレパトアと比較して有意に短く,N領域へのヌクレオチドの付加のほぼない,新生仔型のT細胞受容体の再編成が観察された.さらに頑強な統計解析のため,重複するT細胞受容体のレパトアに限定して解析した結果,新生仔の制御性T細胞と成体制御性T細胞とはまったく異なるT細胞受容体のレパトアをもつことが明らかにされた.
これらの研究結果から,生後まもなく発生するAireに依存性のFoxp3陽性CD4陽性の制御性T細胞が自己免疫寛容の成立および維持に重要な役割をはたしていることが明らかにされた.全身性の自己免疫症状を発症する実験的なモデル,Aireの欠損,生後3日目における胸腺の摘出,若齢におけるFoxp3陽性細胞の除去は,その標的となる臓器が非常に類似した表現型を示すが,制御性T細胞の構成的な欠損マウスや成体において誘導的に制御性T細胞を除去したマウスは,まったく異なる標的となる臓器のスペクトラムを示す.また,生後3日目における胸腺の摘出では,Aireノックアウトマウスと同様に成体における制御性T細胞の数に影響は認められない.筆者らのデータは,これらの実験的なモデルの類似性および相違点に統一した見解をあたえるものであった.さらに,この研究により明らかにされた制御性T細胞の発生の時期特異性は,なぜ自己免疫性多腺性内分泌不全症の患者やAireノックアウトマウスにおける自己免疫症状はかぎられた臓器に出現するのか,という疑問に対する回答を提供し,制御性T細胞を用いた自己免疫疾患の細胞療法において,成体のドナーから単離した制御性T細胞では不十分かつ限局した臓器にしか効果が得られない可能性のあることを示唆した.そして,免疫系の階層的発生の概念10) を拡充するものであった.
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,東京大学医科学研究所 助教を経て,2010年 米国Harvard Medical SchoolにてResearch Fellowを経て,2015年より日本イーライリリー.
研究テーマ:自己免疫疾患の病因.
関心事:免疫学的および哲学的な“寛容”の意味.
© 2015 藤門 範行 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Microbiology and Immunobiology,Division of Immunology)
email:藤門範行
DOI: 10.7875/first.author.2015.043
Regulatory T cells generated early in life play a distinct role in maintaining self-tolerance.
Siyoung Yang, Noriyuki Fujikado, Dmitriy Kolodin, Christophe Benoist, Diane Mathis
Science, 348, 589-594 (2015)
要 約
Aireは胸腺髄質上皮細胞に発現し,末梢組織に特異的な自己抗原の発現を誘導することによりT細胞を選択する,免疫学的な寛容において重要な転写因子である.Aireノックアウトマウスは全身性の自己免疫症状を自然に発症するが,その制御には新生仔期におけるAireの発現が必要十分であることが証明されている.この研究では,新生仔期にAireが特別なFoxp3陽性CD4陽性の制御性T細胞の発生を促進し,これらの制御性T細胞が成体まで安定的に維持されることを発見した.新生仔期に発生した制御性T細胞は自己免疫寛容の維持に必須で,トランスクリプトームやその活性の状態は成体で発生した制御性T細胞とは一線を画していた.また,その発生には,時期特異的かつAireに非依存的な自己抗原の分解および提示の機構の違いが関与し,その結果,成体とは異なるT細胞受容体のレパトアが生み出されることが明らかにされた.これらの発見は,免疫系の階層的な発生の概念を拡充するものであった.
はじめに
Aire遺伝子は自己免疫性多腺性内分泌不全症の原因遺伝子であり,マウスにおいてもAire遺伝子の欠損はヒトに類似した全身性の自己免疫症状をもたらす1).Aire遺伝子のみの変異により中枢性の自己免疫寛容が破綻し自己免疫症状が惹起されることから,自己免疫性多腺性内分泌不全症は比較的まれな疾患であるにもかかわらず多くの免疫学者にとり最良かつ重要な研究対象になっている.自己免疫寛容の成立には,胸腺における自己反応性T細胞の負の選択(中枢性の免疫寛容)と制御性T細胞による免疫の抑制(末梢性の免疫寛容)が必要であるが,Aireはこの両方の機構に関与している.以前に,筆者らは,生後数週間におけるAireの発現が,Aireの欠損による自己免疫症状の制御に必要かつ十分であることを発見した2).この研究では,自己免疫寛容の成立において新生仔期のAireの発現が重要であるという予想外の発見に対しその分子機構の解明を試みた.
1.新生仔期におけるAireの発現の重要性と3つの仮説
以前に筆者らは,時期特異的なAireの発現制御系を開発し,新生仔期におけるAireの発現がAireの欠損による自己免疫症状の制御に必要十分であり,成体におけるAireの発現はこれを補完できないことを証明した2)(図1).この分子細胞生物学的な機構としてつぎの3つの仮説をたて,新生仔と成体における相違点について検証した.1)新生仔の胸腺において自己反応性T細胞のクローンの消失が効率的に起こる.2)新生仔の胸腺において自己免疫症状の制御に重要な制御性T細胞のレパトアが選択される.3)新生仔の胸腺において成体とは異なる末梢組織に特異的な自己抗原が発現する.
2.新生仔の胸腺におけるクローンの消失の効率は成体と同等である
新生仔および成体における負の選択の効率を比較するため,T細胞受容体の遺伝子導入マウスを用いて胸腺細胞のクローンの消失について解析した.その結果,成体あるいは新生仔のどちらの胸腺においても,クロノタイプ陽性細胞の顕著な減少が認められた.とくに,クロノタイプ強陽性の胸腺細胞はどちらにおいてもAireに依存性の負の選択によりほぼ完全に消失しており,その効率に違いはないことが明らかにされた.これらのデータから,新生仔の胸腺において自己反応性T細胞のクローンの消失が効率的に起こるという仮説は棄却された.
3.新生仔期に発生するAireに依存性の制御性T細胞が自己免疫症状の発症を抑制する
胸腺においてFoxp3陽性CD4陽性の制御性T細胞を経時的に計数したところ,生後2日目からFoxp3陽性細胞が認められ,生後4日目には相当数の制御性T細胞が発生し,生後35日目まで漸次的に増加していた.Aireノックアウトマウスにおいても類似した制御性T細胞の発生パターンが観察されたが,Foxp3陽性細胞の生後35日目までの割合および生後10日目までの絶対数は,野生型のマウスと比較して有意に減少していた.
制御性T細胞の自己免疫寛容の維持における相対的な重要性を検証するため,ジフテリア毒素の投与により一時的に制御性T細胞を欠損させることのできる系を用いて解析した.生後0~10日あるいは生後35~45日の期間にジフテリア毒素を投与した結果,生後10日目までに制御性T細胞を欠損させると生後24日目にはすべてのマウスがAireノックアウトマウスと類似した全身性の自己免疫症状を示した.一方,成体において制御性T細胞を欠損させた場合にはこのような変化は認められなかった.また,これらの結果が新生仔に対するジフテリア毒素の毒性によるものである可能性を除外するため,新生仔期に制御性T細胞を欠損させたマウスに若齢のマウスから回収した制御性T細胞を移入したところ自己免疫症状は顕著に回復したが,生後0~10日にジフテリア毒素を投与した若齢のマウスの制御性T細胞の移入では自己免疫症状の回復は認められなかった.
新生仔期に発生する制御性T細胞のAireへの依存性について解析するため,若齢の野生型マウスあるいはAireノックアウトマウスから回収した制御性T細胞を,新生仔期に制御性T細胞を欠損させたマウスあるいはAireノックアウトマウスに移入した.その結果,どちらのマウスに移入した場合でも野生型の制御性T細胞の移入により自己免疫症状の発症は抑制された.これらの結果から,Aireが新生仔期に制御性T細胞の発生を促進し,その欠損はAireノックアウトマウスに類似した自己免疫症状の発症を誘導することが明らかにされた.また,その病態のスペクトラムはFoxp3の構成的な変異や成体における制御性T細胞の欠損によるものとは異なっていた3-5).
4.新生仔期に発生する制御性T細胞は成体まで安定的に維持される
新生仔期に発生する制御性T細胞の特徴をより詳細に解明するため,細胞系譜を追跡する系を用いて解析した.すべての制御性T細胞がGFPを発現するがタモキシフェンの投与により時期特異的にYFPの発現を誘導することのできるマウスを用いることにより,GFPおよびYFPの発現によりある特定の時期に発生した制御性T細胞を半永久的に追跡することが可能になる6).このマウスを用いて,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与し8週間のちまで追跡した結果,どちらの時期に標識された制御性T細胞も非常に安定でその絶対数に変化はなかった.この時期特異的なYFPによる標識の持続性から,新生仔期に発生した制御性T細胞の成体における機能解析が可能であることが明らかにされたので,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与し,生後60日目にGFP陽性YFP陰性の制御性T細胞あるいはGFP陽性YFP陽性の制御性T細胞を回収し,Aireノックアウトマウスの新生仔に移入した.その結果,GFP陽性YFP陰性の制御性T細胞および成体においてYFPにより標識された制御性T細胞を移入した場合にはAireノックアウトマウスにおける自己免疫症状の発症に影響はなかったのに対し,新生仔期にYFPにより標識された制御性T細胞を移入したAireノックアウトマウスにおいては自己免疫症状の発症が顕著に抑制された(図2).これらの結果から,新生仔期に発生した制御性T細胞は明らかな自己免疫の制御機能をもち,その機能は成体の環境においても維持されていることが示唆された.
5.新生仔期に発生する制御性T細胞の表現型
さきのすべての制御性T細胞がGFPを発現しタモキシフェンの投与により時期特異的にYFPの発現を誘導することのできるマウスを用いて,生後0~10日あるいは生後35~45日の期間にタモキシフェンを投与した8~10週齢のマウスからGFP陽性YFP陰性の制御性T細胞およびGFP陽性YFP陽性の制御性T細胞を回収し,これらの遺伝子発現についてマイクロアレイを用いて解析した.その結果,成体においてYFPにより標識された制御性T細胞とGFP陽性YFP陰性の制御性T細胞とのあいだの遺伝子発現には大差はなかったのに対し,新生仔期においてYFPにより標識された制御性T細胞とGFP陽性YFP陰性の制御性T細胞とのあいだには異なる遺伝子の発現が認められた.過去の研究において同定された制御性T細胞を特徴づける遺伝子のデータセットと今回のデータセットとを比較すると,制御性T細胞を特徴づける遺伝子の発現は新生仔期に発生した制御性T細胞における遺伝子発現と有意に類似することが示された.また,新生仔期においてYFPにより標識された制御性T細胞は,GFP陽性YFP陰性の制御性T細胞および成体においてYFPにより標識された制御性T細胞と比較して,Fgl2遺伝子,Ebi3遺伝子,Pdcd1遺伝子,Icos遺伝子などを強く発現し,より高い免疫の抑制活性および増殖能をもつことが明らかにされた.また,遺伝子セットの濃縮解析の結果,新生仔期に発生した制御性T細胞は複製および細胞増殖に関与する遺伝子の発現が有意に高いことが示された.
6.時期特異的かつAireに非依存性の自己抗原提示の機構が新生仔型の制御性T細胞の発生を誘導する
新生仔期に特別な制御性T細胞が発生する分子細胞生物学的な機構の解明を試みた.胎仔の肝細胞に由来する造血幹細胞が新生仔型の制御性T細胞の由来となっている可能性を検証するため,胎仔の肝細胞と生体の骨髄細胞との混合キメラマウスを作製した.その結果,末梢の制御性T細胞における肝幹細胞および骨髄幹細胞の再構築の割合および遺伝子発現はきわめて同様であり,新生仔型の制御性T細胞が発生する機構はその由来が異なるためであるという可能性は否定された.
新生仔の胸腺においてAireが成体とは異なる遺伝子の発現を誘導している可能性を検証するため,Aire欠損の背景をもつAireレポーターマウスを作製した.このマウスではAire遺伝子のプロモーターおよびエンハンサーの制御のもと胸腺髄質上皮細胞がGFPを発現するため,Aireを発現する胸腺髄質上皮細胞のみを解析することが可能になる.新生仔の胸腺を解析した結果,Aireを発現する胸腺髄質上皮細胞の割合,Aireの発現レベル,Aireに依存性の胸腺髄質上皮細胞の転写産物のレパトアは成体とほぼ同等であった.
しかしながら,末梢組織に特異的な自己抗原の転写産物のレパトアが同じであったとしても,そのプロセシングあるいは抗原提示機構の違いにより,異なる自己抗原のペプチドのレパトアが生じる可能性があることから,胸腺髄質上皮細胞のマイクロアレイのデータをあらためて詳細に解析したところ,ペプチドの産生あるいは制御に重要な役割をもつ遺伝子の発現レベルが新生仔と成体とで異なっていることを発見した.なかでも,新生仔においてH2-O遺伝子の発現が有意に低下していることに注目した.H2-O遺伝子がコードするDOはDMの機能を抑制することによりペプチドのレパトアを制御するMHCクラスII分子のシャペロンタンパク質である.一方,DMはMHCクラスII分子のペプチド結合領域からインバリアント鎖の分解産物であるCLIPを除去しペプチドの結合を促進するタンパク質である7,8).すなわち,DOの発現の低下はCLIPの除去を促進し,多様なペプチドのレパトアを生成する可能性があった.新生仔の胸腺においてDOの発現はAireに非依存的に低下しており,反対に,DMの発現は成体と比較して亢進していた.また,新生仔には単一の細胞のレベルにおいてDMとDOの割合が低下している胸腺髄質上皮細胞のサブセットが存在し,CLIPのペプチドへの交換がより効率的に起こっていることが示唆された.実際に,新生仔ではCLIPの結合したMHCクラスII分子の割合が低下しており,末梢組織に特異的な自己抗原のペプチドのレパトアがより多様性に富んでいると考えられた.また,Aireに依存性の末梢組織に特異的な自己抗原のペプチドはミエロイド系の細胞,とくにCD8α陽性の樹状細胞のサブセットによりクロスプレゼンテーションされることが報告されている9).興味深いことに,これらの樹状細胞のサブセットの数は新生仔においていちじるしく減少しており,新生仔においてはAireに依存性の自己抗原のペプチドがクロスプレゼンテーションされる可能性は低いと考えられた.
7.新生仔における制御性T細胞のT細胞受容体のレパトアは多様性に富む
これまでの結果から,新生仔における制御性T細胞のレパトアの多様性が示唆されたため,膵臓に由来する自己抗原を認識するエフェクターT細胞のT細胞受容体のトランスジェニックマウスを利用した単一の細胞における塩基配列解析により,T細胞受容体のレパトアを解析した.このマウスにおいて,制御性T細胞は内在性のT細胞受容体α鎖の再編成および2次的な正の選択に依存して発生する.この系ではT細胞受容体β鎖の固定によりT細胞受容体のレパトアが限定されるが,主要な内在性のα鎖であるVα2鎖をもつ制御性T細胞を回収して解析することによりさらにレパトアを制限することができる.解析の結果,新生仔における制御性T細胞のT細胞受容体のレパトアは,成体のものとは異なり重複するT細胞受容体の割合が低下していた.すなわち,制限されたレパトアの解析のなかでも特定のT細胞受容体のクローンの増殖が抑制されており,そのレパトアがより多様性に富むことが示唆された.また,そのCDR3領域は成体のレパトアと比較して有意に短く,N領域へのヌクレオチドの付加のほぼない,新生仔型のT細胞受容体の再編成が観察された.さらに頑強な統計解析のため,重複するT細胞受容体のレパトアに限定して解析した結果,新生仔の制御性T細胞と成体制御性T細胞とはまったく異なるT細胞受容体のレパトアをもつことが明らかにされた.
おわりに
これらの研究結果から,生後まもなく発生するAireに依存性のFoxp3陽性CD4陽性の制御性T細胞が自己免疫寛容の成立および維持に重要な役割をはたしていることが明らかにされた.全身性の自己免疫症状を発症する実験的なモデル,Aireの欠損,生後3日目における胸腺の摘出,若齢におけるFoxp3陽性細胞の除去は,その標的となる臓器が非常に類似した表現型を示すが,制御性T細胞の構成的な欠損マウスや成体において誘導的に制御性T細胞を除去したマウスは,まったく異なる標的となる臓器のスペクトラムを示す.また,生後3日目における胸腺の摘出では,Aireノックアウトマウスと同様に成体における制御性T細胞の数に影響は認められない.筆者らのデータは,これらの実験的なモデルの類似性および相違点に統一した見解をあたえるものであった.さらに,この研究により明らかにされた制御性T細胞の発生の時期特異性は,なぜ自己免疫性多腺性内分泌不全症の患者やAireノックアウトマウスにおける自己免疫症状はかぎられた臓器に出現するのか,という疑問に対する回答を提供し,制御性T細胞を用いた自己免疫疾患の細胞療法において,成体のドナーから単離した制御性T細胞では不十分かつ限局した臓器にしか効果が得られない可能性のあることを示唆した.そして,免疫系の階層的発生の概念10) を拡充するものであった.
文 献
- Mathis, D. & Benoist, C.: Aire. Annu. Rev. Immunol., 27, 287-312 (2009)[PubMed]
- Guerau-de-Arellano, M., Martinic, M., Benoist, C. et al.: Neonatal tolerance revisited: a perinatal window for Aire control of autoimmunity. J. Exp. Med., 206, 1245-1252 (2009)[PubMed]
- Fontenot, J. D., Rasmussen, J. P., Williams, L. M. et al.: Regulatory T cell lineage specification by the forkhead transcription factor Foxp3. Immunity, 22, 329-341 (2005)[PubMed]
- Kim, J. M., Rasmussen, J. P. & Rudensky, A. Y.: Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice. Nat. Immunol., 8, 191-197 (2007)[PubMed]
- Chen, Z., Benoist, C. & Mathis, D.: How defects in central tolerance impinge on a deficiency in regulatory T cells. Proc. Natl. Acad. Sci. USA, 102, 14735-14740 (2005)[PubMed]
- Rubtsov, Y. P., Niec, R. E., Josefowicz, S. et al.: Stability of the regulatory T cell lineage in vivo. Science, 329, 1667-1671 (2010)[PubMed]
- Mellins, E. D. & Stern, L. J.: HLA-DM and HLA-DO, key regulators of MHC-II processing and presentation. Curr. Opin. Immunol., 26, 115-122 (2014)[PubMed]
- Poluektov, Y. O., Kim, A. & Sadegh-Nasseri, S.: HLA-DO and its role in MHC class II antigen presentation. Front. Immunol., 4, 260 (2013)[PubMed]
- Perry, J. S., Lio, C. W., Kau, A. L. et al.: Distinct contributions of Aire and antigen-presenting-cell subsets to the generation of self-tolerance in the thymus. Immunity, 41, 414-426 (2014)[PubMed]
- Herzenberg, L. A. & Herzenberg, L. A.: Toward a layered immune system. Cell, 59, 953-954 (1989)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,東京大学医科学研究所 助教を経て,2010年 米国Harvard Medical SchoolにてResearch Fellowを経て,2015年より日本イーライリリー.
研究テーマ:自己免疫疾患の病因.
関心事:免疫学的および哲学的な“寛容”の意味.
© 2015 藤門 範行 Licensed under CC 表示 2.1 日本