時計タンパク質は臨界期のタイミングを制御する
小林洋平・ヘンシュ貴雄
(米国Harvard大学Center for Brain Science)
email:小林洋平
DOI: 10.7875/first.author.2015.042
Clock genes control cortical critical period timing.
Yohei Kobayashi, Zhanlei Ye, Takao K. Hensch
Neuron, 86, 264-275 (2015)
時計タンパク質が発振する概日リズムはさまざまな生理機能を制御しているが,脳における役割は時計中枢である視交叉上核を除き不明な点が多い.筆者らは,幼若期の大脳皮質において神経の可塑性が亢進する臨界期の决定に時計タンパク質が関与することを明らかにした.時計タンパク質のひとつであるCLOCKを欠損したマウスは,大脳皮質の1次視覚野において臨界期が遅延した.これは,抑制性ニューロンのひとつであるパルブアルブミン陽性ニューロンが形成する神経回路が未成熟であることに起因し,GABA伝達の促進により解消された.また,パルブアルブミン陽性ニューロンに存在するCLOCKおよびそのパートナータンパク質であるBMAL1が,パルブアルブミン陽性ニューロンが形成する神経回路の形成および臨界期の决定において重要であり,それらの下流の遺伝子としてシナプスの機能や細胞の恒常性にかかわる遺伝子の関与が示唆された.この研究は,時計タンパク質が脳の発達および神経の可塑性を制御することを示したはじめての報告である.
地球に暮らすわれわれの生活は約24時間周期の概日リズムにより支配されている.菌類から植物および動物にいたるまで,ほとんどの生物は概日リズムに適応するように進化し,個体を構成する大部分の細胞は概日リズムを発振している.この体内時計は睡眠および覚醒,ホルモン分泌,体温および血圧の調節,代謝の制御など,さまざまな生理機能を制御しており,概日リズムの異常は睡眠障害,生活習慣病,精神疾患などにかかわると考えられている1).
1972年の哺乳類の時計中枢である視床下部の視交叉上核の発見に端を発し2,3),脳における概日リズムの研究は視交叉上核を主体として研究されてきた.視交叉上核は網膜から受け取った光の情報をもとに概日リズムを発振し,全身の概日リズムを同調させる中心的な役割をもつと考えられている.また,1997年のClock遺伝子の発見以来,哺乳類において概日リズムの形成にかかわる多くの時計タンパク質が同定された4).時計の進行を正に制御するCLOCK-BMAL1複合体,また,CLOCK-BMAL1複合体により発現が制御され時計の進行を負に制御するPERおよびCRYが負のフィードバックループを形成し,約24時間周期のリズムを発振する.これらの時計タンパク質は視交叉上核のみならず脳のほとんどの領域に存在しているが5),それらの役割はよくわかっていない.とりわけ,概日リズムの異常と精神疾患との関連性をふまえると,高次の脳機能をつかさどる大脳皮質に存在する時計タンパク質の役割を理解することは重要である.
筆者らは,時計タンパク質が哺乳類の大脳皮質の発達および神経の可塑性を制御することを見い出した.時計タンパク質のひとつCLOCKを欠損したマウスでは,経験に依存的に神経の可塑性が誘導される時期である臨界期のタイミングが遅延した.また,抑制性ニューロンのひとつであるパルブアルブミン陽性ニューロンに内在する時計タンパク質が,パルブアルブミン陽性ニューロンが形成する神経回路の形成および臨界期の决定において必要であった.幼若期におけるパルブアルブミン陽性ニューロンの成熟は興奮性の神経伝達および抑制性の神経伝達のバランスを最適化し,臨界期の開始を誘導することが知られている6).この研究により,パルブアルブミン陽性ニューロンに存在する時計タンパク質がパルブアルブミン陽性ニューロンが形成する適切な神経回路の形成を促進し,脳における可塑性の時期を决定していることが明らかにされた.
視交叉上核における概日リズムは出生の直前より観察されるが,大脳皮質における概日リズムの発達についてはよくわかっていない.そこで,マウスの大脳皮質の1次視覚野における概日リズムの形成を,CLOCK-BMAL1複合体により転写の誘導される時計遺伝子,Dbp遺伝子,Per1遺伝子,Per2遺伝子の発現をもとに調べた.これら時計遺伝子の発現の振動は開眼ののち(生後12日)から観察されはじめ,成体(生後60日以降)になるまでに確立された.とくに,時計遺伝子の発現の振動の形成は1次視覚野における臨界期の開始と時期を同じくしていたことから,概日リズムの形成が臨界期に影響を及ぼすとの仮説をたてた.
CLOCK-BMAL1複合体に起因する概日リズムが臨界期にあたえる影響について調べるため,CLOCKノックアウトマウス7) を解析に用いた.CLOCKノックアウトマウスでは大脳皮質の1次視覚野における時計遺伝子Dbp遺伝子の発現は顕著に低下しており,概日リズムの減弱が分子レベルにおいて確認された.
CLOCKの欠損が臨界期の形成にあたえる影響について調べるため,臨界期のマウスおよび成体のマウスにおいて4日間にわたり片眼を遮蔽し,視力を測定することにより大脳皮質の1次視覚野における神経の可塑性の有無を解析した.臨界期における片眼の遮蔽ののち,野生型マウスでは視力の低下が認められ神経の可塑性の存在が確認されたが,CLOCKノックアウトマウスでは視力に変化はなかった.一方,成体における片眼の遮蔽により,野生型マウスでは視力の変化は認められなかったが,CLOCKノックアウトマウスでは視力はいちじるしく低下した.これらの結果から,CLOCKノックアウトマウスでは臨界期が遅れて誘導されることが示された.興味深いことに,臨界期のCLOCKノックアウトマウスにGABA受容体の機能を促進するベンゾジアゼピンを注入したところ,野生型マウスと同様に臨界期においてのみ神経の可塑性が認められた.以上の結果から,CLOCKノックアウトマウスで観察される臨界期の遅延は抑制性の神経伝達の低下によりひき起こされていると考えられた.
CLOCKの欠損がどの神経回路に影響をあたえているかを調べるため,CLOCKノックアウトマウスにおいて興奮性ニューロンおよび抑制性ニューロンの各種のマーカーの発現を定量した.その結果,抑制性ニューロンのマーカーのひとつであるパルブアルブミンの発現のみが臨界期および成体において顕著に低下していた.パルブアルブミンそれ自体の発現に概日リズムは認められなかったことから,パルブアルブミンはCLOCK-BMAL1複合体の直接の標的ではないと考えられた.パルブアルブミン陽性ニューロンが形成する神経回路を免疫染色法により可視化したところ,パルブアルブミン陽性ニューロンの数およびパルブアルブミン陽性ニューロンから興奮性ニューロンへの入力が減少していた.また,パルブアルブミン陽性ニューロンをとりかこむペリニューロナルネットの成熟も遅延していた.ペリニューロナルネットは成体において神経の可塑性を制限することが知られていることから8),ペリニューロナルネットの減少は成体のCLOCKノックアウトマウスにおいて確認された神経の可塑性の一因であると考えられた.さらに,パッチクランプ法により神経伝達を電気生理学的に解析したところ,CLOCKノックアウトマウスにおいては興奮性ニューロンに対する微小抑制性シナプス後電流が減少しており,機能的にも抑制性の神経伝達の低下が示された.
パルブアルブミン陽性ニューロンおよびほかの抑制性ニューロンにおけるCLOCKに依存的な時計タンパク質の発現の制御について調べるため,1次視覚野におけるCLOCKおよびその標的であるPER1の発現を免疫染色法により可視化した.CLOCKは80%以上のパルブアルブミン陽性ニューロンにおいて発現していた一方,ほかの抑制性ニューロンであるソマトスタチン陽性ニューロンおよびカルレチニン陽性ニューロンではその約40%にしか発現していなかった.また,パルブアルブミン陽性ニューロンにおいてCLOCKに依存的なPER1の概日リズムが認められた.
パルブアルブミン陽性ニューロンが形成する神経回路の成熟をCLOCKに依存的に制御する遺伝子を特定するため,野生型マウスおよびCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおける遺伝子発現をマイクロアレイ法により網羅的に解析したところ,シナプスの機能,ミトコンドリアの機能,ATPase活性に関与する遺伝子の発現が有意に変化していた.この結果から,パルブアルブミン陽性ニューロンにおいてシナプスおよび恒常性に関与する遺伝子がCLOCKにより制御され,パルブアルブミン陽性ニューロンが形成する神経回路の成熟および維持にかかわっていることが示唆された.
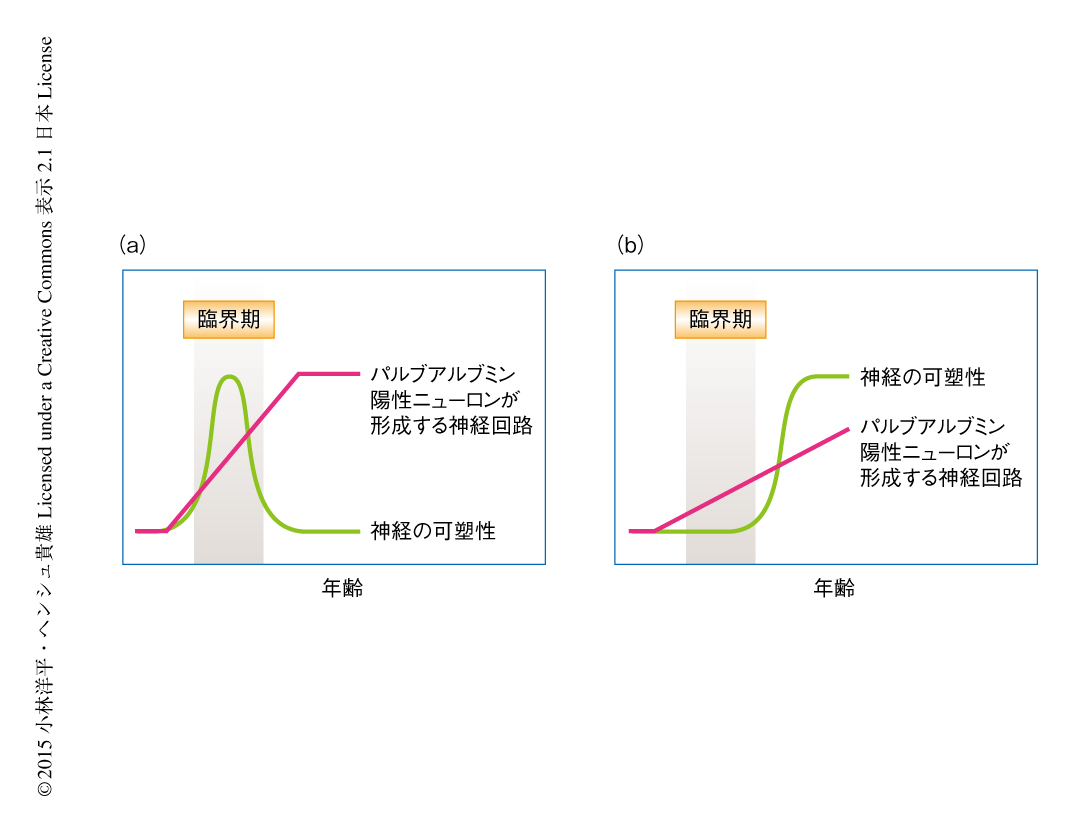
CLOCKのはたらきがパルブアルブミン陽性ニューロンに内在するものによるかどうかを調べるため,パルブアルブミン陽性ニューロンに特異的なCLOCKノックアウトマウスを作製した.このノックアウトマウスでは全身性のCLOCKノックアウトマウスと同様にパルブアルブミン陽性ニューロンが形成する神経回路が未成熟となり,それにともない臨界期の遅延が認められた.また,CLOCKのパートナータンパク質であるBMAL1のパルブアルブミン陽性ニューロンに特異的なノックアウトマウスにおいても同様の結果が得られた.一方で,興奮性ニューロンに特異的なBMAL1ノックアウトマウスではこのような表現型は認められなかった.以上の結果から,パルブアルブミン陽性ニューロンに存在するCLOCK-BMAL1複合体がパルブアルブミン陽性ニューロンが形成する神経回路の成熟を制御し臨界期を决定していることが明らかにされた(図1).
この研究は,視交叉上核の外部の時計タンパク質が脳の発達および神経の可塑性に関与していることをはじめて示した点で重要である.時計タンパク質による遺伝子発現の制御は強い光刺激や睡眠遮断など周囲の環境により影響されることが知られていることから,環境要因がCLOCKに依存的な遺伝子発現を変化させることにより神経の可塑性に影響をあたえることが示唆された.マイクロアレイ法による網羅的な解析によりCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおいて発現が変化していた遺伝子としてシナプスの入力および出力,細胞の恒常性にかかわる遺伝子が同定され,これらが独立あるいは協調的にパルブアルブミン陽性ニューロンが形成する神経回路の成熟にかかわっていると考えられた.興味深いことに,さまざまな精神疾患において時計遺伝子の変異が認められている9).くわえて,パルブアルブミン陽性ニューロンに起因する抑制性の神経伝達もまた自閉症や統合失調症といった精神疾患において変調していること10),また,この研究において同定されたCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおいて発現が変化していた遺伝子の多くもまたこれらの精神疾患において変異が確認されている11,12).パルブアルブミン陽性ニューロンにおける時計タンパク質の役割を明らかにすることにより,精神疾患の原因を根本的に理解する一歩になればと思う.
略歴:2008年 京都大学大学院生命科学研究科博士課程 修了,同年 同 博士研究員を経て,2010年より米国Harvard大学 ポストドクトラルフェロー.
研究テーマ:脳の発達期における臨界期の分子機構.
関心事:2歳になる息子と遊びながら,この子の脳のなかでいったい何が起こっているのだろうと考えをめぐらすこと.
ヘンシュ 貴雄(Takao Hensch)
米国Harvard大学 教授.
研究室URL:http://henschlab.mcb.harvard.edu/
© 2015 小林洋平・ヘンシュ貴雄 Licensed under CC 表示 2.1 日本
(米国Harvard大学Center for Brain Science)
email:小林洋平
DOI: 10.7875/first.author.2015.042
Clock genes control cortical critical period timing.
Yohei Kobayashi, Zhanlei Ye, Takao K. Hensch
Neuron, 86, 264-275 (2015)
要 約
時計タンパク質が発振する概日リズムはさまざまな生理機能を制御しているが,脳における役割は時計中枢である視交叉上核を除き不明な点が多い.筆者らは,幼若期の大脳皮質において神経の可塑性が亢進する臨界期の决定に時計タンパク質が関与することを明らかにした.時計タンパク質のひとつであるCLOCKを欠損したマウスは,大脳皮質の1次視覚野において臨界期が遅延した.これは,抑制性ニューロンのひとつであるパルブアルブミン陽性ニューロンが形成する神経回路が未成熟であることに起因し,GABA伝達の促進により解消された.また,パルブアルブミン陽性ニューロンに存在するCLOCKおよびそのパートナータンパク質であるBMAL1が,パルブアルブミン陽性ニューロンが形成する神経回路の形成および臨界期の决定において重要であり,それらの下流の遺伝子としてシナプスの機能や細胞の恒常性にかかわる遺伝子の関与が示唆された.この研究は,時計タンパク質が脳の発達および神経の可塑性を制御することを示したはじめての報告である.
はじめに
地球に暮らすわれわれの生活は約24時間周期の概日リズムにより支配されている.菌類から植物および動物にいたるまで,ほとんどの生物は概日リズムに適応するように進化し,個体を構成する大部分の細胞は概日リズムを発振している.この体内時計は睡眠および覚醒,ホルモン分泌,体温および血圧の調節,代謝の制御など,さまざまな生理機能を制御しており,概日リズムの異常は睡眠障害,生活習慣病,精神疾患などにかかわると考えられている1).
1972年の哺乳類の時計中枢である視床下部の視交叉上核の発見に端を発し2,3),脳における概日リズムの研究は視交叉上核を主体として研究されてきた.視交叉上核は網膜から受け取った光の情報をもとに概日リズムを発振し,全身の概日リズムを同調させる中心的な役割をもつと考えられている.また,1997年のClock遺伝子の発見以来,哺乳類において概日リズムの形成にかかわる多くの時計タンパク質が同定された4).時計の進行を正に制御するCLOCK-BMAL1複合体,また,CLOCK-BMAL1複合体により発現が制御され時計の進行を負に制御するPERおよびCRYが負のフィードバックループを形成し,約24時間周期のリズムを発振する.これらの時計タンパク質は視交叉上核のみならず脳のほとんどの領域に存在しているが5),それらの役割はよくわかっていない.とりわけ,概日リズムの異常と精神疾患との関連性をふまえると,高次の脳機能をつかさどる大脳皮質に存在する時計タンパク質の役割を理解することは重要である.
筆者らは,時計タンパク質が哺乳類の大脳皮質の発達および神経の可塑性を制御することを見い出した.時計タンパク質のひとつCLOCKを欠損したマウスでは,経験に依存的に神経の可塑性が誘導される時期である臨界期のタイミングが遅延した.また,抑制性ニューロンのひとつであるパルブアルブミン陽性ニューロンに内在する時計タンパク質が,パルブアルブミン陽性ニューロンが形成する神経回路の形成および臨界期の决定において必要であった.幼若期におけるパルブアルブミン陽性ニューロンの成熟は興奮性の神経伝達および抑制性の神経伝達のバランスを最適化し,臨界期の開始を誘導することが知られている6).この研究により,パルブアルブミン陽性ニューロンに存在する時計タンパク質がパルブアルブミン陽性ニューロンが形成する適切な神経回路の形成を促進し,脳における可塑性の時期を决定していることが明らかにされた.
1.大脳皮質における時計遺伝子の発現の振動は幼若期に形成される
視交叉上核における概日リズムは出生の直前より観察されるが,大脳皮質における概日リズムの発達についてはよくわかっていない.そこで,マウスの大脳皮質の1次視覚野における概日リズムの形成を,CLOCK-BMAL1複合体により転写の誘導される時計遺伝子,Dbp遺伝子,Per1遺伝子,Per2遺伝子の発現をもとに調べた.これら時計遺伝子の発現の振動は開眼ののち(生後12日)から観察されはじめ,成体(生後60日以降)になるまでに確立された.とくに,時計遺伝子の発現の振動の形成は1次視覚野における臨界期の開始と時期を同じくしていたことから,概日リズムの形成が臨界期に影響を及ぼすとの仮説をたてた.
2.CLOCKは臨界期のタイミングを决定する
CLOCK-BMAL1複合体に起因する概日リズムが臨界期にあたえる影響について調べるため,CLOCKノックアウトマウス7) を解析に用いた.CLOCKノックアウトマウスでは大脳皮質の1次視覚野における時計遺伝子Dbp遺伝子の発現は顕著に低下しており,概日リズムの減弱が分子レベルにおいて確認された.
CLOCKの欠損が臨界期の形成にあたえる影響について調べるため,臨界期のマウスおよび成体のマウスにおいて4日間にわたり片眼を遮蔽し,視力を測定することにより大脳皮質の1次視覚野における神経の可塑性の有無を解析した.臨界期における片眼の遮蔽ののち,野生型マウスでは視力の低下が認められ神経の可塑性の存在が確認されたが,CLOCKノックアウトマウスでは視力に変化はなかった.一方,成体における片眼の遮蔽により,野生型マウスでは視力の変化は認められなかったが,CLOCKノックアウトマウスでは視力はいちじるしく低下した.これらの結果から,CLOCKノックアウトマウスでは臨界期が遅れて誘導されることが示された.興味深いことに,臨界期のCLOCKノックアウトマウスにGABA受容体の機能を促進するベンゾジアゼピンを注入したところ,野生型マウスと同様に臨界期においてのみ神経の可塑性が認められた.以上の結果から,CLOCKノックアウトマウスで観察される臨界期の遅延は抑制性の神経伝達の低下によりひき起こされていると考えられた.
3.CLOCKはパルブアルブミン陽性ニューロンが形成する神経回路の成熟を制御する
CLOCKの欠損がどの神経回路に影響をあたえているかを調べるため,CLOCKノックアウトマウスにおいて興奮性ニューロンおよび抑制性ニューロンの各種のマーカーの発現を定量した.その結果,抑制性ニューロンのマーカーのひとつであるパルブアルブミンの発現のみが臨界期および成体において顕著に低下していた.パルブアルブミンそれ自体の発現に概日リズムは認められなかったことから,パルブアルブミンはCLOCK-BMAL1複合体の直接の標的ではないと考えられた.パルブアルブミン陽性ニューロンが形成する神経回路を免疫染色法により可視化したところ,パルブアルブミン陽性ニューロンの数およびパルブアルブミン陽性ニューロンから興奮性ニューロンへの入力が減少していた.また,パルブアルブミン陽性ニューロンをとりかこむペリニューロナルネットの成熟も遅延していた.ペリニューロナルネットは成体において神経の可塑性を制限することが知られていることから8),ペリニューロナルネットの減少は成体のCLOCKノックアウトマウスにおいて確認された神経の可塑性の一因であると考えられた.さらに,パッチクランプ法により神経伝達を電気生理学的に解析したところ,CLOCKノックアウトマウスにおいては興奮性ニューロンに対する微小抑制性シナプス後電流が減少しており,機能的にも抑制性の神経伝達の低下が示された.
4.CLOCKはパルブアルブミン陽性ニューロンにおいて特定の遺伝子の発現を制御する
パルブアルブミン陽性ニューロンおよびほかの抑制性ニューロンにおけるCLOCKに依存的な時計タンパク質の発現の制御について調べるため,1次視覚野におけるCLOCKおよびその標的であるPER1の発現を免疫染色法により可視化した.CLOCKは80%以上のパルブアルブミン陽性ニューロンにおいて発現していた一方,ほかの抑制性ニューロンであるソマトスタチン陽性ニューロンおよびカルレチニン陽性ニューロンではその約40%にしか発現していなかった.また,パルブアルブミン陽性ニューロンにおいてCLOCKに依存的なPER1の概日リズムが認められた.
パルブアルブミン陽性ニューロンが形成する神経回路の成熟をCLOCKに依存的に制御する遺伝子を特定するため,野生型マウスおよびCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおける遺伝子発現をマイクロアレイ法により網羅的に解析したところ,シナプスの機能,ミトコンドリアの機能,ATPase活性に関与する遺伝子の発現が有意に変化していた.この結果から,パルブアルブミン陽性ニューロンにおいてシナプスおよび恒常性に関与する遺伝子がCLOCKにより制御され,パルブアルブミン陽性ニューロンが形成する神経回路の成熟および維持にかかわっていることが示唆された.
5.パルブアルブミン陽性ニューロンに内在するCLOCKが臨界期のタイミングを决定する
CLOCKのはたらきがパルブアルブミン陽性ニューロンに内在するものによるかどうかを調べるため,パルブアルブミン陽性ニューロンに特異的なCLOCKノックアウトマウスを作製した.このノックアウトマウスでは全身性のCLOCKノックアウトマウスと同様にパルブアルブミン陽性ニューロンが形成する神経回路が未成熟となり,それにともない臨界期の遅延が認められた.また,CLOCKのパートナータンパク質であるBMAL1のパルブアルブミン陽性ニューロンに特異的なノックアウトマウスにおいても同様の結果が得られた.一方で,興奮性ニューロンに特異的なBMAL1ノックアウトマウスではこのような表現型は認められなかった.以上の結果から,パルブアルブミン陽性ニューロンに存在するCLOCK-BMAL1複合体がパルブアルブミン陽性ニューロンが形成する神経回路の成熟を制御し臨界期を决定していることが明らかにされた(図1).
おわりに
この研究は,視交叉上核の外部の時計タンパク質が脳の発達および神経の可塑性に関与していることをはじめて示した点で重要である.時計タンパク質による遺伝子発現の制御は強い光刺激や睡眠遮断など周囲の環境により影響されることが知られていることから,環境要因がCLOCKに依存的な遺伝子発現を変化させることにより神経の可塑性に影響をあたえることが示唆された.マイクロアレイ法による網羅的な解析によりCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおいて発現が変化していた遺伝子としてシナプスの入力および出力,細胞の恒常性にかかわる遺伝子が同定され,これらが独立あるいは協調的にパルブアルブミン陽性ニューロンが形成する神経回路の成熟にかかわっていると考えられた.興味深いことに,さまざまな精神疾患において時計遺伝子の変異が認められている9).くわえて,パルブアルブミン陽性ニューロンに起因する抑制性の神経伝達もまた自閉症や統合失調症といった精神疾患において変調していること10),また,この研究において同定されたCLOCKノックアウトマウスのパルブアルブミン陽性ニューロンにおいて発現が変化していた遺伝子の多くもまたこれらの精神疾患において変異が確認されている11,12).パルブアルブミン陽性ニューロンにおける時計タンパク質の役割を明らかにすることにより,精神疾患の原因を根本的に理解する一歩になればと思う.
文 献
- Takahashi, J. S., Hong, H. K., Ko, C. H. et al.: The genetics of mammalian circadian order and disorder: implications for physiology and disease. Nat. Rev. Genet., 9, 764-775 (2008)[PubMed]
- Moore, R. Y. & Eichler, V. B.: Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat. Brain Res., 42, 201-206 (1972)[PubMed]
- Stephan, F. K. & Zucker, I.: Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions. Proc. Natl. Acad. Sci. USA, 69, 1583-1586 (1972)[PubMed]
- Lowrey, P. L. & Takahashi, J. S.: Genetics of circadian rhythms in mammalian model organisms. Adv. Genet., 74, 175-230 (2011)[PubMed]
- Yan, L., Miyake, S. & Okamura, H.: Distribution and circadian expression of dbp in SCN and extra-SCN areas in the mouse brain. J. Neurosci. Res., 59, 291-295 (2000)[PubMed]
- Hensch, T. K.: Critical period plasticity in local cortical circuits. Nat. Rev. Neurosci., 6, 877-888 (2005)[PubMed]
- Debruyne, J. P., Noton, E., Lambert, C. M. et al.: A clock shock: mouse CLOCK is not required for circadian oscillator function. Neuron, 50, 465-477 (2006)[PubMed]
- Pizzorusso, T., Medini, P., Berardi, N. et al.: Reactivation of ocular dominance plasticity in the adult visual cortex. Science, 298, 1248-1251 (2002)[PubMed]
- Wulff, K., Gatti, S., Wettstein, J. G. et al.: Sleep and circadian rhythm disruption in psychiatric and neurodegenerative disease. Nat. Rev. Neurosci., 11, 589-599 (2010)[PubMed]
- Marin, O.: Interneuron dysfunction in psychiatric disorders. Nat. Rev. Neurosci., 13, 107-120 (2012)[PubMed]
- Basu, S. N., Kollu, R., Banerjee-Basu, S.: AutDB: a gene reference resource for autism research. Nucleic Acids Res., 37, D832-D836 (2009)[PubMed]
- Allen, N. C., Bagade, S., McQueen, M. B. et al.: Systematic meta-analyses and field synopsis of genetic association studies in schizophrenia: the SzGene database. Nat. Genet., 40, 827-834 (2008)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院生命科学研究科博士課程 修了,同年 同 博士研究員を経て,2010年より米国Harvard大学 ポストドクトラルフェロー.
研究テーマ:脳の発達期における臨界期の分子機構.
関心事:2歳になる息子と遊びながら,この子の脳のなかでいったい何が起こっているのだろうと考えをめぐらすこと.
ヘンシュ 貴雄(Takao Hensch)
米国Harvard大学 教授.
研究室URL:http://henschlab.mcb.harvard.edu/
© 2015 小林洋平・ヘンシュ貴雄 Licensed under CC 表示 2.1 日本