ヒト成人からの褐色脂肪細胞株の単離およびその性状の解析
篠田幸作・梶村真吾
(米国California大学San Francisco校UCSF Diabetes Center)
email:篠田幸作,梶村真吾
DOI: 10.7875/first.author.2015.039
Genetic and functional characterization of clonally derived adult human brown adipocytes.
Kosaku Shinoda, Ineke H. N. Luijten, Yutaka Hasegawa, Haemin Hong, Si B. Sonne, Miae Kim, Ruidan Xue, Maria Chondronikola, Aaron M. Cypess, Yu-Hua Tseng, Jan Nedergaard, Labros S. Sidossis, Shingo Kajimura
Nature Medicine, 21, 389-394 (2015)
哺乳類には余剰なエネルギーを蓄積する白色脂肪組織とエネルギーを消費し熱を産生する褐色脂肪組織の2種類の脂肪組織が存在する.従来は,寒冷に弱い乳幼児や冬眠動物のみが褐色脂肪組織をもつと考えられていたが,イメージング技術の発達により,一部のヒト成人も褐色脂肪組織をもち,その活性は肥満やインスリン抵抗性と負に相関することが明らかにされた.さらに近年,おだやかな寒冷刺激,食品の成分,β3アドレナリン受容体のアゴニストが,ヒトの褐色脂肪組織の分化を誘導および活性化し全身のエネルギー消費に寄与するという報告があいつぎ,エネルギーの摂取を抑制するのでなく,褐色脂肪細胞によるエネルギーの消費を上昇させるという,代謝性疾患に対する新しいコンセプトによる治療法が現実味をおびてきている.この論文においては,ヒト成人の褐色脂肪組織から単一のクローンに由来する褐色脂肪細胞株を樹立し,そのトランスクリプトームを解析しヒトとマウスに共通する2つのマーカー遺伝子KCNK3遺伝子およびMTUS1遺伝子を同定した.さらに,マウスの褐色脂肪細胞のトランスクリプトームとの統合解析により,ヒト成人のもつ褐色脂肪細胞は乳幼児が肩甲骨の付近にもつ古典的な褐色脂肪細胞とは異なる,誘導型の褐色脂肪細胞であることを見い出した.
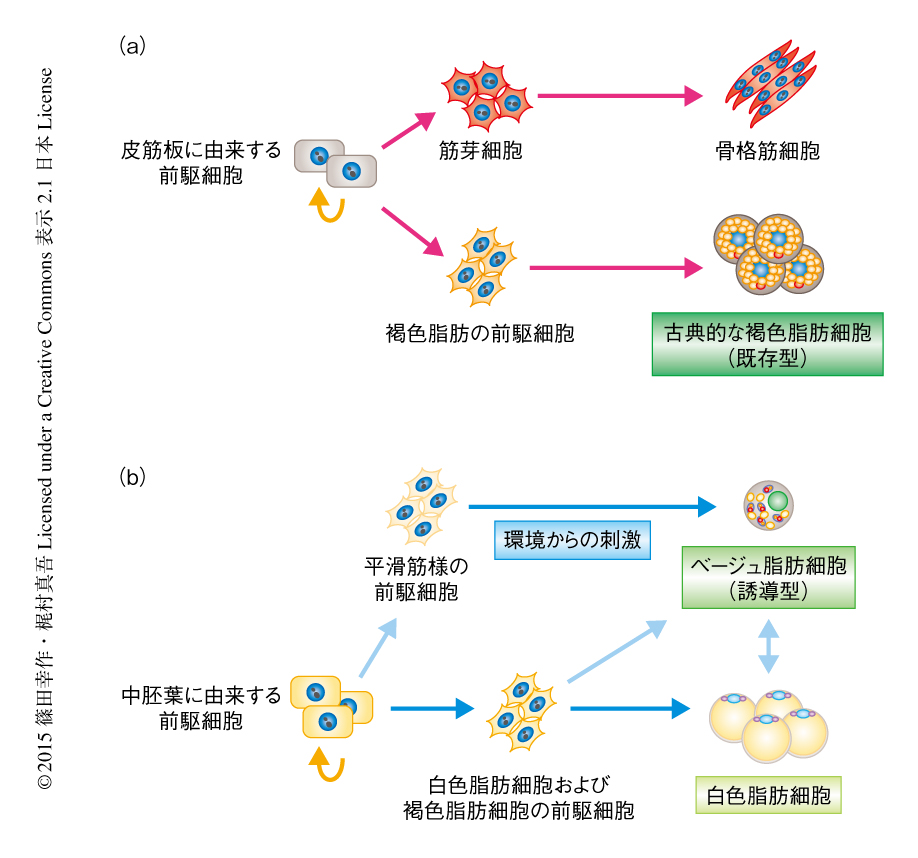
マウスには少なくとも2つの褐色脂肪細胞のあることが知られている(図1).肩甲骨の付近に存在する褐色脂肪細胞は,胎仔期に骨格筋細胞と共通のMyf5陽性の筋前駆細胞から分化し,古典的な褐色脂肪細胞とよばれる.一方,成体期の皮下の白色脂肪組織に散在的に出現するUCP1陽性の細胞は,白色脂肪細胞が褐色化するという古典的な褐色脂肪細胞とは異なる細胞系譜をたどり,白色と褐色の中間色からベージュ脂肪細胞とよばれる.古典的な褐色脂肪細胞の分化が胎仔期に完成するのに対し(既存型),ベージュ脂肪細胞は成体期においても寒冷刺激,一部の糖尿病治療薬の投与1),ホルモン様の刺激2) に応じて分化が誘導されるという高い可塑性を維持している(誘導型).ヒトにおいては,中高齢者および肥満症の患者の多くは褐色脂肪組織を失っている一方,複数のグループから,褐色脂肪組織をもたないヒトでも長期の寒冷刺激により褐色脂肪組織の分化を誘導できるという報告がなされている3-5).よって,応用においては,既存型の褐色脂肪細胞による熱の産生を活性化するより,ベージュ脂肪細胞の分化にはたらく遺伝子プログラムを理解しin vivoにおいて褐色脂肪細胞の分化を誘導するというアプローチが重要だと考えられる.2012年,筆者らおよび別の研究グループは,ヒトの褐色脂肪組織がマウスのベージュ脂肪細胞に特異的なマーカー遺伝子を発現していることを報告した6,7).一方,ヒトの褐色脂肪組織をin vitroにおいて培養するとマウスの古典的な褐色脂肪細胞に特異的なマーカー遺伝子を発現するという報告もある8).この不一致は,脂肪前駆細胞,血管系細胞,内皮細胞,免疫細胞などが混合したヘテロな組織を解析している点,および,遺伝子発現の全体(トランスクリプトーム)ではなく,数個のマーカー遺伝子の発現から結論を導いている点に由来すると考えられた.そこで,筆者らは,ヒト成人から単一のクローンに由来する褐色脂肪細胞株を樹立し,さらに,対照として同じ方法により白色脂肪細胞株も樹立して,これらすべてのトランスクリプトームを包括的かつ統合的に解析した.
30~40歳代かつ標準体型の被験者2名の鎖骨の上部から褐色脂肪組織を採取し,初代培養細胞にしたのち,細胞を不死化させた.脂肪細胞への分化が確認された23のサブクローンから限界希釈法により1細胞のクローンを単離した.得られた65細胞株のうち7細胞株がin vitroにおける脂肪細胞への高い分化能,および,褐色脂肪細胞の遺伝子マーカーの発現を示した.とくに,寒冷刺激を模倣した4時間のフォルスコリンの刺激ののち褐色脂肪細胞の遺伝子マーカーが褐色脂肪組織と同等のレベルまで発現した3つのクローンがin vivoにおける褐色脂肪細胞をもっともよく模倣する細胞株であると考え,同じプロトコールによりヒトの白色脂肪組織から単離した白色脂肪細胞株とともに,次世代シークエンサーを用いたRNA塩基配列解析(RNA-seq)によりトランスクリプトームを得た.また,これら3つの褐色脂肪細胞株はcAMPに対し依存性の高い細胞呼吸能および脂肪の分解能をもち,遺伝子発現の点においても機能の点においても高い“褐色脂肪細胞らしさ”を保持していた.
2012年に発表された,マウスの皮下の脂肪組織から単離されたベージュ脂肪細胞株および肩甲骨の付近から単離された古典的な褐色脂肪細胞株のトランスクリプトーム7) と,今回のヒト成人の褐色脂肪細胞株のトランスクリプトームを,Ensemblの相同遺伝子情報をもとに統合し,ヒト成人の褐色脂肪細胞の遺伝子発現プロファイルはマウスの古典的な褐色脂肪細胞とベージュ脂肪細胞のどちらに近いのか解析した.階層的クラスタリングでは,樹立された3つの褐色脂肪細胞株すべてがマウスのベージュ脂肪細胞と同じクラスターに分類された.また,それとは異なる多変量解析法を用いても,あるいは,多変量解析に供する遺伝子の数を増減させても,同様の結果が得られた.これらの結果から,ヒト成人の褐色脂肪細胞はマウスのベージュ脂肪細胞に相当するという結論が強く支持された.
統合されたトランスクリプトームのデータをもとに,ヒト成人とマウスに共通するマーカー遺伝子の同定を試みた.ヒト成人の褐色脂肪細胞,マウスのベージュ脂肪細胞,マウスの古典的な褐色脂肪細胞,のそれぞれにおいて高く発現する遺伝子をリスト化した.これらから,ヒト成人の褐色脂肪細胞とマウスのベージュ脂肪細胞とにだけ共通する92の遺伝子,および,これら3つすべてに共通する99の遺伝子を同定した.これらの遺伝子から,褐色脂肪細胞株において絶対発現量が多い,3つの細胞株で発現のばらつきが少ない,独立したコホート6) により得られたヒトの褐色脂肪組織における発現パターン,の観点から絞り込み,マーカー遺伝子の有望な候補としてKCNK3遺伝子およびMTUS1遺伝子を選択した.
同一のヒトから採取された8つのペアの白色脂肪組織および褐色脂肪組織におけるKCNK3遺伝子およびMTUS1遺伝子の発現を定量RT-PCR法により定量したところ,褐色脂肪組織において有意に高い発現が確認された.まったく独立したコホートにおけるヒトの脂肪組織のマイクロアレイデータ9,10) の再解析によっても,KCNK3遺伝子およびMTUS1遺伝子の褐色脂肪組織における高い発現が確認された.さらに,褐色脂肪細胞を活性化する外的なシグナルがKCNK3遺伝子およびMTUS1遺伝子の発現をどのように変化させるかについて調べた.褐色脂肪細胞が不活性な室温30℃,および,寒さを感じるが筋肉のふるえは起こらず褐色脂肪細胞のみが活性化される室温19℃において,同一のヒトから褐色脂肪組織を採取し遺伝子の発現を定量RT-PCR法により定量したところ,19℃の寒冷刺激はKCNK3遺伝子の発現を2倍~20倍に,MTUS1遺伝子の発現を2倍~300倍に上昇させることがわかった.寒冷刺激を模倣する選択的なβ3アドレナリン受容体のアゴニストを投与したマウスの皮下の脂肪組織においても,KCNK3遺伝子およびMTUS1遺伝子の発現はいちじるしく上昇していた.これらの結果から,KCNK3遺伝子およびMTUS1遺伝子はヒトの褐色脂肪細胞およびマウスのベージュ脂肪細胞に特異的に発現し,それらの量および活性の遺伝子マーカーになることが明らかにされた.
KCNK3遺伝子およびMTUS1遺伝子の機能をRNAi法によるノックダウンにより調べた.マウスの鼠蹊部に由来する白色脂肪細胞にKcnk3遺伝子あるいはMtus1遺伝子を標的とするsiRNAを導入したのち,PPARγのアゴニストをくわえ4日間にわたり培養することによりベージュ脂肪細胞の分化を誘導した.その結果,ノックダウンにより,ベージュ脂肪細胞に対するマーカー遺伝子の発現および熱産生遺伝子の発現のいちじるしい低下,および,cAMPに対し依存性の高い細胞呼吸能の有意な低下をひき起こした.一方,古典的な褐色脂肪細胞においてのみ高く発現するFzd8遺伝子を標的とするsiRNAを導入してもベージュ脂肪細胞の機能は消失しなかった.すなわち,KCNK3遺伝子およびMTUS1遺伝子はベージュ脂肪細胞の分化および機能に必要であることがわかった.
今回,ヒト成人から褐色脂肪細胞株を樹立し,その遺伝子発現の全体像をとらえることにより,ヒト成人において熱を産生する細胞はベージュ脂肪細胞であることが示された.ベージュ脂肪細胞は,遺伝子発現プロファイルおよび発生学的な起源は古典的な褐色脂胞細胞と異なるが,ベージュ脂肪細胞に熱の産生のほかに特異的な機能があるのかなど,不明な点は多い.今回,同定されたマーカー遺伝子とマウスの遺伝学を駆使しベージュ脂肪細胞の全身における代謝恒常性の維持への役割を調べることが,ヒトにおける肥満および糖尿病の治療へとつながると考えられる.また,マウスにおいてベージュ脂肪細胞の分化を制御する遺伝子が変異を示すヒトの疾患が知られている11,12).発展がいちじるしいゲノム編集技術を用いて,これらの遺伝子の変異をヒト褐色脂肪細胞株に導入することにより,ヒトの細胞においてこのような疾患のモデルとなる新たなプラットフォームを構築することができると考えている.
略歴:2012年 慶應義塾大学大学院政策・メディア研究科 修了,2011年より米国California大学San Francisco校 研究員.
研究テーマ:ベージュ脂肪細胞のゲノミクス,プロテオミクス,バイオインフォマティクス.
関心事:今年,サンフランシスコジャイアンツに移籍した青木選手の活躍.
梶村 真吾(Shingo Kajimura)
米国California大学San Francisco校Assistant Professor.
研究室URL:http://kajimuralab.ucsf.edu/
© 2015 篠田幸作・梶村真吾 Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校UCSF Diabetes Center)
email:篠田幸作,梶村真吾
DOI: 10.7875/first.author.2015.039
Genetic and functional characterization of clonally derived adult human brown adipocytes.
Kosaku Shinoda, Ineke H. N. Luijten, Yutaka Hasegawa, Haemin Hong, Si B. Sonne, Miae Kim, Ruidan Xue, Maria Chondronikola, Aaron M. Cypess, Yu-Hua Tseng, Jan Nedergaard, Labros S. Sidossis, Shingo Kajimura
Nature Medicine, 21, 389-394 (2015)
要 約
哺乳類には余剰なエネルギーを蓄積する白色脂肪組織とエネルギーを消費し熱を産生する褐色脂肪組織の2種類の脂肪組織が存在する.従来は,寒冷に弱い乳幼児や冬眠動物のみが褐色脂肪組織をもつと考えられていたが,イメージング技術の発達により,一部のヒト成人も褐色脂肪組織をもち,その活性は肥満やインスリン抵抗性と負に相関することが明らかにされた.さらに近年,おだやかな寒冷刺激,食品の成分,β3アドレナリン受容体のアゴニストが,ヒトの褐色脂肪組織の分化を誘導および活性化し全身のエネルギー消費に寄与するという報告があいつぎ,エネルギーの摂取を抑制するのでなく,褐色脂肪細胞によるエネルギーの消費を上昇させるという,代謝性疾患に対する新しいコンセプトによる治療法が現実味をおびてきている.この論文においては,ヒト成人の褐色脂肪組織から単一のクローンに由来する褐色脂肪細胞株を樹立し,そのトランスクリプトームを解析しヒトとマウスに共通する2つのマーカー遺伝子KCNK3遺伝子およびMTUS1遺伝子を同定した.さらに,マウスの褐色脂肪細胞のトランスクリプトームとの統合解析により,ヒト成人のもつ褐色脂肪細胞は乳幼児が肩甲骨の付近にもつ古典的な褐色脂肪細胞とは異なる,誘導型の褐色脂肪細胞であることを見い出した.
はじめに
マウスには少なくとも2つの褐色脂肪細胞のあることが知られている(図1).肩甲骨の付近に存在する褐色脂肪細胞は,胎仔期に骨格筋細胞と共通のMyf5陽性の筋前駆細胞から分化し,古典的な褐色脂肪細胞とよばれる.一方,成体期の皮下の白色脂肪組織に散在的に出現するUCP1陽性の細胞は,白色脂肪細胞が褐色化するという古典的な褐色脂肪細胞とは異なる細胞系譜をたどり,白色と褐色の中間色からベージュ脂肪細胞とよばれる.古典的な褐色脂肪細胞の分化が胎仔期に完成するのに対し(既存型),ベージュ脂肪細胞は成体期においても寒冷刺激,一部の糖尿病治療薬の投与1),ホルモン様の刺激2) に応じて分化が誘導されるという高い可塑性を維持している(誘導型).ヒトにおいては,中高齢者および肥満症の患者の多くは褐色脂肪組織を失っている一方,複数のグループから,褐色脂肪組織をもたないヒトでも長期の寒冷刺激により褐色脂肪組織の分化を誘導できるという報告がなされている3-5).よって,応用においては,既存型の褐色脂肪細胞による熱の産生を活性化するより,ベージュ脂肪細胞の分化にはたらく遺伝子プログラムを理解しin vivoにおいて褐色脂肪細胞の分化を誘導するというアプローチが重要だと考えられる.2012年,筆者らおよび別の研究グループは,ヒトの褐色脂肪組織がマウスのベージュ脂肪細胞に特異的なマーカー遺伝子を発現していることを報告した6,7).一方,ヒトの褐色脂肪組織をin vitroにおいて培養するとマウスの古典的な褐色脂肪細胞に特異的なマーカー遺伝子を発現するという報告もある8).この不一致は,脂肪前駆細胞,血管系細胞,内皮細胞,免疫細胞などが混合したヘテロな組織を解析している点,および,遺伝子発現の全体(トランスクリプトーム)ではなく,数個のマーカー遺伝子の発現から結論を導いている点に由来すると考えられた.そこで,筆者らは,ヒト成人から単一のクローンに由来する褐色脂肪細胞株を樹立し,さらに,対照として同じ方法により白色脂肪細胞株も樹立して,これらすべてのトランスクリプトームを包括的かつ統合的に解析した.
1.ヒト成人からの褐色脂肪細胞株の単離
30~40歳代かつ標準体型の被験者2名の鎖骨の上部から褐色脂肪組織を採取し,初代培養細胞にしたのち,細胞を不死化させた.脂肪細胞への分化が確認された23のサブクローンから限界希釈法により1細胞のクローンを単離した.得られた65細胞株のうち7細胞株がin vitroにおける脂肪細胞への高い分化能,および,褐色脂肪細胞の遺伝子マーカーの発現を示した.とくに,寒冷刺激を模倣した4時間のフォルスコリンの刺激ののち褐色脂肪細胞の遺伝子マーカーが褐色脂肪組織と同等のレベルまで発現した3つのクローンがin vivoにおける褐色脂肪細胞をもっともよく模倣する細胞株であると考え,同じプロトコールによりヒトの白色脂肪組織から単離した白色脂肪細胞株とともに,次世代シークエンサーを用いたRNA塩基配列解析(RNA-seq)によりトランスクリプトームを得た.また,これら3つの褐色脂肪細胞株はcAMPに対し依存性の高い細胞呼吸能および脂肪の分解能をもち,遺伝子発現の点においても機能の点においても高い“褐色脂肪細胞らしさ”を保持していた.
2.ヒト成人の褐色脂肪細胞のトランスクリプトームはマウスのベージュ脂肪細胞に酷似する
2012年に発表された,マウスの皮下の脂肪組織から単離されたベージュ脂肪細胞株および肩甲骨の付近から単離された古典的な褐色脂肪細胞株のトランスクリプトーム7) と,今回のヒト成人の褐色脂肪細胞株のトランスクリプトームを,Ensemblの相同遺伝子情報をもとに統合し,ヒト成人の褐色脂肪細胞の遺伝子発現プロファイルはマウスの古典的な褐色脂肪細胞とベージュ脂肪細胞のどちらに近いのか解析した.階層的クラスタリングでは,樹立された3つの褐色脂肪細胞株すべてがマウスのベージュ脂肪細胞と同じクラスターに分類された.また,それとは異なる多変量解析法を用いても,あるいは,多変量解析に供する遺伝子の数を増減させても,同様の結果が得られた.これらの結果から,ヒト成人の褐色脂肪細胞はマウスのベージュ脂肪細胞に相当するという結論が強く支持された.
3.ヒト成人の褐色脂肪細胞における新規の遺伝子マーカー
統合されたトランスクリプトームのデータをもとに,ヒト成人とマウスに共通するマーカー遺伝子の同定を試みた.ヒト成人の褐色脂肪細胞,マウスのベージュ脂肪細胞,マウスの古典的な褐色脂肪細胞,のそれぞれにおいて高く発現する遺伝子をリスト化した.これらから,ヒト成人の褐色脂肪細胞とマウスのベージュ脂肪細胞とにだけ共通する92の遺伝子,および,これら3つすべてに共通する99の遺伝子を同定した.これらの遺伝子から,褐色脂肪細胞株において絶対発現量が多い,3つの細胞株で発現のばらつきが少ない,独立したコホート6) により得られたヒトの褐色脂肪組織における発現パターン,の観点から絞り込み,マーカー遺伝子の有望な候補としてKCNK3遺伝子およびMTUS1遺伝子を選択した.
同一のヒトから採取された8つのペアの白色脂肪組織および褐色脂肪組織におけるKCNK3遺伝子およびMTUS1遺伝子の発現を定量RT-PCR法により定量したところ,褐色脂肪組織において有意に高い発現が確認された.まったく独立したコホートにおけるヒトの脂肪組織のマイクロアレイデータ9,10) の再解析によっても,KCNK3遺伝子およびMTUS1遺伝子の褐色脂肪組織における高い発現が確認された.さらに,褐色脂肪細胞を活性化する外的なシグナルがKCNK3遺伝子およびMTUS1遺伝子の発現をどのように変化させるかについて調べた.褐色脂肪細胞が不活性な室温30℃,および,寒さを感じるが筋肉のふるえは起こらず褐色脂肪細胞のみが活性化される室温19℃において,同一のヒトから褐色脂肪組織を採取し遺伝子の発現を定量RT-PCR法により定量したところ,19℃の寒冷刺激はKCNK3遺伝子の発現を2倍~20倍に,MTUS1遺伝子の発現を2倍~300倍に上昇させることがわかった.寒冷刺激を模倣する選択的なβ3アドレナリン受容体のアゴニストを投与したマウスの皮下の脂肪組織においても,KCNK3遺伝子およびMTUS1遺伝子の発現はいちじるしく上昇していた.これらの結果から,KCNK3遺伝子およびMTUS1遺伝子はヒトの褐色脂肪細胞およびマウスのベージュ脂肪細胞に特異的に発現し,それらの量および活性の遺伝子マーカーになることが明らかにされた.
4.KCNK3遺伝子およびMTUS1遺伝子はベージュ脂肪細胞の分化および機能に必要である
KCNK3遺伝子およびMTUS1遺伝子の機能をRNAi法によるノックダウンにより調べた.マウスの鼠蹊部に由来する白色脂肪細胞にKcnk3遺伝子あるいはMtus1遺伝子を標的とするsiRNAを導入したのち,PPARγのアゴニストをくわえ4日間にわたり培養することによりベージュ脂肪細胞の分化を誘導した.その結果,ノックダウンにより,ベージュ脂肪細胞に対するマーカー遺伝子の発現および熱産生遺伝子の発現のいちじるしい低下,および,cAMPに対し依存性の高い細胞呼吸能の有意な低下をひき起こした.一方,古典的な褐色脂肪細胞においてのみ高く発現するFzd8遺伝子を標的とするsiRNAを導入してもベージュ脂肪細胞の機能は消失しなかった.すなわち,KCNK3遺伝子およびMTUS1遺伝子はベージュ脂肪細胞の分化および機能に必要であることがわかった.
おわりに
今回,ヒト成人から褐色脂肪細胞株を樹立し,その遺伝子発現の全体像をとらえることにより,ヒト成人において熱を産生する細胞はベージュ脂肪細胞であることが示された.ベージュ脂肪細胞は,遺伝子発現プロファイルおよび発生学的な起源は古典的な褐色脂胞細胞と異なるが,ベージュ脂肪細胞に熱の産生のほかに特異的な機能があるのかなど,不明な点は多い.今回,同定されたマーカー遺伝子とマウスの遺伝学を駆使しベージュ脂肪細胞の全身における代謝恒常性の維持への役割を調べることが,ヒトにおける肥満および糖尿病の治療へとつながると考えられる.また,マウスにおいてベージュ脂肪細胞の分化を制御する遺伝子が変異を示すヒトの疾患が知られている11,12).発展がいちじるしいゲノム編集技術を用いて,これらの遺伝子の変異をヒト褐色脂肪細胞株に導入することにより,ヒトの細胞においてこのような疾患のモデルとなる新たなプラットフォームを構築することができると考えている.
文 献
- Ohno, H., Shinoda, K., Spiegelman, B. M. et al.: PPARγ agonists induce a white-to-brown fat conversion through stabilization of PRDM16 protein. Cell Metab., 15, 395-404 (2012)[PubMed] [新着論文レビュー]
- Bostrom, P., Wu, J., Jedrychowski, M. P. et al.: A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature, 481, 463-468 (2012)[PubMed]
- Yoneshiro, T., Aita, S., Matsushita, M. et al.: Recruited brown adipose tissue as an antiobesity agent in humans. J. Clin. Invest., 123, 3404-3408 (2013)[PubMed]
- van der Lans, A. A., Hoeks, J., Brans, B. et al.: Cold acclimation recruits human brown fat and increases nonshivering thermogenesis. J. Clin. Invest., 123, 3395-3403 (2013)[PubMed]
- Lee, P., Smith, S., Linderman, J. et al.: Temperature-acclimated brown adipose tissue modulates insulin sensitivity in humans. Diabetes, 63, 3686-3698 (2014)[PubMed]
- Sharp, L. Z., Shinoda, K., Ohno, H. et al.: Human BAT possesses molecular signatures that resemble beige/brite cells. PLoS One, 7, e49452 (2012)[PubMed]
- Wu, J., Bostrom, P., Sparks, L. M. et al.: Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell, 150, 366-376 (2012)[PubMed]
- Jespersen, N. Z., Larsen, T. J., Peijs, L. et al.: A classical brown adipose tissue mRNA signature partly overlaps with brite in the supraclavicular region of adult humans. Cell Metab., 17, 798-805 (2013)[PubMed]
- Svensson, P. A., Jernas, M., Sjoholm, K. et al.: Gene expression in human brown adipose tissue. Int. J. Mol. Med., 27, 227-232 (2011)[PubMed]
- Sondergaard, E., Gormsen, L. C., Christensen, M. H. et al.: Chronic adrenergic stimulation induces brown adipose tissue differentiation in visceral adipose tissue. Diabet. Med., 32, e4-e8 (2015)[PubMed]
- Ohno, H., Shinoda, K., Ohyama, K. et al.: EHMT1 controls brown adipose cell fate and thermogenesis through the PRDM16 complex. Nature, 504, 163-167 (2013)[PubMed] [新着論文レビュー]
- Kleefstra, T., Smidt, M., Banning, M. J. et al.: Disruption of the gene euchromatin histone methyltransferase1 (EHMT1) is associated with the 9q34 subtelomeric deletion syndrome. J. Med. Genet., 42, 299-306 (2005)[PubMed]
著者プロフィール
略歴:2012年 慶應義塾大学大学院政策・メディア研究科 修了,2011年より米国California大学San Francisco校 研究員.
研究テーマ:ベージュ脂肪細胞のゲノミクス,プロテオミクス,バイオインフォマティクス.
関心事:今年,サンフランシスコジャイアンツに移籍した青木選手の活躍.
梶村 真吾(Shingo Kajimura)
米国California大学San Francisco校Assistant Professor.
研究室URL:http://kajimuralab.ucsf.edu/
© 2015 篠田幸作・梶村真吾 Licensed under CC 表示 2.1 日本