視交叉上核のバソプレシン産生ニューロンの細胞時計はニューロンのあいだの連絡の制御をとおし行動の概日リズムを制御する
三枝 理博
(金沢大学医薬保健研究域医学系 分子神経科学・統合生理学分野)
email:三枝理博
DOI: 10.7875/first.author.2015.034
Cellular clocks in AVP neurons of the SCN are critical for interneuronal coupling regulating circadian behavior rhythm.
Michihiro Mieda, Daisuke Ono, Emi Hasegawa, Hitoshi Okamoto, Ken-ichi Honma, Sato Honma, Takeshi Sakurai
Neuron, 85, 1103-1116 (2015)
視交叉上核の中枢概日時計はさまざまなタイプのニューロンから構成される神経ネットワークである.おのおののニューロンは自律的に概日リズムをきざむ能力をある程度もつが,視交叉上核が中枢概日時計として強固で安定した概日リズムを発振するためにはニューロンのあいだの相互の連絡が必須である.筆者らは,視交叉上核の神経ネットワークの動作の原理を理解するためには,ニューロンのタイプごとの役割を明らかにしていくアプローチが有効と考えた.この研究においては,バソプレシン産生ニューロンにおいて特異的に細胞時計を欠損したマウスを作製した.その解析により,バソプレシン産生ニューロンにおいて細胞時計が機能することによりニューロンのあいだの連絡に重要なタンパク質の発現が促進され,視交叉上核のニューロンの発振する概日リズムが安定し,動物が適切な概日リズムの周期および活動時間をもって行動するよう制御されることが示唆された.
動物の行動やさまざまな身体機能は概日リズムとよばれる約1日周期のリズムをきざむ.哺乳類の概日リズムの制御中枢は視床下部の視交叉上核である1).視交叉上核の中枢概日時計は自律的に概日リズムを発振し全身へ時間情報を送る一方,網膜から伝えられる光の情報により制御され外界の昼夜サイクルに同調する.
これまでに,時計遺伝子の転写翻訳フィードバックループを中心とした,おのおのの細胞において概日リズムをきざむ細胞時計については,その詳細が明らかにされている1).興味深いことに,細胞時計は視交叉上核に特異的なものではなく,全身のほぼすべての細胞が備えている.視交叉上核は複数のタイプからなる約2万個のニューロンから構成されている.視交叉上核から単離された個々のニューロンは位相もバラバラで不安定な概日リズムを示す点で,線維芽細胞などの末梢の細胞となんら変わりはない.多種かつ多数のニューロンのあいだの連絡を介し強固で安定な概日リズムを発振する機能的な神経ネットワークの構築こそ,視交叉上核のみにみられる特異的な性質である.しかしながら,その動作の原理についてはほとんど明らかにされていない.
視交叉上核は大きく中核と外殻とに分けられる.血管作動性腸管ペプチド産生ニューロンおよびバソプレシン産生ニューロンは,それぞれ,中核および外殻に局在するニューロンのうち主要なものである.血管作動性腸管ペプチドは視交叉上核のニューロンのあいだの同調に重要なペプチドで,その欠失により概日リズムに大きな異常が生じる2).しかし,どのタイミングで血管作動性腸管ペプチドが放出されるのか,適切なタイミングでのその放出に血管作動性腸管ペプチド産生ニューロンの細胞時計が必要かなど,その詳細な分子機序は明らかではない.一方,バソプレシン産生ニューロンは概日リズムの振幅がもっとも大きいが,バソプレシンを欠損したラットにおいて概日リズムの周期には変化がないことから,バソプレシンは視交叉上核からの出力を担うペプチドと考えられていた3).よって,バソプレシン産生ニューロンの細胞時計は大きな振幅の時間情報の出力において重要である可能性が考えられた.また,バソプレシン産生ニューロンはほかにもさまざまな神経伝達物質を発現することから,視交叉上核のはたす概日リズムのペースメーカーとしての機能に関与する可能性も考えられた.
視交叉上核のおのおののタイプのニューロンがどのような役割を担うのかを明らかにすることが重要と考え,もっとも数の多いバソプレシン産生ニューロンに注目し,バソプレシン産生ニューロンにおいて特異的にBMAL1を欠損したマウスを作製した.BMAL1(ARNTL)は細胞時計を構成する重要なタンパク質であり,Bmal1ノックアウトマウスは概日リズムが完全に消失する4).
マウスの概日リズムを調べるため,ケージの内部を自発的に動きまわる行動を赤外線センサーにより記録した.明期12時間-暗期12時間の明暗条件において飼育すると,対照となるマウスおよびバソプレシン産生ニューロン特異的Bmal1ノックアウトマウスのどちらも,夜行性の行動を示した.そののち,恒暗条件において飼育すると,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは活動開始のタイミングはあまり変化しない一方で活動終了のタイミングが毎日少しずつ遅れていき,徐々に活動時間が延長し休息時間が短縮していった.約1週間をかけ活動時間が対照となるマウスと比べ約5時間長くなると定常状態に達し,活動時間をほぼ一定に保ちつつ対照となるマウスより約1時間長い概日リズムの周期で行動した.活動時間は延びたが,活動期間のなかごろにみられる中だるみがより顕著になっており,概日リズムの周期あたりの総活動量および総覚醒量に有意な差はみられなかった.これらの結果から,バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスの視交叉上核は,概日リズムを発振するものの,活動開始および活動終了のそれぞれを制御するニューロンのあいだの連絡に異常があるものと考えられた.
バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの概日リズムの異常は,組換えアデノ随伴ウイルスベクターを用いて視交叉上核のバソプレシン産生ニューロンにBMAL1の発現をレスキューすることにより消失した.したがって,視交叉上核のバソプレシン産生ニューロンにおいて細胞時計が機能することが重要であること,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて観察された表現型は神経ネットワークの構築の異常などから2次的に生じたものではないことが確認された.
視交叉上核の神経ネットワークにおいて,おのおののニューロンは少しずつ異なる位相をもって概日リズムをきざんでおり,ピークのタイミングは一定の範囲でばらついている.この概日リズムの位相の分布の幅により日長が符号化され,また,活動時間が決定されると考えられている5).
バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスでは活動時間が顕著に延長していたので,視交叉上核のニューロンのあいだの連絡が弱まり,概日リズムの位相がよりばらついている可能性が考えられた.そこで,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスが明期18時間-暗期6時間の長日条件に適応できるかどうか検討した.長日条件では,マウスの活動時間は短い暗期に対応して圧縮される.その結果,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの活動開始は暗期の開始に同調した一方で,活動終了は対照となるマウスに比べ有意に遅れ,活動時間が延長した.さらに興味深いことに,長日条件から恒暗条件へと変化させると,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは約1週間にわたり一過性に明瞭な概日リズムのない状態になった.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスでは視交叉上核のニューロンのあいだの連絡が弱まり概日時計が脆弱になっており,光環境の急激な変化にともない行動に重篤な異常が現われたものと考えられた.
視交叉上核におけるニューロンのあいだの連絡の状態をさらに調べるため,時差実験を行った.われわれが海外旅行の際に時差ボケになるのは,概日時計が頑強で現地時間にすぐにはなじめないためと考えられる.マウスを明期12時間-暗期12時間の明暗条件において飼育し,そののち,明暗サイクルを8時間早めて時差を起こした.対照となるマウスは活動期間を毎日少しずつ前進させ約2週間かけて新たな明暗サイクルに順応した一方,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは時差を起こすと概日リズムが非常に弱くなり,約8日間でより早く新たな明暗サイクルに同調した.この結果からも,バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスでは視交叉上核のニューロンのあいだの連絡が弱まっていることが示唆された.
転写因子であるCLOCK-BMAL1複合体の標的遺伝子であり発現に概日リズムのみられるPer1遺伝子,バソプレシン遺伝子,Prok2遺伝子,Rgs16遺伝子の発現について検討した.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,Per1遺伝子はバソプレシン産生ニューロンの多い視交叉上核の外殻において発現が顕著に低下していたが,視交叉上核の中核における発現には対照となるマウスと有意な差はなかった.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,視交叉上核におけるバソプレシン遺伝子の発現は激減していた.興味深いことに,視床下部室傍核や視索上核など視交叉上核のほかの領域ではバソプレシン遺伝子の発現レベルは対照となるマウスと変わらなかったことから,CLOCK-BMAL1複合体によるバソプレシン遺伝子の転写制御は視交叉上核に特異的なものであると考えられた.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおけるProk2遺伝子およびRgs16遺伝子の発現は,Per1遺伝子と同様に,視交叉上核の外殻においてのみ大幅に低下していた.バソプレシンおよびPROK2は神経伝達物質として機能する6).RGS16はGiαのGTPase活性化タンパク質でGiシグナル伝達系を抑制する7).視交叉上核のニューロンのあいだの同調に重要な血管作動性腸管ペプチドの受容体はGs共役型なので,RGS16は血管作動性腸管ペプチドシグナル伝達系を間接的に強めバソプレシン産生ニューロンの血管作動性腸管ペプチドに対する応答性を制御している可能性が考えられた.
バソプレシン産生ニューロンにおける細胞時計の消失が視交叉上核の神経ネットワークにおける概日リズムにどのような影響を及ぼすか,視交叉上核の切片を用いex vivoにおいて検討した.時計タンパク質PER2をルシフェラーゼとの融合タンパク質として発現するレポーターマウスより調製した視交叉上核のスライスにおいて,ルシフェラーゼの発光をリアルタイムでモニターすることにより視交叉上核における個々のニューロンの概日リズムを同時に測定することができる8).バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスから調製した視交叉上核のスライスの中核では概日リズムに対照となるマウスと有意な差はみられなかった一方,バソプレシン産生ニューロンが多く含まれる外殻では有意な概日リズムが観察されたものの,振幅が大幅に低下しているニューロンが多かった.BMAL1を欠損しても振動が完全に停止しないのは,視交叉上核の中核のほかのニューロンからの入力があるためと考えられた.驚いたことに,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの視交叉上核の外殻のニューロンでは概日リズムの周期が大幅にばらついており,平均が長くなっていた.さらに,おのおののニューロンの概日リズムの周期も一定せず不安定であった.
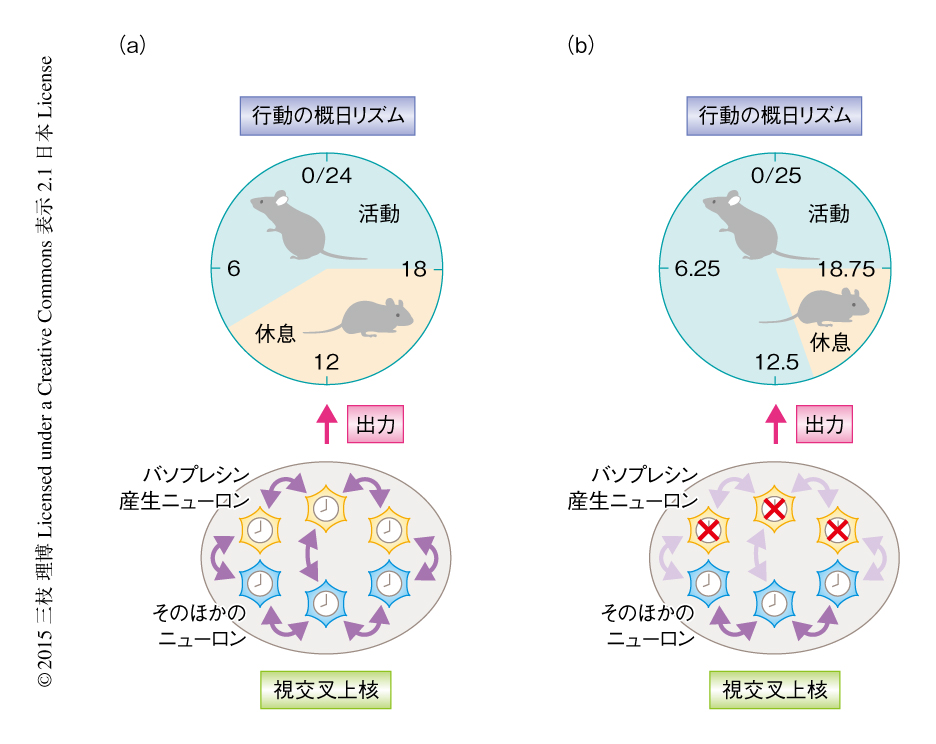
以上の結果から,つぎのようなモデルが考えられた(図1).バソプレシン産生ニューロンの細胞時計はバソプレシン,PROK2,RGS16などニューロンのあいだの連絡に重要な複数のタンパク質の発現を制御する.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,バソプレシン産生ニューロンはそれ以外のニューロンからの入力に駆動されて弱い不安定な概日リズムをきざむ.バソプレシンやPROK2などの神経伝達物質の発現の低下によりバソプレシン産生ニューロンのあいだの連絡は減弱する.RGS16の発現の低下は血管作動性腸管ペプチドなど視交叉上核のニューロンのあいだの同調に重要なペプチドに対するバソプレシン産生ニューロンの応答性を弱めるため.これらがあわさり,バソプレシン産生ニューロンの概日リズムの周期が不安定かつバラバラになり,平均として周期が長くなる.このようなニューロンレベルおよび神経ネットワークレベルでの変化が行動の概日リズムの周期および活動時間の延長の原因になる.
バソプレシンを欠損したラットやバソプレシン受容体を欠損したマウスでは概日リズムの周期に異常は現われないことから3,9),バソプレシン産生ニューロンの細胞時計がきざむ概日リズムはバソプレシンにくわえ複数の因子により伝達されると考えられる.一方で,バソプレシン産生ニューロンの細胞時計が消失しても概日リズムが完全になくなるわけではない.したがって,バソプレシン産生ニューロンはほかのタイプのニューロンと協同して,概日リズムのペースメーカーの機能をはたしていると考えられる.この研究は,中枢概日時計はさまざまなタイプのニューロンから構成されるなか,そのうちバソプレシン産生ニューロンというひとつのタイプのニューロンのみで細胞時計を破壊した最初の例であり,この戦略が中枢概日時計の動作の原理を明らかにするうえで有効であることが示された.
夜間勤務などによる概日リズムの乱れは,睡眠障害のみならず,さまざまな精神疾患,がんやメタボリックシンドロームの危険性を高めると報告されている.中枢概日時計の神経機構を理解しそれを制御する方法を開発することは,生活リズムの乱れがちな現代社会において大きな意義をもつ.
なお,Neuron誌の同じ号に,視交叉上核のニューロメディンS産生ニューロンが概日リズムのペースメーカーの実体であり,このニューロンにおいて細胞時計を破壊すると概日リズムが消失することが報告された10).この論文にも記述されているように,ニューロメディンS産生ニューロンは均一な集団ではなく,バソプレシン産生ニューロンや血管作動性腸管ペプチド産生ニューロン,そのほかのニューロンを含んでいる.したがって,この2つの論文は互いに補完しあうものと考えられる.
略歴:1997年 東京大学大学院理学系研究科 修了,同年 慶應義塾大学医学部 助手,1998年 理化学研究所脳科学総合研究センター 研究員,2001年 米国Texas大学ポスドク,2004年 東京医科歯科大学難治疾患研究所 助教を経て,2008年より金沢大学医薬保健研究域医学系 准教授.
研究テーマ:概日リズム,睡眠および覚醒の神経機構.
© 2015 三枝 理博 Licensed under CC 表示 2.1 日本
(金沢大学医薬保健研究域医学系 分子神経科学・統合生理学分野)
email:三枝理博
DOI: 10.7875/first.author.2015.034
Cellular clocks in AVP neurons of the SCN are critical for interneuronal coupling regulating circadian behavior rhythm.
Michihiro Mieda, Daisuke Ono, Emi Hasegawa, Hitoshi Okamoto, Ken-ichi Honma, Sato Honma, Takeshi Sakurai
Neuron, 85, 1103-1116 (2015)
要 約
視交叉上核の中枢概日時計はさまざまなタイプのニューロンから構成される神経ネットワークである.おのおののニューロンは自律的に概日リズムをきざむ能力をある程度もつが,視交叉上核が中枢概日時計として強固で安定した概日リズムを発振するためにはニューロンのあいだの相互の連絡が必須である.筆者らは,視交叉上核の神経ネットワークの動作の原理を理解するためには,ニューロンのタイプごとの役割を明らかにしていくアプローチが有効と考えた.この研究においては,バソプレシン産生ニューロンにおいて特異的に細胞時計を欠損したマウスを作製した.その解析により,バソプレシン産生ニューロンにおいて細胞時計が機能することによりニューロンのあいだの連絡に重要なタンパク質の発現が促進され,視交叉上核のニューロンの発振する概日リズムが安定し,動物が適切な概日リズムの周期および活動時間をもって行動するよう制御されることが示唆された.
はじめに
動物の行動やさまざまな身体機能は概日リズムとよばれる約1日周期のリズムをきざむ.哺乳類の概日リズムの制御中枢は視床下部の視交叉上核である1).視交叉上核の中枢概日時計は自律的に概日リズムを発振し全身へ時間情報を送る一方,網膜から伝えられる光の情報により制御され外界の昼夜サイクルに同調する.
これまでに,時計遺伝子の転写翻訳フィードバックループを中心とした,おのおのの細胞において概日リズムをきざむ細胞時計については,その詳細が明らかにされている1).興味深いことに,細胞時計は視交叉上核に特異的なものではなく,全身のほぼすべての細胞が備えている.視交叉上核は複数のタイプからなる約2万個のニューロンから構成されている.視交叉上核から単離された個々のニューロンは位相もバラバラで不安定な概日リズムを示す点で,線維芽細胞などの末梢の細胞となんら変わりはない.多種かつ多数のニューロンのあいだの連絡を介し強固で安定な概日リズムを発振する機能的な神経ネットワークの構築こそ,視交叉上核のみにみられる特異的な性質である.しかしながら,その動作の原理についてはほとんど明らかにされていない.
視交叉上核は大きく中核と外殻とに分けられる.血管作動性腸管ペプチド産生ニューロンおよびバソプレシン産生ニューロンは,それぞれ,中核および外殻に局在するニューロンのうち主要なものである.血管作動性腸管ペプチドは視交叉上核のニューロンのあいだの同調に重要なペプチドで,その欠失により概日リズムに大きな異常が生じる2).しかし,どのタイミングで血管作動性腸管ペプチドが放出されるのか,適切なタイミングでのその放出に血管作動性腸管ペプチド産生ニューロンの細胞時計が必要かなど,その詳細な分子機序は明らかではない.一方,バソプレシン産生ニューロンは概日リズムの振幅がもっとも大きいが,バソプレシンを欠損したラットにおいて概日リズムの周期には変化がないことから,バソプレシンは視交叉上核からの出力を担うペプチドと考えられていた3).よって,バソプレシン産生ニューロンの細胞時計は大きな振幅の時間情報の出力において重要である可能性が考えられた.また,バソプレシン産生ニューロンはほかにもさまざまな神経伝達物質を発現することから,視交叉上核のはたす概日リズムのペースメーカーとしての機能に関与する可能性も考えられた.
1.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスは概日リズムの周期および活動時間が長い
視交叉上核のおのおののタイプのニューロンがどのような役割を担うのかを明らかにすることが重要と考え,もっとも数の多いバソプレシン産生ニューロンに注目し,バソプレシン産生ニューロンにおいて特異的にBMAL1を欠損したマウスを作製した.BMAL1(ARNTL)は細胞時計を構成する重要なタンパク質であり,Bmal1ノックアウトマウスは概日リズムが完全に消失する4).
マウスの概日リズムを調べるため,ケージの内部を自発的に動きまわる行動を赤外線センサーにより記録した.明期12時間-暗期12時間の明暗条件において飼育すると,対照となるマウスおよびバソプレシン産生ニューロン特異的Bmal1ノックアウトマウスのどちらも,夜行性の行動を示した.そののち,恒暗条件において飼育すると,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは活動開始のタイミングはあまり変化しない一方で活動終了のタイミングが毎日少しずつ遅れていき,徐々に活動時間が延長し休息時間が短縮していった.約1週間をかけ活動時間が対照となるマウスと比べ約5時間長くなると定常状態に達し,活動時間をほぼ一定に保ちつつ対照となるマウスより約1時間長い概日リズムの周期で行動した.活動時間は延びたが,活動期間のなかごろにみられる中だるみがより顕著になっており,概日リズムの周期あたりの総活動量および総覚醒量に有意な差はみられなかった.これらの結果から,バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスの視交叉上核は,概日リズムを発振するものの,活動開始および活動終了のそれぞれを制御するニューロンのあいだの連絡に異常があるものと考えられた.
バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの概日リズムの異常は,組換えアデノ随伴ウイルスベクターを用いて視交叉上核のバソプレシン産生ニューロンにBMAL1の発現をレスキューすることにより消失した.したがって,視交叉上核のバソプレシン産生ニューロンにおいて細胞時計が機能することが重要であること,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて観察された表現型は神経ネットワークの構築の異常などから2次的に生じたものではないことが確認された.
2.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスは視交叉上核のニューロンのあいだの連絡が弱まり中枢概日時計の機能が低下している
視交叉上核の神経ネットワークにおいて,おのおののニューロンは少しずつ異なる位相をもって概日リズムをきざんでおり,ピークのタイミングは一定の範囲でばらついている.この概日リズムの位相の分布の幅により日長が符号化され,また,活動時間が決定されると考えられている5).
バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスでは活動時間が顕著に延長していたので,視交叉上核のニューロンのあいだの連絡が弱まり,概日リズムの位相がよりばらついている可能性が考えられた.そこで,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスが明期18時間-暗期6時間の長日条件に適応できるかどうか検討した.長日条件では,マウスの活動時間は短い暗期に対応して圧縮される.その結果,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの活動開始は暗期の開始に同調した一方で,活動終了は対照となるマウスに比べ有意に遅れ,活動時間が延長した.さらに興味深いことに,長日条件から恒暗条件へと変化させると,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは約1週間にわたり一過性に明瞭な概日リズムのない状態になった.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスでは視交叉上核のニューロンのあいだの連絡が弱まり概日時計が脆弱になっており,光環境の急激な変化にともない行動に重篤な異常が現われたものと考えられた.
視交叉上核におけるニューロンのあいだの連絡の状態をさらに調べるため,時差実験を行った.われわれが海外旅行の際に時差ボケになるのは,概日時計が頑強で現地時間にすぐにはなじめないためと考えられる.マウスを明期12時間-暗期12時間の明暗条件において飼育し,そののち,明暗サイクルを8時間早めて時差を起こした.対照となるマウスは活動期間を毎日少しずつ前進させ約2週間かけて新たな明暗サイクルに順応した一方,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスは時差を起こすと概日リズムが非常に弱くなり,約8日間でより早く新たな明暗サイクルに同調した.この結果からも,バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスでは視交叉上核のニューロンのあいだの連絡が弱まっていることが示唆された.
3.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスは視交叉上核の外殻にてニューロンのあいだの連絡に重要なタンパク質の発現が顕著に低下している
転写因子であるCLOCK-BMAL1複合体の標的遺伝子であり発現に概日リズムのみられるPer1遺伝子,バソプレシン遺伝子,Prok2遺伝子,Rgs16遺伝子の発現について検討した.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,Per1遺伝子はバソプレシン産生ニューロンの多い視交叉上核の外殻において発現が顕著に低下していたが,視交叉上核の中核における発現には対照となるマウスと有意な差はなかった.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,視交叉上核におけるバソプレシン遺伝子の発現は激減していた.興味深いことに,視床下部室傍核や視索上核など視交叉上核のほかの領域ではバソプレシン遺伝子の発現レベルは対照となるマウスと変わらなかったことから,CLOCK-BMAL1複合体によるバソプレシン遺伝子の転写制御は視交叉上核に特異的なものであると考えられた.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおけるProk2遺伝子およびRgs16遺伝子の発現は,Per1遺伝子と同様に,視交叉上核の外殻においてのみ大幅に低下していた.バソプレシンおよびPROK2は神経伝達物質として機能する6).RGS16はGiαのGTPase活性化タンパク質でGiシグナル伝達系を抑制する7).視交叉上核のニューロンのあいだの同調に重要な血管作動性腸管ペプチドの受容体はGs共役型なので,RGS16は血管作動性腸管ペプチドシグナル伝達系を間接的に強めバソプレシン産生ニューロンの血管作動性腸管ペプチドに対する応答性を制御している可能性が考えられた.
4.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスの視交叉上核の外殻のニューロンが発振する概日リズムは弱く不安定で周期が長い
バソプレシン産生ニューロンにおける細胞時計の消失が視交叉上核の神経ネットワークにおける概日リズムにどのような影響を及ぼすか,視交叉上核の切片を用いex vivoにおいて検討した.時計タンパク質PER2をルシフェラーゼとの融合タンパク質として発現するレポーターマウスより調製した視交叉上核のスライスにおいて,ルシフェラーゼの発光をリアルタイムでモニターすることにより視交叉上核における個々のニューロンの概日リズムを同時に測定することができる8).バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスから調製した視交叉上核のスライスの中核では概日リズムに対照となるマウスと有意な差はみられなかった一方,バソプレシン産生ニューロンが多く含まれる外殻では有意な概日リズムが観察されたものの,振幅が大幅に低下しているニューロンが多かった.BMAL1を欠損しても振動が完全に停止しないのは,視交叉上核の中核のほかのニューロンからの入力があるためと考えられた.驚いたことに,バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスの視交叉上核の外殻のニューロンでは概日リズムの周期が大幅にばらついており,平均が長くなっていた.さらに,おのおののニューロンの概日リズムの周期も一定せず不安定であった.
5.バソプレシン産生ニューロンにおいて特異的に細胞時計を消失したマウスにおいて概日リズムに異常が生じる機構
以上の結果から,つぎのようなモデルが考えられた(図1).バソプレシン産生ニューロンの細胞時計はバソプレシン,PROK2,RGS16などニューロンのあいだの連絡に重要な複数のタンパク質の発現を制御する.バソプレシン産生ニューロン特異的Bmal1ノックアウトマウスにおいて,バソプレシン産生ニューロンはそれ以外のニューロンからの入力に駆動されて弱い不安定な概日リズムをきざむ.バソプレシンやPROK2などの神経伝達物質の発現の低下によりバソプレシン産生ニューロンのあいだの連絡は減弱する.RGS16の発現の低下は血管作動性腸管ペプチドなど視交叉上核のニューロンのあいだの同調に重要なペプチドに対するバソプレシン産生ニューロンの応答性を弱めるため.これらがあわさり,バソプレシン産生ニューロンの概日リズムの周期が不安定かつバラバラになり,平均として周期が長くなる.このようなニューロンレベルおよび神経ネットワークレベルでの変化が行動の概日リズムの周期および活動時間の延長の原因になる.
おわりに
バソプレシンを欠損したラットやバソプレシン受容体を欠損したマウスでは概日リズムの周期に異常は現われないことから3,9),バソプレシン産生ニューロンの細胞時計がきざむ概日リズムはバソプレシンにくわえ複数の因子により伝達されると考えられる.一方で,バソプレシン産生ニューロンの細胞時計が消失しても概日リズムが完全になくなるわけではない.したがって,バソプレシン産生ニューロンはほかのタイプのニューロンと協同して,概日リズムのペースメーカーの機能をはたしていると考えられる.この研究は,中枢概日時計はさまざまなタイプのニューロンから構成されるなか,そのうちバソプレシン産生ニューロンというひとつのタイプのニューロンのみで細胞時計を破壊した最初の例であり,この戦略が中枢概日時計の動作の原理を明らかにするうえで有効であることが示された.
夜間勤務などによる概日リズムの乱れは,睡眠障害のみならず,さまざまな精神疾患,がんやメタボリックシンドロームの危険性を高めると報告されている.中枢概日時計の神経機構を理解しそれを制御する方法を開発することは,生活リズムの乱れがちな現代社会において大きな意義をもつ.
なお,Neuron誌の同じ号に,視交叉上核のニューロメディンS産生ニューロンが概日リズムのペースメーカーの実体であり,このニューロンにおいて細胞時計を破壊すると概日リズムが消失することが報告された10).この論文にも記述されているように,ニューロメディンS産生ニューロンは均一な集団ではなく,バソプレシン産生ニューロンや血管作動性腸管ペプチド産生ニューロン,そのほかのニューロンを含んでいる.したがって,この2つの論文は互いに補完しあうものと考えられる.
文 献
- Welsh, D. K., Takahashi, J. S. & Kay, S. A.: Suprachiasmatic nucleus: cell autonomy and network properties. Annu. Rev. Physiol., 72, 551-577 (2010)[PubMed]
- Aton, S. J., Colwell, C. S., Harmar, A. J. et al.: Vasoactive intestinal polypeptide mediates circadian rhythmicity and synchrony in mammalian clock neurons. Nat. Neurosci., 8, 476-483 (2005)[PubMed]
- Kalsbeek, A., Fliers, E., Hofman, M. A. et al.: Vasopressin and the output of the hypothalamic biological clock. J. Neuroendocrinol., 22, 362-372 (2010)[PubMed]
- Bunger, M. K., Wilsbacher, L. D., Moran, S. M. et al.: Mop3 is an essential component of the master circadian pacemaker in mammals. Cell, 103, 1009-1017 (2000)[PubMed]
- VanderLeest, H. T., Houben, T., Michel, S. et al.: Seasonal encoding by the circadian pacemaker of the SCN. Curr. Biol., 17, 468-473 (2007)[PubMed]
- Cheng, M. Y., Bullock, C. M., Li, C. et al.: Prokineticin 2 transmits the behavioural circadian rhythm of the suprachiasmatic nucleus. Nature, 417, 405-410 (2002)[PubMed]
- Doi, M., Ishida, A., Miyake, A. et al.: Circadian regulation of intracellular G-protein signalling mediates intercellular synchrony and rhythmicity in the suprachiasmatic nucleus. Nat. Commun., 2, 327 (2011)[PubMed]
- Yoo, S. H., Yamazaki, S., Lowrey, P. L. et al.: PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc. Natl. Acad. Sci. USA, 101, 5339-5346 (2004)[PubMed]
- Yamaguchi, Y., Suzuki, T., Mizoro, Y. et al.: Mice genetically deficient in vasopressin V1a and V1b receptors are resistant to jet lag. Science, 342, 85-90 (2013)[PubMed] [新着論文レビュー]
- Lee, I. T., Chang, A. S., Manandhar, M. et al.: Neuromedin S-producing neurons act as essential pacemakers in the suprachiasmatic nucleus to couple clock neurons and dictate circadian rhythms. Neuron, 85, 1086-1102 (2015)[PubMed]
著者プロフィール
略歴:1997年 東京大学大学院理学系研究科 修了,同年 慶應義塾大学医学部 助手,1998年 理化学研究所脳科学総合研究センター 研究員,2001年 米国Texas大学ポスドク,2004年 東京医科歯科大学難治疾患研究所 助教を経て,2008年より金沢大学医薬保健研究域医学系 准教授.
研究テーマ:概日リズム,睡眠および覚醒の神経機構.
© 2015 三枝 理博 Licensed under CC 表示 2.1 日本