Toll様受容体TLR8は1本鎖RNAの分解産物を認識する
丹治裕美・大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2015.021
Toll-like receptor 8 senses degradation products of single-stranded RNA.
Hiromi Tanji, Umeharu Ohto, Takuma Shibata, Masato Taoka, Yoshio Yamauchi, Toshiaki Isobe, Kensuke Miyake, Toshiyuki Shimizu
Nature Structural & Molecular Biology, 22, 109-115 (2015)
Toll様受容体TLR7およびTLR8はウイルスや死細胞に由来するRNAを認識して自然免疫反応をひき起こすが,その1本鎖RNAの認識の機構は不明であった.今回,筆者らは,TLR8と1本鎖RNAとの複合体のX線結晶構造解析により,TLR8による1本鎖RNAの認識の機構を明らかにした.その結果,TLR8は,二量体の界面に存在する第1結合部位によりウリジンを,リング型の構造の凹面に存在する第2結合部位によりオリゴヌクレオチドを認識していた.これらは1本鎖RNAの一部ではなく,その分解産物であった.さらに,TLR8はモノヌクレオシドのうちウリジンともっとも強く結合すること,および,1本鎖RNAの存在のもとではTLR8とウリジンとの結合が増強されることが明らかにされた.これらの結果より,TLR8は1本鎖RNAの分解産物であるウリジンおよびオリゴヌクレオチドによる協調的な効果により活性化されると結論づけられた.
Toll様受容体(Toll-like receptor:TLR)は病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと細胞内のTIRドメインからなる1).ヒトでは10種類が同定されており,2本鎖RNA,リポ多糖,リポタンパク質など,多様な分子を認識する1).
Toll様受容体のうちTLR7,TLR8,TLR9は核酸を認識するサブファミリーを構成し,いずれもエンドソームに存在する2).TLR7およびTLR8はウイルスや細菌に由来する1本鎖RNAを認識し,活性化すると炎症性サイトカインやインターフェロンの産生を促進し,最終的に抗ウイルス反応や炎症応答をひき起こす3,4).実際に,TLR7およびTLR8はA型インフルエンザやHIV-1などのウイルスの感染にかかわっている4,5).また,TLR7およびTLR8はsiRNAや自己に由来するRNAによっても活性化することが知られており,自己免疫疾患との関連が指摘されている6,7).TLR8はウリジンやグアノシンに富んだ1本鎖RNAを認識すると考えられており,TLR8を活性化する1本鎖RNAとしては,ssRNA40,ORN06,ORN02が知られている4,8).一方で,TLR7およびTLR8は分子量200~300程度の合成低分子リガンドによっても活性化されることがわかっている9,10).
近年の筆者らの研究により,リガンド非結合型および低分子リガンド結合型のTLR8の構造が解明された11)(新着論文レビュー でも掲載).その結果,TLR8は二量体の界面に存在する結合部位において合成低分子リガンドを認識すること,および,TLR8は二量体構造を再構成することにより細胞の内部にシグナルを伝達することが明らかにされた.しかしながら,合成低分子リガンドと1本鎖RNAとは構造および化学的な特徴がまったく異なることから,TLR8による1本鎖RNAの認識の機構は大きな謎であった.今回,筆者らは,TLR8と1本鎖RNAとの複合体のX線結晶構造解析により,TLR8による1本鎖RNAの認識の機構に関する構造基盤を明らかにした.
ヒトのTLR8の細胞外ドメインの全長のC末端にプロテインAタグを付加したコンストラクトを用い,糖鎖の生合成の阻害剤であるキフネンシンの存在のもとショウジョウバエS2細胞において発現させ,高純度の精製試料を得た11).TLR8の活性化にはLRR14およびLRR15のあいだにあるZループにおける切断が必要だが12),この精製試料はすでにZループにおいて切断されていた11).TLR8と,そのアゴニストである20塩基からなる3種類の1本鎖RNAとをそれぞれ蒸気拡散平衡法により共結晶化し,X線結晶構造解析により分解能2.0~2.6Åで構造を決定した(PDB ID:4R07,4R08,4R09,4R0A).
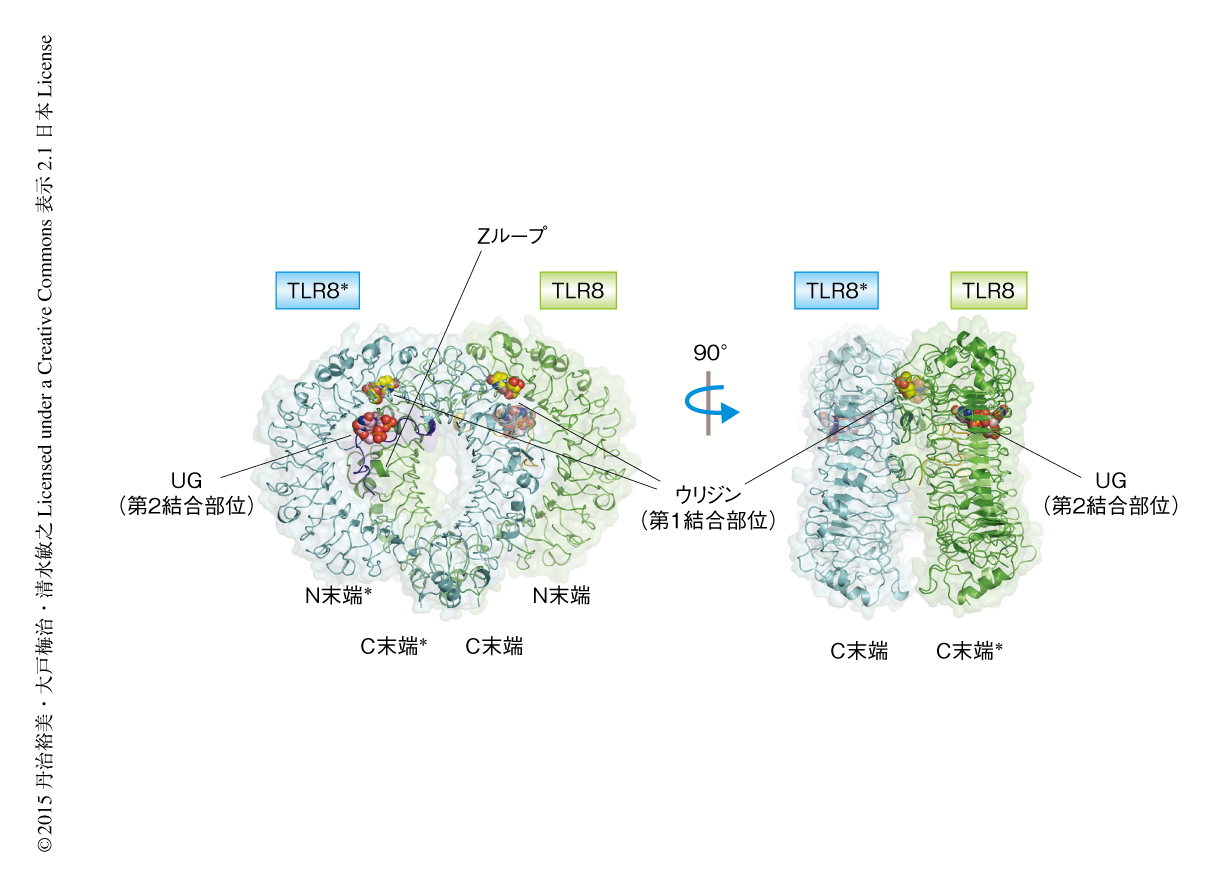
いずれの複合体のTLR8の構造も,低分子リガンド結合型のTLR8の構造とほぼ同じ配置の活性化型の二量体であった(図1).いずれの複合体の構造においても,20塩基の1本鎖RNAと共結晶化したにもかかわらず,それに相当する1本鎖RNAは観察されなかった.その代わり,二量体の界面に存在する結合部位(第1結合部位)にウリジンが,また,TLR8のリング型の構造の凹面とZループとにはさまれた結合部位(第2結合部位)にジヌクレオチドUGが観察された.第1結合部位は以前に報告された合成低分子リガンドとの結合部位と同一であり,第2結合部位は新規に同定された部位であった.同定されたウリジンあるいはジヌクレオチドが20塩基の1本鎖RNAの一部なのか,あるいは,それが分解して生じた断片なのかを明らかにするため,複合体の結晶を溶解して液体クロマトグラフィー-質量分析法により解析した.その結果,20塩基の1本鎖RNAは検出されず,代わりに,RNAの分解産物であるウリジン,ジヌクレオチドUG,トリヌクレオチドUUGがおもに検出された.このことから,結晶構造において観察されたウリジンおよびジヌクレオチドUGはいずれも1本鎖RNAの分解産物であると結論づけられた.
複合体の構造において,第1結合部位におけるウリジンの塩基部分はArg429,Tyr353,Phe405,Val520*,Asp543*により,リボース部分はVal378,Lys350,Gly351,Tyr348,Val573*,Thr574*により,それぞれかこまれていた(二量体を構成する2つのプロトマーのアミノ酸残基について,片方は無印,他方はアスタリスクを用いて表す).ウリジンはPhe405とスタッキング相互作用を形成しており,さらに,Arg429,Asp543*,Thr574*などとも水素結合を形成していた.Phe405とのスタッキング相互作用およびAsp543*とThr574*との水素結合は合成低分子リガンドの認識と共通していたが,その一方で,Tyr348,Val378,Val573*などが構成する疎水性ポケットとの相互作用は合成低分子リガンドとの結合においてのみ観察された.
第2結合部位はTLR8のリング型の凹面のLRR10~LRR13にわたる範囲とZループとにはさまれた部位に存在していた.この部位は二量体の界面の外に存在するため,リガンドとの結合による二量体構造の再構成には直接は関与しないことが示唆された.
ジヌクレオチドUGとTLR8とのあいだにはいくつかの特徴的な相互作用が観察された.とくに,グアノシンはHis469,Asp343,Arg375と水素結合を形成し,さらにHis373およびHis469とはスタッキング相互作用を形成していた.しかしながら,解析した3つの複合体の構造において,第2結合部位によるグアノシンの塩基部分の認識はほぼ同じであったが,ほかの部分の認識は異なっていたため,その認識は厳密ではないことが考えられた.
TLR8の活性化における第1結合部位および第2結合部位の重要性について調べるため,それぞれの部位のAla置換変異体の活性をHEK293T細胞を用いたNF-κBレポーター遺伝子アッセイにより調べた.その結果,第1結合部位にあるアミノ酸残基を置換すると合成低分子リガンドおよび1本鎖RNAに対する応答が消失あるいは低下した一方,第2結合部位にあるアミノ酸残基を置換すると,1本鎖RNAに対する応答は低下したものの,合成低分子リガンドに対する応答は変化しなかった.これらの結果から,第1結合部位は合成低分子リガンドおよび1本鎖RNAの認識にかかわるが,第2結合部位は1本鎖RNAの認識のみにかかわることが示唆された.
TLR8と各種のリガンドとのあいだの親和性を等温滴定カロリメトリーにより直接的に測定した.その結果,モノヌクレオシド(ウリジン,シチジン,チミジン,グアノシン,アデノシン)およびUMP(5’-UMP,3’-UMP)のうち,ウリジンがもっとも強くTLR8と結合したが,その解離定数は55μMであり,合成低分子リガンドとの結合と比べると弱かった.しかしながら,1本鎖RNAの存在のもとでは解離定数は1.0μMまで上昇し,合成低分子リガンドとほぼ同等の親和性がみられた.これは,ウリジンと1本鎖RNAとのあいだに協調的な効果の存在することを意味した.NF-κBレポーター遺伝子アッセイによる結果もこの結果と一致した.つまり,ウリジンと1本鎖RNAとの共刺激でのみ,TLR8は活性化されたのである.このことから,TLR8はウリジンのセンサーであるといえた.
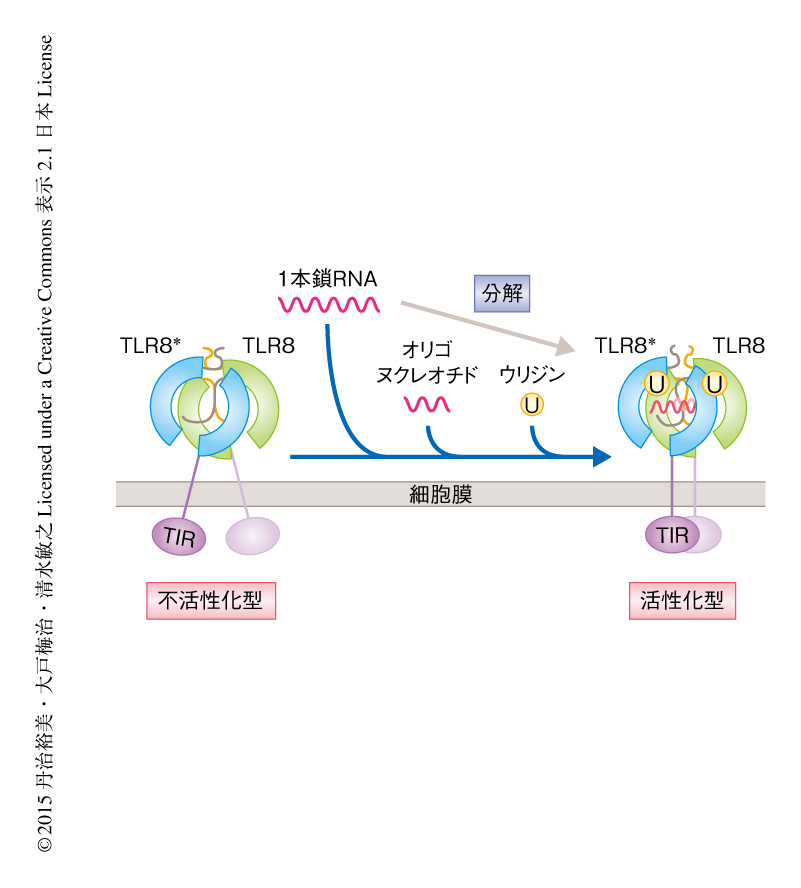
TLR8の第2結合部位は結晶構造において二量体の界面に存在しなかったこと,および,リガンド非結合型のTLR8と1本鎖RNAと結合した状態のTLR8のX線小角散乱パターンはよく一致したことから,1本鎖RNAとの結合だけではTLR8の活性化型の二量体は形成されないことが示唆された.TLR8は2つの結合部位に1本鎖RNAの分解産物であるウリジンおよびオリゴヌクレオチドが協調的に結合することにより活性化すると考えられた.この協調的な効果は,第2結合部位への1本鎖RNAの結合が,アロステリックな影響により第1結合部位へのウリジンの結合を促進しているものと考えられた.
これらのことから,TLR8の活性化にはウリジンが必須であり,ウリジンの含有率の高い1本鎖RNAがTLR8を活性化しうると考えられた.実際に,TLR8を活性化することのできるRNAにおいて,ウリジンをアデノシンにより置換するとTLR8を活性化できなくなることが報告されている4).
以上より,TLR8は,まず,不活性化型の二量体を形成し,つづいて,1本鎖RNAの分解産物であるウリジンと第1結合部位において,1本鎖RNAあるいはその分解産物であるオリゴヌクレオチドと第2結合部位において結合することにより,活性化型の二量体になると結論づけられた.これにともなう二量体構造の再構成により,細胞の内部においてTIRドメインが接近し下流へとシグナルが伝達されると考えられた(図2).
この研究により,TLR8の1本鎖RNAの認識の機構が詳細に明らかにされた.TLR8が2か所の結合部位によりRNAの分解産物を認識することは新規の発見であり,TLR8を活性化できる合成低分子リガンドの構造はウリジンと類似しており,両者が同様にTLR8を活性化するという謎を解明するものでもあった.これらの結果は,TLR8の機能が2か所の結合部位により制御できるという可能性を示唆しており,新しい視点をとりいれた治療薬の開発に応用できることが期待される.
略歴:東京大学大学院薬学系研究科修士課程 在学中.
研究テーマ:自然免疫系の受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 講師.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2015 丹治裕美・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2015.021
Toll-like receptor 8 senses degradation products of single-stranded RNA.
Hiromi Tanji, Umeharu Ohto, Takuma Shibata, Masato Taoka, Yoshio Yamauchi, Toshiaki Isobe, Kensuke Miyake, Toshiyuki Shimizu
Nature Structural & Molecular Biology, 22, 109-115 (2015)
要 約
Toll様受容体TLR7およびTLR8はウイルスや死細胞に由来するRNAを認識して自然免疫反応をひき起こすが,その1本鎖RNAの認識の機構は不明であった.今回,筆者らは,TLR8と1本鎖RNAとの複合体のX線結晶構造解析により,TLR8による1本鎖RNAの認識の機構を明らかにした.その結果,TLR8は,二量体の界面に存在する第1結合部位によりウリジンを,リング型の構造の凹面に存在する第2結合部位によりオリゴヌクレオチドを認識していた.これらは1本鎖RNAの一部ではなく,その分解産物であった.さらに,TLR8はモノヌクレオシドのうちウリジンともっとも強く結合すること,および,1本鎖RNAの存在のもとではTLR8とウリジンとの結合が増強されることが明らかにされた.これらの結果より,TLR8は1本鎖RNAの分解産物であるウリジンおよびオリゴヌクレオチドによる協調的な効果により活性化されると結論づけられた.
はじめに
Toll様受容体(Toll-like receptor:TLR)は病原体の分子パターンを認識して自然免疫を活性化させるI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと細胞内のTIRドメインからなる1).ヒトでは10種類が同定されており,2本鎖RNA,リポ多糖,リポタンパク質など,多様な分子を認識する1).
Toll様受容体のうちTLR7,TLR8,TLR9は核酸を認識するサブファミリーを構成し,いずれもエンドソームに存在する2).TLR7およびTLR8はウイルスや細菌に由来する1本鎖RNAを認識し,活性化すると炎症性サイトカインやインターフェロンの産生を促進し,最終的に抗ウイルス反応や炎症応答をひき起こす3,4).実際に,TLR7およびTLR8はA型インフルエンザやHIV-1などのウイルスの感染にかかわっている4,5).また,TLR7およびTLR8はsiRNAや自己に由来するRNAによっても活性化することが知られており,自己免疫疾患との関連が指摘されている6,7).TLR8はウリジンやグアノシンに富んだ1本鎖RNAを認識すると考えられており,TLR8を活性化する1本鎖RNAとしては,ssRNA40,ORN06,ORN02が知られている4,8).一方で,TLR7およびTLR8は分子量200~300程度の合成低分子リガンドによっても活性化されることがわかっている9,10).
近年の筆者らの研究により,リガンド非結合型および低分子リガンド結合型のTLR8の構造が解明された11)(新着論文レビュー でも掲載).その結果,TLR8は二量体の界面に存在する結合部位において合成低分子リガンドを認識すること,および,TLR8は二量体構造を再構成することにより細胞の内部にシグナルを伝達することが明らかにされた.しかしながら,合成低分子リガンドと1本鎖RNAとは構造および化学的な特徴がまったく異なることから,TLR8による1本鎖RNAの認識の機構は大きな謎であった.今回,筆者らは,TLR8と1本鎖RNAとの複合体のX線結晶構造解析により,TLR8による1本鎖RNAの認識の機構に関する構造基盤を明らかにした.
1.TLR8は2か所のリガンドとの結合部位をもつ
ヒトのTLR8の細胞外ドメインの全長のC末端にプロテインAタグを付加したコンストラクトを用い,糖鎖の生合成の阻害剤であるキフネンシンの存在のもとショウジョウバエS2細胞において発現させ,高純度の精製試料を得た11).TLR8の活性化にはLRR14およびLRR15のあいだにあるZループにおける切断が必要だが12),この精製試料はすでにZループにおいて切断されていた11).TLR8と,そのアゴニストである20塩基からなる3種類の1本鎖RNAとをそれぞれ蒸気拡散平衡法により共結晶化し,X線結晶構造解析により分解能2.0~2.6Åで構造を決定した(PDB ID:4R07,4R08,4R09,4R0A).
いずれの複合体のTLR8の構造も,低分子リガンド結合型のTLR8の構造とほぼ同じ配置の活性化型の二量体であった(図1).いずれの複合体の構造においても,20塩基の1本鎖RNAと共結晶化したにもかかわらず,それに相当する1本鎖RNAは観察されなかった.その代わり,二量体の界面に存在する結合部位(第1結合部位)にウリジンが,また,TLR8のリング型の構造の凹面とZループとにはさまれた結合部位(第2結合部位)にジヌクレオチドUGが観察された.第1結合部位は以前に報告された合成低分子リガンドとの結合部位と同一であり,第2結合部位は新規に同定された部位であった.同定されたウリジンあるいはジヌクレオチドが20塩基の1本鎖RNAの一部なのか,あるいは,それが分解して生じた断片なのかを明らかにするため,複合体の結晶を溶解して液体クロマトグラフィー-質量分析法により解析した.その結果,20塩基の1本鎖RNAは検出されず,代わりに,RNAの分解産物であるウリジン,ジヌクレオチドUG,トリヌクレオチドUUGがおもに検出された.このことから,結晶構造において観察されたウリジンおよびジヌクレオチドUGはいずれも1本鎖RNAの分解産物であると結論づけられた.
2.第1結合部位におけるウリジンの認識
複合体の構造において,第1結合部位におけるウリジンの塩基部分はArg429,Tyr353,Phe405,Val520*,Asp543*により,リボース部分はVal378,Lys350,Gly351,Tyr348,Val573*,Thr574*により,それぞれかこまれていた(二量体を構成する2つのプロトマーのアミノ酸残基について,片方は無印,他方はアスタリスクを用いて表す).ウリジンはPhe405とスタッキング相互作用を形成しており,さらに,Arg429,Asp543*,Thr574*などとも水素結合を形成していた.Phe405とのスタッキング相互作用およびAsp543*とThr574*との水素結合は合成低分子リガンドの認識と共通していたが,その一方で,Tyr348,Val378,Val573*などが構成する疎水性ポケットとの相互作用は合成低分子リガンドとの結合においてのみ観察された.
3.第2結合部位におけるオリゴヌクレオチドの認識
第2結合部位はTLR8のリング型の凹面のLRR10~LRR13にわたる範囲とZループとにはさまれた部位に存在していた.この部位は二量体の界面の外に存在するため,リガンドとの結合による二量体構造の再構成には直接は関与しないことが示唆された.
ジヌクレオチドUGとTLR8とのあいだにはいくつかの特徴的な相互作用が観察された.とくに,グアノシンはHis469,Asp343,Arg375と水素結合を形成し,さらにHis373およびHis469とはスタッキング相互作用を形成していた.しかしながら,解析した3つの複合体の構造において,第2結合部位によるグアノシンの塩基部分の認識はほぼ同じであったが,ほかの部分の認識は異なっていたため,その認識は厳密ではないことが考えられた.
4.1本鎖RNAの認識には第1結合部位および第2結合部位の両者が必要である
TLR8の活性化における第1結合部位および第2結合部位の重要性について調べるため,それぞれの部位のAla置換変異体の活性をHEK293T細胞を用いたNF-κBレポーター遺伝子アッセイにより調べた.その結果,第1結合部位にあるアミノ酸残基を置換すると合成低分子リガンドおよび1本鎖RNAに対する応答が消失あるいは低下した一方,第2結合部位にあるアミノ酸残基を置換すると,1本鎖RNAに対する応答は低下したものの,合成低分子リガンドに対する応答は変化しなかった.これらの結果から,第1結合部位は合成低分子リガンドおよび1本鎖RNAの認識にかかわるが,第2結合部位は1本鎖RNAの認識のみにかかわることが示唆された.
5.TLR8はウリジンのセンサーである
TLR8と各種のリガンドとのあいだの親和性を等温滴定カロリメトリーにより直接的に測定した.その結果,モノヌクレオシド(ウリジン,シチジン,チミジン,グアノシン,アデノシン)およびUMP(5’-UMP,3’-UMP)のうち,ウリジンがもっとも強くTLR8と結合したが,その解離定数は55μMであり,合成低分子リガンドとの結合と比べると弱かった.しかしながら,1本鎖RNAの存在のもとでは解離定数は1.0μMまで上昇し,合成低分子リガンドとほぼ同等の親和性がみられた.これは,ウリジンと1本鎖RNAとのあいだに協調的な効果の存在することを意味した.NF-κBレポーター遺伝子アッセイによる結果もこの結果と一致した.つまり,ウリジンと1本鎖RNAとの共刺激でのみ,TLR8は活性化されたのである.このことから,TLR8はウリジンのセンサーであるといえた.
6.1本鎖RNAによるTLR8の活性化の機構
TLR8の第2結合部位は結晶構造において二量体の界面に存在しなかったこと,および,リガンド非結合型のTLR8と1本鎖RNAと結合した状態のTLR8のX線小角散乱パターンはよく一致したことから,1本鎖RNAとの結合だけではTLR8の活性化型の二量体は形成されないことが示唆された.TLR8は2つの結合部位に1本鎖RNAの分解産物であるウリジンおよびオリゴヌクレオチドが協調的に結合することにより活性化すると考えられた.この協調的な効果は,第2結合部位への1本鎖RNAの結合が,アロステリックな影響により第1結合部位へのウリジンの結合を促進しているものと考えられた.
これらのことから,TLR8の活性化にはウリジンが必須であり,ウリジンの含有率の高い1本鎖RNAがTLR8を活性化しうると考えられた.実際に,TLR8を活性化することのできるRNAにおいて,ウリジンをアデノシンにより置換するとTLR8を活性化できなくなることが報告されている4).
以上より,TLR8は,まず,不活性化型の二量体を形成し,つづいて,1本鎖RNAの分解産物であるウリジンと第1結合部位において,1本鎖RNAあるいはその分解産物であるオリゴヌクレオチドと第2結合部位において結合することにより,活性化型の二量体になると結論づけられた.これにともなう二量体構造の再構成により,細胞の内部においてTIRドメインが接近し下流へとシグナルが伝達されると考えられた(図2).
おわりに
この研究により,TLR8の1本鎖RNAの認識の機構が詳細に明らかにされた.TLR8が2か所の結合部位によりRNAの分解産物を認識することは新規の発見であり,TLR8を活性化できる合成低分子リガンドの構造はウリジンと類似しており,両者が同様にTLR8を活性化するという謎を解明するものでもあった.これらの結果は,TLR8の機能が2か所の結合部位により制御できるという可能性を示唆しており,新しい視点をとりいれた治療薬の開発に応用できることが期待される.
文 献
- Akira, S. & Takeda, K.: Toll-like receptor signalling. Nat. Rev. Immunol., 4, 499-511 (2004)[PubMed]
- Roach, J. C., Glusman, G., Rowen, L. et al.: The evolution of vertebrate Toll-like receptors. Proc. Natl. Acad. Sci. USA, 102, 9577-9582 (2005)[PubMed]
- Diebold, S. S., Kaisho, T., Hemmi, H. et al.: Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science, 303, 1529-1531 (2004)[PubMed]
- Heil, F., Hemmi, H., Hochrein, H. et al.: Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8. Science, 303, 1526-1529 (2004)[PubMed]
- Wang, J. P., Bowen, G. N., Padden, C. et al.: Toll-like receptor-mediated activation of neutrophils by influenza A virus. Blood, 112, 2028-2034 (2008)[PubMed]
- Hornung, V. Guenthner-Biller, M., Bourquin, C. et al.: Sequence-specific potent induction of IFN-α by short interfering RNA in plasmacytoid dendritic cells through TLR7. Nat. Med., 11, 263-270 (2005)[PubMed]
- Barrat, F. J., Meeker, T., Gregorio, J. et al.: Nucleic acids of mammalian origin can act as endogenous ligands for Toll-like receptors and may promote systemic lupus erythematosus. J. Exp. Med., 202, 1131-1139 (2005)[PubMed]
- Forsbach, A., Nemorin, J. G., Montino, C. et al.: Identification of RNA sequence motifs stimulating sequence-specific TLR8-dependent immune responses. J. Immunol., 180, 3729-3738 (2008)[PubMed]
- Hemmi, H., Kaisho, T., Takeuchi, O. et al.: Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nat. Immunol., 3, 196-200 (2002)[PubMed]
- Jurk, M., Heil, F., Vollmer, J. et al.: Human TLR7 or TLR8 independently confer responsiveness to the antiviral compound R-848. Nat. Immunol., 3, 499-499 (2002)[PubMed]
- Tanji, H., Ohto, U., Shibata, T. et al.: Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands. Science, 339, 1426-1429 (2013)[PubMed] [新着論文レビュー]
- Ishii, N., Funami, K., Tatematsu, M. et al.: Endosomal localization of TLR8 confers distinctive proteolytic processing on human myeloid cells. . Immunol., 193, 5118-5128 (2014)[PubMed]
著者プロフィール
略歴:東京大学大学院薬学系研究科修士課程 在学中.
研究テーマ:自然免疫系の受容体のX線結晶構造解析.
抱負:タンパク質の構造解析をとおして,さまざまな生命現象を明らかにしたい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 講師.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2015 丹治裕美・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本