小脳における登上線維シナプスの競合および維持の過程をささえる新しいC1ql1シグナル伝達系
掛川 渉・柚崎通介
(慶應義塾大学医学部 生理学教室)
email:掛川 渉
DOI: 10.7875/first.author.2015.020
Anterograde C1ql1 signaling is required in order to determine and maintain a single-winner climbing fiber in the mouse cerebellum.
Wataru Kakegawa, Nikolaos Mitakidis, Eriko Miura, Manabu Abe, Keiko Matsuda, Yukari H. Takeo, Kazuhisa Kohda, Junko Motohashi, Akiyo Takahashi, Soichi Nagao, Shin-ichi Muramatsu, Masahiko Watanabe, Kenji Sakimura, A. Radu Aricescu, Michisuke Yuzaki
Neuron, 85, 316-329 (2015)
小脳において神経回路の要衝を担うプルキンエ細胞は,登上線維の起始核である延髄下オリーブ核細胞より強力な興奮性の入力をうける.生後まもないプルキンエ細胞には複数の登上線維が投射しているが,発達にともない,強い登上線維は強化され弱い登上線維は除去されることにより,成熟期には1つのプルキンエ細胞に対し1本の強力な登上線維のみが残る.筆者らは,このシナプスの競合の過程に下オリーブ核細胞に発現するC1ql1が決定的な役割をはたすことを明らかにした.C1ql1はプルキンエ細胞に発現する細胞接着型のGタンパク質共役受容体BAI3と結合し,強い登上線維シナプスの強化および弱い登上線維シナプスの除去をひき起こすとともに,残った登上線維シナプスの維持を制御した.また,C1ql1とBAI3との結合を阻害したマウスでは,シナプスの機能が障害され運動における学習能がいちじるしく低下した.C1ql1やBAI3に類似したタンパク質は小脳だけでなく脳の全域に広く発現していることから,この新しいC1ql1シグナル伝達機構の解明が,中枢シナプスの形成,維持,除去の過程を理解するための大きな糸口となるものと期待される.
脳を構成するニューロンはシナプスを介して互いに結合し,複雑な神経回路を構築することによりはじめて機能する.幼少期の脳においては,いったん過剰なシナプスが形成されるが,発達にともない必要なシナプスは強化され不必要なシナプスはしだいに除去されていく.このような“シナプス刈り込み”は脳の多くの領域において観察される普遍的な現象であり,正しい成熟型の神経回路を形成するためにきわめて重要な過程であると考えられている.事実,シナプス刈り込みの障害が発達障害あるいは精神神経疾患の病態の発現に寄与する所見も数多く報告されつつある.しかし,シナプス刈り込みがどのような分子機構によりひき起こされているかについては,現在もなお未解明な点が多い.
運動における記憶および学習を担う小脳のプルキンエ細胞は,延髄下オリーブ核細胞から投射する登上線維により強い興奮性の入力をうける.登上線維シナプスにおいては生後の発達期に劇的なシナプス刈り込みが起こるため,中枢シナプスの競合の過程を理解するための最適なモデル系として精力的に研究されている1).プルキンエ細胞は顆粒細胞から投射する平行線維よりもうひとつの興奮性の入力をうけるが,これまでに,筆者らは,平行線維の終末より放出される新規の分泌タンパク質Cbln1が,生後の発達の際に平行線維シナプスの形成を強力に制御するとともに,成熟期における平行線維シナプスの維持に必須であることを明らかにした2,3).Cbln1は自然免疫系をささえる補体C1qの機能ドメインをもつC1qファミリーに属する4).また,補体C1qそのものも脳に豊富に発現し,正常な発達や加齢そして病的な過程におけるシナプスの除去にかかわることが知られている5).最近,筆者らは,Cbln1と同じC1qファミリーに属するC1ql1が,登上線維の起始核である下オリーブ核細胞に選択的に発現していることを見い出した6).この所見は,C1ql1が登上線維シナプスにおけるシナプス刈り込みに深く関与している可能性を示唆していた.そこで,この仮説を検証するため,C1ql1ノックアウトマウスを作製しその表現型を解析した.
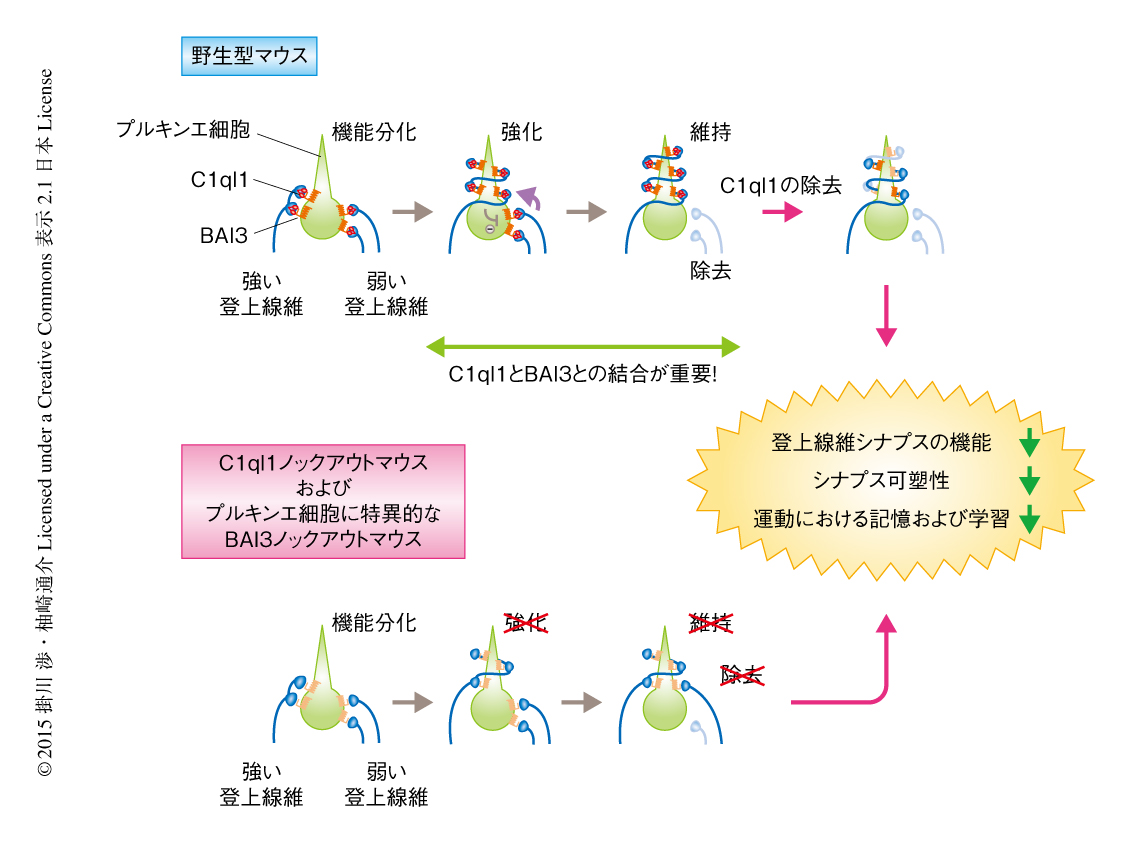
C1ql1ノックアウトマウスにおける登上線維シナプスの競合の過程を電気生理学な手法および免疫組織学的な手法により観察した.野生型のマウスの場合,生後の発達期のプルキンエ細胞は複数の未熟な登上線維により入力をうけるが,そののち,登上線維のあいだに強弱が生まれ,強い登上線維はより強化されるとともに弱い登上線維は除去されて,成熟期においては1つのプルキンエ細胞に対し1本の強い登上線維のみが残る1)(図1).しかし,C1ql1ノックアウトマウスでは,登上線維のあいだに強弱は生まれたものの,成熟期において強い登上線維による入力はより強化されず,くわえて,弱い登上線維による入力も残存していた(図1).また,出生の直後の野生型マウスの登上線維にC1ql1を過剰に発現させると,登上線維のあいだに強弱が生じただけでなく,発現したすべての登上線維シナプスにおいてシナプスの強度が亢進し,それと同時に,1本の強い登上線維シナプスのみが残る過程が早期化されることもわかった.これらの結果から,C1ql1はもともとの登上線維の強弱によらず登上線維シナプスを強化するはたらきがあるとともに,ある段階からは強い登上線維を残して弱い登上線維を除去する,という二律背反的な作用をもつことが示唆された.
これまでに,培養海馬ニューロンを用いたin vitroにおける実験において,C1ql1はBAI3と結合することが報告されている7).BAI3は細胞接着型のGタンパク質共役受容体のメンバーで,プルキンエ細胞に豊富に発現している8).そこで,C1ql1およびBAI3の局在をおのおのに対する特異的な抗体を用いた免疫電子顕微鏡法により観察したところ,ともに登上線維シナプスに集積していることがわかった.この所見は超解像顕微鏡法においても確認され,C1ql1とBAI3が登上線維シナプスにおいて近接している像が得られた.この結果は,C1ql1とBAI3が登上線維シナプスにおいて選択的に結合していることを示唆した.
BAI3をプルキンエ細胞において選択的に欠損させたコンディショナルノックアウトマウスを作製し,登上線維シナプスの形態および機能について解析した.プルキンエ細胞に特異的なBAI3ノックアウトマウスはC1ql1ノックアウトマウスと酷似しており,生後の発達期において強い登上線維シナプスはより強化されず,また,成熟期においても複数の登上線維シナプスにより入力をうけるプルキンエ細胞が数多く認められた(図1).BAI3がC1ql1の受容体である可能性を確かめるため,C1ql1と結合できない変異型のBAI3を設計し,子宮内電気穿孔法を用いてプルキンエ細胞に特異的なBAI3ノックアウトマウスの小脳に発現させた.その結果,野生型のBAI3はプルキンエ細胞に特異的なBAI3ノックアウトマウスにみられた登上線維シナプスの異常な表現型をほぼ完全に回復させたが,C1ql1と結合できない変異型BAI3を発現させてもその回復はまったく認められなかった.したがって,BAI3はC1ql1の受容体としてはたらき,BAI3とC1ql1との結合が発達期の小脳における登上線維シナプスの競合を制御していることが明らかにされた.
C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスにみられた登上線維シナプスの異常な表現型が成熟期において回復するかどうか,ウイルスベクターによる遺伝子導入技術を用いて検討した.野生型BAI3をプルキンエ細胞に特異的なBAI3ノックアウトマウスの成熟したプルキンエ細胞に発現させると,登上線維シナプスが強化されるとともに,登上線維シナプスの投射が複数の入力から1本の入力へと変化した.野生型C1ql1を成熟したC1ql1ノックアウトマウスの登上線維に発現させると,野生型BAI3を発現させたときと同様に,登上線維シナプスの異常が完全に回復した.一方,C1ql1とBAI3との結合が阻害される変異型C1ql1あるいは変異型BAI3の発現は,登上線維シナプスの異常を回復させなかった.これらの結果は,C1ql1とBAI3とが相互に結合することにより,成熟したのちにも登上線維シナプスの競合の過程を制御することを示した.
では,成熟した野生型マウスにおいてC1ql1とBAI3との結合を阻害した場合,完成された登上線維シナプスは障害を示すだろうか? この問いに答えるため,RNAi技術を用いたC1ql1の急性除去を試みた.その結果,C1ql1を急性除去した登上線維はプルキンエ細胞に対し1本のみの入力を示したものの,シナプスの数や応答が大きく減少していた(図1).同様な所見は,プルキンエ細胞に発現するBAI3の急性除去によっても得られたことから,C1ql1-BAI3シグナル伝達系は生後の発達期のみでなく,成熟したマウスにおいて残った登上線維シナプスを維持するためにも必要であることがわかった.
登上線維シナプスを介するプルキンエ細胞への強力な興奮性の入力は,平行線維シナプスにおいて観察される代表的なシナプス可塑性のひとつである長期抑圧(long-term depression:LTD)の誘導に必須とされる.今日,平行線維シナプスでの長期抑圧は運動における記憶および学習の分子基盤と考えられており,事実,長期抑圧の障害された多くの遺伝子改変動物において重篤な運動学習の障害が認められている9,10).そこで,C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスを用い,長期抑圧の誘導実験および小脳に依存性の運動学習課題を行った.すると,C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスにおいて長期抑圧の障害が認められ,それにともない,運動における学習能のいちじるしい低下が観察された(図1).これらの障害は登上線維シナプスへの入力の低下によるCa2+の流入量の減少により生じているものと思われるが,BAI3の細胞内領域にはGタンパク質をはじめさまざまなシグナル伝達タンパク質が結合することから7),今後,C1ql1-BAI3シグナル伝達系が長期抑圧および運動における学習能を直接的に制御している可能性についても検討していきたい.
今回,筆者らは,登上線維シナプスの競合の過程および小脳の機能をささえるまったく新しいC1ql1シグナル伝達系を見い出した.これまで,登上線維シナプスの競合の過程にかかわるタンパク質の多くはプルキンエ細胞に発現し,それらのタンパク質を起点とした逆行性シグナルのみが注目されてきた.しかし,登上線維シナプスにおける競合の過程をより深く理解するためには,おのおのの登上線維の活動にともなう順行性シグナルについても考える必要がある.神経の活動に依存して分泌されうるC1ql1が登上線維シナプスの競合に必要な順行性シグナルを担うものと予想される.
今日,アルツハイマー病や統合失調症をはじめとするさまざまな精神神経疾患の病態の発現において,シナプスに発現するタンパク質の関与が示唆されつつある.したがって,シナプスの形成および機能を制御するこの新しいC1ql1シグナル伝達機構を解明することが,これらの疾患に対する治療の開発につながる可能性も高い.
C1ql1およびBAI3に類似したタンパク質は小脳だけでなく脳の全域に広く発現していることから6,8),C1ql1-BAI3シグナグル伝達系の解明が中枢シナプスの形成,維持,除去の機構を理解するための大きな糸口となるものと期待される.
略歴:2003年 群馬大学大学院医学系研究科 修了,同年 米国St. Jude Children’s Research Hospital博士研究員,2004年 慶應義塾大学医学部 助手を経て,2011年より同 専任講師.
研究テーマ:記憶および学習をささえる分子基盤の解明および制御.
抱負:実験を楽しみ,ディスカッションを楽しむ.そして,新たな事象を明らかにする.研究者としての醍醐味を存分に味わいながら,社会に還元できる研究を行っていきたい.
柚崎 通介(Michisuke Yuzaki)
慶應義塾大学医学部 教授.
研究室URL:http://www.yuzaki-lab.org
© 2015 掛川 渉・柚崎通介 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 生理学教室)
email:掛川 渉
DOI: 10.7875/first.author.2015.020
Anterograde C1ql1 signaling is required in order to determine and maintain a single-winner climbing fiber in the mouse cerebellum.
Wataru Kakegawa, Nikolaos Mitakidis, Eriko Miura, Manabu Abe, Keiko Matsuda, Yukari H. Takeo, Kazuhisa Kohda, Junko Motohashi, Akiyo Takahashi, Soichi Nagao, Shin-ichi Muramatsu, Masahiko Watanabe, Kenji Sakimura, A. Radu Aricescu, Michisuke Yuzaki
Neuron, 85, 316-329 (2015)
要 約
小脳において神経回路の要衝を担うプルキンエ細胞は,登上線維の起始核である延髄下オリーブ核細胞より強力な興奮性の入力をうける.生後まもないプルキンエ細胞には複数の登上線維が投射しているが,発達にともない,強い登上線維は強化され弱い登上線維は除去されることにより,成熟期には1つのプルキンエ細胞に対し1本の強力な登上線維のみが残る.筆者らは,このシナプスの競合の過程に下オリーブ核細胞に発現するC1ql1が決定的な役割をはたすことを明らかにした.C1ql1はプルキンエ細胞に発現する細胞接着型のGタンパク質共役受容体BAI3と結合し,強い登上線維シナプスの強化および弱い登上線維シナプスの除去をひき起こすとともに,残った登上線維シナプスの維持を制御した.また,C1ql1とBAI3との結合を阻害したマウスでは,シナプスの機能が障害され運動における学習能がいちじるしく低下した.C1ql1やBAI3に類似したタンパク質は小脳だけでなく脳の全域に広く発現していることから,この新しいC1ql1シグナル伝達機構の解明が,中枢シナプスの形成,維持,除去の過程を理解するための大きな糸口となるものと期待される.
はじめに
脳を構成するニューロンはシナプスを介して互いに結合し,複雑な神経回路を構築することによりはじめて機能する.幼少期の脳においては,いったん過剰なシナプスが形成されるが,発達にともない必要なシナプスは強化され不必要なシナプスはしだいに除去されていく.このような“シナプス刈り込み”は脳の多くの領域において観察される普遍的な現象であり,正しい成熟型の神経回路を形成するためにきわめて重要な過程であると考えられている.事実,シナプス刈り込みの障害が発達障害あるいは精神神経疾患の病態の発現に寄与する所見も数多く報告されつつある.しかし,シナプス刈り込みがどのような分子機構によりひき起こされているかについては,現在もなお未解明な点が多い.
運動における記憶および学習を担う小脳のプルキンエ細胞は,延髄下オリーブ核細胞から投射する登上線維により強い興奮性の入力をうける.登上線維シナプスにおいては生後の発達期に劇的なシナプス刈り込みが起こるため,中枢シナプスの競合の過程を理解するための最適なモデル系として精力的に研究されている1).プルキンエ細胞は顆粒細胞から投射する平行線維よりもうひとつの興奮性の入力をうけるが,これまでに,筆者らは,平行線維の終末より放出される新規の分泌タンパク質Cbln1が,生後の発達の際に平行線維シナプスの形成を強力に制御するとともに,成熟期における平行線維シナプスの維持に必須であることを明らかにした2,3).Cbln1は自然免疫系をささえる補体C1qの機能ドメインをもつC1qファミリーに属する4).また,補体C1qそのものも脳に豊富に発現し,正常な発達や加齢そして病的な過程におけるシナプスの除去にかかわることが知られている5).最近,筆者らは,Cbln1と同じC1qファミリーに属するC1ql1が,登上線維の起始核である下オリーブ核細胞に選択的に発現していることを見い出した6).この所見は,C1ql1が登上線維シナプスにおけるシナプス刈り込みに深く関与している可能性を示唆していた.そこで,この仮説を検証するため,C1ql1ノックアウトマウスを作製しその表現型を解析した.
1.発達期の登上線維シナプスの競合の過程におけるC1ql1の機能的な役割
C1ql1ノックアウトマウスにおける登上線維シナプスの競合の過程を電気生理学な手法および免疫組織学的な手法により観察した.野生型のマウスの場合,生後の発達期のプルキンエ細胞は複数の未熟な登上線維により入力をうけるが,そののち,登上線維のあいだに強弱が生まれ,強い登上線維はより強化されるとともに弱い登上線維は除去されて,成熟期においては1つのプルキンエ細胞に対し1本の強い登上線維のみが残る1)(図1).しかし,C1ql1ノックアウトマウスでは,登上線維のあいだに強弱は生まれたものの,成熟期において強い登上線維による入力はより強化されず,くわえて,弱い登上線維による入力も残存していた(図1).また,出生の直後の野生型マウスの登上線維にC1ql1を過剰に発現させると,登上線維のあいだに強弱が生じただけでなく,発現したすべての登上線維シナプスにおいてシナプスの強度が亢進し,それと同時に,1本の強い登上線維シナプスのみが残る過程が早期化されることもわかった.これらの結果から,C1ql1はもともとの登上線維の強弱によらず登上線維シナプスを強化するはたらきがあるとともに,ある段階からは強い登上線維を残して弱い登上線維を除去する,という二律背反的な作用をもつことが示唆された.
2.BAI3は登上線維シナプスを制御するC1ql1の受容体である
これまでに,培養海馬ニューロンを用いたin vitroにおける実験において,C1ql1はBAI3と結合することが報告されている7).BAI3は細胞接着型のGタンパク質共役受容体のメンバーで,プルキンエ細胞に豊富に発現している8).そこで,C1ql1およびBAI3の局在をおのおのに対する特異的な抗体を用いた免疫電子顕微鏡法により観察したところ,ともに登上線維シナプスに集積していることがわかった.この所見は超解像顕微鏡法においても確認され,C1ql1とBAI3が登上線維シナプスにおいて近接している像が得られた.この結果は,C1ql1とBAI3が登上線維シナプスにおいて選択的に結合していることを示唆した.
BAI3をプルキンエ細胞において選択的に欠損させたコンディショナルノックアウトマウスを作製し,登上線維シナプスの形態および機能について解析した.プルキンエ細胞に特異的なBAI3ノックアウトマウスはC1ql1ノックアウトマウスと酷似しており,生後の発達期において強い登上線維シナプスはより強化されず,また,成熟期においても複数の登上線維シナプスにより入力をうけるプルキンエ細胞が数多く認められた(図1).BAI3がC1ql1の受容体である可能性を確かめるため,C1ql1と結合できない変異型のBAI3を設計し,子宮内電気穿孔法を用いてプルキンエ細胞に特異的なBAI3ノックアウトマウスの小脳に発現させた.その結果,野生型のBAI3はプルキンエ細胞に特異的なBAI3ノックアウトマウスにみられた登上線維シナプスの異常な表現型をほぼ完全に回復させたが,C1ql1と結合できない変異型BAI3を発現させてもその回復はまったく認められなかった.したがって,BAI3はC1ql1の受容体としてはたらき,BAI3とC1ql1との結合が発達期の小脳における登上線維シナプスの競合を制御していることが明らかにされた.
3.C1ql1とBAI3との結合は成熟期における登上線維シナプスの維持の過程に必須である
C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスにみられた登上線維シナプスの異常な表現型が成熟期において回復するかどうか,ウイルスベクターによる遺伝子導入技術を用いて検討した.野生型BAI3をプルキンエ細胞に特異的なBAI3ノックアウトマウスの成熟したプルキンエ細胞に発現させると,登上線維シナプスが強化されるとともに,登上線維シナプスの投射が複数の入力から1本の入力へと変化した.野生型C1ql1を成熟したC1ql1ノックアウトマウスの登上線維に発現させると,野生型BAI3を発現させたときと同様に,登上線維シナプスの異常が完全に回復した.一方,C1ql1とBAI3との結合が阻害される変異型C1ql1あるいは変異型BAI3の発現は,登上線維シナプスの異常を回復させなかった.これらの結果は,C1ql1とBAI3とが相互に結合することにより,成熟したのちにも登上線維シナプスの競合の過程を制御することを示した.
では,成熟した野生型マウスにおいてC1ql1とBAI3との結合を阻害した場合,完成された登上線維シナプスは障害を示すだろうか? この問いに答えるため,RNAi技術を用いたC1ql1の急性除去を試みた.その結果,C1ql1を急性除去した登上線維はプルキンエ細胞に対し1本のみの入力を示したものの,シナプスの数や応答が大きく減少していた(図1).同様な所見は,プルキンエ細胞に発現するBAI3の急性除去によっても得られたことから,C1ql1-BAI3シグナル伝達系は生後の発達期のみでなく,成熟したマウスにおいて残った登上線維シナプスを維持するためにも必要であることがわかった.
4.C1ql1とBAI3との結合の阻害はシナプス可塑性および小脳の運動学習に異常をもたらす
登上線維シナプスを介するプルキンエ細胞への強力な興奮性の入力は,平行線維シナプスにおいて観察される代表的なシナプス可塑性のひとつである長期抑圧(long-term depression:LTD)の誘導に必須とされる.今日,平行線維シナプスでの長期抑圧は運動における記憶および学習の分子基盤と考えられており,事実,長期抑圧の障害された多くの遺伝子改変動物において重篤な運動学習の障害が認められている9,10).そこで,C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスを用い,長期抑圧の誘導実験および小脳に依存性の運動学習課題を行った.すると,C1ql1ノックアウトマウスおよびプルキンエ細胞に特異的なBAI3ノックアウトマウスにおいて長期抑圧の障害が認められ,それにともない,運動における学習能のいちじるしい低下が観察された(図1).これらの障害は登上線維シナプスへの入力の低下によるCa2+の流入量の減少により生じているものと思われるが,BAI3の細胞内領域にはGタンパク質をはじめさまざまなシグナル伝達タンパク質が結合することから7),今後,C1ql1-BAI3シグナル伝達系が長期抑圧および運動における学習能を直接的に制御している可能性についても検討していきたい.
おわりに
今回,筆者らは,登上線維シナプスの競合の過程および小脳の機能をささえるまったく新しいC1ql1シグナル伝達系を見い出した.これまで,登上線維シナプスの競合の過程にかかわるタンパク質の多くはプルキンエ細胞に発現し,それらのタンパク質を起点とした逆行性シグナルのみが注目されてきた.しかし,登上線維シナプスにおける競合の過程をより深く理解するためには,おのおのの登上線維の活動にともなう順行性シグナルについても考える必要がある.神経の活動に依存して分泌されうるC1ql1が登上線維シナプスの競合に必要な順行性シグナルを担うものと予想される.
今日,アルツハイマー病や統合失調症をはじめとするさまざまな精神神経疾患の病態の発現において,シナプスに発現するタンパク質の関与が示唆されつつある.したがって,シナプスの形成および機能を制御するこの新しいC1ql1シグナル伝達機構を解明することが,これらの疾患に対する治療の開発につながる可能性も高い.
C1ql1およびBAI3に類似したタンパク質は小脳だけでなく脳の全域に広く発現していることから6,8),C1ql1-BAI3シグナグル伝達系の解明が中枢シナプスの形成,維持,除去の機構を理解するための大きな糸口となるものと期待される.
文 献
- Watanabe, M. & Kano, M.: Climbing fiber synapse elimination in cerebellar Purkinje cells. Eur. J. Neurosci., 34, 1697-1710 (2011)[PubMed]
- Hirai, H., Pang, Z., Bao, D. et al.: Cbln1 is essential for synaptic integrity and plasticity in the cerebellum. Nat. Neurosci., 8, 1534-1541 (2005)[PubMed]
- Matsuda, K., Miura, E., Miyazaki, T. et al.: Cbln1 is a ligand for an orphan glutamate receptor δ2, a bidirectional synapse organizer. Science, 328, 363-368 (2010)[PubMed]
- Yuzaki, M.: Cbln1 and its family proteins in synapse formation and maintenance. Curr. Opin. Neurobiol., 21, 215-220 (2011)[PubMed]
- Stephan, A. H., Barres, B. A. & Stevens, B.: The complement system: an unexpected role in synaptic pruning during development and disease. Annu. Rev. Neurosci., 35, 369-389 (2012)[PubMed]
- Iijima, T., Miura, E., Watanabe, M. et al.: Distinct expression of C1q-like family mRNAs in mouse brain and biochemical characterization of their encoded proteins. Eur. J. Neurosci., 31, 1606-1615 (2010)[PubMed]
- Bolliger, M. F., Martinelli, D. C. & Sudhof, T. C.: The cell-adhesion G protein-coupled receptor BAI3 is a high-affinity receptor for C1q-like proteins. Proc. Natl. Acad. Sci. USA, 108, 2534-2539 (2011)[PubMed]
- Kee, H. J., Ahn, K. Y., Choi, K. C. et al.: Expression of brain-specific angiogenesis inhibitor 3 (BAI3) in normal brain and implications for BAI3 in ischemia-induced brain angiogenesis and malignant glioma. FEBS Lett., 569, 307-316 (2004)[PubMed]
- Ito, M., Yamaguchi, K., Nagao, S. et al.: Long-term depression as a model of cerebellar plasticity. Prog. Brain Res., 210, 1-30 (2014)[PubMed]
- Yuzaki, M.: Cerebellar LTD vs. motor learning-lessons learned from studying GluD2. Neural Netw., 47, 36-41 (2013)[PubMed]
著者プロフィール
略歴:2003年 群馬大学大学院医学系研究科 修了,同年 米国St. Jude Children’s Research Hospital博士研究員,2004年 慶應義塾大学医学部 助手を経て,2011年より同 専任講師.
研究テーマ:記憶および学習をささえる分子基盤の解明および制御.
抱負:実験を楽しみ,ディスカッションを楽しむ.そして,新たな事象を明らかにする.研究者としての醍醐味を存分に味わいながら,社会に還元できる研究を行っていきたい.
柚崎 通介(Michisuke Yuzaki)
慶應義塾大学医学部 教授.
研究室URL:http://www.yuzaki-lab.org
© 2015 掛川 渉・柚崎通介 Licensed under CC 表示 2.1 日本