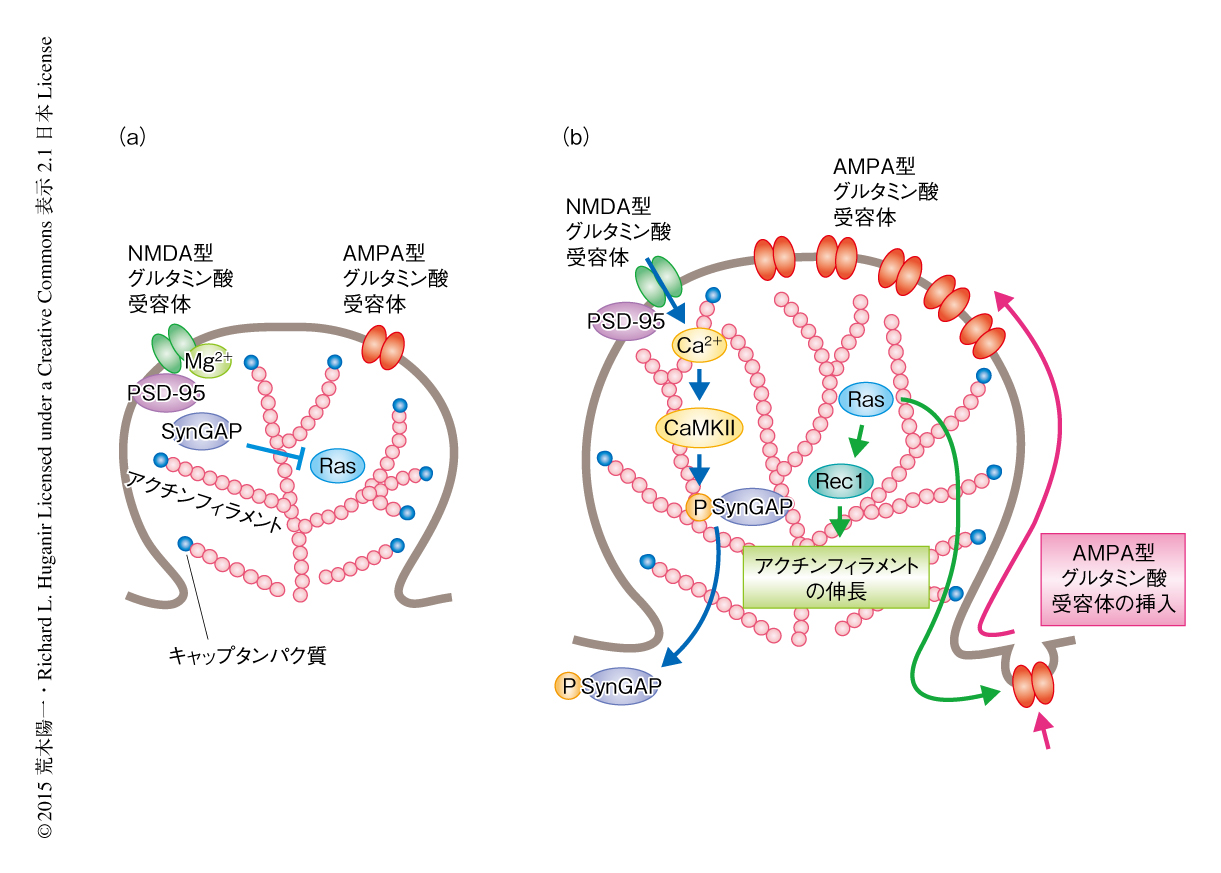
長期増強において後シナプスからのSynGAPの離散がAMPA型グルタミン酸受容体の後シナプス膜への挿入および後シナプスの肥大化をひき起こす
荒木陽一・Richard L. Huganir
(米国Johns Hopkins大学School of Medicine,Department of Neuroscience)
email:荒木陽一
DOI: 10.7875/first.author.2015.019
Rapid dispersion of SynGAP from synaptic spines triggers AMPA receptor insertion and spine enlargement during LTP.
Yoichi Araki, Menglong Zeng, Mingjie Zhang, Richard L. Huganir
Neuron, 85, 173-189 (2015)
学習および記憶において重要な役割をはたす長期増強の成立において,シナプスにおけるNMDA型グルタミン酸受容体の活性化およびCa2+/カルモジュリン依存性プロテインキナーゼIIの活性化が必須であることがわかっている.一方,長期増強の成立には,その下流における低分子量Gタンパク質の活性化,AMPA型グルタミン酸受容体の後シナプス膜への挿入,アクチンフィラメントの再構成および伸長による後シナプスの肥大化,という一連の細胞生物学的な変化が必要であることも明らかにされていた.しかし,Ca2+/カルモジュリン依存性プロテインキナーゼIIの活性がどのように下流の低分子量Gタンパク質へと伝達されるのかは不明のままで,長期増強の成立の過程におけるミッシングリンクであった.この研究により,このミッシングリンクは,Ca2+/カルモジュリン依存性プロテインキナーゼIIがSynGAPをリン酸化し,それによりSynGAPが後シナプスから離散することによって,低分子量Gタンパク質が活性化するという現象であることが発見された.興味深いことに,近年,ヒトの知的障害において見い出されたSynGAPの複数の変異において,SynGAPの離散の分子機構は欠失していた.
近年,記憶の成立および維持の過程について,光遺伝学的な手法などを用いた神経回路レベルの研究により異なる種類の記憶は脳の異なる部位に蓄積されること1,2),また,記憶の獲得はおもにシナプスの可塑性,とくに,シナプスの結合の強化である長期増強(LTP:long-term potentiation)によること3) が明らかにされてきた.長期増強には,シナプスに強い刺激がくわわったときのNMDA型グルタミン酸受容体をつうじたCa2+の流入,および,それにつづくCa2+/カルモジュリン依存性プロテインキナーゼIIの活性化が重要であること,また,これらにひきつづく低分子量Gタンパク質Ras,Cdc42,Rac1,Rhoの活性化が,AMPA型グルタミン酸受容体の後シナプス膜への挿入,および,後シナプスにおけるアクチンフィラメントの再構成および伸長による後シナプスの肥大化において必須の役割を担うことが明らかにされていたが4-6),Ca2+/カルモジュリン依存性プロテインキナーゼIIの活性化がどのように低分子量Gタンパク質の活性化をひき起こすかについて不明のままミッシングリンクとなっていた.今回,筆者らの研究により,このミッシングリンクが明らかにされ,これらの分子機構の破綻がいかに知的障害の原因となりうるかが細胞生物学的に説明された.
低分子量Gタンパク質RasのGAP(GTPase-activating protein,GTPase活性化タンパク質)のひとつであるSynGAPに注目した.GFPを付加したSynGAPを海馬初代培養ニューロンに導入し,NMDA型グルタミン酸受容体のアゴニストであるグリシンを含む培養液を潅流させることにより後シナプス膜のNMDA型グルタミン酸受容体を活性化させ,in vitroにおいて化学的に長期増強をひき起こした.長期増強を起こしたシナプスにおいては後シナプス膜にAMPA型グルタミン酸受容体が挿入され,その結果,AMPA型グルタミン酸受容体の総数が増加することによりシナプスの結合強度が高まること,また,それと同時に,後シナプスにおいてアクチンフィラメントが再構成および伸長することにより後シナプスが肥大化することが知られており(図1),この手法により刺激したシナプスにおいても同様の現象が確認された.SynGAPはNMDA型グルタミン酸受容体のアゴニストのよる刺激のまえには後シナプスに高度に濃縮されていたが,刺激ののちにそれが離散するようすが観察された.薬理学的な実験により,このSynGAPの離散はNMDA型グルタミン酸受容体およびCa2+/カルモジュリン依存性プロテインキナーゼIIの活性に依存することが明らかにされた.また,タイムラプスライブイメージング法により,刺激から数分以内に起こるSynGAPの離散から,後シナプスが肥大化したままになるか,一時的な肥大化だけでもとにもどるかといった,のちのシナプスの運命がよく予測できることがわかった.SynGAPの離散した後シナプスはその肥大化をよく維持したが,SynGAPが離散せずにとどまった後シナプスでは肥大化は一時的なものにとどまりもとの大きさにもどるものが多かった.
SynGAPの後シナプスからの離散はCa2+/カルモジュリン依存性プロテインキナーゼIIに依存的であったことから,SynGAPのリン酸化部位を同定し,Ser1108およびSer1138がCa2+/カルモジュリン依存性プロテインキナーゼIIに依存的にリン酸化されることを明らかにした.SynGAPは後シナプス膜に存在するPSD-95と結合することにより後シナプス膜にアンカーされていると考えられていたことから,このリン酸化がPSD-95との結合に及ぼす影響について調べた.HEK細胞に野生型のSynGAPあるいはリン酸化模倣変異を導入したSynGAPを発現させ,免疫沈降法によりPSD-95との結合について調べた.その結果,リン酸化模倣変異型SynGAPはPSD-95との結合が有意に弱まっており,この部位のリン酸化によりSynGAPとPSD-95との結合は外れることが示唆された.また,野生型SynGAPあるいはリン酸化模倣変異型SynGAPをニューロンに発現させたところ,後シナプスに濃縮している割合はリン酸化模倣変異型SynGAPのほうが低かった.これにより,Ca2+/カルモジュリン依存性プロテインキナーゼIIによりリン酸化されたSynGAPは,後シナプス膜へのアンカータンパク質であるPSD-95との結合が外れることにより後シナプスから離散することが示唆された.
SynGAPのリン酸化がシナプスの結合の強度を制御しているかどうか,海馬初代培養ニューロンにおいて調べた.内在性のSynGAPをshRNAによりノックダウンしたうえで,それぞれshRNAに耐性をもつ,野生型SynGAP,非リン酸化変異型SynGAP,リン酸化模倣変異型SynGAPを発現させたのち,NMDA型グルタミン酸受容体のアゴニストの刺激により長期増強を誘起した.その結果,野生型SynGAPを発現させたニューロンでは刺激ののちシナプスにおけるRasの活性が正常に上昇し,そののち,AMPA型グルタミン酸受容体が後シナプス膜に挿入されるのと同時に,後シナプスの肥大化がみられ,シナプスの結合が増強されていた.しかし,非リン酸化変異型SynGAPを発現させたニューロンではRasの活性の上昇はみられず,その下流のAMPA型グルタミン酸受容体の後シナプス膜への挿入,後シナプスの肥大化,シナプスの結合の強度の増強もみられなかった.一方,リン酸化模倣変異型SynGAPを発現させたニューロンでは,SynGAPが後シナプスに局在できないため刺激のまえからRasの活性は上昇しており,AMPA型グルタミン酸受容体の後シナプス膜への挿入,後シナプスの肥大化もすでに起こっており,刺激によるそれらの新たな上昇はみられなかった.また,SynGAPを後シナプス膜に人工的に係留したところ,同じように,AMPA型グルタミン酸受容体の後シナプス膜への挿入および後シナプスの肥大化はみられず,SynGAPの後シナプス膜への局在がシグナルの伝達に重要であることが強く示唆された.これらの結果より,長期増強を誘起したときのSynGAPのリン酸化は,その後シナプスからの離散を介してAMPA型グルタミン酸受容体を後シナプス膜に挿入し,後シナプスを肥大化させ,シナプスの結合の強度を増強することが明らかにされた.
ヒトの知的障害において発見された変異をもつSynGAPをニューロンに発現させ,SynGAPの離散の分子機構が保存されているかどうか調べた.その結果,調べた3つの変異すべてにおいて,NMDA型グルタミン酸受容体のアゴニストの刺激により長期増強を誘起こしたシナプスにおける後シナプスからのSynGAPの離散の分子機構は欠失していること,それにともなう後シナプスの肥大化も起こらないことが明らかにされた.
この研究により,長期増強の成立の過程においてCa2+/カルモジュリン依存性プロテインキナーゼIIの活性がどのように低分子量Gタンパク質へと伝達されるかというミッシングリンクのひとつが,Ca2+/カルモジュリン依存性プロテインキナーゼIIによるSynGAPのリン酸化によりひき起こされるSynGAPの後シナプスからの離散であることが明らかにされた.
近年の次世代シークエンサーの発達,とくに,エキソームシークエンスの発展により,ある特定の疾患において生じている遺伝子の変異が急速に発見されている.興味深いことに,変異の見い出された遺伝子はいままで生物学的に同一の経路にあると考えられてきたものも多く,逆に,ここから疾患の分子機構の全体像が垣間みえてきたものも多い.知的障害については,長期増強を成立させる経路にあるもの,なかでも,低分子量Gタンパク質の活性を制御するGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)およびGAP,さらに,その下流において後シナプスの肥大化を制御するアクチンの再構成および伸長を制御するタンパク質に変異が多くみつかっており7-11),この分子機構の制御それ自体がヒトの知的能力に影響をあたえていることが推察される.これらの知見により,なお考慮すべき点はあるものの,たとえば,発達段階に特異的な適切な酵素活性の制御など,知的障害の創薬ターゲットの選定も視野にはいってきた.
略歴:2005年 東京大学大学院薬学系研究科博士課程 修了,米国Johns Hopkins大学School of Medicine博士研究員を経て,2012年より同 リサーチアソシエイト.
研究テーマ:グルタミン酸シナプスの可塑性の分子機構の解明およびライブイメージング.
抱負:近年,シナプス伝達の異常が原因であると明らかになってきた知的障害,自閉症,統合失調症,アルツハイマー病などの治療法の解明や治療薬の開発に,シナプス可塑性の分子機構の解明をつうじて貢献したい.
Richard L. Huganir
米国Johns Hopkins大学School of Medicine教授.
研究室URL:http://neuroscience.bs.jhmi.edu/huganir/
© 2015 荒木陽一・Richard L. Huganir Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学School of Medicine,Department of Neuroscience)
email:荒木陽一
DOI: 10.7875/first.author.2015.019
Rapid dispersion of SynGAP from synaptic spines triggers AMPA receptor insertion and spine enlargement during LTP.
Yoichi Araki, Menglong Zeng, Mingjie Zhang, Richard L. Huganir
Neuron, 85, 173-189 (2015)
要 約
学習および記憶において重要な役割をはたす長期増強の成立において,シナプスにおけるNMDA型グルタミン酸受容体の活性化およびCa2+/カルモジュリン依存性プロテインキナーゼIIの活性化が必須であることがわかっている.一方,長期増強の成立には,その下流における低分子量Gタンパク質の活性化,AMPA型グルタミン酸受容体の後シナプス膜への挿入,アクチンフィラメントの再構成および伸長による後シナプスの肥大化,という一連の細胞生物学的な変化が必要であることも明らかにされていた.しかし,Ca2+/カルモジュリン依存性プロテインキナーゼIIの活性がどのように下流の低分子量Gタンパク質へと伝達されるのかは不明のままで,長期増強の成立の過程におけるミッシングリンクであった.この研究により,このミッシングリンクは,Ca2+/カルモジュリン依存性プロテインキナーゼIIがSynGAPをリン酸化し,それによりSynGAPが後シナプスから離散することによって,低分子量Gタンパク質が活性化するという現象であることが発見された.興味深いことに,近年,ヒトの知的障害において見い出されたSynGAPの複数の変異において,SynGAPの離散の分子機構は欠失していた.
はじめに
近年,記憶の成立および維持の過程について,光遺伝学的な手法などを用いた神経回路レベルの研究により異なる種類の記憶は脳の異なる部位に蓄積されること1,2),また,記憶の獲得はおもにシナプスの可塑性,とくに,シナプスの結合の強化である長期増強(LTP:long-term potentiation)によること3) が明らかにされてきた.長期増強には,シナプスに強い刺激がくわわったときのNMDA型グルタミン酸受容体をつうじたCa2+の流入,および,それにつづくCa2+/カルモジュリン依存性プロテインキナーゼIIの活性化が重要であること,また,これらにひきつづく低分子量Gタンパク質Ras,Cdc42,Rac1,Rhoの活性化が,AMPA型グルタミン酸受容体の後シナプス膜への挿入,および,後シナプスにおけるアクチンフィラメントの再構成および伸長による後シナプスの肥大化において必須の役割を担うことが明らかにされていたが4-6),Ca2+/カルモジュリン依存性プロテインキナーゼIIの活性化がどのように低分子量Gタンパク質の活性化をひき起こすかについて不明のままミッシングリンクとなっていた.今回,筆者らの研究により,このミッシングリンクが明らかにされ,これらの分子機構の破綻がいかに知的障害の原因となりうるかが細胞生物学的に説明された.
1.SynGAPはNMDA型グルタミン酸受容体の活性に依存して後シナプスから離散する
低分子量Gタンパク質RasのGAP(GTPase-activating protein,GTPase活性化タンパク質)のひとつであるSynGAPに注目した.GFPを付加したSynGAPを海馬初代培養ニューロンに導入し,NMDA型グルタミン酸受容体のアゴニストであるグリシンを含む培養液を潅流させることにより後シナプス膜のNMDA型グルタミン酸受容体を活性化させ,in vitroにおいて化学的に長期増強をひき起こした.長期増強を起こしたシナプスにおいては後シナプス膜にAMPA型グルタミン酸受容体が挿入され,その結果,AMPA型グルタミン酸受容体の総数が増加することによりシナプスの結合強度が高まること,また,それと同時に,後シナプスにおいてアクチンフィラメントが再構成および伸長することにより後シナプスが肥大化することが知られており(図1),この手法により刺激したシナプスにおいても同様の現象が確認された.SynGAPはNMDA型グルタミン酸受容体のアゴニストのよる刺激のまえには後シナプスに高度に濃縮されていたが,刺激ののちにそれが離散するようすが観察された.薬理学的な実験により,このSynGAPの離散はNMDA型グルタミン酸受容体およびCa2+/カルモジュリン依存性プロテインキナーゼIIの活性に依存することが明らかにされた.また,タイムラプスライブイメージング法により,刺激から数分以内に起こるSynGAPの離散から,後シナプスが肥大化したままになるか,一時的な肥大化だけでもとにもどるかといった,のちのシナプスの運命がよく予測できることがわかった.SynGAPの離散した後シナプスはその肥大化をよく維持したが,SynGAPが離散せずにとどまった後シナプスでは肥大化は一時的なものにとどまりもとの大きさにもどるものが多かった.
2.SynGAPはリン酸化によりPSD-95との結合が外れることで後シナプスから離散する
SynGAPの後シナプスからの離散はCa2+/カルモジュリン依存性プロテインキナーゼIIに依存的であったことから,SynGAPのリン酸化部位を同定し,Ser1108およびSer1138がCa2+/カルモジュリン依存性プロテインキナーゼIIに依存的にリン酸化されることを明らかにした.SynGAPは後シナプス膜に存在するPSD-95と結合することにより後シナプス膜にアンカーされていると考えられていたことから,このリン酸化がPSD-95との結合に及ぼす影響について調べた.HEK細胞に野生型のSynGAPあるいはリン酸化模倣変異を導入したSynGAPを発現させ,免疫沈降法によりPSD-95との結合について調べた.その結果,リン酸化模倣変異型SynGAPはPSD-95との結合が有意に弱まっており,この部位のリン酸化によりSynGAPとPSD-95との結合は外れることが示唆された.また,野生型SynGAPあるいはリン酸化模倣変異型SynGAPをニューロンに発現させたところ,後シナプスに濃縮している割合はリン酸化模倣変異型SynGAPのほうが低かった.これにより,Ca2+/カルモジュリン依存性プロテインキナーゼIIによりリン酸化されたSynGAPは,後シナプス膜へのアンカータンパク質であるPSD-95との結合が外れることにより後シナプスから離散することが示唆された.
3.SynGAPの後シナプスからの離散はシナプスの結合の強度を制御する
SynGAPのリン酸化がシナプスの結合の強度を制御しているかどうか,海馬初代培養ニューロンにおいて調べた.内在性のSynGAPをshRNAによりノックダウンしたうえで,それぞれshRNAに耐性をもつ,野生型SynGAP,非リン酸化変異型SynGAP,リン酸化模倣変異型SynGAPを発現させたのち,NMDA型グルタミン酸受容体のアゴニストの刺激により長期増強を誘起した.その結果,野生型SynGAPを発現させたニューロンでは刺激ののちシナプスにおけるRasの活性が正常に上昇し,そののち,AMPA型グルタミン酸受容体が後シナプス膜に挿入されるのと同時に,後シナプスの肥大化がみられ,シナプスの結合が増強されていた.しかし,非リン酸化変異型SynGAPを発現させたニューロンではRasの活性の上昇はみられず,その下流のAMPA型グルタミン酸受容体の後シナプス膜への挿入,後シナプスの肥大化,シナプスの結合の強度の増強もみられなかった.一方,リン酸化模倣変異型SynGAPを発現させたニューロンでは,SynGAPが後シナプスに局在できないため刺激のまえからRasの活性は上昇しており,AMPA型グルタミン酸受容体の後シナプス膜への挿入,後シナプスの肥大化もすでに起こっており,刺激によるそれらの新たな上昇はみられなかった.また,SynGAPを後シナプス膜に人工的に係留したところ,同じように,AMPA型グルタミン酸受容体の後シナプス膜への挿入および後シナプスの肥大化はみられず,SynGAPの後シナプス膜への局在がシグナルの伝達に重要であることが強く示唆された.これらの結果より,長期増強を誘起したときのSynGAPのリン酸化は,その後シナプスからの離散を介してAMPA型グルタミン酸受容体を後シナプス膜に挿入し,後シナプスを肥大化させ,シナプスの結合の強度を増強することが明らかにされた.
4.ヒトの知的障害において見い出されたSynGAPの複数の変異においてSynGAPの離散の分子機構は欠失していた
ヒトの知的障害において発見された変異をもつSynGAPをニューロンに発現させ,SynGAPの離散の分子機構が保存されているかどうか調べた.その結果,調べた3つの変異すべてにおいて,NMDA型グルタミン酸受容体のアゴニストの刺激により長期増強を誘起こしたシナプスにおける後シナプスからのSynGAPの離散の分子機構は欠失していること,それにともなう後シナプスの肥大化も起こらないことが明らかにされた.
おわりに
この研究により,長期増強の成立の過程においてCa2+/カルモジュリン依存性プロテインキナーゼIIの活性がどのように低分子量Gタンパク質へと伝達されるかというミッシングリンクのひとつが,Ca2+/カルモジュリン依存性プロテインキナーゼIIによるSynGAPのリン酸化によりひき起こされるSynGAPの後シナプスからの離散であることが明らかにされた.
近年の次世代シークエンサーの発達,とくに,エキソームシークエンスの発展により,ある特定の疾患において生じている遺伝子の変異が急速に発見されている.興味深いことに,変異の見い出された遺伝子はいままで生物学的に同一の経路にあると考えられてきたものも多く,逆に,ここから疾患の分子機構の全体像が垣間みえてきたものも多い.知的障害については,長期増強を成立させる経路にあるもの,なかでも,低分子量Gタンパク質の活性を制御するGEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)およびGAP,さらに,その下流において後シナプスの肥大化を制御するアクチンの再構成および伸長を制御するタンパク質に変異が多くみつかっており7-11),この分子機構の制御それ自体がヒトの知的能力に影響をあたえていることが推察される.これらの知見により,なお考慮すべき点はあるものの,たとえば,発達段階に特異的な適切な酵素活性の制御など,知的障害の創薬ターゲットの選定も視野にはいってきた.
文 献
- Liu, X., Ramirez, S., Pang, P. T. et al.: Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 484, 381-385 (2012)[PubMed]
- Dolen, G., Darvishzadeh, A., Huang, K. W. et al.: Social reward requires coordinated activity of nucleus accumbens oxytocin and serotonin. Nature, 501, 179-184 (2013)[PubMed]
- Nabavi, S., Fox, R., Proulx, C. D. et al.: Engineering a memory with LTD and LTP. Nature, 511, 348-352 (2014)[PubMed]
- Zhu, J. J., Qin, Y., Zhao, M. et al.: Ras and Rap control AMPA receptor trafficking during synaptic plasticity. Cell, 110, 443-455 (2002)[PubMed]
- Harvey, C. D., Yasuda, R., Zhong, H. et al.: The spread of Ras activity triggered by activation of a single dendritic spine. Science, 321, 136-140 (2008)[PubMed]
- Matsuzaki, M., Honkura, N., Ellis-Davies, G. C. et al.: Structural basis of long-term potentiation in single dendritic spines. Nature, 429, 761-766 (2004)[PubMed]
- Hamdan, F. F., Gauthier, J., Spiegelman, D. et al.: Mutations in SYNGAP1 in autosomal nonsyndromic mental retardation. N. Engl. J. Med., 360, 599-605 (2009)[PubMed]
- Allen, K. M., Gleeson, J. G., Bagrodia, S. et al.: PAK3 mutation in nonsyndromic X-linked mental retardation. Nat. Genet., 20, 25-30 (1998)[PubMed]
- Billuart, P., Bienvenu, T., Ronce, N. et al.: Oligophrenin-1 encodes a rhoGAP protein involved in X-linked mental retardation. Nature, 392, 923-926 (1998)[PubMed]
- Kutsche, K., Yntema, H., Brandt, A. et al.: Mutations in ARHGEF6, encoding a guanine nucleotide exchange factor for Rho GTPases, in patients with X-linked mental retardation. Nat. Genet., 26, 247-250 (2000)[PubMed]
- Ramakers, G. J.: Rho proteins, mental retardation and the cellular basis of cognition. Trends Neurosci., 25, 191-199 (2002)[PubMed]
著者プロフィール
略歴:2005年 東京大学大学院薬学系研究科博士課程 修了,米国Johns Hopkins大学School of Medicine博士研究員を経て,2012年より同 リサーチアソシエイト.
研究テーマ:グルタミン酸シナプスの可塑性の分子機構の解明およびライブイメージング.
抱負:近年,シナプス伝達の異常が原因であると明らかになってきた知的障害,自閉症,統合失調症,アルツハイマー病などの治療法の解明や治療薬の開発に,シナプス可塑性の分子機構の解明をつうじて貢献したい.
Richard L. Huganir
米国Johns Hopkins大学School of Medicine教授.
研究室URL:http://neuroscience.bs.jhmi.edu/huganir/
© 2015 荒木陽一・Richard L. Huganir Licensed under CC 表示 2.1 日本