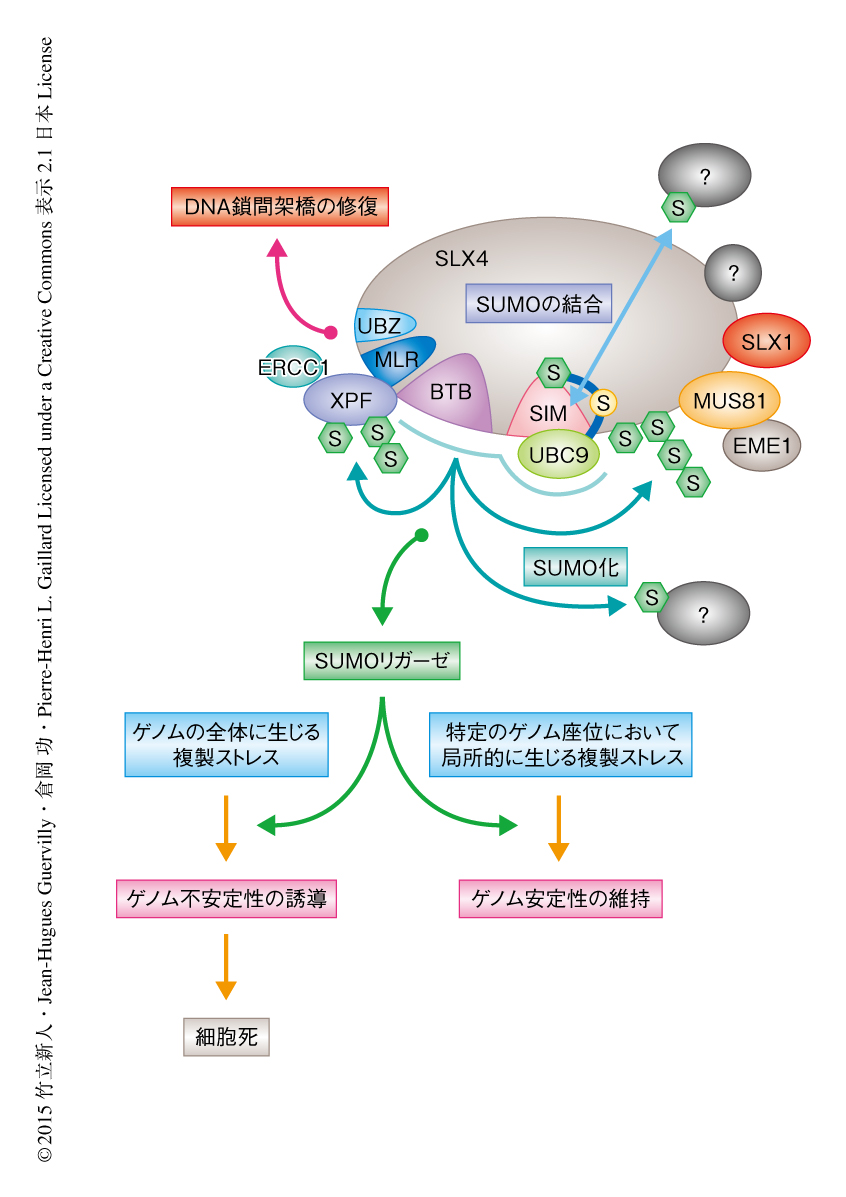
SLX4複合体はSUMOリガーゼであり複製ストレス応答およびゲノム安定性の維持に寄与する
竹立新人1・Jean-Hugues Guervilly 1・倉岡 功2・Pierre-Henri L. Gaillard 1
(1フランスCentre National de la Recherche Scientifique,Unité Mixte de Recherche 7258,Inserm-Unité 1068,Centre de Recherche en Cancérologie de Marseille,Institut Paoli-Calmettes,Aix-Marseille Université,2大阪大学大学院基礎工学研究科 物質創成専攻生体機能化学グループ)
email:竹立新人
DOI: 10.7875/first.author.2015.017
The SLX4 complex is a SUMO E3 ligase that impacts on replication stress outcome and genome stability.
Jean-Hugues Guervilly, Arato Takedachi, Valeria Naim, Sarah Scaglione, Charly Chawhan, Yoann Lovera, Emmanuelle Despras, Isao Kuraoka, Patricia Kannouche, Filippo Rosselli, Pierre-Henri L. Gaillard
Molecular Cell, 57, 123-137 (2015)
Fanconi貧血の原因遺伝子産物であるSLX4はゲノム安定性の維持機構においてレギュレーターとしてはたらくと考えられている.しかし,SLX4がどのようにこの機構を制御しているのかについては未解明な部分が多い.筆者らは,SLX4複合体がSUMOリガーゼであり,SLX4およびSLX4と相互作用するタンパク質XPFのSUMO化に寄与することを明らかにした.また,SLX4は活性化したSUMO結合酵素UBC9と特異的に結合し,SLX4のSUMOリガーゼ活性にはSUMOとの相互作用にかかわるSIMドメインおよびタンパク質間相互作用やオリゴマーの形成にかかわるBTBドメインが必要となることがわかった.さらに,SLX4を介したSUMOリガーゼ活性は複製ストレス応答において細胞毒性をひき起こす一方,染色体の脆弱部位の形成にともなう細胞死を防ぐのに必須であることが明らかにされた.
細胞はDNA損傷に対し複雑なシグナル伝達ネットワークをもち,細胞周期の進行と複製,修復,組換えの機構をうまく制御しながらDNA損傷の処理にあたる.Fanconi貧血の原因遺伝子産物であるSLX4(FANCP)は,そのなかでコーディネーターとして機能すると考えられている.たとえば,分裂酵母のSlx4は構造に特異的なエンドヌクレアーゼSlx1と結合しリボソームRNAの安定性を制御する1).出芽酵母においてSlx4はRad1XPF-Rad10ERCC1複合体と結合してDNA 2本鎖切断の修復に寄与するとともに,足場タンパク質Rtt107と協調して停止した複製の再開に寄与する2).ヒトのSLX4において,SLX1およびXPF-ERCC1複合体との相互作用は高度に保存され,さらに,MUS81-EME1複合体をくわえた3種類の構造に特異的なエンドヌクレアーゼと相互作用してこれらの機能を制御すると考えられている3-5).さらに,ヒトのSLX4はミスマッチ修復タンパク質MSH2-MSH3複合体,テロメアタンパク質TRF2,細胞周期制御にかかわるキナーゼPLK1と相互作用する3,5).
興味深いことに,後生動物のSLX4はN末端側にさらにUBZドメイン,MLRドメイン,BTBドメインを含む領域をもつ3-6).筆者らは,SLX4において新たにSIMドメインを同定し,SUMOに関連したSLX4の機能について解析した.
アミノ酸配列の解析により,後生動物のSLX4において保存された3つのSIMドメインSIM1~SIM3を同定した(図1).精製タンパク質を用いた解析により,SIM1およびSIM2がとくにSUMOとの結合ドメインとして機能し,ポリSUMO鎖と親和性を示すことがわかった.また,細胞においてSLX4およびSLX4と相互作用するタンパク質XPFが特異的にSUMO化され,SLX4がXPFのSUMO化を促進すること,さらに,SLX4およびXPFのSUMO化はSIMドメインに依存的に起こることがわかった.SLX4においてXPFとの相互作用にかかわるMLRドメイン,および,タンパク質間相互作用やオリゴマーの形成にかかわるとともにXPFとの直接的な結合が報告されているBTBドメインについて解析したところ3,5,6),MLRドメインに変異を導入したSLX4を発現させた細胞においてSLX4自体にSUMO化がみられた一方,XPFのSUMO化は顕著に阻害され,XPFのSUMO化にはSLX4との相互作用が必要であることが示唆された.一方,BTBドメインに変異をもつSLX4を発現させた細胞において,BTBドメインに変異をもつSLX4とXPFとの相互作用はわずかに阻害されるにとどまったものの,SLX4およびXPFのSUMO化はみられなかった.BTBドメインに変異を導入したSLX4は,SIMドメインに変異を導入したSLX4とは対照的に,細胞においてSUMO化されたタンパク質と相互作用したことから,SLX4のSUMO化およびSLX4によるXPFのSUMO化の促進は,単にSLX4のSUMOとの結合活性のみにより起こるのではないことが示唆された.
SLX4がXPFのSUMO化を促進したことから,SLX4がSUMOリガーゼもしくはその構成タンパク質であることが示唆された.既知のSUMOリガーゼはSUMO結合酵素であるUBC9と結合することから,SLX4とUBC9との結合について調べた7).その結果,HeLa細胞を用いた免疫沈降によりSLX4とUBC9との相互作用がみられたものの,精製タンパク質を用いたプルダウンアッセイにおいてUBC9とSLX4断片との結合は認められなかった.この結果から,SLX4が細胞においてSUMO化もしくは活性化されたUBC9と特異的に相互作用することが考えられた.そこで,精製したUBC9をATP存在下においてSUMO活性化酵素であるSAE1-SAE2複合体およびSUMO2とプレインキュベーションしてSUMO化および活性化UBC9を形成させたのち,BTBドメイン,SIM1,SIM2を含むSLX4断片との相互作用について調べた.SUMO化UBC9および活性化UBC9は,それぞれ,UBC9とSUMOとが共有結合あるいはチオエステル結合したものであるため,還元剤を処理することよりこれらを区別することができる.その結果,SLX4断片は活性化UBC9と特異的に相互作用することがわかった.
興味深いことに,BTBドメインを欠失するSLX4断片は活性化UBC9と相互作用する一方,SIMドメインに存在する脂肪族アミノ酸残基により構成される疎水性コアに変異を導入したSLX4断片においては活性化UBC9との相互作用が阻害された.また,SIMドメインの疎水性コアの近傍には酸性アミノ酸残基からなるクラスターが存在し,その変異体においてSUMO鎖および活性化UBC9との相互作用が阻害されたことから,SLX4のSIM1およびSIM2に存在する陰電荷が,高次構造においてUBC9の活性中心の近傍に位置する塩基性パッチと静電的に相互作用することが示唆された.これと一致して,UBC9の塩基性パッチを構成するアミノ酸残基に変異を導入したところ,SLX4断片との相互作用が阻害された.さらに,SUMO化および活性化の起こらないUBC9の活性中心の変異体はSLX4断片と相互作用しなかった.これらの結果から,SLX4と活性化UBC9との結合においては,SIMドメインとSUMOとのあいだの相互作用,および,SIMドメインのもつ陰電荷とUBC9の活性中心の近傍の塩基性パッチとのあいだの静電的な相互作用の両方が必要となることが明らかになった(図1).
SLX4と活性化UBC9とが特異的に相互作用したことから,SLX4がSUMOリガーゼであることがあらためて示唆された.しかし,精製タンパク質を用いた解析において,SLX4を介したXPFのSUMO化を検出することはできなかった.そこで,HeLa細胞からの免疫沈降により得られたSLX4複合体にSUMO活性化酵素,SUMO結合酵素であるUBC9,SUMO2をくわえて,そのSUMOリガーゼ活性について調べた.その結果,ATPに依存的なSLX4およびXPFのSUMO化が検出された一方,同じくSLX4複合体の構成タンパク質であるMUS81のSUMO化はみられず,SLX4とXPFが特異的にSUMO化されることが示唆された.重要なことに,既知のSUMOリガーゼはこの精製試料において検出されなかった.また,この解析においても,SUMOリガーゼ活性におけるBTBドメインとSIMドメインの重要性,および,SLX4と活性化UBC9とのあいだの相互作用の重要性が確認された.
興味深いことに,SLX4の免疫沈降の際の塩濃度を150 mMから500 mMに変えた条件ではSUMOリガーゼ活性が顕著に低下した.このことから,SLX4に依存的なSUMOリガーゼ活性はなんらかの補因子の影響をうけることが示唆された.SLX4はDNA損傷応答に密接に関与することから,この補因子はDNAであると考えた.そこで,500 mMの塩濃度の条件において免疫沈降した試料にDNA断片をくわえたところ,SUMOリガーゼ活性は150 mMの塩濃度の条件において免疫沈降した試料と同じ程度にまで回復した.
SLX4に依存的なSUMOリガーゼ活性が大腸菌に由来する精製タンパク質を用いた実験系で再現できない理由として,ほかの翻訳後修飾の関与が考えられた.そこで,HeLa細胞からの免疫沈降により得られたSLX4複合体を脱リン酸化酵素により処理したところ,SUMOリガーゼ活性は顕著に低下した.これらの結果から,SLX4に依存的なSUMOリガーゼ活性はDNAおよびリン酸化により促進されることがわかった.SLX4が活性化UBC9と特異的に相互作用し細胞においてXPFのSUMO化を制御することとあわせると,SLX4がSUMOリガーゼあるいは少なくともその必須の構成タンパク質であることが明らかになった.
内因性のSLX4の発現を抑制したうえで野生型SLX4あるいは変異型SLX4を発現させた細胞を用いてマイトマイシンCに対する感受性を調べた結果,SLX4のUBZドメインがDNA鎖間架橋の修復に寄与するのと対照的に8),SLX4を介したSUMOリガーゼ活性はこれに関与しないことがわかった.一方,外因性のSLX4の発現によりSIMドメインおよびBTBドメインに依存的な細胞毒性がみられた.SLX4は複製ストレス応答の際に起こるDNA 2本鎖切断に寄与することが知られているが9),これらがなんらかの因果関係をもつことが考えられた.そこで,DNA合成阻害剤であるヒドロキシ尿素に対する感受性を調べたところ,ヒドロキシ尿素によりDNAの複製フォークが停止した細胞においてSLX4を介したSUMOリガーゼ活性が細胞毒性をひき起こすことがわかった.
ヒドロキシ尿素およびチェックポイントキナーゼであるATRの阻害剤を併用した場合に,複製フォークの崩壊,DNA 2本鎖切断の誘導,複製フォークにおける過度の一本鎖DNAの形成が起こり,その結果,細胞死が誘導されることが知られている9).そこで,ヒドロキシ尿素およびATR阻害剤に対する感受性を調べたところ,SLX4を介したSUMOリガーゼ活性が複製ストレス応答における急性の細胞毒性にも寄与することがわかった.一方,SLX4と相互作用する構造に特異的なエンドヌクレアーゼの発現を抑制した細胞において同様に解析した結果,SLX1およびXPF-ERCC1複合体について,ヒドロキシ尿素の処理ののちの細胞毒性に対する寄与が限局的にみられたが,急性の細胞毒性には影響がみられなかった.これらの結果から,複製ストレスの際に生じるSLX4に依存的な細胞毒性はおもにSLX4を介したSUMOリガーゼ活性に起因し,エンドヌクレアーゼによる影響は限局されていることが示唆された.また,SLX4の発現を抑制した細胞においてはヒドロキシ尿素の処理ののちのリン酸化されたヒストンH2AXの誘導が抑制され,さらに,ヒドロキシ尿素の処理ののちの染色体の切断がSLX4のもつSIMドメインに依存的に起こったことから,複製ストレス応答の際,SLX4を介したSUMOリガーゼ活性によりDNA 2本鎖切断が生じ,その結果,細胞毒性が誘導されることがわかった.
一般的な複製ストレスの場合とは対照的に,染色体の脆弱部位など複製の困難な特定のゲノム座位において複製ストレスが集中したとき,SLX4によりDNA 2本鎖切断が促進されることはかえって細胞にとり有益にはたらくと考えられる.実際に,アフィジコリンの処理により染色体の脆弱部位の形成を促進した細胞の分裂期の染色体において,野生型SLX4,UBZドメインに変異を導入したSLX4,SIMドメインに変異を導入したSLX4はいずれもFANCD2と共局在し,これらが染色体の脆弱部位に局在することが示唆された.また,SLX4は分裂期の細胞においてMUS81やERCC1と共局在し,これらの染色体の脆弱部位への局在に必須であったが,UBZドメインに変異を導入したSLX4およびSIMドメインに変異を導入したSLX4についても同様の結果が得られた.
興味深いことに,分裂期の細胞においてSLX4は姉妹染色分体の切断部位やギャップに局在していた.そこで,外因性の野生型SLX4を発現する細胞およびUBZドメインに変異を導入したSLX4を発現する細胞を観察したところ,分裂中期において姉妹染色分体の切断やギャップの形成が高頻度で観察された.対照的に,SIMドメインに変異を導入したSLX4を発現した細胞においてはその頻度は顕著に減少し,さらに,BTBドメインに変異を導入したSLX4を発現した細胞においてこれらはほとんど観察されなかった.この結果から,SLX4はSIMドメインに非依存的に染色体の脆弱部位に局在する一方,SIMドメインに依存的に姉妹染色分体の切断やギャップの形成を促進することが示唆された.
構造に特異的なエンドヌクレアーゼが染色体の脆弱部位にはたらくことにより適切な染色体の分離が促進されることから10),SLX4がその過程でどのように機能しているのかについて調べた.その結果,SIMドメインに変異を導入したSLX4を発現する細胞においては,SLX4の発現を抑制した細胞と同様に,分裂後期の染色体どうしの架橋や遅滞染色体が顕著に増加するとともに,細胞死が誘導された.この結果から,SLX4を介したSUMOリガーゼ活性は染色体の脆弱部位のような特定のゲノム座位における複製や染色体の分離に必要とされ,ゲノム安定性の維持に寄与することが明らかになった(図2).
筆者らは,この論文において,SLX4がSUMOリガーゼあるいはその必須の構成タンパク質であることを明らかにした.最近の報告から,1本鎖DNA結合タンパク質RPA,DNA 2本鎖切断の認識にかかわるMRN複合体,テロメアタンパク質TRF2とSLX4との相互作用がSIMドメインにより促進されることが明らかになり11),これらとSLX4を介したSUMOリガーゼ活性との関連性は興味深い.SLX4を介したSUMOリガーゼ活性がゲノムの全体に生じる複製ストレスにおいて細胞毒性をひき起こす一方,特定のゲノム座位における複製ストレスを解消することがわかったが,その機構についての分子レベルでの詳細は未解明である.リン酸化やユビキチン化などほかの翻訳後修飾との連携とあわせ,さらなる研究の発展が期待される.
略歴:2010年 大阪大学大学院医学系研究科 修了,同年 大阪大学大学院生命機能研究科 特任研究員,2011年 フランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員,2012年 大阪大学大学院生命機能研究科 特任研究員を経て,2013年よりフランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員.
研究テーマ:翻訳後修飾を介したDNA損傷応答.
抱負:DNA損傷応答にはたらくおのおののタンパク質の動きをとらえたい.
Jean-Hugues Guervilly
フランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員.
倉岡 功(Isao Kuraoka)
大阪大学大学院基礎工学研究科 准教授.
Pierre-Henri L. Gaillard
フランスCentre de Recherche en Cancérologie de MarseilleにてTeam Leader.
研究室URL:http://crcm.marseille.inserm.fr/en/researchteams/pierre-henri-gaillard/
© 2015 竹立新人・Jean-Hugues Guervilly・倉岡 功・Pierre-Henri L. Gaillard Licensed under CC 表示 2.1 日本
(1フランスCentre National de la Recherche Scientifique,Unité Mixte de Recherche 7258,Inserm-Unité 1068,Centre de Recherche en Cancérologie de Marseille,Institut Paoli-Calmettes,Aix-Marseille Université,2大阪大学大学院基礎工学研究科 物質創成専攻生体機能化学グループ)
email:竹立新人
DOI: 10.7875/first.author.2015.017
The SLX4 complex is a SUMO E3 ligase that impacts on replication stress outcome and genome stability.
Jean-Hugues Guervilly, Arato Takedachi, Valeria Naim, Sarah Scaglione, Charly Chawhan, Yoann Lovera, Emmanuelle Despras, Isao Kuraoka, Patricia Kannouche, Filippo Rosselli, Pierre-Henri L. Gaillard
Molecular Cell, 57, 123-137 (2015)
要 約
Fanconi貧血の原因遺伝子産物であるSLX4はゲノム安定性の維持機構においてレギュレーターとしてはたらくと考えられている.しかし,SLX4がどのようにこの機構を制御しているのかについては未解明な部分が多い.筆者らは,SLX4複合体がSUMOリガーゼであり,SLX4およびSLX4と相互作用するタンパク質XPFのSUMO化に寄与することを明らかにした.また,SLX4は活性化したSUMO結合酵素UBC9と特異的に結合し,SLX4のSUMOリガーゼ活性にはSUMOとの相互作用にかかわるSIMドメインおよびタンパク質間相互作用やオリゴマーの形成にかかわるBTBドメインが必要となることがわかった.さらに,SLX4を介したSUMOリガーゼ活性は複製ストレス応答において細胞毒性をひき起こす一方,染色体の脆弱部位の形成にともなう細胞死を防ぐのに必須であることが明らかにされた.
はじめに
細胞はDNA損傷に対し複雑なシグナル伝達ネットワークをもち,細胞周期の進行と複製,修復,組換えの機構をうまく制御しながらDNA損傷の処理にあたる.Fanconi貧血の原因遺伝子産物であるSLX4(FANCP)は,そのなかでコーディネーターとして機能すると考えられている.たとえば,分裂酵母のSlx4は構造に特異的なエンドヌクレアーゼSlx1と結合しリボソームRNAの安定性を制御する1).出芽酵母においてSlx4はRad1XPF-Rad10ERCC1複合体と結合してDNA 2本鎖切断の修復に寄与するとともに,足場タンパク質Rtt107と協調して停止した複製の再開に寄与する2).ヒトのSLX4において,SLX1およびXPF-ERCC1複合体との相互作用は高度に保存され,さらに,MUS81-EME1複合体をくわえた3種類の構造に特異的なエンドヌクレアーゼと相互作用してこれらの機能を制御すると考えられている3-5).さらに,ヒトのSLX4はミスマッチ修復タンパク質MSH2-MSH3複合体,テロメアタンパク質TRF2,細胞周期制御にかかわるキナーゼPLK1と相互作用する3,5).
興味深いことに,後生動物のSLX4はN末端側にさらにUBZドメイン,MLRドメイン,BTBドメインを含む領域をもつ3-6).筆者らは,SLX4において新たにSIMドメインを同定し,SUMOに関連したSLX4の機能について解析した.
1.SLX4のSIMドメインおよびBTBドメインはSLX4およびXPFのSUMO化を促進する
アミノ酸配列の解析により,後生動物のSLX4において保存された3つのSIMドメインSIM1~SIM3を同定した(図1).精製タンパク質を用いた解析により,SIM1およびSIM2がとくにSUMOとの結合ドメインとして機能し,ポリSUMO鎖と親和性を示すことがわかった.また,細胞においてSLX4およびSLX4と相互作用するタンパク質XPFが特異的にSUMO化され,SLX4がXPFのSUMO化を促進すること,さらに,SLX4およびXPFのSUMO化はSIMドメインに依存的に起こることがわかった.SLX4においてXPFとの相互作用にかかわるMLRドメイン,および,タンパク質間相互作用やオリゴマーの形成にかかわるとともにXPFとの直接的な結合が報告されているBTBドメインについて解析したところ3,5,6),MLRドメインに変異を導入したSLX4を発現させた細胞においてSLX4自体にSUMO化がみられた一方,XPFのSUMO化は顕著に阻害され,XPFのSUMO化にはSLX4との相互作用が必要であることが示唆された.一方,BTBドメインに変異をもつSLX4を発現させた細胞において,BTBドメインに変異をもつSLX4とXPFとの相互作用はわずかに阻害されるにとどまったものの,SLX4およびXPFのSUMO化はみられなかった.BTBドメインに変異を導入したSLX4は,SIMドメインに変異を導入したSLX4とは対照的に,細胞においてSUMO化されたタンパク質と相互作用したことから,SLX4のSUMO化およびSLX4によるXPFのSUMO化の促進は,単にSLX4のSUMOとの結合活性のみにより起こるのではないことが示唆された.
2.SLX4は活性化UBC9と特異的に相互作用する
SLX4がXPFのSUMO化を促進したことから,SLX4がSUMOリガーゼもしくはその構成タンパク質であることが示唆された.既知のSUMOリガーゼはSUMO結合酵素であるUBC9と結合することから,SLX4とUBC9との結合について調べた7).その結果,HeLa細胞を用いた免疫沈降によりSLX4とUBC9との相互作用がみられたものの,精製タンパク質を用いたプルダウンアッセイにおいてUBC9とSLX4断片との結合は認められなかった.この結果から,SLX4が細胞においてSUMO化もしくは活性化されたUBC9と特異的に相互作用することが考えられた.そこで,精製したUBC9をATP存在下においてSUMO活性化酵素であるSAE1-SAE2複合体およびSUMO2とプレインキュベーションしてSUMO化および活性化UBC9を形成させたのち,BTBドメイン,SIM1,SIM2を含むSLX4断片との相互作用について調べた.SUMO化UBC9および活性化UBC9は,それぞれ,UBC9とSUMOとが共有結合あるいはチオエステル結合したものであるため,還元剤を処理することよりこれらを区別することができる.その結果,SLX4断片は活性化UBC9と特異的に相互作用することがわかった.
興味深いことに,BTBドメインを欠失するSLX4断片は活性化UBC9と相互作用する一方,SIMドメインに存在する脂肪族アミノ酸残基により構成される疎水性コアに変異を導入したSLX4断片においては活性化UBC9との相互作用が阻害された.また,SIMドメインの疎水性コアの近傍には酸性アミノ酸残基からなるクラスターが存在し,その変異体においてSUMO鎖および活性化UBC9との相互作用が阻害されたことから,SLX4のSIM1およびSIM2に存在する陰電荷が,高次構造においてUBC9の活性中心の近傍に位置する塩基性パッチと静電的に相互作用することが示唆された.これと一致して,UBC9の塩基性パッチを構成するアミノ酸残基に変異を導入したところ,SLX4断片との相互作用が阻害された.さらに,SUMO化および活性化の起こらないUBC9の活性中心の変異体はSLX4断片と相互作用しなかった.これらの結果から,SLX4と活性化UBC9との結合においては,SIMドメインとSUMOとのあいだの相互作用,および,SIMドメインのもつ陰電荷とUBC9の活性中心の近傍の塩基性パッチとのあいだの静電的な相互作用の両方が必要となることが明らかになった(図1).
3.SLX4複合体はSUMOリガーゼ活性をもつ
SLX4と活性化UBC9とが特異的に相互作用したことから,SLX4がSUMOリガーゼであることがあらためて示唆された.しかし,精製タンパク質を用いた解析において,SLX4を介したXPFのSUMO化を検出することはできなかった.そこで,HeLa細胞からの免疫沈降により得られたSLX4複合体にSUMO活性化酵素,SUMO結合酵素であるUBC9,SUMO2をくわえて,そのSUMOリガーゼ活性について調べた.その結果,ATPに依存的なSLX4およびXPFのSUMO化が検出された一方,同じくSLX4複合体の構成タンパク質であるMUS81のSUMO化はみられず,SLX4とXPFが特異的にSUMO化されることが示唆された.重要なことに,既知のSUMOリガーゼはこの精製試料において検出されなかった.また,この解析においても,SUMOリガーゼ活性におけるBTBドメインとSIMドメインの重要性,および,SLX4と活性化UBC9とのあいだの相互作用の重要性が確認された.
興味深いことに,SLX4の免疫沈降の際の塩濃度を150 mMから500 mMに変えた条件ではSUMOリガーゼ活性が顕著に低下した.このことから,SLX4に依存的なSUMOリガーゼ活性はなんらかの補因子の影響をうけることが示唆された.SLX4はDNA損傷応答に密接に関与することから,この補因子はDNAであると考えた.そこで,500 mMの塩濃度の条件において免疫沈降した試料にDNA断片をくわえたところ,SUMOリガーゼ活性は150 mMの塩濃度の条件において免疫沈降した試料と同じ程度にまで回復した.
SLX4に依存的なSUMOリガーゼ活性が大腸菌に由来する精製タンパク質を用いた実験系で再現できない理由として,ほかの翻訳後修飾の関与が考えられた.そこで,HeLa細胞からの免疫沈降により得られたSLX4複合体を脱リン酸化酵素により処理したところ,SUMOリガーゼ活性は顕著に低下した.これらの結果から,SLX4に依存的なSUMOリガーゼ活性はDNAおよびリン酸化により促進されることがわかった.SLX4が活性化UBC9と特異的に相互作用し細胞においてXPFのSUMO化を制御することとあわせると,SLX4がSUMOリガーゼあるいは少なくともその必須の構成タンパク質であることが明らかになった.
4.SLX4を介したSUMOリガーゼ活性は複製ストレス応答において細胞毒性をひき起こす
内因性のSLX4の発現を抑制したうえで野生型SLX4あるいは変異型SLX4を発現させた細胞を用いてマイトマイシンCに対する感受性を調べた結果,SLX4のUBZドメインがDNA鎖間架橋の修復に寄与するのと対照的に8),SLX4を介したSUMOリガーゼ活性はこれに関与しないことがわかった.一方,外因性のSLX4の発現によりSIMドメインおよびBTBドメインに依存的な細胞毒性がみられた.SLX4は複製ストレス応答の際に起こるDNA 2本鎖切断に寄与することが知られているが9),これらがなんらかの因果関係をもつことが考えられた.そこで,DNA合成阻害剤であるヒドロキシ尿素に対する感受性を調べたところ,ヒドロキシ尿素によりDNAの複製フォークが停止した細胞においてSLX4を介したSUMOリガーゼ活性が細胞毒性をひき起こすことがわかった.
ヒドロキシ尿素およびチェックポイントキナーゼであるATRの阻害剤を併用した場合に,複製フォークの崩壊,DNA 2本鎖切断の誘導,複製フォークにおける過度の一本鎖DNAの形成が起こり,その結果,細胞死が誘導されることが知られている9).そこで,ヒドロキシ尿素およびATR阻害剤に対する感受性を調べたところ,SLX4を介したSUMOリガーゼ活性が複製ストレス応答における急性の細胞毒性にも寄与することがわかった.一方,SLX4と相互作用する構造に特異的なエンドヌクレアーゼの発現を抑制した細胞において同様に解析した結果,SLX1およびXPF-ERCC1複合体について,ヒドロキシ尿素の処理ののちの細胞毒性に対する寄与が限局的にみられたが,急性の細胞毒性には影響がみられなかった.これらの結果から,複製ストレスの際に生じるSLX4に依存的な細胞毒性はおもにSLX4を介したSUMOリガーゼ活性に起因し,エンドヌクレアーゼによる影響は限局されていることが示唆された.また,SLX4の発現を抑制した細胞においてはヒドロキシ尿素の処理ののちのリン酸化されたヒストンH2AXの誘導が抑制され,さらに,ヒドロキシ尿素の処理ののちの染色体の切断がSLX4のもつSIMドメインに依存的に起こったことから,複製ストレス応答の際,SLX4を介したSUMOリガーゼ活性によりDNA 2本鎖切断が生じ,その結果,細胞毒性が誘導されることがわかった.
5.SLX4は染色体の脆弱部位に局在し姉妹染色分体の切断および正常な染色体の分離を促進する
一般的な複製ストレスの場合とは対照的に,染色体の脆弱部位など複製の困難な特定のゲノム座位において複製ストレスが集中したとき,SLX4によりDNA 2本鎖切断が促進されることはかえって細胞にとり有益にはたらくと考えられる.実際に,アフィジコリンの処理により染色体の脆弱部位の形成を促進した細胞の分裂期の染色体において,野生型SLX4,UBZドメインに変異を導入したSLX4,SIMドメインに変異を導入したSLX4はいずれもFANCD2と共局在し,これらが染色体の脆弱部位に局在することが示唆された.また,SLX4は分裂期の細胞においてMUS81やERCC1と共局在し,これらの染色体の脆弱部位への局在に必須であったが,UBZドメインに変異を導入したSLX4およびSIMドメインに変異を導入したSLX4についても同様の結果が得られた.
興味深いことに,分裂期の細胞においてSLX4は姉妹染色分体の切断部位やギャップに局在していた.そこで,外因性の野生型SLX4を発現する細胞およびUBZドメインに変異を導入したSLX4を発現する細胞を観察したところ,分裂中期において姉妹染色分体の切断やギャップの形成が高頻度で観察された.対照的に,SIMドメインに変異を導入したSLX4を発現した細胞においてはその頻度は顕著に減少し,さらに,BTBドメインに変異を導入したSLX4を発現した細胞においてこれらはほとんど観察されなかった.この結果から,SLX4はSIMドメインに非依存的に染色体の脆弱部位に局在する一方,SIMドメインに依存的に姉妹染色分体の切断やギャップの形成を促進することが示唆された.
構造に特異的なエンドヌクレアーゼが染色体の脆弱部位にはたらくことにより適切な染色体の分離が促進されることから10),SLX4がその過程でどのように機能しているのかについて調べた.その結果,SIMドメインに変異を導入したSLX4を発現する細胞においては,SLX4の発現を抑制した細胞と同様に,分裂後期の染色体どうしの架橋や遅滞染色体が顕著に増加するとともに,細胞死が誘導された.この結果から,SLX4を介したSUMOリガーゼ活性は染色体の脆弱部位のような特定のゲノム座位における複製や染色体の分離に必要とされ,ゲノム安定性の維持に寄与することが明らかになった(図2).
おわりに
筆者らは,この論文において,SLX4がSUMOリガーゼあるいはその必須の構成タンパク質であることを明らかにした.最近の報告から,1本鎖DNA結合タンパク質RPA,DNA 2本鎖切断の認識にかかわるMRN複合体,テロメアタンパク質TRF2とSLX4との相互作用がSIMドメインにより促進されることが明らかになり11),これらとSLX4を介したSUMOリガーゼ活性との関連性は興味深い.SLX4を介したSUMOリガーゼ活性がゲノムの全体に生じる複製ストレスにおいて細胞毒性をひき起こす一方,特定のゲノム座位における複製ストレスを解消することがわかったが,その機構についての分子レベルでの詳細は未解明である.リン酸化やユビキチン化などほかの翻訳後修飾との連携とあわせ,さらなる研究の発展が期待される.
文 献
- Coulon, S., Gaillard, P. H., Chahwan, C. et al.: Slx1-Slx4 are subunits of a structure-specific endonuclease that maintains ribosomal DNA in fission yeast. Mol. Biol. Cell, 15, 71-80 (2004)[PubMed]
- Flott, S., Alabert, C., Toh, G. W. et al.: Phosphorylation of Slx4 by Mec1 and Tel1 regulates the single-strand annealing mode of DNA repair in budding yeast. Mol. Cell. Biol., 27, 6433-6445 (2007)[PubMed]
- Fekairi, S., Scaglione, S., Chahwan, C. et al.: Human SLX4 is a Holliday junction resolvase subunit that binds multiple DNA repair/recombination endonucleases. Cell, 138, 78-89 (2009)[PubMed]
- Munoz, I. M., Hain, K., Declais, A. C. et al.: Coordination of structure-specific nucleases by human SLX4/BTBD12 is required for DNA repair. Mol. Cell, 35, 116-127 (2009)[PubMed]
- Svendsen, J. M., Smogorzewska, A., Sowa, M. E. et al.: Mammalian BTBD12/SLX4 assembles a Holliday junction resolvase and is required for DNA repair. Cell, 138, 63-77 (2009)[PubMed]
- Andersen, S. L., Bergstralh, D. T., Kohl, K. P. et al.: Drosophila MUS312 and the vertebrate ortholog BTBD12 interact with DNA structure-specific endonucleases in DNA repair and recombination. Mol. Cell, 35, 128-135 (2009)[PubMed]
- Melchior, F., Schergaut, M. & Pichler, A.: SUMO: ligases, isopeptidases and nuclear pores. Trends Biochem. Sci., 28, 612-618 (2003)[PubMed]
- Kim, Y., Spitz, G. S., Veturi, U. et al.: Regulation of multiple DNA repair pathways by the Fanconi anemia protein SLX4. Blood, 121, 54-63 (2013)[PubMed]
- Couch, F. B., Bansbach, C. E., Driscoll, R. et al.: ATR phosphorylates SMARCAL1 to prevent replication fork collapse. Genes Dev., 27, 1610-1623 (2013)[PubMed]
- Naim, V., Wilhelm, T., Debatisse, M. et al.: ERCC1 and MUS81-EME1 promote sister chromatid separation by processing late replication intermediates at common fragile sites during mitosis. Nat. Cell Biol., 15, 1008-1015 (2013)[PubMed]
- Ouyang, J., Garner, E., Hallet, A. et al.: Noncovalent interactions with SUMO and ubiquitin orchestrate distinct functions of the SLX4 complex in genome maintenance. Mol. Cell, 57, 108-122 (2015)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院医学系研究科 修了,同年 大阪大学大学院生命機能研究科 特任研究員,2011年 フランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員,2012年 大阪大学大学院生命機能研究科 特任研究員を経て,2013年よりフランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員.
研究テーマ:翻訳後修飾を介したDNA損傷応答.
抱負:DNA損傷応答にはたらくおのおののタンパク質の動きをとらえたい.
Jean-Hugues Guervilly
フランスCentre de Recherche en Cancérologie de Marseilleポスドク研究員.
倉岡 功(Isao Kuraoka)
大阪大学大学院基礎工学研究科 准教授.
Pierre-Henri L. Gaillard
フランスCentre de Recherche en Cancérologie de MarseilleにてTeam Leader.
研究室URL:http://crcm.marseille.inserm.fr/en/researchteams/pierre-henri-gaillard/
© 2015 竹立新人・Jean-Hugues Guervilly・倉岡 功・Pierre-Henri L. Gaillard Licensed under CC 表示 2.1 日本