Rhoファミリーに属するRnd1はRasおよびMAPキナーゼ経路の不活性化により乳腺細胞の悪性化および上皮間葉移行を阻害する
岡田知代・Filippo G. Giancotti
(米国Memorial Sloan-Kettering Cancer Center,Cell Biology Program)
email:岡田知代
DOI: 10.7875/first.author.2015.013
The Rho GTPase Rnd1 suppresses mammary tumorigenesis and EMT by restraining Ras-MAPK signalling.
Tomoyo Okada, Surajit Sinha, Ilaria Esposito, Gaia Schiavon, Miguel A. López-Lago, Wenjing Su, Christine A. Pratilas, Cristina Abele, Jonathan M. Hernandez, Masahiro Ohara, Morihito Okada, Agnes Viale, Adriana Heguy, Nicholas D. Socci, Anna Sapino, Venkatraman E. Seshan, Stephen Long, Giorgio Inghirami, Neal Rosen, Filippo G. Giancotti
Nature Cell Biology, 17, 81-94 (2015)
筆者らは,バイオインフォマティクスによる解析により乳がんにおいて転移を抑制するタンパク質の候補としてRhoファミリーに属するRnd1を見い出した.Rnd1の欠失は細胞接着および細胞極性の形成を破壊して上皮間葉移行を誘導し,Mycの発現およびp53の欠失と協同して悪性化を起こした.その分子機構を検討した結果,Rnd1はプレキシンB1と複合体を形成してRap1の活性を抑制し,その結果,p120がRap1からの抑制から解放されることにより活性化され,Rasの活性を抑制することを見い出した.Rnd1を欠失した正常な乳腺細胞はマウスに未分化かつ浸潤性の腫瘍を形成した.逆に,高頻度に転移をともなう乳がんモデルマウスへのRnd1の強制発現は肺への転移巣の形成を抑制した.ヒトの乳がん組織のゲノム解析により,RND1遺伝子座の欠失,RND1遺伝子のエピジェネティックな発現の抑制,さらに,低頻度ながらRND1遺伝子の変異によるRnd1の不活性化が検出された.この研究により,高頻度に転移をともなうタイプの乳がんにおいて,Rnd1の欠失は発がん性Rasタイプの発がん機構のひとつであると考えられた.
乳がんは遺伝的,分子病態的,臨床的に多様なサブタイプからなる乳腺細胞におけるがんの総称である.高頻度に転移をともなうタイプの乳がんにおいては,そのがん化の分子病態および転移の機序はいまだ明らかにされていない.乳がんの発生から転移にいたる経過は異なる遺伝子の変化をともない,いくつかのステップをへて起こると考えられている1).また,初期の悪性化ののちに起こる転移においては,上皮間葉移行とよばれる形質の変化をともなうことが知られている2).筆者らは,細胞接着の制御において中心的にはたらくRhoファミリーに注目し3),ヒトの乳がんにおける遺伝子の発現および臨床経過を検討することにより,RND1遺伝子を腫瘍抑制遺伝子の候補として見い出した.その細胞における機能および分子機能を検討したところ,RND1遺伝子の欠失が単独で細胞の異常な増殖および上皮間葉移行による高頻度な転移という形質の変化をもたらすことが明らかになり,Rnd1は強力な腫瘍抑制タンパク質であることがわかった.
Rhoファミリーは細胞骨格の制御タンパク質として,細胞接着や細胞極性を制御することにより乳腺組織の構築にかかわっている.Rasとは異なり,がんに特異的な変異はあまりみられないが,多数のがん組織において強発現していることが知られている.乳がんの進行に関与する新たな遺伝子を検索するため,99のヒトの乳がん組織に由来する遺伝子発現プロフィールと臨床経過との相関を解析した4).その結果,Rhoファミリーに属する20の遺伝子のうち,RND1遺伝子およびRHOD遺伝子の発現が乳がんの転移リスクと有意に逆相関の関係を示すことが見い出された.さらに,がん遺伝子の発現データベースOncomineに登録されているすべてのデータセットを解析した結果,RND1遺伝子の発現は予後不良のサブタイプにおいて顕著に低下していた.また,RND1遺伝子の発現は転移予後のマーカーを発現するグループにおいても有意に低下しており,RND1遺伝子は高頻度に転移をともなうタイプの乳がんにおける新規の腫瘍抑制遺伝子である可能性が示唆された.
Rnd1の腫瘍抑制能について検討するため,ヒトの正常な乳腺上皮細胞であるMCF10A細胞においてshRNAを用いてRnd1をノックダウンしたところ,乳腺上皮細胞において特徴的な細胞のクラスター形成がほぼ完全に破壊され個々の細胞が散在するという細胞接着における変化が観察された.免疫染色により,正常な細胞では細胞接着の部位に集積するEカドヘリンがRnd1をノックダウンした細胞においては完全に消失していることが観察され,また,ウェスタンブロット法および定量PCR法によりEカドヘリンの発現の明らかな低下が確認され,典型的な上皮間葉移行が認められた.一方,細胞周期について検討したところ,Rnd1をノックダウンした細胞は,ノックダウンから2~3日目においてS期およびM期の細胞の増加および細胞周期の促進がみられたのち,すみやかに細胞周期は停滞に転じた.ノックダウンから9~10日目には増殖は完全に停止し,その大多数は細胞老化による細胞分裂の停止であった.この増殖の停止はDNA損傷応答および活性酸素種の産生をともなっていた.これらの結果は,がん遺伝子に誘導される細胞老化に特有の変化を示唆した.また,この増殖の抑制はp27の発現によるものであった.
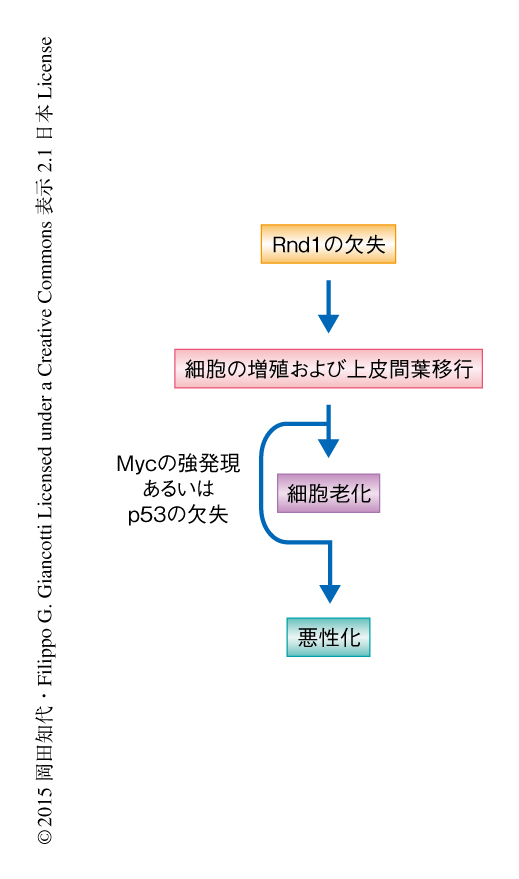
Rasによる細胞老化はMycとの共発現により解除され悪性化に転じることが知られている5).そこで,Rnd1のノックダウンとともにMycを強制発現させたところ,細胞老化による増殖の抑制は完全に解除された.この細胞は足場非依存性の増殖能を示し,細胞浸潤の顕著な亢進がみられた.また,この細胞をマトリゲルにおいて3次元培養したところ,浸潤した細胞をともなう巨大な異型の腺構造を示し,免疫染色により,増殖している細胞の顕著な増加,基底膜の構造の消失,細胞接着の異常,細胞極性の消失が認められた.これらの結果から,Rnd1のノックダウンにより,制御を脱した細胞の増殖,および,細胞間および細胞と基底膜とのあいだの接着の崩壊が起こることが明らかにされた(図1).
Rnd1は,繊維芽細胞においてはRhoを,ニューロンにおいてはRasを制御することが報告されている6).Rnd1のノックダウンによる乳腺細胞の悪性化の分子機構を解明するため,成長因子のシグナルの制御にかかわるタンパク質の活性につきRnd1のノックダウンの影響を調べたところ,Rho,Rac,CDC42の活性に変化はみられなかったが,2日目および5日目においてRasの活性が顕著に上昇していた.しかしながら,Rasの下流であるMAPキナーゼ経路あるいはAKTの活性はそのタイミングにおいて上昇しておらず,むしろ活性の低下がみられた.正常な細胞におけるRasの異常な活性化は広汎なフィードバック反応を起こすことが知られている.Rnd1のノックダウンにおいて,Rasの活性化の起こるタイミングにおいてRasの活性制御にかかわる遺伝子の発現を調べたところ,抑制的にはたらく遺伝子の発現に顕著な上昇がみられた.さらに,Rnd1のノックダウンにより細胞老化による増殖停止の状態にある細胞から出現した復帰変異を起こしたクローンにおいては,Rasの活性化とともにRasの下流の経路の活性,とくに成長因子の刺激による時間経過において後期の活性が顕著に上昇しており,シグナルの持続的な活性化を起こしていた.
Rnd1のノックダウンによる悪性化がRasによるものであることをさらに証明するため,Rnd1のノックダウンによる形質の変化に対する特異的な阻害剤の影響について調べた.その結果,2つのMEKの阻害剤により,上皮間葉移行,足場非依存性の増殖能,浸潤能はほぼ消失した.PI3Kの阻害剤には上皮間葉移行に対する影響はみられなかったが,足場非依存性の増殖能および浸潤能が有意に低下した.これらの結果は,Rnd1のノックダウンによる形質の変化は,おもにRasの下流のMAPキナーゼ経路によるものであることを示した.さらに,臨床における乳がん試料の3つのコホートにおいて,RND1遺伝子の発現は発がん性Rasを発現させて得られた遺伝子変化のパターン7) と有意に逆相関の関係を示しており,RND1遺伝子を欠失した乳がんは発がん性Rasタイプの腫瘍であることが示唆された.
Rnd1はニューロンにおいてプレキシンB1と,繊維芽細胞においてp190と複合体を形成し,それぞれ,RasおよびRhoを制御すると報告されている6).Rnd1のエフェクター領域に変異を導入した変異体においては細胞増殖の抑制能が阻害されていた(機能欠損型変異).それらの変異体はプレキシンB1に対する結合能を完全に欠損していたのに対し,p190との結合にはまったく影響がみられなかったことから,プレキシンB1がRnd1とともに腫瘍抑制活性をになっている可能性が示唆された.さらに,ヒトの正常な乳腺上皮細胞であるMCF10A細胞においてプレキシンB1をノックダウンしたところ,上皮間葉移行およびRasの活性化を呈し,Rnd1のノックダウンと同様の形質の変化がみられたことから,腫瘍抑制活性はRnd1とプレキシンB1との複合体によるRasの制御によるものであることが強く示唆された.
最近の研究により,プレキシンB1はRasに対してではなく,Rap1に対して強力なGAP(GTPase-activating protein,GTPase活性化タンパク質)としての活性をもつことが証明された8).そこで,Rnd1とプレキシンB1との複合体がRap1の制御を介してRasの活性を抑制しているとの仮説をたてた.ヒトの正常な乳腺上皮細胞であるMCF10A細胞において,Rnd1のノックダウンによりRap1の活性の上昇がみられた.恒常活性型Rapの強発現によりRasおよびMAPキナーゼ経路の活性が亢進した.さらに,Rap1に対するGAPの強発現によりすべてのRap1サブタイプの活性を抑制したところ,Rnd1のノックダウンによるRasの活性の亢進が阻害された.この結果は,Rnd1のノックダウンによるRasの活性化にはRap1の介在が必要であることを示した.
これまでに,in vitroにおいて,Rap1はRasに対するGAPであるp120と強く結合するが,p120により抑制されないこと,および,活性型Rap1はp120のGAP活性を抑制することが報告されていた9).免疫沈降法により,細胞において恒常活性型Rap1はp120と複合体を形成するが,野生型Rap1およびドミナントネガティブ型Rap1にはp120との結合はみられなかった.MCF10A細胞においてp120をノックダウンしたところRasおよびMAPキナーゼ経路の顕著な活性化が認められた.これらの結果は,Rnd1とプレキシンB1との複合体がRap1を不活性化し,それによりp120を解放しRasの抑制にいたるとのモデルを支持した(図2).
Rnd1の腫瘍抑制能をin vivoにおいて証明するため,マウスの正常な乳腺細胞であるCommaD細胞においてRnd1をノックダウンし,これをマウスの乳腺組織へ注入した.CommaD細胞は乳腺幹細胞を豊富に含むことが知られており,野生型CommaD細胞の注入により正常な乳腺に近い組織の形成がみられたのに対し,Rnd1をノックダウンしたCommaD細胞の注入により時間とともに増大する腫瘍の形成が認められた.この腫瘍の組織を解析したところ,Eカドヘリンの顕著な消失,基底膜からのラミニンの消失,ビメンチンの広汎かつ顕著な発現など,上皮間葉移行に合致した所見がみられ,Rnd1の上皮間葉移行における機能および腫瘍抑制能がin vivoにおいても証明された.さらに,肺への転移へのRnd1のノックダウンの影響を調べるため,2種類の高頻度に転移をともなう乳がんマウスモデルにおいてRnd1を強発現させて経過を観察したところ,Rnd1の強発現は肺への転移巣の有意な縮小をもたらした.
RND1遺伝子に特異的なプローブを用いた蛍光in situハイブリダイゼーションにより,120例において17%の症例にRND1遺伝子座の欠失が認められた.また,ヒトの乳がん細胞株に対し,DNAメチル化の阻害剤,ヒストン脱アセチル化酵素の阻害剤,EZH2の阻害剤を,単独あるいは混合して使用したところRND1遺伝子の発現の顕著な上昇がみられた.これは,RND1遺伝子が,プロモーター領域におけるDNAメチル化,ヒストン脱アセチル化酵素によるヒストンの脱アセチル化,ポリコーム抑制複合体2によるヒストンのメチル化による発現の抑制をうけていることを示した.くわえて,ポリコーム抑制複合体2の活性サブユニットであるEZH2のRND1遺伝子のプロモーター領域への結合がクロマチン免疫沈降法により検出された.さらに,RND1遺伝子のコード領域の塩基配列を次世代シークエンサーにより解析したところ,97例においてアミノ酸置換をともなう変異が4つ検出された.それらの変異を導入した変異体は,そのうち3つにおいて増殖抑制能が完全に消失し,もうひとつでおいては増殖抑制能の部分的な消失が認められ,機能欠損型変異であることが確認された.これら変異体はプレキシンB1への結合能が完全に消失していた.これらの結果から,ヒトの乳がんにおいてRND1遺伝子はさまざまな機序により不活性化されていることが明らかにされた.
乳がんにおいてRasの悪性変異の頻度は約5%とまれであるが,その下流のMAPキナーゼ経路の活性化が約半数の乳がんにおいて認められており,Rasの変異以外の機序の存在が示唆されていた.筆者らは,Rhoファミリーに属するRnd1がRasの活性化を制御することにより腫瘍抑制タンパク質として機能することを見い出した.Rnd1のノックダウンはRasおよびその下流のMAPキナーゼ経路を活性化することにより,乳腺細胞の制御を逸脱した増殖能,および,上皮間葉移行による乳腺細胞の細胞接着の異常および乳腺構造の破壊を誘導した.正常な乳腺細胞におけるRnd1の欠失はp27の発現による強い増殖の抑制を誘導するが,Mycの強制発現,あるいは,p53の欠失によりこの抑制は解除され,悪性化にいたることがわかった.さらに,Rnd1とプレキシンB1との複合体が,プレキシンB1のもつGAP活性によりRap1の活性を抑制し,その結果,p120がRap1からの抑制から解除されRasを制御できる状態となるというモデルが構築された.さらに,3つの乳がんコホートにおいて発がん性Rasを発現させて得られた遺伝子変化のパターンがRND1遺伝子の低発現と有意に相関していたこと,また,RND1,プレキシンB1,p120の欠失はほぼ重ならず発生していたことは,Rnd1,プレキシンB1,p120が実際にヒトにおいて発がん性Rasタイプの乳がんを発生させる新たな腫瘍抑制タンパク質である可能性を支持した.
略歴:1996年 神戸大学大学院医学研究科博士課程 修了,2000年 米国Memorial Sloan-Kettering Cancer CenterにてResearch Associateを経て,2011年より同Senior Research Scientist.
研究テーマ:RasおよびRhoファミリーのシグナル伝達系と,細胞接着の制御,発がん,がんの転移の分子機構.
Filippo G. Giancotti
米国Memorial Sloan-Kettering Cancer CenterにてLab Head.
研究室URL:http://www.mskcc.org/research/lab/filippo-giancotti
© 2015 岡田知代・Filippo G. Giancotti Licensed under CC 表示 2.1 日本
(米国Memorial Sloan-Kettering Cancer Center,Cell Biology Program)
email:岡田知代
DOI: 10.7875/first.author.2015.013
The Rho GTPase Rnd1 suppresses mammary tumorigenesis and EMT by restraining Ras-MAPK signalling.
Tomoyo Okada, Surajit Sinha, Ilaria Esposito, Gaia Schiavon, Miguel A. López-Lago, Wenjing Su, Christine A. Pratilas, Cristina Abele, Jonathan M. Hernandez, Masahiro Ohara, Morihito Okada, Agnes Viale, Adriana Heguy, Nicholas D. Socci, Anna Sapino, Venkatraman E. Seshan, Stephen Long, Giorgio Inghirami, Neal Rosen, Filippo G. Giancotti
Nature Cell Biology, 17, 81-94 (2015)
要 約
筆者らは,バイオインフォマティクスによる解析により乳がんにおいて転移を抑制するタンパク質の候補としてRhoファミリーに属するRnd1を見い出した.Rnd1の欠失は細胞接着および細胞極性の形成を破壊して上皮間葉移行を誘導し,Mycの発現およびp53の欠失と協同して悪性化を起こした.その分子機構を検討した結果,Rnd1はプレキシンB1と複合体を形成してRap1の活性を抑制し,その結果,p120がRap1からの抑制から解放されることにより活性化され,Rasの活性を抑制することを見い出した.Rnd1を欠失した正常な乳腺細胞はマウスに未分化かつ浸潤性の腫瘍を形成した.逆に,高頻度に転移をともなう乳がんモデルマウスへのRnd1の強制発現は肺への転移巣の形成を抑制した.ヒトの乳がん組織のゲノム解析により,RND1遺伝子座の欠失,RND1遺伝子のエピジェネティックな発現の抑制,さらに,低頻度ながらRND1遺伝子の変異によるRnd1の不活性化が検出された.この研究により,高頻度に転移をともなうタイプの乳がんにおいて,Rnd1の欠失は発がん性Rasタイプの発がん機構のひとつであると考えられた.
はじめに
乳がんは遺伝的,分子病態的,臨床的に多様なサブタイプからなる乳腺細胞におけるがんの総称である.高頻度に転移をともなうタイプの乳がんにおいては,そのがん化の分子病態および転移の機序はいまだ明らかにされていない.乳がんの発生から転移にいたる経過は異なる遺伝子の変化をともない,いくつかのステップをへて起こると考えられている1).また,初期の悪性化ののちに起こる転移においては,上皮間葉移行とよばれる形質の変化をともなうことが知られている2).筆者らは,細胞接着の制御において中心的にはたらくRhoファミリーに注目し3),ヒトの乳がんにおける遺伝子の発現および臨床経過を検討することにより,RND1遺伝子を腫瘍抑制遺伝子の候補として見い出した.その細胞における機能および分子機能を検討したところ,RND1遺伝子の欠失が単独で細胞の異常な増殖および上皮間葉移行による高頻度な転移という形質の変化をもたらすことが明らかになり,Rnd1は強力な腫瘍抑制タンパク質であることがわかった.
1.乳がんデータセットの解析による新規の腫瘍抑制遺伝子RND1遺伝子の同定
Rhoファミリーは細胞骨格の制御タンパク質として,細胞接着や細胞極性を制御することにより乳腺組織の構築にかかわっている.Rasとは異なり,がんに特異的な変異はあまりみられないが,多数のがん組織において強発現していることが知られている.乳がんの進行に関与する新たな遺伝子を検索するため,99のヒトの乳がん組織に由来する遺伝子発現プロフィールと臨床経過との相関を解析した4).その結果,Rhoファミリーに属する20の遺伝子のうち,RND1遺伝子およびRHOD遺伝子の発現が乳がんの転移リスクと有意に逆相関の関係を示すことが見い出された.さらに,がん遺伝子の発現データベースOncomineに登録されているすべてのデータセットを解析した結果,RND1遺伝子の発現は予後不良のサブタイプにおいて顕著に低下していた.また,RND1遺伝子の発現は転移予後のマーカーを発現するグループにおいても有意に低下しており,RND1遺伝子は高頻度に転移をともなうタイプの乳がんにおける新規の腫瘍抑制遺伝子である可能性が示唆された.
2.正常な乳腺上皮細胞におけるRnd1の腫瘍抑制タンパク質としての役割
Rnd1の腫瘍抑制能について検討するため,ヒトの正常な乳腺上皮細胞であるMCF10A細胞においてshRNAを用いてRnd1をノックダウンしたところ,乳腺上皮細胞において特徴的な細胞のクラスター形成がほぼ完全に破壊され個々の細胞が散在するという細胞接着における変化が観察された.免疫染色により,正常な細胞では細胞接着の部位に集積するEカドヘリンがRnd1をノックダウンした細胞においては完全に消失していることが観察され,また,ウェスタンブロット法および定量PCR法によりEカドヘリンの発現の明らかな低下が確認され,典型的な上皮間葉移行が認められた.一方,細胞周期について検討したところ,Rnd1をノックダウンした細胞は,ノックダウンから2~3日目においてS期およびM期の細胞の増加および細胞周期の促進がみられたのち,すみやかに細胞周期は停滞に転じた.ノックダウンから9~10日目には増殖は完全に停止し,その大多数は細胞老化による細胞分裂の停止であった.この増殖の停止はDNA損傷応答および活性酸素種の産生をともなっていた.これらの結果は,がん遺伝子に誘導される細胞老化に特有の変化を示唆した.また,この増殖の抑制はp27の発現によるものであった.
3.Rnd1の欠失およびMycの強制発現による乳腺上皮細胞の悪性化
Rasによる細胞老化はMycとの共発現により解除され悪性化に転じることが知られている5).そこで,Rnd1のノックダウンとともにMycを強制発現させたところ,細胞老化による増殖の抑制は完全に解除された.この細胞は足場非依存性の増殖能を示し,細胞浸潤の顕著な亢進がみられた.また,この細胞をマトリゲルにおいて3次元培養したところ,浸潤した細胞をともなう巨大な異型の腺構造を示し,免疫染色により,増殖している細胞の顕著な増加,基底膜の構造の消失,細胞接着の異常,細胞極性の消失が認められた.これらの結果から,Rnd1のノックダウンにより,制御を脱した細胞の増殖,および,細胞間および細胞と基底膜とのあいだの接着の崩壊が起こることが明らかにされた(図1).
4.Rnd1の欠失によるRasの活性化
Rnd1は,繊維芽細胞においてはRhoを,ニューロンにおいてはRasを制御することが報告されている6).Rnd1のノックダウンによる乳腺細胞の悪性化の分子機構を解明するため,成長因子のシグナルの制御にかかわるタンパク質の活性につきRnd1のノックダウンの影響を調べたところ,Rho,Rac,CDC42の活性に変化はみられなかったが,2日目および5日目においてRasの活性が顕著に上昇していた.しかしながら,Rasの下流であるMAPキナーゼ経路あるいはAKTの活性はそのタイミングにおいて上昇しておらず,むしろ活性の低下がみられた.正常な細胞におけるRasの異常な活性化は広汎なフィードバック反応を起こすことが知られている.Rnd1のノックダウンにおいて,Rasの活性化の起こるタイミングにおいてRasの活性制御にかかわる遺伝子の発現を調べたところ,抑制的にはたらく遺伝子の発現に顕著な上昇がみられた.さらに,Rnd1のノックダウンにより細胞老化による増殖停止の状態にある細胞から出現した復帰変異を起こしたクローンにおいては,Rasの活性化とともにRasの下流の経路の活性,とくに成長因子の刺激による時間経過において後期の活性が顕著に上昇しており,シグナルの持続的な活性化を起こしていた.
Rnd1のノックダウンによる悪性化がRasによるものであることをさらに証明するため,Rnd1のノックダウンによる形質の変化に対する特異的な阻害剤の影響について調べた.その結果,2つのMEKの阻害剤により,上皮間葉移行,足場非依存性の増殖能,浸潤能はほぼ消失した.PI3Kの阻害剤には上皮間葉移行に対する影響はみられなかったが,足場非依存性の増殖能および浸潤能が有意に低下した.これらの結果は,Rnd1のノックダウンによる形質の変化は,おもにRasの下流のMAPキナーゼ経路によるものであることを示した.さらに,臨床における乳がん試料の3つのコホートにおいて,RND1遺伝子の発現は発がん性Rasを発現させて得られた遺伝子変化のパターン7) と有意に逆相関の関係を示しており,RND1遺伝子を欠失した乳がんは発がん性Rasタイプの腫瘍であることが示唆された.
5.Rnd1とプレキシンB1との複合体の形成によるRasの活性化の抑制
Rnd1はニューロンにおいてプレキシンB1と,繊維芽細胞においてp190と複合体を形成し,それぞれ,RasおよびRhoを制御すると報告されている6).Rnd1のエフェクター領域に変異を導入した変異体においては細胞増殖の抑制能が阻害されていた(機能欠損型変異).それらの変異体はプレキシンB1に対する結合能を完全に欠損していたのに対し,p190との結合にはまったく影響がみられなかったことから,プレキシンB1がRnd1とともに腫瘍抑制活性をになっている可能性が示唆された.さらに,ヒトの正常な乳腺上皮細胞であるMCF10A細胞においてプレキシンB1をノックダウンしたところ,上皮間葉移行およびRasの活性化を呈し,Rnd1のノックダウンと同様の形質の変化がみられたことから,腫瘍抑制活性はRnd1とプレキシンB1との複合体によるRasの制御によるものであることが強く示唆された.
6.Rnd1とプレキシンB1との複合体によるRap1およびp120を介したRasの活性化の制御
最近の研究により,プレキシンB1はRasに対してではなく,Rap1に対して強力なGAP(GTPase-activating protein,GTPase活性化タンパク質)としての活性をもつことが証明された8).そこで,Rnd1とプレキシンB1との複合体がRap1の制御を介してRasの活性を抑制しているとの仮説をたてた.ヒトの正常な乳腺上皮細胞であるMCF10A細胞において,Rnd1のノックダウンによりRap1の活性の上昇がみられた.恒常活性型Rapの強発現によりRasおよびMAPキナーゼ経路の活性が亢進した.さらに,Rap1に対するGAPの強発現によりすべてのRap1サブタイプの活性を抑制したところ,Rnd1のノックダウンによるRasの活性の亢進が阻害された.この結果は,Rnd1のノックダウンによるRasの活性化にはRap1の介在が必要であることを示した.
これまでに,in vitroにおいて,Rap1はRasに対するGAPであるp120と強く結合するが,p120により抑制されないこと,および,活性型Rap1はp120のGAP活性を抑制することが報告されていた9).免疫沈降法により,細胞において恒常活性型Rap1はp120と複合体を形成するが,野生型Rap1およびドミナントネガティブ型Rap1にはp120との結合はみられなかった.MCF10A細胞においてp120をノックダウンしたところRasおよびMAPキナーゼ経路の顕著な活性化が認められた.これらの結果は,Rnd1とプレキシンB1との複合体がRap1を不活性化し,それによりp120を解放しRasの抑制にいたるとのモデルを支持した(図2).
7.マウスの乳がんモデルにおけるRnd1の腫瘍抑制能
Rnd1の腫瘍抑制能をin vivoにおいて証明するため,マウスの正常な乳腺細胞であるCommaD細胞においてRnd1をノックダウンし,これをマウスの乳腺組織へ注入した.CommaD細胞は乳腺幹細胞を豊富に含むことが知られており,野生型CommaD細胞の注入により正常な乳腺に近い組織の形成がみられたのに対し,Rnd1をノックダウンしたCommaD細胞の注入により時間とともに増大する腫瘍の形成が認められた.この腫瘍の組織を解析したところ,Eカドヘリンの顕著な消失,基底膜からのラミニンの消失,ビメンチンの広汎かつ顕著な発現など,上皮間葉移行に合致した所見がみられ,Rnd1の上皮間葉移行における機能および腫瘍抑制能がin vivoにおいても証明された.さらに,肺への転移へのRnd1のノックダウンの影響を調べるため,2種類の高頻度に転移をともなう乳がんマウスモデルにおいてRnd1を強発現させて経過を観察したところ,Rnd1の強発現は肺への転移巣の有意な縮小をもたらした.
8.ヒトの乳がんにおけるRND1遺伝子の欠失の機序
RND1遺伝子に特異的なプローブを用いた蛍光in situハイブリダイゼーションにより,120例において17%の症例にRND1遺伝子座の欠失が認められた.また,ヒトの乳がん細胞株に対し,DNAメチル化の阻害剤,ヒストン脱アセチル化酵素の阻害剤,EZH2の阻害剤を,単独あるいは混合して使用したところRND1遺伝子の発現の顕著な上昇がみられた.これは,RND1遺伝子が,プロモーター領域におけるDNAメチル化,ヒストン脱アセチル化酵素によるヒストンの脱アセチル化,ポリコーム抑制複合体2によるヒストンのメチル化による発現の抑制をうけていることを示した.くわえて,ポリコーム抑制複合体2の活性サブユニットであるEZH2のRND1遺伝子のプロモーター領域への結合がクロマチン免疫沈降法により検出された.さらに,RND1遺伝子のコード領域の塩基配列を次世代シークエンサーにより解析したところ,97例においてアミノ酸置換をともなう変異が4つ検出された.それらの変異を導入した変異体は,そのうち3つにおいて増殖抑制能が完全に消失し,もうひとつでおいては増殖抑制能の部分的な消失が認められ,機能欠損型変異であることが確認された.これら変異体はプレキシンB1への結合能が完全に消失していた.これらの結果から,ヒトの乳がんにおいてRND1遺伝子はさまざまな機序により不活性化されていることが明らかにされた.
おわりに
乳がんにおいてRasの悪性変異の頻度は約5%とまれであるが,その下流のMAPキナーゼ経路の活性化が約半数の乳がんにおいて認められており,Rasの変異以外の機序の存在が示唆されていた.筆者らは,Rhoファミリーに属するRnd1がRasの活性化を制御することにより腫瘍抑制タンパク質として機能することを見い出した.Rnd1のノックダウンはRasおよびその下流のMAPキナーゼ経路を活性化することにより,乳腺細胞の制御を逸脱した増殖能,および,上皮間葉移行による乳腺細胞の細胞接着の異常および乳腺構造の破壊を誘導した.正常な乳腺細胞におけるRnd1の欠失はp27の発現による強い増殖の抑制を誘導するが,Mycの強制発現,あるいは,p53の欠失によりこの抑制は解除され,悪性化にいたることがわかった.さらに,Rnd1とプレキシンB1との複合体が,プレキシンB1のもつGAP活性によりRap1の活性を抑制し,その結果,p120がRap1からの抑制から解除されRasを制御できる状態となるというモデルが構築された.さらに,3つの乳がんコホートにおいて発がん性Rasを発現させて得られた遺伝子変化のパターンがRND1遺伝子の低発現と有意に相関していたこと,また,RND1,プレキシンB1,p120の欠失はほぼ重ならず発生していたことは,Rnd1,プレキシンB1,p120が実際にヒトにおいて発がん性Rasタイプの乳がんを発生させる新たな腫瘍抑制タンパク質である可能性を支持した.
文 献
- Vargo-Gogola, T. & Rosen, J. M.: Modelling breast cancer: one size does not fit all. Nat. Rev. Cancer, 7, 659-672 (2007)[PubMed]
- Ansieau, S., Bastid, J., Doreau, A. et al.: Induction of EMT by twist proteins as a collateral effect of tumor-promoting inactivation of premature senescence. Cancer Cell, 14, 79-89 (2008)[PubMed]
- Jaffe, A. B. & Hall, A.: Rho GTPases: biochemistry and biology. Annu. Rev. Cell Dev. Biol., 21, 247-269 (2005)[PubMed]
- Minn, A. J., Gupta, G. P., Padua, D. et al.: Lung metastasis genes couple breast tumor size and metastatic spread. Proc. Natl. Acad. Sci. USA, 104, 6740-6745 (2007)[PubMed]
- Podsypanina, K., Politi, K., Beverly, L. J. et al.: Oncogene cooperation in tumor maintenance and tumor recurrence in mouse mammary tumors induced by Myc and mutant Kras. Proc. Natl. Acad. Sci. USA, 105, 5242-5247 (2008)[PubMed]
- Chardin, P.: Function and regulation of Rnd proteins. Nat. Rev. Mol. Cell Biol., 7, 54-62 (2006)[PubMed]
- Bild, A. H., Yao, G., Chang, J. T. et al.: Oncogenic pathway signatures in human cancers as a guide to targeted therapies. Nature, 439, 353-357 (2006)[PubMed]
- Wang, Y., He, H., Srivastava, N. et al.: Plexins are GTPase-activating proteins for Rap and are activated by induced dimerization. Sci. Signal., 5, ra6 (2012)[PubMed]
- Frech, M., John J., Pizon, V. et al.: Inhibition of GTPase activating protein stimulation of Ras-p21 GTPase by the Krev-1 gene product. Science, 249, 169-171 (1990)[PubMed]
著者プロフィール
略歴:1996年 神戸大学大学院医学研究科博士課程 修了,2000年 米国Memorial Sloan-Kettering Cancer CenterにてResearch Associateを経て,2011年より同Senior Research Scientist.
研究テーマ:RasおよびRhoファミリーのシグナル伝達系と,細胞接着の制御,発がん,がんの転移の分子機構.
Filippo G. Giancotti
米国Memorial Sloan-Kettering Cancer CenterにてLab Head.
研究室URL:http://www.mskcc.org/research/lab/filippo-giancotti
© 2015 岡田知代・Filippo G. Giancotti Licensed under CC 表示 2.1 日本