Cdc42はフォーミンタンパク質Fmnl3を介して内皮細胞におけるフィロポディアの形成を促進し血管新生を誘導する
若山勇紀・福原茂朋
(国立循環器病研究センター研究所 細胞生物学部)
email:若山勇紀,福原茂朋
DOI: 10.7875/first.author.2015.011
Cdc42 mediates Bmp-induced sprouting angiogenesis through Fmnl3-driven assembly of endothelial filopodia in zebrafish.
Yuki Wakayama, Shigetomo Fukuhara, Koji Ando, Michiyuki Matsuda, Naoki Mochizuki
Developmental Cell, 32, 109-122 (2015)
既存の血管から血管枝が発芽して伸長し新たな血管網を構築する過程を血管新生という.血管新生において,内皮細胞はフィロポディアを活発に伸ばしながら遊走し新たな血管網を形成する.これまで,内皮細胞の形態あるいは運動を制御する機構は,おもに培養内皮細胞を用いてin vitroにおいて解析されてきた.そのため,生体における血管新生において内皮細胞がフィロポディアを形成する機序は不明であった.今回,筆者らは,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞の形態および運動能を制御するシグナル伝達系の解明を試みた.血管新生により尾側静脈が形成される際,BmpがArhgef9bを介して低分子量Gタンパク質Cdc42を活性化し,内皮細胞におけるフィロポディアの形成を誘導することが示された.また,Cdc42はフォーミンタンパク質であるアクチン制御タンパク質Fmnl3を活性化し,内皮細胞におけるフィロポディアの形成を誘導することが示された.以上の結果より,尾側静脈における血管新生にはBmpによるArhgef9b-Cdc42-Fmnl3シグナル伝達系を介したフィロポディアの形成が重要であることが明らかにされた.
既存の血管から血管枝が発芽して伸長し新たな血管網を構築する過程を血管新生という1).血管新生は胎生期における血管発生の過程において活発に起こり全身に血管網を構築する.また,成体における血管新生は,組織が虚血状態におちいったときそれを解消するため誘導される一方,がんや網膜症などさまざまな疾患の際にも惹起され病態の悪化をひき起こす.
生体における血管新生において,伸長する血管の先端に位置する内皮細胞は血管新生タンパク質に反応して遊走する方向にフィロポディア(糸状仮足)を形成する2,3).フィロポディアは直線状のアクチン線維の束でみたされた細い突起状の構造体であり,おもに細胞の遊走において重要なはたらきをしている4).細胞の遊走においてフィロポディアはガイダンスタンパク質を感知するためのアンテナとして機能する一方,細胞の先導端において細胞外基質と接着することにより細胞の遊走のための足場を形成する役割をもつ.しかし,最近,フィロポディアは血管新生における内皮細胞の効率的な遊走においては必要であるが,血管新生タンパク質を感知するためのアンテナとしては機能していないとの報告がなされ5),血管新生におけるフィロポディアの役割は不明なままである.
Rhoファミリーに属する低分子量Gタンパク質は,アクチン細胞骨格の再編を介して細胞の形態および運動を制御するシグナルタンパク質である6).RhoファミリーのメンバーのなかでもRho,Rac,Cdc42の機能が詳細に解析されており,それぞれ,ストレスファイバー,ラメリポディア(葉状仮足),フィロポディアの形成を制御する.また,これらRhoファミリーのメンバーによる細胞形態の制御にはアクチン制御タンパク質が関与するが,なかでも,フォーミンタンパク質はフィロポディアにみられるような直線状のアクチン線維の形成を制御する7).哺乳動物には15種類のフォーミンタンパク質が存在するが,そのうち,mDia2(別名DIAPH3)およびFmnl3(別名FRL2)がフィロポディアの形成にかかわることが報告されている.通常,mDia2はN末端領域とC末端領域との分子内相互作用により触媒領域であるFH2ドメインがマスクされ不活性化された状態に維持されているが,活性化Cdc42がN末端領域と結合することによりこの分子内結合が解除されFH2ドメインに依存的なアクチンの重合が誘導される.しかし,Fmnl3の活性制御の機構については報告されていない.
Rhoファミリーのメンバーは内皮細胞の形態や運動能の制御にも関与する2,8).VEGFはRacやCdc42を介して細胞の遊走を亢進することが知られている.しかし,これら知見は培養内皮細胞を用いたin vitroにおける解析により得られたものであり,生体における血管新生において内皮細胞の形態および運動がどのような分子機序により制御されているかは不明であった.この研究では,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞の形態および運動能を制御するシグナル伝達系の解明を試みた.
血管新生における内皮細胞の形態および運動能の制御機構を解析するため,ゼブラフィッシュにおける尾側静脈の形成に着目した.尾側静脈はゼブラフィッシュの尾部に形成される静脈血管で,血管新生により形成される.尾側静脈の形成の過程で内皮細胞においてアクチン細胞骨格を観察するため,内皮細胞においてアクチン可視化プローブを発現するトランスジェニックゼブラフィッシュを樹立し解析した.その結果,尾側静脈の形成において,内皮細胞は先導端においてアクチン線維にみたされたフィロポディアを活発に伸長および退縮させながら遊走していることがわかった.そこで,フィロポディアが尾側静脈の形成における内皮細胞の遊走に必要かどうかを検討した.低濃度のアクチン重合阻害剤を処理することにより内皮細胞におけるフィロポディアの形成および細胞の遊走は阻害され,尾側静脈の形成不全がみられた.これにより,尾側静脈の形成における内皮細胞の遊走にはフィロポディアが必須であることが示された.
これまでに,Bmpシグナルが血管新生による尾側静脈の形成を制御することが報告されている9).そこで,Bmpが尾側静脈における内皮細胞のフィロポディアの形成に関与するかどうか検討した.熱ショックプロモーターを用いてゼブラフィッシュの全身においてBmpのアンタゴニストであるNogginを過剰に発現させたところ,内皮細胞におけるフィロポディアの形成が抑制され,尾側静脈の形成も阻害された.逆に,Bmp2を全身において過剰に発現させたところ,尾側静脈より内皮細胞がフィロポディアを伸ばしながら出芽して遊走し,異所性の静脈血管が形成された.以上の結果から,Bmpが尾側静脈における内皮細胞の遊走およびフィロポディアの形成を制御していることが示された.
低分子量Gタンパク質であるCdc42が尾側静脈における内皮細胞のフィロポディアの形成を制御するかどうか検討した.尾側静脈の形成の過程において内皮細胞のどこでCdc42が活性化しているかを知るため,Cdc42の特異的なエフェクターであるN-WASPのCdc42結合領域とGFPとを融合したタンパク質をゼブラフィッシュの内皮細胞において一過性に発現させ,生体の内皮細胞におけるCdc42の活性を可視化した.その結果,先導端に形成されたフィロポディアにおけるCdc42の活性が高いことがわかった.Cdc42がフィロポディアの形成に必要かどうかを知るため,アンチセンスモルフォリノオリゴヌクレオチドを用いてCdc42の発現を部分的にノックダウンしたところ,内皮細胞におけるフィロポディアの形成が阻害され,尾側静脈の形成にも異常がみられた.さらに,Cdc42の特異的な阻害タンパク質であるACK42を内皮細胞に発現させたところ,内皮細胞におけるフィロポディアの形成および細胞の遊走が阻害された.これにより,Cdc42が尾側静脈における内皮細胞のフィロポディアの形成を制御していることが示された.
Gタンパク質にはグアニンヌクレオチドが結合しており,不活性型のGタンパク質にはGDP,活性型のGタンパク質にはGTPが結合している.GEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)は不活性型のGタンパク質に結合するGDPをGTPと交換することによりGタンパク質を活性化する.内皮細胞におけるフィロポディアの形成にかかわる低分子量Gタンパク質Cdc42のGEFの同定を試みた.これまで,血管の発生にかかわる転写因子Etsrpにより発現の誘導される遺伝子として,GEFをコードするarhgef9b遺伝子およびfgd5遺伝子が報告されている10).そこで,これらの遺伝子にコードされるGEFが尾側静脈における内皮細胞のフィロポディアの形成に関与するかどうか検討した.in situハイブリダイゼーション解析の結果,ゼブラフィッシュの胚においてarhgef9b遺伝子およびfgd5遺伝子は血管に限局して発現していた.アンチセンスモルフォリノオリゴヌクレオチドを用いてArhgef9bをノックダウンしたところ,尾側静脈における内皮細胞のフィロポディアの形成が抑制され,尾側静脈の形成も阻害された.一方,Fgd5をノックダウンしても血管の形成に異常はみられなかった.以上の結果から,Arhgef9bが尾側静脈における内皮細胞のフィロポディアの形成を制御するCdc42のGEFであることが示唆された.
Arhgef9bがBmpの下流で機能しているかどうかを検討した.それぞれ,単独の投与では効果をもたない濃度のArhgef9bおよびBmp受容体に対するアンチセンスモルフォリノオリゴヌクレオチドを同時にゼブラフィッシュの受精卵に投与したところ,尾側静脈の形成が阻害された.これにより,Arhgef9bとBmp受容体は遺伝学的に相互作用がある,すなわち,Arhgef9bはBmpの下流で機能していることが示唆された.
Cdc42の下流においてフィロポディアの形成を制御するアクチン制御タンパク質の同定を試みた.フォーミンタンパク質は直線状のアクチン線維の形成に関与する.フォーミンタンパク質に対する阻害剤を処理することにより,内皮細胞におけるフィロポディアが消失し尾側静脈の形成が阻害されたことから,尾側静脈の形成にはフォーミンタンパク質が関与すると考えられた.そこで,培養内皮細胞のRT-PCR解析,さらには,ゼブラフィッシュの胚のin situハイブリダイゼーション解析により,血管に発現するフォーミンタンパク質を調べたところ,Fmnl3が血管に限局して発現していた.アンチセンスモルフォリノオリゴヌクレオチドを用いてFmnl3をノックダウンしたところ,内皮細胞におけるフィロポディアの形成が抑制され,尾側静脈の形成が阻害された.このことから,Fmnl3は尾側静脈における内皮細胞のフィロポディアの形成を制御していることが示された.
さきに述べたように,フォーミンタンパク質であるmDia2はN末端領域とC末端領域との分子内相互作用によりFH2ドメインをマスクし不活性化された状態を維持する.活性化Cdc42がN末端領域に結合するとこの分子内結合が解除され,FH2ドメインに依存的なアクチンの重合が誘導される.同じくフォーミンタンパク質であるFmnl3の活性も同様な機序により制御されているのか検討した.共免疫沈降実験により,Fmnl3のN末端領域とC末端領域との相互作用が示された.また,培養内皮細胞にFmnl3欠損変異体を発現させアクチン線維をファロイジンにより染色したところ,FH2ドメインを含むC末端領域の発現によりアクチンの重合が亢進し,この活性はN末端領域の共発現により抑制された.これにより,Fmnl3の活性はN末端領域とC末端領域との分子内結合により抑制されていることがわかった(図1).
Fmnl3の活性化の機序について検討した.共免疫沈降実験によりFmnl3のN末端領域とRho,Rac,Cdc42との結合について調べたところ,活性化Cdc42がFmnl3のN末端領域と結合した.さらに,野生型のFmnl3は活性化Cdc42と相乗的にアクチンの重合を惹起したが,Cdc42に結合できない変異型のFmnl3はその効果をもたなかった.以上の結果から,Cdc42はFmnl3のN末端領域と結合することによりFmnl3の分子内相互作用を解除し,FH2ドメインに依存的なアクチンの重合を誘導することが示された(図1).
Cdc42によるFmnl3の活性化が尾側静脈の形成に重要なのかどうかを検討した.アンチセンスモルフォリノオリゴヌクレオチドを用いたFmnl3のノックダウンにより尾側静脈の形成は阻害されたが,この表現型はFmnl3の再発現によりレスキューされた.しかし,Cdc42に結合できない変異型Fmnl3はFmnl3のノックダウンによる尾側静脈の形成不全をレスキューできなかった.以上から,尾側静脈の形成にはCdc42によるFmnl3の活性化が必要であることが示唆された(図2).
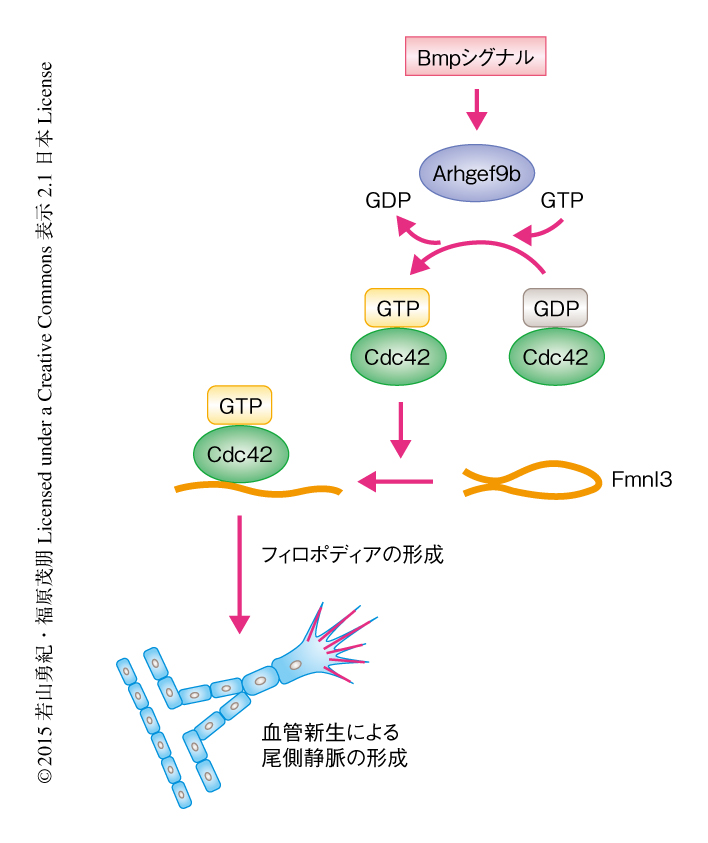
今回,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞のフィロポディアの役割,および,それを制御するシグナル伝達系が解明された.血管新生により尾側静脈が形成される際,Bmpが内皮細胞の先導端においてArhgef9bに依存的にCdc42を活性化すること,さらに,活性化したCdc42がフォーミンタンパク質Fmnl3を介してフィロポディアの形成を惹起することにより,内皮細胞の遊走を亢進し血管新生を誘導することが明らかになった(図2).今後,このシグナル伝達系が尾側静脈のほかの血管新生においても機能しているのか,同様に,成体における病的な血管新生においても機能しているのか,解析が待たれる.
略歴:大阪大学大学院医学系研究科 在学中.
研究テーマ:血管新生の過程における内皮細胞の形態制御の機構.
関心事:生体において細胞のダイナミックな形態の変化を観察すること.
福原 茂朋(Shigetomo Fukuhara)
国立循環器病研究センター研究所 室長.
© 2015 若山勇紀・福原茂朋 Licensed under CC 表示 2.1 日本
(国立循環器病研究センター研究所 細胞生物学部)
email:若山勇紀,福原茂朋
DOI: 10.7875/first.author.2015.011
Cdc42 mediates Bmp-induced sprouting angiogenesis through Fmnl3-driven assembly of endothelial filopodia in zebrafish.
Yuki Wakayama, Shigetomo Fukuhara, Koji Ando, Michiyuki Matsuda, Naoki Mochizuki
Developmental Cell, 32, 109-122 (2015)
要 約
既存の血管から血管枝が発芽して伸長し新たな血管網を構築する過程を血管新生という.血管新生において,内皮細胞はフィロポディアを活発に伸ばしながら遊走し新たな血管網を形成する.これまで,内皮細胞の形態あるいは運動を制御する機構は,おもに培養内皮細胞を用いてin vitroにおいて解析されてきた.そのため,生体における血管新生において内皮細胞がフィロポディアを形成する機序は不明であった.今回,筆者らは,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞の形態および運動能を制御するシグナル伝達系の解明を試みた.血管新生により尾側静脈が形成される際,BmpがArhgef9bを介して低分子量Gタンパク質Cdc42を活性化し,内皮細胞におけるフィロポディアの形成を誘導することが示された.また,Cdc42はフォーミンタンパク質であるアクチン制御タンパク質Fmnl3を活性化し,内皮細胞におけるフィロポディアの形成を誘導することが示された.以上の結果より,尾側静脈における血管新生にはBmpによるArhgef9b-Cdc42-Fmnl3シグナル伝達系を介したフィロポディアの形成が重要であることが明らかにされた.
はじめに
既存の血管から血管枝が発芽して伸長し新たな血管網を構築する過程を血管新生という1).血管新生は胎生期における血管発生の過程において活発に起こり全身に血管網を構築する.また,成体における血管新生は,組織が虚血状態におちいったときそれを解消するため誘導される一方,がんや網膜症などさまざまな疾患の際にも惹起され病態の悪化をひき起こす.
生体における血管新生において,伸長する血管の先端に位置する内皮細胞は血管新生タンパク質に反応して遊走する方向にフィロポディア(糸状仮足)を形成する2,3).フィロポディアは直線状のアクチン線維の束でみたされた細い突起状の構造体であり,おもに細胞の遊走において重要なはたらきをしている4).細胞の遊走においてフィロポディアはガイダンスタンパク質を感知するためのアンテナとして機能する一方,細胞の先導端において細胞外基質と接着することにより細胞の遊走のための足場を形成する役割をもつ.しかし,最近,フィロポディアは血管新生における内皮細胞の効率的な遊走においては必要であるが,血管新生タンパク質を感知するためのアンテナとしては機能していないとの報告がなされ5),血管新生におけるフィロポディアの役割は不明なままである.
Rhoファミリーに属する低分子量Gタンパク質は,アクチン細胞骨格の再編を介して細胞の形態および運動を制御するシグナルタンパク質である6).RhoファミリーのメンバーのなかでもRho,Rac,Cdc42の機能が詳細に解析されており,それぞれ,ストレスファイバー,ラメリポディア(葉状仮足),フィロポディアの形成を制御する.また,これらRhoファミリーのメンバーによる細胞形態の制御にはアクチン制御タンパク質が関与するが,なかでも,フォーミンタンパク質はフィロポディアにみられるような直線状のアクチン線維の形成を制御する7).哺乳動物には15種類のフォーミンタンパク質が存在するが,そのうち,mDia2(別名DIAPH3)およびFmnl3(別名FRL2)がフィロポディアの形成にかかわることが報告されている.通常,mDia2はN末端領域とC末端領域との分子内相互作用により触媒領域であるFH2ドメインがマスクされ不活性化された状態に維持されているが,活性化Cdc42がN末端領域と結合することによりこの分子内結合が解除されFH2ドメインに依存的なアクチンの重合が誘導される.しかし,Fmnl3の活性制御の機構については報告されていない.
Rhoファミリーのメンバーは内皮細胞の形態や運動能の制御にも関与する2,8).VEGFはRacやCdc42を介して細胞の遊走を亢進することが知られている.しかし,これら知見は培養内皮細胞を用いたin vitroにおける解析により得られたものであり,生体における血管新生において内皮細胞の形態および運動がどのような分子機序により制御されているかは不明であった.この研究では,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞の形態および運動能を制御するシグナル伝達系の解明を試みた.
1.ゼブラフィッシュの尾側静脈の形成には内皮細胞におけるフィロポディアの形成が必要である
血管新生における内皮細胞の形態および運動能の制御機構を解析するため,ゼブラフィッシュにおける尾側静脈の形成に着目した.尾側静脈はゼブラフィッシュの尾部に形成される静脈血管で,血管新生により形成される.尾側静脈の形成の過程で内皮細胞においてアクチン細胞骨格を観察するため,内皮細胞においてアクチン可視化プローブを発現するトランスジェニックゼブラフィッシュを樹立し解析した.その結果,尾側静脈の形成において,内皮細胞は先導端においてアクチン線維にみたされたフィロポディアを活発に伸長および退縮させながら遊走していることがわかった.そこで,フィロポディアが尾側静脈の形成における内皮細胞の遊走に必要かどうかを検討した.低濃度のアクチン重合阻害剤を処理することにより内皮細胞におけるフィロポディアの形成および細胞の遊走は阻害され,尾側静脈の形成不全がみられた.これにより,尾側静脈の形成における内皮細胞の遊走にはフィロポディアが必須であることが示された.
2.Bmpは尾側静脈における内皮細胞のフィロポディアの形成を制御する
これまでに,Bmpシグナルが血管新生による尾側静脈の形成を制御することが報告されている9).そこで,Bmpが尾側静脈における内皮細胞のフィロポディアの形成に関与するかどうか検討した.熱ショックプロモーターを用いてゼブラフィッシュの全身においてBmpのアンタゴニストであるNogginを過剰に発現させたところ,内皮細胞におけるフィロポディアの形成が抑制され,尾側静脈の形成も阻害された.逆に,Bmp2を全身において過剰に発現させたところ,尾側静脈より内皮細胞がフィロポディアを伸ばしながら出芽して遊走し,異所性の静脈血管が形成された.以上の結果から,Bmpが尾側静脈における内皮細胞の遊走およびフィロポディアの形成を制御していることが示された.
3.Cdc42は尾側静脈における内皮細胞のフィロポディアの形成を制御する
低分子量Gタンパク質であるCdc42が尾側静脈における内皮細胞のフィロポディアの形成を制御するかどうか検討した.尾側静脈の形成の過程において内皮細胞のどこでCdc42が活性化しているかを知るため,Cdc42の特異的なエフェクターであるN-WASPのCdc42結合領域とGFPとを融合したタンパク質をゼブラフィッシュの内皮細胞において一過性に発現させ,生体の内皮細胞におけるCdc42の活性を可視化した.その結果,先導端に形成されたフィロポディアにおけるCdc42の活性が高いことがわかった.Cdc42がフィロポディアの形成に必要かどうかを知るため,アンチセンスモルフォリノオリゴヌクレオチドを用いてCdc42の発現を部分的にノックダウンしたところ,内皮細胞におけるフィロポディアの形成が阻害され,尾側静脈の形成にも異常がみられた.さらに,Cdc42の特異的な阻害タンパク質であるACK42を内皮細胞に発現させたところ,内皮細胞におけるフィロポディアの形成および細胞の遊走が阻害された.これにより,Cdc42が尾側静脈における内皮細胞のフィロポディアの形成を制御していることが示された.
4.BmpはArhgef9bを介してCdc42を活性化しフィロポディアの形成を誘導する
Gタンパク質にはグアニンヌクレオチドが結合しており,不活性型のGタンパク質にはGDP,活性型のGタンパク質にはGTPが結合している.GEF(guanine nucleotide exchange factor,グアニンヌクレオチド交換因子)は不活性型のGタンパク質に結合するGDPをGTPと交換することによりGタンパク質を活性化する.内皮細胞におけるフィロポディアの形成にかかわる低分子量Gタンパク質Cdc42のGEFの同定を試みた.これまで,血管の発生にかかわる転写因子Etsrpにより発現の誘導される遺伝子として,GEFをコードするarhgef9b遺伝子およびfgd5遺伝子が報告されている10).そこで,これらの遺伝子にコードされるGEFが尾側静脈における内皮細胞のフィロポディアの形成に関与するかどうか検討した.in situハイブリダイゼーション解析の結果,ゼブラフィッシュの胚においてarhgef9b遺伝子およびfgd5遺伝子は血管に限局して発現していた.アンチセンスモルフォリノオリゴヌクレオチドを用いてArhgef9bをノックダウンしたところ,尾側静脈における内皮細胞のフィロポディアの形成が抑制され,尾側静脈の形成も阻害された.一方,Fgd5をノックダウンしても血管の形成に異常はみられなかった.以上の結果から,Arhgef9bが尾側静脈における内皮細胞のフィロポディアの形成を制御するCdc42のGEFであることが示唆された.
Arhgef9bがBmpの下流で機能しているかどうかを検討した.それぞれ,単独の投与では効果をもたない濃度のArhgef9bおよびBmp受容体に対するアンチセンスモルフォリノオリゴヌクレオチドを同時にゼブラフィッシュの受精卵に投与したところ,尾側静脈の形成が阻害された.これにより,Arhgef9bとBmp受容体は遺伝学的に相互作用がある,すなわち,Arhgef9bはBmpの下流で機能していることが示唆された.
5.Fmnl3は尾側静脈における内皮細胞のフィロポディアの形成を制御する
Cdc42の下流においてフィロポディアの形成を制御するアクチン制御タンパク質の同定を試みた.フォーミンタンパク質は直線状のアクチン線維の形成に関与する.フォーミンタンパク質に対する阻害剤を処理することにより,内皮細胞におけるフィロポディアが消失し尾側静脈の形成が阻害されたことから,尾側静脈の形成にはフォーミンタンパク質が関与すると考えられた.そこで,培養内皮細胞のRT-PCR解析,さらには,ゼブラフィッシュの胚のin situハイブリダイゼーション解析により,血管に発現するフォーミンタンパク質を調べたところ,Fmnl3が血管に限局して発現していた.アンチセンスモルフォリノオリゴヌクレオチドを用いてFmnl3をノックダウンしたところ,内皮細胞におけるフィロポディアの形成が抑制され,尾側静脈の形成が阻害された.このことから,Fmnl3は尾側静脈における内皮細胞のフィロポディアの形成を制御していることが示された.
6.Cdc42はFmnl3を介して尾側静脈における内皮細胞のフィロポディアの形成を誘導する
さきに述べたように,フォーミンタンパク質であるmDia2はN末端領域とC末端領域との分子内相互作用によりFH2ドメインをマスクし不活性化された状態を維持する.活性化Cdc42がN末端領域に結合するとこの分子内結合が解除され,FH2ドメインに依存的なアクチンの重合が誘導される.同じくフォーミンタンパク質であるFmnl3の活性も同様な機序により制御されているのか検討した.共免疫沈降実験により,Fmnl3のN末端領域とC末端領域との相互作用が示された.また,培養内皮細胞にFmnl3欠損変異体を発現させアクチン線維をファロイジンにより染色したところ,FH2ドメインを含むC末端領域の発現によりアクチンの重合が亢進し,この活性はN末端領域の共発現により抑制された.これにより,Fmnl3の活性はN末端領域とC末端領域との分子内結合により抑制されていることがわかった(図1).
Fmnl3の活性化の機序について検討した.共免疫沈降実験によりFmnl3のN末端領域とRho,Rac,Cdc42との結合について調べたところ,活性化Cdc42がFmnl3のN末端領域と結合した.さらに,野生型のFmnl3は活性化Cdc42と相乗的にアクチンの重合を惹起したが,Cdc42に結合できない変異型のFmnl3はその効果をもたなかった.以上の結果から,Cdc42はFmnl3のN末端領域と結合することによりFmnl3の分子内相互作用を解除し,FH2ドメインに依存的なアクチンの重合を誘導することが示された(図1).
Cdc42によるFmnl3の活性化が尾側静脈の形成に重要なのかどうかを検討した.アンチセンスモルフォリノオリゴヌクレオチドを用いたFmnl3のノックダウンにより尾側静脈の形成は阻害されたが,この表現型はFmnl3の再発現によりレスキューされた.しかし,Cdc42に結合できない変異型Fmnl3はFmnl3のノックダウンによる尾側静脈の形成不全をレスキューできなかった.以上から,尾側静脈の形成にはCdc42によるFmnl3の活性化が必要であることが示唆された(図2).
おわりに
今回,ゼブラフィッシュをモデル生物として用いた蛍光イメージング解析により,血管新生における内皮細胞のフィロポディアの役割,および,それを制御するシグナル伝達系が解明された.血管新生により尾側静脈が形成される際,Bmpが内皮細胞の先導端においてArhgef9bに依存的にCdc42を活性化すること,さらに,活性化したCdc42がフォーミンタンパク質Fmnl3を介してフィロポディアの形成を惹起することにより,内皮細胞の遊走を亢進し血管新生を誘導することが明らかになった(図2).今後,このシグナル伝達系が尾側静脈のほかの血管新生においても機能しているのか,同様に,成体における病的な血管新生においても機能しているのか,解析が待たれる.
文 献
- Carmeliet, P.: Mechanisms of angiogenesis and arteriogenesis. Nat. Med., 6, 389-395 (2000)[PubMed]
- De Smet, F., Segura, I., De Bock, K. et al.: Mechanisms of vessel branching: filopodia on endothelial tip cells lead the way. Arterioscler. Thromb. Vasc. Biol., 29, 639-649 (2009)[PubMed]
- Gerhardt, H., Golding, M., Fruttiger, M. et al.: VEGF guides angiogenic sprouting utilizing endothelial tip cell filopodia. J. Cell Biol., 161, 1163-1177 (2003)[PubMed]
- Mattila, P. K. & Lappalainen, P.: Filopodia: molecular architecture and cellular functions. Nat. Rev. Mol. Cell Biol., 9, 446-454 (2008)[PubMed]
- Phng, L. K., Stanchi, F. & Gerhardt, H.: Filopodia are dispensable for endothelial tip cell guidance. Development, 140, 4031-4040 (2013)[PubMed]
- Heasman, S. J. & Ridley, A. J.: Mammalian Rho GTPases: new insights into their functions from in vivo studies. Nat. Rev. Mol. Cell Biol., 9, 690-701 (2008)[PubMed]
- Watanabe, N. & Higashida, C.: Formins: processive cappers of growing actin filaments. Exp. Cell Res., 301, 16-22 (2004)[PubMed]
- Lamalice, L., Le, B. F. & Huot, J.: Endothelial cell migration during angiogenesis. Circ. Res., 100, 782-794 (2007)[PubMed]
- Wiley, D. M., Kim, J. D., Hao, J. et al.: Distinct signalling pathways regulate sprouting angiogenesis from the dorsal aorta and the axial vein. Nat. Cell Biol., 13, 686-692 (2011)[PubMed]
- Gomez, G. A., Veldman, M. B., Zhao, Y. et al.: Discovery and characterization of novel vascular and hematopoietic genes downstream of etsrp in zebrafish. PLoS. One, 4, e4994 (2009)[PubMed]
著者プロフィール
略歴:大阪大学大学院医学系研究科 在学中.
研究テーマ:血管新生の過程における内皮細胞の形態制御の機構.
関心事:生体において細胞のダイナミックな形態の変化を観察すること.
福原 茂朋(Shigetomo Fukuhara)
国立循環器病研究センター研究所 室長.
© 2015 若山勇紀・福原茂朋 Licensed under CC 表示 2.1 日本