シナプスにおける2つのタイプの長期増強が前帯状回において共存し不安と慢性疼痛との相互作用を形成する
古賀浩平・Min Zhuo
(カナダToronto大学Faculty of Medicine,Department of Physiology)
email:古賀浩平
DOI: 10.7875/first.author.2015.012
Coexistence of two forms of LTP in ACC provides a synaptic mechanism for the interactions between anxiety and chronic pain.
Kohei Koga, Giannina Descalzi, Tao Chen, Hyoung-Gon Ko, Jinshan Lu, Shermaine Li, Junehee Son, TaeHyun Kim, Chuljung Kwak, Richard L. Huganir, Ming-gao Zhao, Bong-Kiun Kaang, Graham L. Collingridge, Min Zhuo
Neuron, 85, 377-389 (2015)
慢性疼痛が不安をひき起こす一方,不安は痛みを増大させることが知られている.しかしながら,不安と慢性疼痛とがいかに相互に作用するかについてのシナプスの機序はこれまでほとんど知られていなかった.筆者らは,これまでに,後シナプスにおける長期増強はNMDA型グルタミン酸受容体を介することを報告していたが,今回,マウスの前帯状回においてシナプス前終末における長期増強を同定した.この長期増強には,カイニン酸型グルタミン酸受容体,アデニル酸シクラーゼ,プロテインキナーゼAの関与することが明らかにされた.さらに,過分極活性化環状ヌクレオチド依存性チャネルがシナプス前終末における長期増強の発現に必要であること,また,神経の損傷および不安様の行動はシナプス前終末における長期増強を特異的に消失させることが見い出された.過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬を前帯状回に投与することにより,抗不安作用および侵害刺激からの逃避行動を緩和する効果が得られた.これらの結果から,前帯状回において2つのタイプの長期増強が共存し,不安と慢性疼痛とが相互に影響している可能性が示された.
慢性疼痛の患者はしばしば不安など情動の不調をうったえる.また,不安が慢性疼痛を増強する可能性が示されている.大脳皮質のうち,前帯状回は感覚認知や感情応答などさまざまな高次の脳機能をもつことが知られている1).ヒトにおけるイメージングや動物を用いた研究により,前帯状回が痛みや侵害の受容に関与すること,また,前帯状回が不安に関係することが示されている.前帯状回におけるシナプス伝達の亢進が不安および侵害の受容に寄与する可能性が考えられるが,これらがいかに相互作用するかについてのシナプスの機序は明らかにされていない.
長期増強(long-term potentiation:LTP)は中枢神経系における活動に依存的なシナプスの可塑性のおもなモデルであり,記憶および学習の分子機序と考えられている2).NMDA型グルタミン酸受容体を介するかどうかにより,2つのタイプの長期増強が報告されている3,4).海馬のCA1野において観察される長期増強はNMDA型グルタミン酸受容体の活性を必要とする一方3),海馬のCA3野に投射する苔状線維における長期増強はNMDA型グルタミン酸受容体に非依存的であることが知られている4).
これまでに,大脳皮質においてNMDA型グルタミン酸受容体の活性を介する後シナプスにおける長期増強の機序が多く研究されてきた1).前帯状回の後シナプスにおける長期増強はNMDA型グルタミン酸受容体の活性を必要とし,AMPA型グルタミン酸受容体を介することが明らかにされている1,5).また,神経損傷モデルにおいては,前帯状回のシナプス前終末におけるグルタミン酸の放出の増加やAMPA型グルタミン酸受容体の活性化など,興奮性のシナプス伝達の亢進が報告されている6).前帯状回においてAMPA型グルタミン酸受容体を抑制すると神経損傷モデルにおいて侵害刺激からの逃避行動が緩和されることから,前帯状回の後シナプスにおける長期増強が侵害の受容にかかわる可能性が示唆されている1,6).一方で,慢性疼痛により亢進するシナプス前終末におけるグルタミン酸の放出の機能的な意義は何なのか? この研究においては,前帯状回のシナプス前終末における長期増強の機序,および,不安と慢性疼痛との相互作用について調べた.
これまで,おもに海馬や扁桃体においてシナプス前終末における長期増強の機序が研究されてきたが4,7),大脳皮質のシナプス前終末における長期増強の機序は不明であった.8~12週齢の成体のマウスから脳の冠状断の切片を作製し,ピクロトキシンによりGABAA受容体を拮抗した状態で,前帯状回のII層/III層の錐体細胞からパッチクランプ記録を行った5,6).電圧を-60 mVに固定し,V層/VI層に留置した刺激用の電極を用いて誘発性興奮性シナプス後電流を記録した.シナプス前終末の変化を観察するため,50 msの間隔でペアとなるパルスをあたえて2つの誘発性興奮性シナプス後電流の振幅の比を測定した.記録が安定した細胞に電圧を-60 mVに固定した状態で2 Hz,2分間の低頻度の刺激をあたえたところ,誘発性興奮性シナプス後電流の振幅の有意な増大が観察された.また,ペアとなるパルスをあたえたときの振幅の比は低頻度の刺激ののち有意に抑制された.一方,対照においては,誘発性興奮性シナプス後電流の振幅およびペアとなるパルスをあたえたときの振幅の比に変化はなかった.さらに,NMDA型グルタミン酸受容体,代謝型グルタミン酸受容体,後シナプスにおけるCa2+経路がこのシナプス前終末における長期増強に関与するかどうかを薬理学的に検討した結果,これらには依存しないことが明らかにされた.
海馬においては,カイニン酸型グルタミン酸受容体がシナプス前終末においてはたらきシナプス伝達や長期増強に役割を担うことが示されている4,8).前帯状回のシナプス前終末における長期増強にカイニン酸型グルタミン酸受容体GluK1およびGluK2が関与するかどうか検討した.GluK1のノックアウトマウスでは野生型のマウスと比べシナプス前終末における長期増強が有意に抑制された一方,GluK2のノックアウトマウスではシナプス前終末における長期増強は正常であった.
長期増強にプロテインキナーゼAの関与することが知られている4,7).そこで,前帯状回のシナプス前終末における長期増強がプロテインキナーゼA経路に依存しているかどうかを薬理学的に調べたところ,プロテインキナーゼAの阻害薬はシナプス前終末における長期増強を有意に抑制した.
哺乳類においては9種類のアデニル酸シクラーゼが知られており,アデニル酸シクラーゼ1およびアデニル酸シクラーゼ8がそのおもなサブタイプであることから1,6),これらがシナプス前終末における長期増強に関与するかどうか調べた.アデニル酸シクラーゼ1のノックアウトマウスは野生型のマウスと比べシナプス前終末における長期増強を有意に抑制した一方,アデニル酸シクラーゼ8のノックアウトマウスではシナプス前終末における長期増強は正常であった.
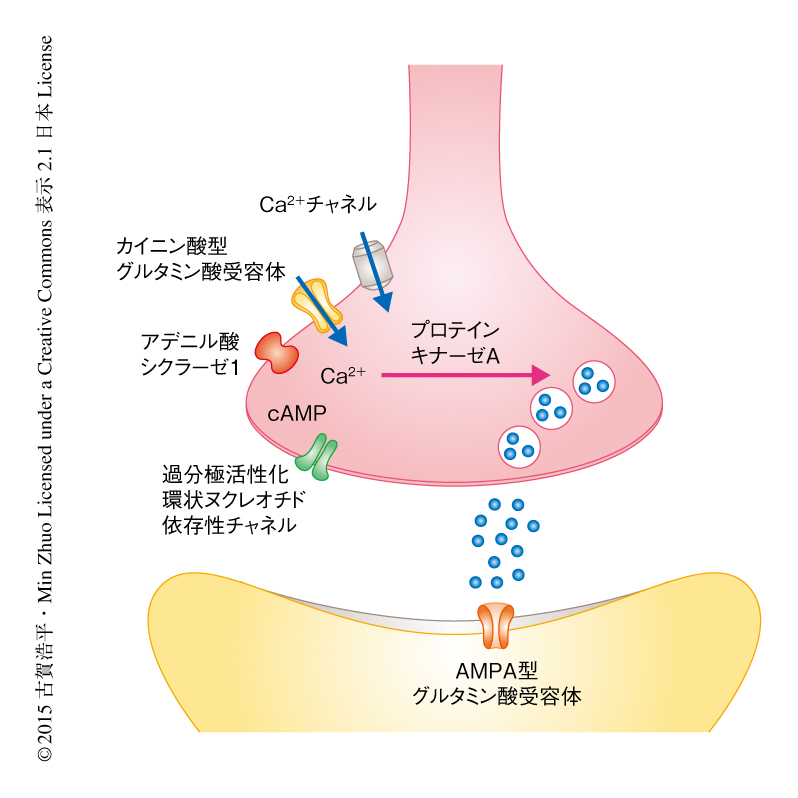
以上のことから,前帯状回のシナプス前終末における長期増強には,カイニン酸型グルタミン酸受容体GluK1およびアデニル酸シクラーゼ1を介したプロテインキナーゼA経路の活性が必要であることがわかった(図1).
前帯状回はさまざまな高次の脳機能をもち,たとえば,恐怖,不安,痛みにおいて重要な役割をはたすが1,5,9),シナプスのレベルにおけるその機序は不明であった.そこで,前帯状回のシナプス前終末における長期増強が痛みや恐怖に関与するかどうか検討した.
非侵害刺激と前帯状回シナプス前終末における長期増強との関係について調べた.機械刺激に対し逃避行動を示したマウスの前帯状回からシナプス前終末における長期増強の記録を行ったところ正常であった.40℃の温刺激を60秒間あたえたマウスも正常なシナプス前終末における長期増強を示した.急性侵害刺激と前帯状回シナプス前終末における長期増強との関係についても検討し,55℃の熱刺激をあたえて逃避行動を示したマウスの前帯状回からシナプス前終末における長期増強の記録を行ったが正常であった.
2種類の慢性疼痛モデルを用いて実験を行った.右後肢に完全フロイントアジュバントを投与して2~3日のちの慢性炎症モデルの帯状回からシナプス前終末における長期増強の記録を行った結果,長期増強は消失していた.末梢における神経損傷モデルを作製し7~8日のちにシナプス前終末における長期増強の記録を行ったところ,長期増強は消失していた.慢性疼痛モデルが前帯状回シナプス前終末におけるグルタミン酸の放出を促進するという報告とあわせて考えると,慢性疼痛モデルはシナプス前終末がすでに活性化しているため,シナプス前終末におけるこれ以上の長期増強が起こらない可能性が考えられた.恐怖の学習と前帯状回シナプス前終末における長期増強との関係についても検討した.恐怖の条件づけをあたえた直後および2~3日のちのマウスを用いてシナプス前終末における長期増強の記録を行ったところ,正常であった.
以上のことから,慢性疼痛が前帯状回のシナプス前終末における長期増強にかかわる一方,恐怖の学習は影響しないことが明らかにされた.
前帯状回は視床から入力をうけることが知られ.また,過分極活性化環状ヌクレオチド依存性チャネルは海馬のCA3野においてシナプス前終末にはたらきシナプス伝達の制御に関係することが報告されている10).まず,ウェスタンブロット法により,過分極活性化環状ヌクレオチド依存性チャネルが前帯状回および視床において発現していることが確認され,さらに,電子顕微鏡を用いて,過分極活性化環状ヌクレオチド依存性チャネルが前帯状回のシナプス前終末および後シナプスに局在することが観察された.過分極活性化環状ヌクレオチド依存性チャネルは過分極誘発性陽イオン電流の発生にかかわることが知られている10).パッチクランプ記録法を用いて前帯状回に投射する視床細胞から過分極誘発性陽イオン電流を記録した.逆行性トレーサーDiIを前帯状回に投与し,3日のちに脳の冠状断の切片を作製した.DiI陽性およびDiI陰性の視床細胞,前帯状回のII層/III層の錐体細胞において観察した結果,前帯状回に投射する視床細胞は有意に大きな過分極誘発性陽イオン電流を示した.
過分極活性化環状ヌクレオチド依存性チャネルが前帯状回のシナプス前終末における長期増強に関与するかどうか調べた.過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬はシナプス前終末における長期増強の誘導および維持を抑制したことから,過分極活性化環状ヌクレオチド依存性チャネルは前帯状回のシナプス前終末における長期増強にかかわることが明らかにされた(図1).
神経の損傷による前帯状回におけるシナプス前終末の亢進,および,過分極活性化環状ヌクレオチド依存性チャネルに対する特異性について検討した.c-fos遺伝子は細胞の活性に依存的に発現する遺伝子である6).筆者らは,c-fos遺伝子の発現が活性化するとGFPにより蛍光を示すトランスジェニックマウスを用いて,神経損傷モデルにおいて前帯状回にてc-fos遺伝子の発現が活性化していることを報告している6).過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬は神経損傷モデルにおいてc-fos遺伝子の発現が活性化した細胞における誘発性興奮性シナプス後電流の振幅を有意に抑制し,ペアとなるパルスをあたえたときの振幅の比にも有意な変化が観察された.一方,過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬は神経損傷モデルおよび対照においてc-fos遺伝子の発現が活性化していない細胞には影響しなかった.以上のことから,過分極活性化環状ヌクレオチド依存性チャネルは神経の損傷により活性化した前帯状回におけるシナプス前終末の制御にかかわることが明らかにされた.
不安と前帯状回シナプス前終末における長期増強との関係について検討した.不安様の行動の評価に用いられる実験法のひとつに高架式十字迷路法がある.高架式十字迷路は2つの壁のない走行路(不安を感じる場所)と,2つの壁のある走行路(安全な場所)から構成され,高所がマウスの不安様の行動を誘発すると考えられている.マウスを高架式十字迷路に5分間おいたのち,すばやく脳の冠状断の切片を作製した.対象となるマウスに前帯状回にシナプス前終末における長期増強を誘導するような刺激をあたえても長期増強は発生しなかった.一方,壁のある走行路におかれたマウスは正常なシナプス前終末における長期増強を示した.さらに,壁のない走行路におかれたマウスはシナプス前終末における長期増強の有意な抑制を示した.これらの結果は,前帯状回シナプス前終末が不安様の行動に関与するという以前の報告とあわせて考えると,不安様の行動により前帯状回シナプス前終末がすでに活性化しているため,シナプス前終末におけるこれ以上の長期増強が起こらない可能性が考えられた.壁のない走行路におかれたマウスをもとのケージにもどし,1時間後および9時間後に切片を作製した.その結果,シナプス前終末における長期増強の振幅が時間に依存して回復したことから,不安な環境への暴露によるシナプス前終末における長期増強の抑制は時間に依存的であり,急性期に観察されることが示された.不安と後シナプスにおける長期増強の関係についても調べたが,壁のない走行路におかれたマウスにおいても正常な後シナプスにおける長期増強の発現が示された.
以上のことから,シナプス前終末における長期増強が不安様の行動にかかわる一方,後シナプスにおける長期増強は関与しないことが明らかにされた.
前帯状回において過分極活性化環状ヌクレオチド依存性チャネルを抑制すると慢性疼痛によりひき起こされる不安様の行動は緩和されるかどうか,行動薬理学的な実験法により検討した.不安様の行動の評価には,高架式十字迷路法およびオープンフィールド法を用いた.その結果,神経損傷モデルマウスは対照となるマウスと比べ有意に不安様の行動の増加を示した11).神経の損傷により不安様の行動の増加したマウスの前帯状回に過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬を投与した結果,不安様の行動の増加は緩和された.さらに,過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬の前帯状回への投与は,神経の損傷による機械刺激に対する逃避行動の閾値も有意に改善した.
筆者らは,先行研究において,プロテインキナーゼMζが前帯状回の後シナプスにおける長期増強にかかわることを報告している6).また,プロテインキナーゼMζの阻害薬を前帯状回に投与すると,神経の損傷による機械刺激に対する逃避行動の閾値が改善することも示している6).そこで,前帯状回の後シナプスが神経の損傷による不安様の行動にかかわるかどうか検討した結果,プロテインキナーゼζの阻害薬を前帯状回に投与しても神経の損傷による不安様の行動に変化はなかった.
これらの結果から,神経の損傷による不安様の行動には前帯状回の過分極活性化環状ヌクレオチド依存性チャネルがかかわること.また,前帯状回の後シナプスは関与していない可能性が示唆された.
今回,筆者らは,前帯状回のシナプス前終末に着目し不安と慢性疼痛との関係について研究した結果,不安様の行動および慢性疼痛が前帯状回のシナプス前終末における長期増強において共存することが明らかにされた.前帯状回のシナプス前終末における長期増強が不安様の行動にかかわり,後シナプスはおもに侵害刺激からの逃避行動に関与するというシナプスの機序の一端が明らかにされた.さらに,過分極活性化環状ヌクレオチド依存性チャネルはおもにシナプス前終末においてはたらき,慢性疼痛および不安様の行動を制御している可能性が示された.しかしながら,過分極活性化環状ヌクレオチド依存性チャネルは前帯状回の後シナプスにも発現していることから,そこでも役割をもつ可能性は残っている.したがって,前帯状回における過分極活性化環状ヌクレオチド依存性チャネルの詳細な機序の解明は今後の課題である.今回の研究で得られた前帯状回のシナプス前終末における長期増強の機序の解明が進み,将来,不安や慢性疼痛に対する治療薬の評価や開発に役だつことを期待している.
略歴:2007年 九州大学大学院医学研究科博士課程 修了,同年 同 博士研究員,2008年 熊本健康保健科学大学 博士研究員を経て,2009年よりカナダToronto大学 博士研究員.
研究テーマ:感覚入力がいかに情動を形成するかをシナプスのレベルで理解する.
関心事:料理はじめました.
Min Zhuo
カナダToronto大学Professor.
研究室URL:http://www.individual.utoronto.ca/zhuo/
© 2015 古賀浩平・Min Zhuo Licensed under CC 表示 2.1 日本
(カナダToronto大学Faculty of Medicine,Department of Physiology)
email:古賀浩平
DOI: 10.7875/first.author.2015.012
Coexistence of two forms of LTP in ACC provides a synaptic mechanism for the interactions between anxiety and chronic pain.
Kohei Koga, Giannina Descalzi, Tao Chen, Hyoung-Gon Ko, Jinshan Lu, Shermaine Li, Junehee Son, TaeHyun Kim, Chuljung Kwak, Richard L. Huganir, Ming-gao Zhao, Bong-Kiun Kaang, Graham L. Collingridge, Min Zhuo
Neuron, 85, 377-389 (2015)
要 約
慢性疼痛が不安をひき起こす一方,不安は痛みを増大させることが知られている.しかしながら,不安と慢性疼痛とがいかに相互に作用するかについてのシナプスの機序はこれまでほとんど知られていなかった.筆者らは,これまでに,後シナプスにおける長期増強はNMDA型グルタミン酸受容体を介することを報告していたが,今回,マウスの前帯状回においてシナプス前終末における長期増強を同定した.この長期増強には,カイニン酸型グルタミン酸受容体,アデニル酸シクラーゼ,プロテインキナーゼAの関与することが明らかにされた.さらに,過分極活性化環状ヌクレオチド依存性チャネルがシナプス前終末における長期増強の発現に必要であること,また,神経の損傷および不安様の行動はシナプス前終末における長期増強を特異的に消失させることが見い出された.過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬を前帯状回に投与することにより,抗不安作用および侵害刺激からの逃避行動を緩和する効果が得られた.これらの結果から,前帯状回において2つのタイプの長期増強が共存し,不安と慢性疼痛とが相互に影響している可能性が示された.
はじめに
慢性疼痛の患者はしばしば不安など情動の不調をうったえる.また,不安が慢性疼痛を増強する可能性が示されている.大脳皮質のうち,前帯状回は感覚認知や感情応答などさまざまな高次の脳機能をもつことが知られている1).ヒトにおけるイメージングや動物を用いた研究により,前帯状回が痛みや侵害の受容に関与すること,また,前帯状回が不安に関係することが示されている.前帯状回におけるシナプス伝達の亢進が不安および侵害の受容に寄与する可能性が考えられるが,これらがいかに相互作用するかについてのシナプスの機序は明らかにされていない.
長期増強(long-term potentiation:LTP)は中枢神経系における活動に依存的なシナプスの可塑性のおもなモデルであり,記憶および学習の分子機序と考えられている2).NMDA型グルタミン酸受容体を介するかどうかにより,2つのタイプの長期増強が報告されている3,4).海馬のCA1野において観察される長期増強はNMDA型グルタミン酸受容体の活性を必要とする一方3),海馬のCA3野に投射する苔状線維における長期増強はNMDA型グルタミン酸受容体に非依存的であることが知られている4).
これまでに,大脳皮質においてNMDA型グルタミン酸受容体の活性を介する後シナプスにおける長期増強の機序が多く研究されてきた1).前帯状回の後シナプスにおける長期増強はNMDA型グルタミン酸受容体の活性を必要とし,AMPA型グルタミン酸受容体を介することが明らかにされている1,5).また,神経損傷モデルにおいては,前帯状回のシナプス前終末におけるグルタミン酸の放出の増加やAMPA型グルタミン酸受容体の活性化など,興奮性のシナプス伝達の亢進が報告されている6).前帯状回においてAMPA型グルタミン酸受容体を抑制すると神経損傷モデルにおいて侵害刺激からの逃避行動が緩和されることから,前帯状回の後シナプスにおける長期増強が侵害の受容にかかわる可能性が示唆されている1,6).一方で,慢性疼痛により亢進するシナプス前終末におけるグルタミン酸の放出の機能的な意義は何なのか? この研究においては,前帯状回のシナプス前終末における長期増強の機序,および,不安と慢性疼痛との相互作用について調べた.
1.マウスの前帯状回のシナプス前終末における長期増強の確立と同定
これまで,おもに海馬や扁桃体においてシナプス前終末における長期増強の機序が研究されてきたが4,7),大脳皮質のシナプス前終末における長期増強の機序は不明であった.8~12週齢の成体のマウスから脳の冠状断の切片を作製し,ピクロトキシンによりGABAA受容体を拮抗した状態で,前帯状回のII層/III層の錐体細胞からパッチクランプ記録を行った5,6).電圧を-60 mVに固定し,V層/VI層に留置した刺激用の電極を用いて誘発性興奮性シナプス後電流を記録した.シナプス前終末の変化を観察するため,50 msの間隔でペアとなるパルスをあたえて2つの誘発性興奮性シナプス後電流の振幅の比を測定した.記録が安定した細胞に電圧を-60 mVに固定した状態で2 Hz,2分間の低頻度の刺激をあたえたところ,誘発性興奮性シナプス後電流の振幅の有意な増大が観察された.また,ペアとなるパルスをあたえたときの振幅の比は低頻度の刺激ののち有意に抑制された.一方,対照においては,誘発性興奮性シナプス後電流の振幅およびペアとなるパルスをあたえたときの振幅の比に変化はなかった.さらに,NMDA型グルタミン酸受容体,代謝型グルタミン酸受容体,後シナプスにおけるCa2+経路がこのシナプス前終末における長期増強に関与するかどうかを薬理学的に検討した結果,これらには依存しないことが明らかにされた.
2.シナプス前終末における長期増強の機序
海馬においては,カイニン酸型グルタミン酸受容体がシナプス前終末においてはたらきシナプス伝達や長期増強に役割を担うことが示されている4,8).前帯状回のシナプス前終末における長期増強にカイニン酸型グルタミン酸受容体GluK1およびGluK2が関与するかどうか検討した.GluK1のノックアウトマウスでは野生型のマウスと比べシナプス前終末における長期増強が有意に抑制された一方,GluK2のノックアウトマウスではシナプス前終末における長期増強は正常であった.
長期増強にプロテインキナーゼAの関与することが知られている4,7).そこで,前帯状回のシナプス前終末における長期増強がプロテインキナーゼA経路に依存しているかどうかを薬理学的に調べたところ,プロテインキナーゼAの阻害薬はシナプス前終末における長期増強を有意に抑制した.
哺乳類においては9種類のアデニル酸シクラーゼが知られており,アデニル酸シクラーゼ1およびアデニル酸シクラーゼ8がそのおもなサブタイプであることから1,6),これらがシナプス前終末における長期増強に関与するかどうか調べた.アデニル酸シクラーゼ1のノックアウトマウスは野生型のマウスと比べシナプス前終末における長期増強を有意に抑制した一方,アデニル酸シクラーゼ8のノックアウトマウスではシナプス前終末における長期増強は正常であった.
以上のことから,前帯状回のシナプス前終末における長期増強には,カイニン酸型グルタミン酸受容体GluK1およびアデニル酸シクラーゼ1を介したプロテインキナーゼA経路の活性が必要であることがわかった(図1).
3.慢性疼痛モデルにおいてはシナプス前終末における長期増強が消失する
前帯状回はさまざまな高次の脳機能をもち,たとえば,恐怖,不安,痛みにおいて重要な役割をはたすが1,5,9),シナプスのレベルにおけるその機序は不明であった.そこで,前帯状回のシナプス前終末における長期増強が痛みや恐怖に関与するかどうか検討した.
非侵害刺激と前帯状回シナプス前終末における長期増強との関係について調べた.機械刺激に対し逃避行動を示したマウスの前帯状回からシナプス前終末における長期増強の記録を行ったところ正常であった.40℃の温刺激を60秒間あたえたマウスも正常なシナプス前終末における長期増強を示した.急性侵害刺激と前帯状回シナプス前終末における長期増強との関係についても検討し,55℃の熱刺激をあたえて逃避行動を示したマウスの前帯状回からシナプス前終末における長期増強の記録を行ったが正常であった.
2種類の慢性疼痛モデルを用いて実験を行った.右後肢に完全フロイントアジュバントを投与して2~3日のちの慢性炎症モデルの帯状回からシナプス前終末における長期増強の記録を行った結果,長期増強は消失していた.末梢における神経損傷モデルを作製し7~8日のちにシナプス前終末における長期増強の記録を行ったところ,長期増強は消失していた.慢性疼痛モデルが前帯状回シナプス前終末におけるグルタミン酸の放出を促進するという報告とあわせて考えると,慢性疼痛モデルはシナプス前終末がすでに活性化しているため,シナプス前終末におけるこれ以上の長期増強が起こらない可能性が考えられた.恐怖の学習と前帯状回シナプス前終末における長期増強との関係についても検討した.恐怖の条件づけをあたえた直後および2~3日のちのマウスを用いてシナプス前終末における長期増強の記録を行ったところ,正常であった.
以上のことから,慢性疼痛が前帯状回のシナプス前終末における長期増強にかかわる一方,恐怖の学習は影響しないことが明らかにされた.
4.過分極活性化環状ヌクレオチド依存性チャネルはシナプス前終末における長期増強にかかわる
前帯状回は視床から入力をうけることが知られ.また,過分極活性化環状ヌクレオチド依存性チャネルは海馬のCA3野においてシナプス前終末にはたらきシナプス伝達の制御に関係することが報告されている10).まず,ウェスタンブロット法により,過分極活性化環状ヌクレオチド依存性チャネルが前帯状回および視床において発現していることが確認され,さらに,電子顕微鏡を用いて,過分極活性化環状ヌクレオチド依存性チャネルが前帯状回のシナプス前終末および後シナプスに局在することが観察された.過分極活性化環状ヌクレオチド依存性チャネルは過分極誘発性陽イオン電流の発生にかかわることが知られている10).パッチクランプ記録法を用いて前帯状回に投射する視床細胞から過分極誘発性陽イオン電流を記録した.逆行性トレーサーDiIを前帯状回に投与し,3日のちに脳の冠状断の切片を作製した.DiI陽性およびDiI陰性の視床細胞,前帯状回のII層/III層の錐体細胞において観察した結果,前帯状回に投射する視床細胞は有意に大きな過分極誘発性陽イオン電流を示した.
過分極活性化環状ヌクレオチド依存性チャネルが前帯状回のシナプス前終末における長期増強に関与するかどうか調べた.過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬はシナプス前終末における長期増強の誘導および維持を抑制したことから,過分極活性化環状ヌクレオチド依存性チャネルは前帯状回のシナプス前終末における長期増強にかかわることが明らかにされた(図1).
神経の損傷による前帯状回におけるシナプス前終末の亢進,および,過分極活性化環状ヌクレオチド依存性チャネルに対する特異性について検討した.c-fos遺伝子は細胞の活性に依存的に発現する遺伝子である6).筆者らは,c-fos遺伝子の発現が活性化するとGFPにより蛍光を示すトランスジェニックマウスを用いて,神経損傷モデルにおいて前帯状回にてc-fos遺伝子の発現が活性化していることを報告している6).過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬は神経損傷モデルにおいてc-fos遺伝子の発現が活性化した細胞における誘発性興奮性シナプス後電流の振幅を有意に抑制し,ペアとなるパルスをあたえたときの振幅の比にも有意な変化が観察された.一方,過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬は神経損傷モデルおよび対照においてc-fos遺伝子の発現が活性化していない細胞には影響しなかった.以上のことから,過分極活性化環状ヌクレオチド依存性チャネルは神経の損傷により活性化した前帯状回におけるシナプス前終末の制御にかかわることが明らかにされた.
5.不安様の行動はシナプス前終末における長期増強を抑制する
不安と前帯状回シナプス前終末における長期増強との関係について検討した.不安様の行動の評価に用いられる実験法のひとつに高架式十字迷路法がある.高架式十字迷路は2つの壁のない走行路(不安を感じる場所)と,2つの壁のある走行路(安全な場所)から構成され,高所がマウスの不安様の行動を誘発すると考えられている.マウスを高架式十字迷路に5分間おいたのち,すばやく脳の冠状断の切片を作製した.対象となるマウスに前帯状回にシナプス前終末における長期増強を誘導するような刺激をあたえても長期増強は発生しなかった.一方,壁のある走行路におかれたマウスは正常なシナプス前終末における長期増強を示した.さらに,壁のない走行路におかれたマウスはシナプス前終末における長期増強の有意な抑制を示した.これらの結果は,前帯状回シナプス前終末が不安様の行動に関与するという以前の報告とあわせて考えると,不安様の行動により前帯状回シナプス前終末がすでに活性化しているため,シナプス前終末におけるこれ以上の長期増強が起こらない可能性が考えられた.壁のない走行路におかれたマウスをもとのケージにもどし,1時間後および9時間後に切片を作製した.その結果,シナプス前終末における長期増強の振幅が時間に依存して回復したことから,不安な環境への暴露によるシナプス前終末における長期増強の抑制は時間に依存的であり,急性期に観察されることが示された.不安と後シナプスにおける長期増強の関係についても調べたが,壁のない走行路におかれたマウスにおいても正常な後シナプスにおける長期増強の発現が示された.
以上のことから,シナプス前終末における長期増強が不安様の行動にかかわる一方,後シナプスにおける長期増強は関与しないことが明らかにされた.
6.前帯状回の過分極活性化環状ヌクレオチド依存性チャネルは慢性疼痛がひき起こす不安様の行動に関与する
前帯状回において過分極活性化環状ヌクレオチド依存性チャネルを抑制すると慢性疼痛によりひき起こされる不安様の行動は緩和されるかどうか,行動薬理学的な実験法により検討した.不安様の行動の評価には,高架式十字迷路法およびオープンフィールド法を用いた.その結果,神経損傷モデルマウスは対照となるマウスと比べ有意に不安様の行動の増加を示した11).神経の損傷により不安様の行動の増加したマウスの前帯状回に過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬を投与した結果,不安様の行動の増加は緩和された.さらに,過分極活性化環状ヌクレオチド依存性チャネルの拮抗薬の前帯状回への投与は,神経の損傷による機械刺激に対する逃避行動の閾値も有意に改善した.
筆者らは,先行研究において,プロテインキナーゼMζが前帯状回の後シナプスにおける長期増強にかかわることを報告している6).また,プロテインキナーゼMζの阻害薬を前帯状回に投与すると,神経の損傷による機械刺激に対する逃避行動の閾値が改善することも示している6).そこで,前帯状回の後シナプスが神経の損傷による不安様の行動にかかわるかどうか検討した結果,プロテインキナーゼζの阻害薬を前帯状回に投与しても神経の損傷による不安様の行動に変化はなかった.
これらの結果から,神経の損傷による不安様の行動には前帯状回の過分極活性化環状ヌクレオチド依存性チャネルがかかわること.また,前帯状回の後シナプスは関与していない可能性が示唆された.
おわりに
今回,筆者らは,前帯状回のシナプス前終末に着目し不安と慢性疼痛との関係について研究した結果,不安様の行動および慢性疼痛が前帯状回のシナプス前終末における長期増強において共存することが明らかにされた.前帯状回のシナプス前終末における長期増強が不安様の行動にかかわり,後シナプスはおもに侵害刺激からの逃避行動に関与するというシナプスの機序の一端が明らかにされた.さらに,過分極活性化環状ヌクレオチド依存性チャネルはおもにシナプス前終末においてはたらき,慢性疼痛および不安様の行動を制御している可能性が示された.しかしながら,過分極活性化環状ヌクレオチド依存性チャネルは前帯状回の後シナプスにも発現していることから,そこでも役割をもつ可能性は残っている.したがって,前帯状回における過分極活性化環状ヌクレオチド依存性チャネルの詳細な機序の解明は今後の課題である.今回の研究で得られた前帯状回のシナプス前終末における長期増強の機序の解明が進み,将来,不安や慢性疼痛に対する治療薬の評価や開発に役だつことを期待している.
文 献
- Zhuo, M.: Cortical excitation and chronic pain. Trends Neurosci., 31, 199-207 (2008)[PubMed]
- Bliss, T. V. & Collingridge, G. L.: A synaptic model of memory: long-term potentiation in the hippocampus. Nature, 361, 31-39 (1993)[PubMed]
- Bliss, T. V. & Collingridge, G. L.: Expression of NMDA receptor-dependent LTP in the hippocampus: bridging the divide. Mol. Brain, 6, 1-14 (2013)[PubMed]
- Nicoll, R. A. & Schmitz, D.: Synaptic plasticity at hippocampal mossy fibre synapses. Nat. Rev. Neurosci., 6, 863-876 (2005)[PubMed]
- Zhao, M. G., Toyoda, H., Lee, Y. S. et al.: Roles of NMDA NR2B subtype receptor in prefrontal long-term potentiation and contextual fear memory. Neuron, 47, 859-872 (2005)[PubMed]
- Li, X. Y., Ko, H. G., Chen, T. et al.: Alleviating neuropathic pain hypersensitivity by inhibiting PKMζ in the anterior cingulate cortex. Science, 330, 1400-1404 (2010)[PubMed]
- Shin, R. M., Tully, K., Li, Y. et al.: Hierarchical order of coexisting pre- and postsynaptic forms of long-term potentiation at synapses in amygdala. Proc. Natl. Acad. Sci. USA, 107, 19073-19078 (2010)[PubMed]
- Bortolotto, Z. A., Clarke, V. R., Delany, C. M. et al.: Kainate receptors are involved in synaptic plasticity. Nature, 402, 297-301 (1999)[PubMed]
- Frankland, P. W., Bontempi, B., Talton, L. E. et al.: The involvement of the anterior cingulate cortex in remote contextual fear memory. Science, 304, 881-883 (2004)[PubMed]
- Mellor, J., Nicoll, R. A., Schmitz, D.: Mediation of hippocampal mossy fiber long-term potentiation by presynaptic Ih channels. Science, 295, 143-147 (2002)[PubMed]
- Matsuzawa-Yanagida, K., Narita, M., Nakajima, M. et al.: Usefulness of antidepressants for improving the neuropathic pain-like state and pain-induced anxiety through actions at different brain sites. Neuropsychopharmacology. 33, 1952-1265 (2001)[PubMed]
著者プロフィール
略歴:2007年 九州大学大学院医学研究科博士課程 修了,同年 同 博士研究員,2008年 熊本健康保健科学大学 博士研究員を経て,2009年よりカナダToronto大学 博士研究員.
研究テーマ:感覚入力がいかに情動を形成するかをシナプスのレベルで理解する.
関心事:料理はじめました.
Min Zhuo
カナダToronto大学Professor.
研究室URL:http://www.individual.utoronto.ca/zhuo/
© 2015 古賀浩平・Min Zhuo Licensed under CC 表示 2.1 日本