メモリーCD4陽性T細胞の長期の生存を制御するNotchシグナル
前川洋一・安友康二
(徳島大学大学院ヘルスバイオサイエンス研究部 生体防御医学分野)
email:安友康二
DOI: 10.7875/first.author.2015.004
Notch controls the survival of memory CD4+ T cells by regulating glucose uptake.
Yoichi Maekawa, Chieko Ishifune, Shin-ichi Tsukumo, Katsuto Hozumi, Hideo Yagita, Koji Yasutomo
Nature Medicine, 21, 55-61 (2015)
CD4陽性T細胞は同一の病原体による再感染から生体を守るメモリーCD4陽性T細胞へと分化する.一方,自己抗原に対し反応するメモリーCD4陽性T細胞は組織や臓器に長くとどまり自己の損傷をひき起こす.メモリーCD4陽性T細胞が維持される機構については依然として不明な点が多い.筆者らは,Notchシグナルの伝達に必須のタンパク質であるRbpjが欠損すると,メモリーCD4陽性T細胞の生存が障害されることを見い出した.また,自己免疫疾患モデルの一種である実験的自己免疫性脳脊髄炎マウスにNotchシグナル阻害剤を投与したところ,メモリーCD4陽性T細胞の数が減少し,実験的自己免疫性脳脊髄炎の再発が阻止された.Rbpjを欠損したメモリーCD4陽性T細胞はインスリンの刺激などに対しAKTのリン酸化が起こらず,グルコース輸送体であるGlut1の発現を上昇させることができないため,細胞にグルコースを十分に取り込むことができなかった.グルコースの取り込み機構の障害を迂回するためにグルコースの代謝産物であるピルビン酸を投与したところ,Notchシグナルの欠失による自己反応性のメモリーCD4陽性T細胞の減少が抑制された.このことは,メモリーCD4陽性T細胞の生存はグルコースの代謝に依存することを示唆した.これらの知見は,メモリーCD4陽性T細胞の維持において,グルコース取り込みの制御を介しNotchシグナルが中心的な役割をはたしていることを示した.
CD4陽性T細胞はT細胞受容体によりMHCクラスII分子に提示された特異的な抗原を認識すると,エフェクターCD4陽性T細胞あるいはメモリーCD4陽性T細胞への分化を開始する1,2).エフェクターCD4陽性T細胞は短命であるのに対し,メモリーCD4陽性T細胞は骨髄のようなリンパ組織や臓器に定着しより長期間にわたり生存し,同一の病原体による再感染の際に重要な役割を担う3).一方,自己反応性をもつなど病的なメモリーCD4陽性T細胞の持続的な存在は生体にとり有害である.そのことから,メモリーCD4陽性T細胞が未感作のCD4陽性T細胞あるいはエフェクターCD4陽性T細胞と比較して長期間にわたり生存することのできる分子基盤の解明が重要なポイントになる.最近の報告から,脂肪酸の代謝がメモリーCD8陽性T細胞の生存に深く関与していることが明らかにされている4,5).しかし,メモリーCD4陽性T細胞の維持においてどのような代謝経路が関与しているのかについて,その詳細は不明であった.
Notchシグナルは種々の細胞分化や細胞系譜の決定を制御している.細胞の表面に表出しているNotchはリガンドと結合するとその細胞内ドメインが切断され核へと移行する.移行した細胞内ドメインは転写因子であるRbpjと結合し標的遺伝子の発現を制御する.筆者らおよびほかのグループの研究により,NotchシグナルはT細胞の発生や分化におけるさまざまな過程において重要であることが明らかにされている6,7).しかし,CD4陽性メモリーT細胞の制御におけるNotchシグナルの関与については,いまだ確認されていない.
免疫応答の際に,CD4陽性T細胞は抗原に特異的なクローンが選択的に活性化され一過性に増殖する.増殖したCD4陽性T細胞のクローンの一部分はメモリーCD4陽性T細胞として長期間にわたり生存すると考えられており,メモリーCD4陽性T細胞は同じ抗原により再刺激をうけるとすみやかに増殖する機能をもつ.このようなメモリーCD4陽性T細胞の再増殖が免疫記憶の鍵になる.
Notchシグナルの欠失したRbpjノックアウトマウスにおいて,抗原に特異的なCD4陽性T細胞の再活性化について継時的に解析した.その結果,免疫ののちの早期には正常であった抗原に特異的なCD4陽性T細胞の再増殖が,免疫ののち長期間が経過するにしたがい徐々に消失した.
CD4陽性T細胞において,Notchシグナルが細胞の生存に関与するかどうかを直接的に解析した.抗原に特異的なCD4陽性T細胞の生体における動態を解析するため,卵白アルブミンに対し特異的なT細胞受容体を遺伝子導入したマウスに由来するCD4陽性T細胞を用いた.野生型マウスおよびRbpjノックアウトマウスから得たCD4陽性T細胞を同じ数だけレシピエントマウスに移入したのち卵白アルブミンを免疫し,CD4陽性T細胞の数を継時的に解析してその比率を算出した.Rbpjを欠損したメモリーCD4陽性T細胞は免疫ののちの早期には野生型のCD4陽性T細胞と同様の数であったが,そののち,継時的に細胞数の顕著な減少が認められた.また,Ly6Cの発現を指標としてメモリーCD4陽性T細胞を解析したところ,Rbpjノックアウトマウスでは野生型マウスと比べ細胞数が著明に減少した.これらのことから,メモリーCD4陽性T細胞においてNotchシグナルは細胞の長期間にわたる生存に必須であることが証明された.NotchにはNotch1~Notch4の4種類があるが,メモリーCD4陽性T細胞の長期の生存にはNotch1およびNotch2の2つが必要であることも明らかにされた.
メモリーCD4陽性T細胞の長期の生存をささえるNotchシグナルに関連する微小環境についても,その一部が明らかにされた.メモリーCD4陽性T細胞の一部は骨髄において長期間にわたり生存することが報告されている8).5種類のNotchのリガンドのうち,Dll1は骨髄に存在するCD11c陽性細胞に発現している.CD11c陽性細胞でのみDll1を欠損させたマウスでは,脾臓におけるメモリーCD4陽性T細胞の定着および生存に影響はなかったが,骨髄においてメモリーCD4陽性T細胞の比率が低下していた.このことから,骨髄においては,CD11c陽性細胞の発現するDll1により刺激されるNotchシグナルがメモリーCD4陽性T細胞の定着および生存を制御していることが明らかになった.一方,脾臓やリンパ節,あるいは,さまざまな臓器において,メモリーCD4陽性T細胞はどのようなNotchシグナルに関連する微小環境にささえられ生存しているのかは依然として不明である.
NotchシグナルによるメモリーCD4陽性T細胞の生存が疾患モデルにおいても機能しているかどうか検討した.メモリーCD4陽性T細胞は細菌や寄生虫の再感染の際にすみやかに反応しこれらを排除する.リーシュマニア原虫の感染においては,Th1型のCD4陽性T細胞の応答が抵抗性に必須であることが知られている.Rbpjノックアウトマウスにリーシュマニア原虫を感染させたところ,1回目の感染の際に獲得した抵抗性が再感染において発揮されず,リーシュマニア原虫を排除できなった.つまり,Notchシグナルが欠失することによりリーシュマニア原虫に対するメモリーCD4陽性T細胞の生存が障害され,再感染に対する抵抗性が維持されなかったと考えられた.
自己免疫疾患においては自己反応性のメモリーCD4陽性T細胞が長期間にわたり生存し,自己の組織や臓器を慢性的に傷害する.自己免疫疾患のひとつ多発性硬化症では再発と寛解をくり返すが,再発には自己反応性のメモリーCD4陽性T細胞の再活性化が関与していると考えられる.自己免疫疾患モデルの一種である実験的自己免疫性脳脊髄炎モデルにおいて,自己反応性のメモリーCD4陽性T細胞におけるNotchシグナルの関与について検討した.実験的自己免疫性脳脊髄炎はマウスにミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドを特定の方法で免疫することにより誘導することができる.また,実験的自己免疫性脳脊髄炎を発症したマウスから分離したCD4陽性T細胞により一過性に実験的自己免疫性脳脊髄炎を移入することができ,さらに,そののち,ミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドを投与すると実験的自己免疫性脳脊髄炎を再発させることもできる.これは,自己反応性のメモリーCD4陽性T細胞が生体において長期間にわたり生存していることを意味する.
ミエリンオリゴデンドロサイト糖タンパク質に対し特異的なCD4陽性T細胞を移入したマウスにNotchシグナル阻害剤を投与したところ,実験的自己免疫性脳脊髄炎を再発させることができなかった.また,Notchシグナル阻害剤の投与により,移入したCD4陽性T細胞の数がいちじるしく減少した.このことから,自己免疫疾患に関連する自己反応性のメモリーCD4陽性T細胞の生存にもNotchシグナルが関与することが明らかになった.
Notchシグナルがどのような分子機構によりメモリーCD4陽性T細胞の生存および維持を制御しているのか検討した.メモリーCD4陽性T細胞の維持にはインターロイキン7などの生存性サイトカインが重要であることが報告されていたため,インターロイキン7シグナル伝達経路について解析した.インターロイキン7受容体の発現やその下流のStat5のリン酸化について検討したが,いずれもRbpjを欠損したメモリーCD4陽性T細胞において差異は認められなかった.さらに,恒常活性型のStat5の導入により,Rbpjを欠損したメモリーCD4陽性T細胞の著減を回復させることはできなかった.また,Notchシグナルの欠失による抗アポトーシス遺伝子の発現への影響は認められなかった.さらに,ラパマイシンの投与により,Rbpjを欠損したメモリーCD4陽性T細胞の著減を回復させることはできなかった.
NotchシグナルはT細胞の発生する時期にグルコースの取り込みに関与しているとの報告があったことから9),メモリーCD4陽性T細胞へのグルコースの取り込みについて検討した.Rbpjを欠損したメモリーCD4陽性T細胞は抗原による刺激ののちの早期には,野生型のCD4陽性T細胞と同等のグルコース取り込み能を示したが,細胞数の減少が顕著となる免疫から16日目にはグルコースの取り込みが有意に低下した.グルコースの取り込みの不全が細胞数の著減の原因であるかどうか検証するため,グルコースの代謝産物であるピルビン酸を作用させることによりグルコースの取り込み機構の障害を迂回し,細胞数の減少を回復できるかどうか検討した.卵白アルブミンに特異的なCD4陽性T細胞の移入実験において免疫8日目から1週間にわたりピルビン酸を投与したところ,Rbpjを欠損したメモリーCD4陽性T細胞の減少に回復が認められた.また,実験的自己免疫性脳脊髄炎の移入実験においてNotchシグナル阻害剤とともにピルビン酸を投与したところ,メモリーCD4陽性T細胞の減少が回復し,実験的自己免疫性脳脊髄炎を再発させることもできた.
メモリーCD4陽性T細胞において解糖系を中心としたエネルギー代謝について検討した.その結果,野生型マウスとRbpjノックアウトマウスとでメモリーCD4陽性T細胞における基礎的な解糖系に有意な差は認められなかった.一方,Rbpjを欠損したメモリーCD4陽性T細胞においては,インスリンによるグルコース取り込みの促進にともなう解糖系の亢進がまったく観察されなかった.このことから,Rbpjを欠損したメモリーCD4陽性T細胞には誘導性のグルコース取り込みに障害のあることが予想された.グルコース輸送体であるGlut1の発現について検討したところ,野生型マウスにおいてはインスリンの刺激に対しGlut1の発現が上昇したが,Rbpjノックアウトマウスにおいては発現の上昇は観察されなかった.そこで,インスリン受容体の下流のシグナル伝達経路について解析したところ,Rbpjを欠損したメモリーCD4陽性T細胞ではAKTのリン酸化が十分に起こっていないことがわかった.また,Rbpjを欠損したメモリーCD4陽性T細胞に活性型のAKTを導入したところ細胞数の減少を抑制した.このことから,Rbpjを欠損したメモリーCD4陽性T細胞における細胞数の著減の原因として,AKTの不十分な活性化にともなうグルコースの取り込みの不全によるエネルギー不足が考えられた.
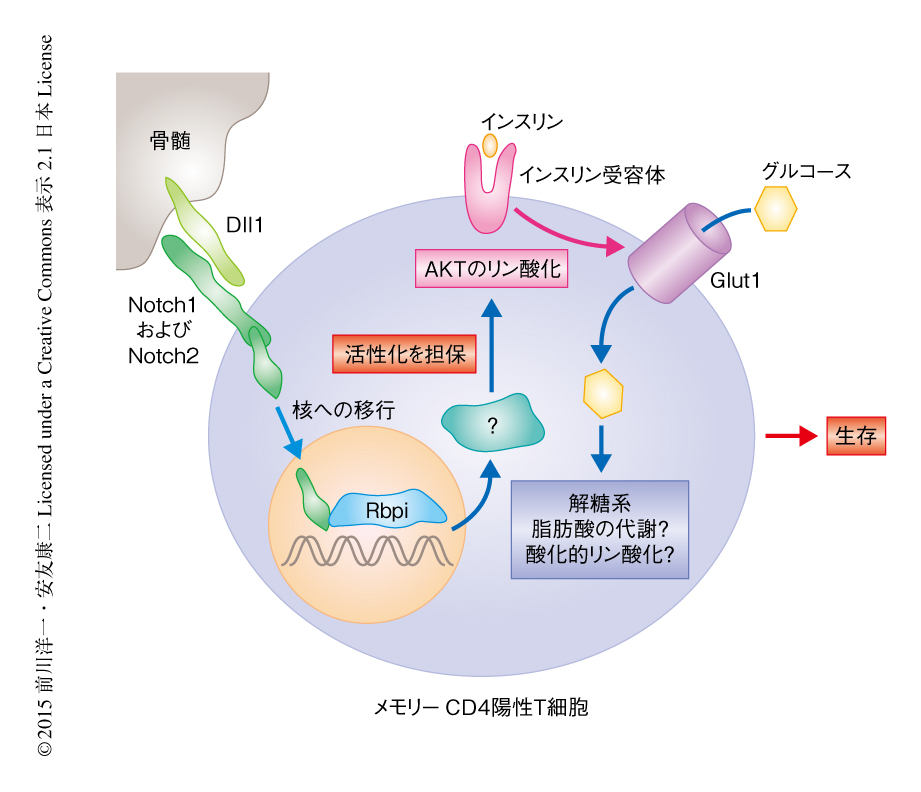
この論文において,筆者らは,メモリーCD4陽性T細胞の長期の生存においてNotchシグナルが重要であること,NotchシグナルはAKTの活性化を担保することによりグルコースの取り込みを制御しメモリーCD4陽性T細胞におけるエネルギー代謝を制御していることを明らかにした(図1).メモリーCD8陽性T細胞の生存には脂肪酸の代謝によるエネルギーの供給が重要であるとのコンセンサスが得られつつある一方4,5),メモリーCD8陽性T細胞は細胞外の脂肪酸を直接に使うのではなく,細胞外のグルコースを使って脂肪酸の酸化および酸化的リン酸化を支持しているとの報告がある10).今回の筆者らの報告をあわせると,メモリーT細胞の維持にはグルコースの代謝が必要であり,その制御をNotchシグナルが担っているのではないかと考えられる.NotchシグナルがどのようにAKTのリン酸化を担保しているのかについては依然として不明であり,今後の検討が必要である.
メモリーCD4陽性T細胞はたび重なる感染による脅威を防ぐうえで欠くことはできない.一方,自己反応性のメモリーCD4陽性T細胞が長期間にわたり存続することにより自己の組織や臓器が傷害される.それゆえ,メモリーCD4陽性T細胞の増殖および生存を適切に制御する方法の確立が必要である.この論文は,Notchシグナルあるいはグルコース代謝の制御が有害な自己反応性のメモリーCD4陽性T細胞の除去,また,ワクチン効果の長期の維持を可能にする新たな方策になることを示した.
略歴:1997年 徳島大学大学院医学研究科博士課程 修了,同年 徳島大学医学部 助手,同 講師,同 准教授を経て,2012年より岐阜大学大学院医学系研究科 教授.
研究テーマ:寄生虫による感染症の克服にむけた宿主における免疫記憶機構の解明.
安友 康二(Koji Yasutomo)
徳島大学大学院ヘルスバイオサイエンス研究部 教授.
研究室URL:http://immunology.hosp.med.tokushima-u.ac.jp/immunology/system/top/
© 2015 前川洋一・安友康二 Licensed under CC 表示 2.1 日本
(徳島大学大学院ヘルスバイオサイエンス研究部 生体防御医学分野)
email:安友康二
DOI: 10.7875/first.author.2015.004
Notch controls the survival of memory CD4+ T cells by regulating glucose uptake.
Yoichi Maekawa, Chieko Ishifune, Shin-ichi Tsukumo, Katsuto Hozumi, Hideo Yagita, Koji Yasutomo
Nature Medicine, 21, 55-61 (2015)
要 約
CD4陽性T細胞は同一の病原体による再感染から生体を守るメモリーCD4陽性T細胞へと分化する.一方,自己抗原に対し反応するメモリーCD4陽性T細胞は組織や臓器に長くとどまり自己の損傷をひき起こす.メモリーCD4陽性T細胞が維持される機構については依然として不明な点が多い.筆者らは,Notchシグナルの伝達に必須のタンパク質であるRbpjが欠損すると,メモリーCD4陽性T細胞の生存が障害されることを見い出した.また,自己免疫疾患モデルの一種である実験的自己免疫性脳脊髄炎マウスにNotchシグナル阻害剤を投与したところ,メモリーCD4陽性T細胞の数が減少し,実験的自己免疫性脳脊髄炎の再発が阻止された.Rbpjを欠損したメモリーCD4陽性T細胞はインスリンの刺激などに対しAKTのリン酸化が起こらず,グルコース輸送体であるGlut1の発現を上昇させることができないため,細胞にグルコースを十分に取り込むことができなかった.グルコースの取り込み機構の障害を迂回するためにグルコースの代謝産物であるピルビン酸を投与したところ,Notchシグナルの欠失による自己反応性のメモリーCD4陽性T細胞の減少が抑制された.このことは,メモリーCD4陽性T細胞の生存はグルコースの代謝に依存することを示唆した.これらの知見は,メモリーCD4陽性T細胞の維持において,グルコース取り込みの制御を介しNotchシグナルが中心的な役割をはたしていることを示した.
はじめに
CD4陽性T細胞はT細胞受容体によりMHCクラスII分子に提示された特異的な抗原を認識すると,エフェクターCD4陽性T細胞あるいはメモリーCD4陽性T細胞への分化を開始する1,2).エフェクターCD4陽性T細胞は短命であるのに対し,メモリーCD4陽性T細胞は骨髄のようなリンパ組織や臓器に定着しより長期間にわたり生存し,同一の病原体による再感染の際に重要な役割を担う3).一方,自己反応性をもつなど病的なメモリーCD4陽性T細胞の持続的な存在は生体にとり有害である.そのことから,メモリーCD4陽性T細胞が未感作のCD4陽性T細胞あるいはエフェクターCD4陽性T細胞と比較して長期間にわたり生存することのできる分子基盤の解明が重要なポイントになる.最近の報告から,脂肪酸の代謝がメモリーCD8陽性T細胞の生存に深く関与していることが明らかにされている4,5).しかし,メモリーCD4陽性T細胞の維持においてどのような代謝経路が関与しているのかについて,その詳細は不明であった.
Notchシグナルは種々の細胞分化や細胞系譜の決定を制御している.細胞の表面に表出しているNotchはリガンドと結合するとその細胞内ドメインが切断され核へと移行する.移行した細胞内ドメインは転写因子であるRbpjと結合し標的遺伝子の発現を制御する.筆者らおよびほかのグループの研究により,NotchシグナルはT細胞の発生や分化におけるさまざまな過程において重要であることが明らかにされている6,7).しかし,CD4陽性メモリーT細胞の制御におけるNotchシグナルの関与については,いまだ確認されていない.
1.Notchシグナルの欠失したメモリーCD4陽性T細胞は長期の生存ができない
免疫応答の際に,CD4陽性T細胞は抗原に特異的なクローンが選択的に活性化され一過性に増殖する.増殖したCD4陽性T細胞のクローンの一部分はメモリーCD4陽性T細胞として長期間にわたり生存すると考えられており,メモリーCD4陽性T細胞は同じ抗原により再刺激をうけるとすみやかに増殖する機能をもつ.このようなメモリーCD4陽性T細胞の再増殖が免疫記憶の鍵になる.
Notchシグナルの欠失したRbpjノックアウトマウスにおいて,抗原に特異的なCD4陽性T細胞の再活性化について継時的に解析した.その結果,免疫ののちの早期には正常であった抗原に特異的なCD4陽性T細胞の再増殖が,免疫ののち長期間が経過するにしたがい徐々に消失した.
CD4陽性T細胞において,Notchシグナルが細胞の生存に関与するかどうかを直接的に解析した.抗原に特異的なCD4陽性T細胞の生体における動態を解析するため,卵白アルブミンに対し特異的なT細胞受容体を遺伝子導入したマウスに由来するCD4陽性T細胞を用いた.野生型マウスおよびRbpjノックアウトマウスから得たCD4陽性T細胞を同じ数だけレシピエントマウスに移入したのち卵白アルブミンを免疫し,CD4陽性T細胞の数を継時的に解析してその比率を算出した.Rbpjを欠損したメモリーCD4陽性T細胞は免疫ののちの早期には野生型のCD4陽性T細胞と同様の数であったが,そののち,継時的に細胞数の顕著な減少が認められた.また,Ly6Cの発現を指標としてメモリーCD4陽性T細胞を解析したところ,Rbpjノックアウトマウスでは野生型マウスと比べ細胞数が著明に減少した.これらのことから,メモリーCD4陽性T細胞においてNotchシグナルは細胞の長期間にわたる生存に必須であることが証明された.NotchにはNotch1~Notch4の4種類があるが,メモリーCD4陽性T細胞の長期の生存にはNotch1およびNotch2の2つが必要であることも明らかにされた.
メモリーCD4陽性T細胞の長期の生存をささえるNotchシグナルに関連する微小環境についても,その一部が明らかにされた.メモリーCD4陽性T細胞の一部は骨髄において長期間にわたり生存することが報告されている8).5種類のNotchのリガンドのうち,Dll1は骨髄に存在するCD11c陽性細胞に発現している.CD11c陽性細胞でのみDll1を欠損させたマウスでは,脾臓におけるメモリーCD4陽性T細胞の定着および生存に影響はなかったが,骨髄においてメモリーCD4陽性T細胞の比率が低下していた.このことから,骨髄においては,CD11c陽性細胞の発現するDll1により刺激されるNotchシグナルがメモリーCD4陽性T細胞の定着および生存を制御していることが明らかになった.一方,脾臓やリンパ節,あるいは,さまざまな臓器において,メモリーCD4陽性T細胞はどのようなNotchシグナルに関連する微小環境にささえられ生存しているのかは依然として不明である.
NotchシグナルによるメモリーCD4陽性T細胞の生存が疾患モデルにおいても機能しているかどうか検討した.メモリーCD4陽性T細胞は細菌や寄生虫の再感染の際にすみやかに反応しこれらを排除する.リーシュマニア原虫の感染においては,Th1型のCD4陽性T細胞の応答が抵抗性に必須であることが知られている.Rbpjノックアウトマウスにリーシュマニア原虫を感染させたところ,1回目の感染の際に獲得した抵抗性が再感染において発揮されず,リーシュマニア原虫を排除できなった.つまり,Notchシグナルが欠失することによりリーシュマニア原虫に対するメモリーCD4陽性T細胞の生存が障害され,再感染に対する抵抗性が維持されなかったと考えられた.
2.自己反応性のメモリーCD4陽性T細胞の長期の生存と自己免疫
自己免疫疾患においては自己反応性のメモリーCD4陽性T細胞が長期間にわたり生存し,自己の組織や臓器を慢性的に傷害する.自己免疫疾患のひとつ多発性硬化症では再発と寛解をくり返すが,再発には自己反応性のメモリーCD4陽性T細胞の再活性化が関与していると考えられる.自己免疫疾患モデルの一種である実験的自己免疫性脳脊髄炎モデルにおいて,自己反応性のメモリーCD4陽性T細胞におけるNotchシグナルの関与について検討した.実験的自己免疫性脳脊髄炎はマウスにミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドを特定の方法で免疫することにより誘導することができる.また,実験的自己免疫性脳脊髄炎を発症したマウスから分離したCD4陽性T細胞により一過性に実験的自己免疫性脳脊髄炎を移入することができ,さらに,そののち,ミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドを投与すると実験的自己免疫性脳脊髄炎を再発させることもできる.これは,自己反応性のメモリーCD4陽性T細胞が生体において長期間にわたり生存していることを意味する.
ミエリンオリゴデンドロサイト糖タンパク質に対し特異的なCD4陽性T細胞を移入したマウスにNotchシグナル阻害剤を投与したところ,実験的自己免疫性脳脊髄炎を再発させることができなかった.また,Notchシグナル阻害剤の投与により,移入したCD4陽性T細胞の数がいちじるしく減少した.このことから,自己免疫疾患に関連する自己反応性のメモリーCD4陽性T細胞の生存にもNotchシグナルが関与することが明らかになった.
3.NotchシグナルによるメモリーCD4陽性T細胞におけるグルコース代謝の制御
Notchシグナルがどのような分子機構によりメモリーCD4陽性T細胞の生存および維持を制御しているのか検討した.メモリーCD4陽性T細胞の維持にはインターロイキン7などの生存性サイトカインが重要であることが報告されていたため,インターロイキン7シグナル伝達経路について解析した.インターロイキン7受容体の発現やその下流のStat5のリン酸化について検討したが,いずれもRbpjを欠損したメモリーCD4陽性T細胞において差異は認められなかった.さらに,恒常活性型のStat5の導入により,Rbpjを欠損したメモリーCD4陽性T細胞の著減を回復させることはできなかった.また,Notchシグナルの欠失による抗アポトーシス遺伝子の発現への影響は認められなかった.さらに,ラパマイシンの投与により,Rbpjを欠損したメモリーCD4陽性T細胞の著減を回復させることはできなかった.
NotchシグナルはT細胞の発生する時期にグルコースの取り込みに関与しているとの報告があったことから9),メモリーCD4陽性T細胞へのグルコースの取り込みについて検討した.Rbpjを欠損したメモリーCD4陽性T細胞は抗原による刺激ののちの早期には,野生型のCD4陽性T細胞と同等のグルコース取り込み能を示したが,細胞数の減少が顕著となる免疫から16日目にはグルコースの取り込みが有意に低下した.グルコースの取り込みの不全が細胞数の著減の原因であるかどうか検証するため,グルコースの代謝産物であるピルビン酸を作用させることによりグルコースの取り込み機構の障害を迂回し,細胞数の減少を回復できるかどうか検討した.卵白アルブミンに特異的なCD4陽性T細胞の移入実験において免疫8日目から1週間にわたりピルビン酸を投与したところ,Rbpjを欠損したメモリーCD4陽性T細胞の減少に回復が認められた.また,実験的自己免疫性脳脊髄炎の移入実験においてNotchシグナル阻害剤とともにピルビン酸を投与したところ,メモリーCD4陽性T細胞の減少が回復し,実験的自己免疫性脳脊髄炎を再発させることもできた.
メモリーCD4陽性T細胞において解糖系を中心としたエネルギー代謝について検討した.その結果,野生型マウスとRbpjノックアウトマウスとでメモリーCD4陽性T細胞における基礎的な解糖系に有意な差は認められなかった.一方,Rbpjを欠損したメモリーCD4陽性T細胞においては,インスリンによるグルコース取り込みの促進にともなう解糖系の亢進がまったく観察されなかった.このことから,Rbpjを欠損したメモリーCD4陽性T細胞には誘導性のグルコース取り込みに障害のあることが予想された.グルコース輸送体であるGlut1の発現について検討したところ,野生型マウスにおいてはインスリンの刺激に対しGlut1の発現が上昇したが,Rbpjノックアウトマウスにおいては発現の上昇は観察されなかった.そこで,インスリン受容体の下流のシグナル伝達経路について解析したところ,Rbpjを欠損したメモリーCD4陽性T細胞ではAKTのリン酸化が十分に起こっていないことがわかった.また,Rbpjを欠損したメモリーCD4陽性T細胞に活性型のAKTを導入したところ細胞数の減少を抑制した.このことから,Rbpjを欠損したメモリーCD4陽性T細胞における細胞数の著減の原因として,AKTの不十分な活性化にともなうグルコースの取り込みの不全によるエネルギー不足が考えられた.
おわりに
この論文において,筆者らは,メモリーCD4陽性T細胞の長期の生存においてNotchシグナルが重要であること,NotchシグナルはAKTの活性化を担保することによりグルコースの取り込みを制御しメモリーCD4陽性T細胞におけるエネルギー代謝を制御していることを明らかにした(図1).メモリーCD8陽性T細胞の生存には脂肪酸の代謝によるエネルギーの供給が重要であるとのコンセンサスが得られつつある一方4,5),メモリーCD8陽性T細胞は細胞外の脂肪酸を直接に使うのではなく,細胞外のグルコースを使って脂肪酸の酸化および酸化的リン酸化を支持しているとの報告がある10).今回の筆者らの報告をあわせると,メモリーT細胞の維持にはグルコースの代謝が必要であり,その制御をNotchシグナルが担っているのではないかと考えられる.NotchシグナルがどのようにAKTのリン酸化を担保しているのかについては依然として不明であり,今後の検討が必要である.
メモリーCD4陽性T細胞はたび重なる感染による脅威を防ぐうえで欠くことはできない.一方,自己反応性のメモリーCD4陽性T細胞が長期間にわたり存続することにより自己の組織や臓器が傷害される.それゆえ,メモリーCD4陽性T細胞の増殖および生存を適切に制御する方法の確立が必要である.この論文は,Notchシグナルあるいはグルコース代謝の制御が有害な自己反応性のメモリーCD4陽性T細胞の除去,また,ワクチン効果の長期の維持を可能にする新たな方策になることを示した.
文 献
- Castellino, F. & Germain, R. N.: Cooperation between CD4+ and CD8+ T cells: when, where, and how. Annu. Rev. Immunol., 24, 519-540 (2006)[PubMed]
- Reiner, S. L.: Decision making during the conception and career of CD4+ T cells. Nat. Rev. Immunol., 9, 81-82 (2009)[PubMed]
- Bevan, M. J.: Memory T cells as an occupying force. Eur. J. Immunol., 41, 1192-1195 (2011)[PubMed]
- Pearce, E. L., Walsh, M. C., Cejas, P. J. et al.: Enhancing CD8 T-cell memory by modulating fatty acid metabolism. Nature, 460, 103-107 (2009)[PubMed]
- Araki, K., Turner, A. P., Shaffer, V. O. et al.: mTOR regulates memory CD8 T-cell differentiation. Nature, 460, 108-112 (2009)[PubMed]
- Maekawa, Y., Minato, Y., Ishifune, C. et al.: Notch2 integrates signaling by the transcription factors RBP-J and CREB1 to promote T cell cytotoxicity. Nat. Immunol., 9, 1140-1147 (2008)[PubMed]
- Amsen, D., Blander, J. M., Lee, G. R. et al.: Instruction of distinct CD4 T helper cell fates by different notch ligands on antigen-presenting cells. Cell, 117, 515-526 (2004)[PubMed]
- Tokoyoda, K., Zehentmeier, S., Hegazy, A. N. et al.: Professional memory CD4+ T lymphocytes preferentially reside and rest in the bone marrow. Immunity, 30, 721-730 (2009)[PubMed]
- Ciofani, M. & Zuniga-Pflucker, J. C.: Notch promotes survival of pre-T cells at the β-selection checkpoint by regulating cellular metabolism. Nat. Immunol., 6, 881-888 (2005)[PubMed]
- O'Sullivan, D., van der Windt, G. J., Huang, S. C. et al.: Memory CD8+ T cells use cell-intrinsic lipolysis to support the metabolic programming necessary for development. Immunity, 41, 75-88 (2014)[PubMed]
著者プロフィール
略歴:1997年 徳島大学大学院医学研究科博士課程 修了,同年 徳島大学医学部 助手,同 講師,同 准教授を経て,2012年より岐阜大学大学院医学系研究科 教授.
研究テーマ:寄生虫による感染症の克服にむけた宿主における免疫記憶機構の解明.
安友 康二(Koji Yasutomo)
徳島大学大学院ヘルスバイオサイエンス研究部 教授.
研究室URL:http://immunology.hosp.med.tokushima-u.ac.jp/immunology/system/top/
© 2015 前川洋一・安友康二 Licensed under CC 表示 2.1 日本