T細胞の中枢性の自己寛容を生涯にわたり保証する胸腺の髄質上皮幹細胞の同定
瀬海美穂・濱崎洋子・湊 長博
(京都大学大学院医学研究科 免疫細胞生物学分野)
email:濱崎洋子
DOI: 10.7875/first.author.2015.003
Medullary thymic epithelial stem cells maintain a functional thymus to ensure lifelong central T cell tolerance.
Miho Sekai, Yoko Hamazaki, Nagahiro Minato
Immunity, 41, 753-761 (2014)
胸腺はT細胞の産生に必須の中枢リンパ組織であり,髄質および皮質からなる.胸腺の上皮細胞は組織の構築の中心を担うとともに,T細胞の産生のための主要な支持細胞として機能する.中枢性の自己寛容の成立に必須の役割をはたす髄質上皮細胞は,本来,胸腺には存在しない末梢のさまざまな組織に特異的な自己抗原を異所性に発現することにより,これら多くの自己抗原に対し反応しうるT細胞クローンの除去に寄与する.これまで,髄質上皮細胞を産生する発生の初期の髄質上皮前駆細胞の存在は示されていたが,成体におけるその維持の機構については明らかでなかった.この研究において,筆者らは,マウスの個体においてほぼ生涯にわたり機能的な髄質上皮細胞を供給しつづけ,かつ,自己複製能をもつ髄質上皮幹細胞を,胎生期の胸腺から同定した.また,髄質上皮幹細胞の移植により,胸腺の髄質の機能不全に起因する自己免疫疾患の発症を抑制しうることが示された.胸腺は青年期よりのち退縮し機能の低下する臓器であるが,髄質上皮幹細胞の活性は胎生期および新生仔期と比べ成体では顕著に低下していること,その一方で,T細胞の産生に障害のあるマウスでは髄質上皮幹細胞の活性は高く維持されていることも明らかにされた.以上の結果は,自己免疫疾患の発症機構の理解と治療法の開発に大きく貢献するとともに,免疫学の大きな謎のひとつである胸腺の退縮の機構やその意義の理解に新たな局面をひらくものである.
免疫系は非自己(病原体などの異物)を攻撃しそれを排除するとともに,自己(自分の組織など)を攻撃しない自己寛容のしくみをもつ.自己寛容が破綻したことにより起こるのが自己免疫疾患であるが,自己寛容の成立には,リンパ球の発生の過程において起こる中枢性の機構と,成熟したリンパ球が末梢組織において獲得する末梢性の機構とが存在し,この2つの機構は正常な免疫系の確立においてともに重要である.胸腺組織は免疫応答の司令塔であるT細胞の産生に必須の中枢リンパ組織であり,髄質および皮質からなる.皮質はおもに自己のMHC分子への反応性の獲得および幅広い抗原に反応しうるレパトアの形成を担い,髄質は中枢性の自己寛容の成立において中心的な役割をはたす.髄質および皮質においては主要な支持細胞として機能する上皮細胞が組織の骨格を形成しているが,髄質上皮細胞は本来は胸腺に発現しないような組織に特異的な自己抗原を発現し,同じ髄質に存在する樹状細胞と協調して未熟なT細胞に自己抗原を提示し,自己反応性のクローンを除去することにより自己寛容の成立に寄与することが知られている1).組織に特異的な自己抗原の発現には髄質上皮細胞の発現する核内タンパク質Aireが関与しており,その欠損や異常,および,髄質上皮細胞の分化の異常により,組織に特異的な自己抗原の発現が顕著に低下したヒトやマウスでは臓器に特異的な自己免疫疾患を発症することが知られている2,3).
これまで,中枢性の自己寛容の成立に必須の髄質上皮細胞を産生する“前駆細胞”は胸腺の発生の過程において同定されていたが4,5),髄質上皮細胞が個体の生涯にわたりどのように維持されるのかについてはよくわかっていなかった.組織を構成する細胞は,おのおのの組織により,幹細胞,前駆細胞から新たな細胞の産生,成熟した細胞の分裂,のいずれかの機構により維持されるが,髄質上皮細胞のターンオーバーは2~3週間と比較的速いことなどから6),幹細胞により維持されているのではないかと想定されてきた.しかしながら,自己複製能をもつとともに分化した子孫細胞を産生するという幹細胞の定義をみたす細胞は同定されていなかった.この研究では,以前に筆者らが報告した,胎生期の髄質上皮前駆細胞の画分がどのくらいの期間にわたり髄質上皮細胞を維持できるか,もし,長期にわたり維持できるとすればそのなかに幹細胞の定義をみたす細胞は存在するか,その移植により自己免疫疾患の発症を回避できるか,について検討することにより,髄質上皮幹細胞の存在について検証した.
以前に,筆者らは,胎生期の胸腺の原基において上皮細胞のあいだの密着結合に機能する接着分子であるクローディン3およびクローディン4を発現する一部の細胞が髄質上皮細胞を産生する前駆細胞であることを報告した5).この胎生期のクローディン陽性の髄質上皮前駆細胞の画分の長期的および機能的なポテンシャルを生体において検証するため,胸腺再構築実験系を確立した.この実験系は,胸腺を構成するすべての細胞(ホスト)をいちど酵素処理により分散させ,GFPなどにより標識した機能評価の対象となる細胞の画分(ドナー)をくわえたのち,再度,in vitroにおいて胸腺を再構成しマウスの腎被膜下に移植する.これにより,ドナーに由来する細胞がどのくらいの期間にわたり胸腺において維持されるか,また,移植した胸腺から産生されたT細胞が自己免疫疾患を起こすかどうか(自己反応性のT細胞が除去されているか)について,in vivoにおいて検証することが可能になった.
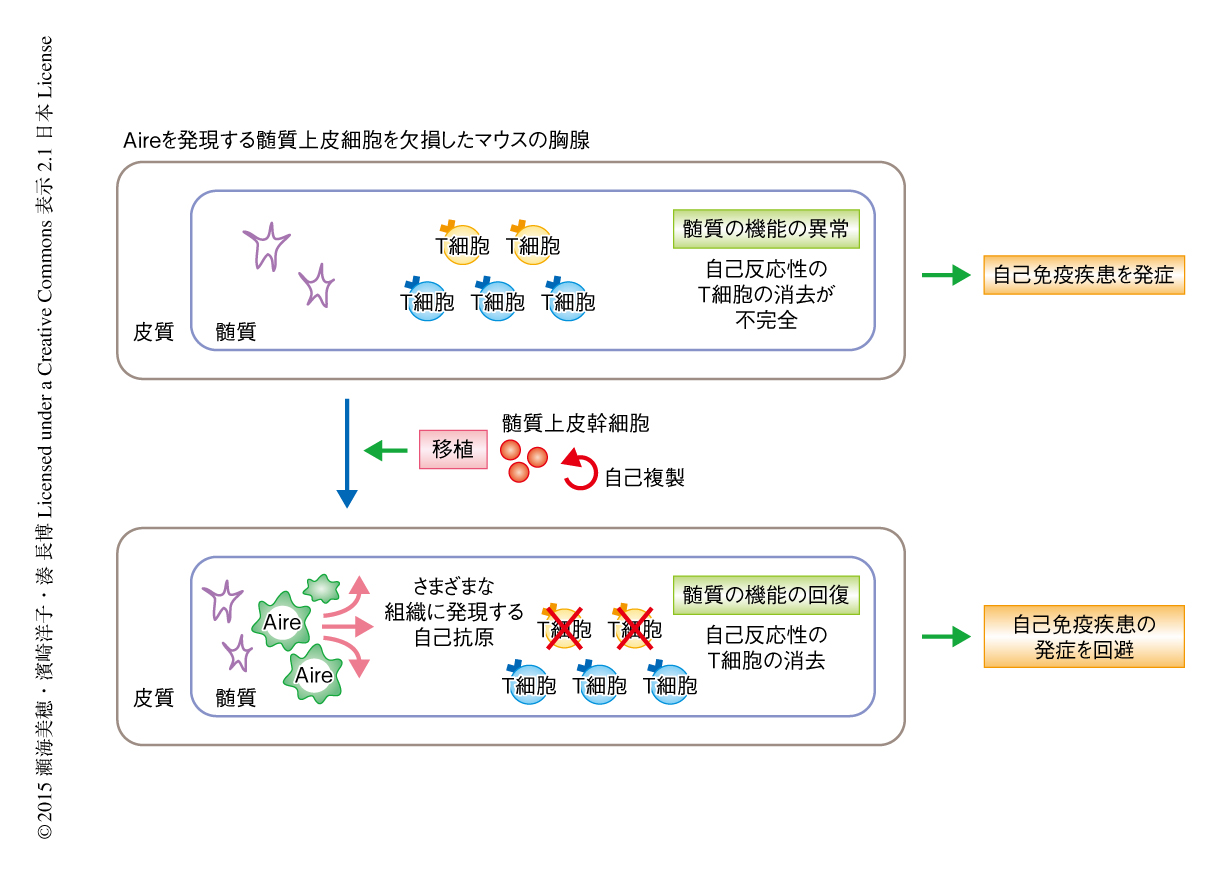
髄質上皮細胞において核内タンパク質Aireの発現を欠損し髄質の機能不全および自己免疫疾患を呈するマウスの胸腺をホストとして用い,胎生期のクローディン陽性の髄質上皮前駆細胞の画分をドナーとし,この異常をレスキューできるかどうか評価した.その結果,クローディン陽性の髄質上皮前駆細胞の画分は1年半以上にわたり胸腺に正常な髄質上皮細胞を供給しつづけ,この再構成された胸腺は,組織に特異的な自己抗原の発現において野生型マウスの胸腺と同等であった.さらに,Aireの発現を欠損したマウスにおいて認められた自己免疫応答も,クローディン陽性の髄質上皮前駆細胞の画分をくわえた胸腺を移植したマウスでは抑制されており,自己免疫疾患の発症を回避していることがわかった.これらは,移植ののち3カ月から18カ月のあいだ,すなわち,マウスの個体のほぼ生涯にわたり同様に観察された.以上の結果から,胎生期のクローディン陽性の髄質上皮前駆細胞の画分は中枢性の自己寛容を誘導しうる機能的な髄質上皮細胞をマウスの個体の生涯にわたり維持する能力をもつことが明らかになった(図1).
胎生期のクローディン陽性の髄質上皮前駆細胞の画分は個体の生涯にわたり機能的な髄質上皮細胞を維持することが可能であったことから,この画分に幹細胞の存在する可能性について検討した.胎生期のクローディン陽性の髄質上皮前駆細胞の画分の細胞表面分子についてフローサイトメーターを用いてより詳細に検討したところ,その一部がSSEA-1を発現すること,また,SSEA-1陽性画分には髄質上皮細胞の成熟マーカーの発現がほとんど認められず,SSEA-1陰性画分と比較して未熟な細胞集団であることが示唆された.そこで,SSEA-1陽性画分とSSEA-1陰性画分をセルソーターにより分画し,胸腺再構築実験系を用いて髄質上皮細胞の産生に対する長期的な寄与について比較したところ,SSEA-1陽性画分のほうが顕著に寄与の高いことが明らかになった.
幹細胞の定義である自己複製能を評価することを目的として,コロニー培養系を確立した.この培養系により,コロニーの数および大きさを測定することでコロニー形成能をもつ細胞の数とその増殖能の定量が可能になった.胸腺再構築実験系を用いた結果と一致して,SSEA-1陽性画分はSSEA-1陰性画分と比較してコロニー形成能が顕著に高く,さらに,継代の効率も高かったことから,この画分に自己複製能をもつ細胞が高度に濃縮していることが明らかになった.1細胞に由来する自己複製した胸腺上皮コロニー細胞について,幹細胞のもう一方の定義である分化した細胞を産生する能力について検討したところ,in vivoにおいてその一部がAireおよび髄質上皮細胞の成熟マーカーを発現する髄質上皮細胞へと分化することが確認された.以上の結果から,自己複製能を示し髄質上皮細胞への単一の分化能をもつ髄質上皮幹細胞が,胎生期のSSEA-1陽性クローディン陽性の髄質上皮前駆細胞の画分に含まれることが明らかになった.
髄質上皮幹細胞がSSEA-1陽性クローディン陽性という細胞表面マーカーにより定義されうるならば,成体のマウスの胸腺においても同様の細胞表面マーカーにより髄質上皮幹細胞を同定できることが考えられた.そこで,成体のマウスの胸腺からセルソーターにより胎生期と同じ細胞画分を回収し,その髄質上皮細胞の長期にわたる再構成能について検討したところ,成体期においてもその活性はSSEA-1陽性クローディン陽性の画分に含まれることが確認された.一方で,胎生期,新生仔期,成体期において,SSEA-1陽性クローディン陽性の髄質上皮前駆細胞の画分による成熟した髄質上皮細胞の産生能について比較したところ,週齢とともに顕著な低下の傾向を示すことが明らかになった.
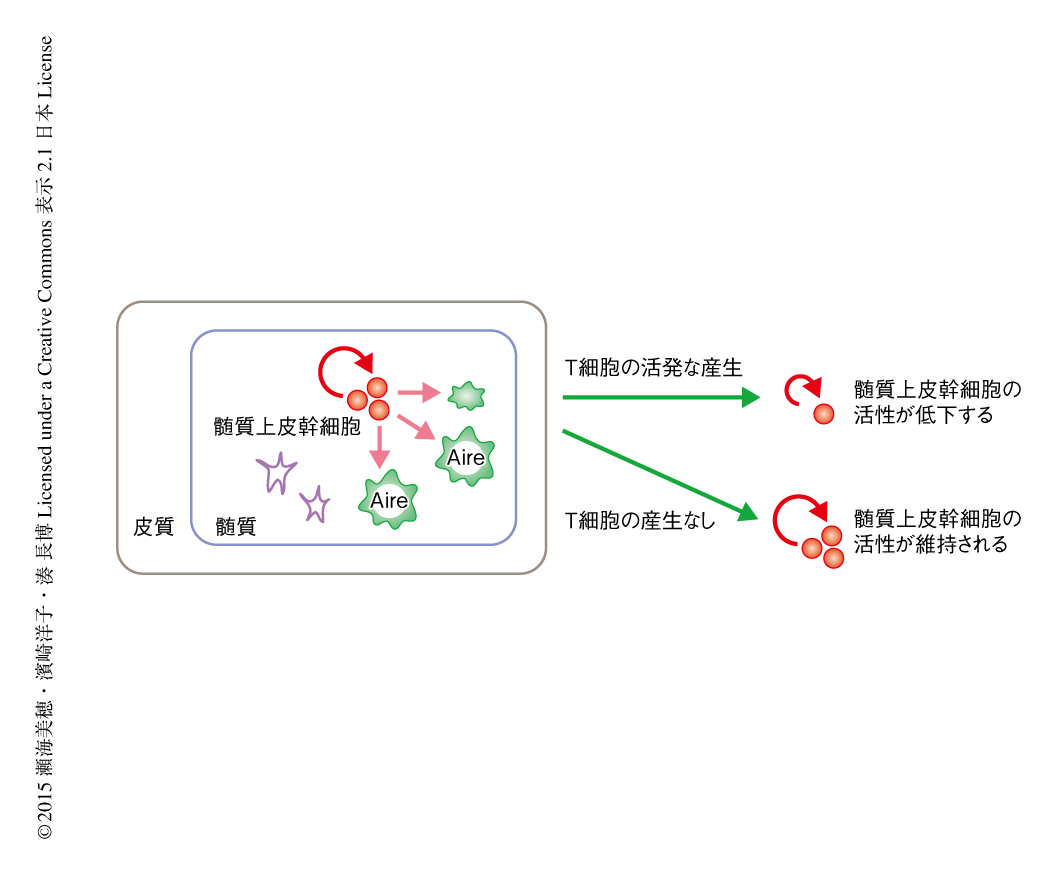
髄質上皮幹細胞による成熟した髄質上皮細胞の産生能は加齢にともない低下したことから,コロニー形成能の加齢による変化についても検討した.まず,髄質および皮質を含む胸腺すべての上皮細胞を用いて,さまざまな週齢の野生型マウスにおいて1胸腺あたりのコロニー形成能を比較した.その結果,コロニー形成能は生後すぐに劇的に低下することが明らかになった.一方,興味深いことに,T細胞の分化が分化段階の早期に停止するRag2ノックアウトマウスではこの劇的なコロニー形成能の低下は認められず,成体期においても高く維持されていた.胸腺の上皮細胞の発生および分化とその維持はリンパ球と上皮細胞との相互作用により成り立つことが明らかになっており7),とくに,Aireを発現する髄質上皮細胞の産生には成熟したT細胞が供給するTNFに関連するシグナルが必須である8,9).Rag2ノックアウトマウスは成熟したT細胞を欠損するため,胸腺の微小環境,とくに髄質上皮細胞が未発達である.SSEA-1陽性クローディン陽性の髄質上皮幹細胞の活性を野生型マウスとRag2ノックアウトマウスとで比較したところ,Rag2ノックアウトマウスはコロニー形成能および生体における長期にわたる髄質の再構成能ともに,野生型マウスと比較して有意に高かった.以上の結果から,髄質上皮幹細胞の活性の低下の原因は,加齢そのものではなく,出生の前後の活発なT細胞の産生によるものである可能性が強く示唆された.
この研究は,機能的な胸腺の髄質上皮細胞の産生,および,その機能であるT細胞の中枢性の自己寛容を生涯にわたり維持しうる胸腺の髄質上皮幹細胞の存在をはじめて証明した(図2).また,髄質上皮幹細胞の移植により髄質の機能不全をともなう臓器に特異的な自己免疫疾患の発症を抑制しうること,および,髄質上皮幹細胞の活性の制御機構の一端を明らかにすることができた.近年,胸腺組織の発生および分化の機構が分子レベルで明らかになるにつれ,多くの自己免疫疾患の発症は胸腺組織の異常をともなうことがわかってきた.また,胸腺組織は化学療法や放射線治療にともない顕著な傷害をうけ,これが治療ののちの正常な免疫系の回復を困難にする一因である可能性も示唆されている.以上の背景から,この研究は,今後,自己免疫疾患の発症機構の解明とその制御法の確立のみならず,ながらく不明であった胸腺の退縮の機構とその意義の理解,化学療法や放射線治療などにより傷害をうけた胸腺および免疫系の早期の機能回復法の確立に大きく寄与するものと考えられる.
京都大学大学院医学研究科 助教.
濱崎 洋子(Yoko Hamazaki)
京都大学大学院医学研究科 准教授.
湊 長博(Nagahiro Minato)
京都大学大学院医学研究科 教授.
© 2015 瀬海美穂・濱崎洋子・湊 長博 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 免疫細胞生物学分野)
email:濱崎洋子
DOI: 10.7875/first.author.2015.003
Medullary thymic epithelial stem cells maintain a functional thymus to ensure lifelong central T cell tolerance.
Miho Sekai, Yoko Hamazaki, Nagahiro Minato
Immunity, 41, 753-761 (2014)
要 約
胸腺はT細胞の産生に必須の中枢リンパ組織であり,髄質および皮質からなる.胸腺の上皮細胞は組織の構築の中心を担うとともに,T細胞の産生のための主要な支持細胞として機能する.中枢性の自己寛容の成立に必須の役割をはたす髄質上皮細胞は,本来,胸腺には存在しない末梢のさまざまな組織に特異的な自己抗原を異所性に発現することにより,これら多くの自己抗原に対し反応しうるT細胞クローンの除去に寄与する.これまで,髄質上皮細胞を産生する発生の初期の髄質上皮前駆細胞の存在は示されていたが,成体におけるその維持の機構については明らかでなかった.この研究において,筆者らは,マウスの個体においてほぼ生涯にわたり機能的な髄質上皮細胞を供給しつづけ,かつ,自己複製能をもつ髄質上皮幹細胞を,胎生期の胸腺から同定した.また,髄質上皮幹細胞の移植により,胸腺の髄質の機能不全に起因する自己免疫疾患の発症を抑制しうることが示された.胸腺は青年期よりのち退縮し機能の低下する臓器であるが,髄質上皮幹細胞の活性は胎生期および新生仔期と比べ成体では顕著に低下していること,その一方で,T細胞の産生に障害のあるマウスでは髄質上皮幹細胞の活性は高く維持されていることも明らかにされた.以上の結果は,自己免疫疾患の発症機構の理解と治療法の開発に大きく貢献するとともに,免疫学の大きな謎のひとつである胸腺の退縮の機構やその意義の理解に新たな局面をひらくものである.
はじめに
免疫系は非自己(病原体などの異物)を攻撃しそれを排除するとともに,自己(自分の組織など)を攻撃しない自己寛容のしくみをもつ.自己寛容が破綻したことにより起こるのが自己免疫疾患であるが,自己寛容の成立には,リンパ球の発生の過程において起こる中枢性の機構と,成熟したリンパ球が末梢組織において獲得する末梢性の機構とが存在し,この2つの機構は正常な免疫系の確立においてともに重要である.胸腺組織は免疫応答の司令塔であるT細胞の産生に必須の中枢リンパ組織であり,髄質および皮質からなる.皮質はおもに自己のMHC分子への反応性の獲得および幅広い抗原に反応しうるレパトアの形成を担い,髄質は中枢性の自己寛容の成立において中心的な役割をはたす.髄質および皮質においては主要な支持細胞として機能する上皮細胞が組織の骨格を形成しているが,髄質上皮細胞は本来は胸腺に発現しないような組織に特異的な自己抗原を発現し,同じ髄質に存在する樹状細胞と協調して未熟なT細胞に自己抗原を提示し,自己反応性のクローンを除去することにより自己寛容の成立に寄与することが知られている1).組織に特異的な自己抗原の発現には髄質上皮細胞の発現する核内タンパク質Aireが関与しており,その欠損や異常,および,髄質上皮細胞の分化の異常により,組織に特異的な自己抗原の発現が顕著に低下したヒトやマウスでは臓器に特異的な自己免疫疾患を発症することが知られている2,3).
これまで,中枢性の自己寛容の成立に必須の髄質上皮細胞を産生する“前駆細胞”は胸腺の発生の過程において同定されていたが4,5),髄質上皮細胞が個体の生涯にわたりどのように維持されるのかについてはよくわかっていなかった.組織を構成する細胞は,おのおのの組織により,幹細胞,前駆細胞から新たな細胞の産生,成熟した細胞の分裂,のいずれかの機構により維持されるが,髄質上皮細胞のターンオーバーは2~3週間と比較的速いことなどから6),幹細胞により維持されているのではないかと想定されてきた.しかしながら,自己複製能をもつとともに分化した子孫細胞を産生するという幹細胞の定義をみたす細胞は同定されていなかった.この研究では,以前に筆者らが報告した,胎生期の髄質上皮前駆細胞の画分がどのくらいの期間にわたり髄質上皮細胞を維持できるか,もし,長期にわたり維持できるとすればそのなかに幹細胞の定義をみたす細胞は存在するか,その移植により自己免疫疾患の発症を回避できるか,について検討することにより,髄質上皮幹細胞の存在について検証した.
1.胎生期の髄質上皮前駆細胞の画分は髄質上皮細胞を生涯にわたり維持でき移植により自己免疫疾患を回避できる
以前に,筆者らは,胎生期の胸腺の原基において上皮細胞のあいだの密着結合に機能する接着分子であるクローディン3およびクローディン4を発現する一部の細胞が髄質上皮細胞を産生する前駆細胞であることを報告した5).この胎生期のクローディン陽性の髄質上皮前駆細胞の画分の長期的および機能的なポテンシャルを生体において検証するため,胸腺再構築実験系を確立した.この実験系は,胸腺を構成するすべての細胞(ホスト)をいちど酵素処理により分散させ,GFPなどにより標識した機能評価の対象となる細胞の画分(ドナー)をくわえたのち,再度,in vitroにおいて胸腺を再構成しマウスの腎被膜下に移植する.これにより,ドナーに由来する細胞がどのくらいの期間にわたり胸腺において維持されるか,また,移植した胸腺から産生されたT細胞が自己免疫疾患を起こすかどうか(自己反応性のT細胞が除去されているか)について,in vivoにおいて検証することが可能になった.
髄質上皮細胞において核内タンパク質Aireの発現を欠損し髄質の機能不全および自己免疫疾患を呈するマウスの胸腺をホストとして用い,胎生期のクローディン陽性の髄質上皮前駆細胞の画分をドナーとし,この異常をレスキューできるかどうか評価した.その結果,クローディン陽性の髄質上皮前駆細胞の画分は1年半以上にわたり胸腺に正常な髄質上皮細胞を供給しつづけ,この再構成された胸腺は,組織に特異的な自己抗原の発現において野生型マウスの胸腺と同等であった.さらに,Aireの発現を欠損したマウスにおいて認められた自己免疫応答も,クローディン陽性の髄質上皮前駆細胞の画分をくわえた胸腺を移植したマウスでは抑制されており,自己免疫疾患の発症を回避していることがわかった.これらは,移植ののち3カ月から18カ月のあいだ,すなわち,マウスの個体のほぼ生涯にわたり同様に観察された.以上の結果から,胎生期のクローディン陽性の髄質上皮前駆細胞の画分は中枢性の自己寛容を誘導しうる機能的な髄質上皮細胞をマウスの個体の生涯にわたり維持する能力をもつことが明らかになった(図1).
2.胎生期のクローディン陽性の髄質上皮前駆細胞の画分にはSSEA-1を発現する髄質上皮幹細胞が存在する
胎生期のクローディン陽性の髄質上皮前駆細胞の画分は個体の生涯にわたり機能的な髄質上皮細胞を維持することが可能であったことから,この画分に幹細胞の存在する可能性について検討した.胎生期のクローディン陽性の髄質上皮前駆細胞の画分の細胞表面分子についてフローサイトメーターを用いてより詳細に検討したところ,その一部がSSEA-1を発現すること,また,SSEA-1陽性画分には髄質上皮細胞の成熟マーカーの発現がほとんど認められず,SSEA-1陰性画分と比較して未熟な細胞集団であることが示唆された.そこで,SSEA-1陽性画分とSSEA-1陰性画分をセルソーターにより分画し,胸腺再構築実験系を用いて髄質上皮細胞の産生に対する長期的な寄与について比較したところ,SSEA-1陽性画分のほうが顕著に寄与の高いことが明らかになった.
幹細胞の定義である自己複製能を評価することを目的として,コロニー培養系を確立した.この培養系により,コロニーの数および大きさを測定することでコロニー形成能をもつ細胞の数とその増殖能の定量が可能になった.胸腺再構築実験系を用いた結果と一致して,SSEA-1陽性画分はSSEA-1陰性画分と比較してコロニー形成能が顕著に高く,さらに,継代の効率も高かったことから,この画分に自己複製能をもつ細胞が高度に濃縮していることが明らかになった.1細胞に由来する自己複製した胸腺上皮コロニー細胞について,幹細胞のもう一方の定義である分化した細胞を産生する能力について検討したところ,in vivoにおいてその一部がAireおよび髄質上皮細胞の成熟マーカーを発現する髄質上皮細胞へと分化することが確認された.以上の結果から,自己複製能を示し髄質上皮細胞への単一の分化能をもつ髄質上皮幹細胞が,胎生期のSSEA-1陽性クローディン陽性の髄質上皮前駆細胞の画分に含まれることが明らかになった.
髄質上皮幹細胞がSSEA-1陽性クローディン陽性という細胞表面マーカーにより定義されうるならば,成体のマウスの胸腺においても同様の細胞表面マーカーにより髄質上皮幹細胞を同定できることが考えられた.そこで,成体のマウスの胸腺からセルソーターにより胎生期と同じ細胞画分を回収し,その髄質上皮細胞の長期にわたる再構成能について検討したところ,成体期においてもその活性はSSEA-1陽性クローディン陽性の画分に含まれることが確認された.一方で,胎生期,新生仔期,成体期において,SSEA-1陽性クローディン陽性の髄質上皮前駆細胞の画分による成熟した髄質上皮細胞の産生能について比較したところ,週齢とともに顕著な低下の傾向を示すことが明らかになった.
3.髄質上皮幹細胞の活性は活発なT細胞の産生により生後すぐに劇的に低下する
髄質上皮幹細胞による成熟した髄質上皮細胞の産生能は加齢にともない低下したことから,コロニー形成能の加齢による変化についても検討した.まず,髄質および皮質を含む胸腺すべての上皮細胞を用いて,さまざまな週齢の野生型マウスにおいて1胸腺あたりのコロニー形成能を比較した.その結果,コロニー形成能は生後すぐに劇的に低下することが明らかになった.一方,興味深いことに,T細胞の分化が分化段階の早期に停止するRag2ノックアウトマウスではこの劇的なコロニー形成能の低下は認められず,成体期においても高く維持されていた.胸腺の上皮細胞の発生および分化とその維持はリンパ球と上皮細胞との相互作用により成り立つことが明らかになっており7),とくに,Aireを発現する髄質上皮細胞の産生には成熟したT細胞が供給するTNFに関連するシグナルが必須である8,9).Rag2ノックアウトマウスは成熟したT細胞を欠損するため,胸腺の微小環境,とくに髄質上皮細胞が未発達である.SSEA-1陽性クローディン陽性の髄質上皮幹細胞の活性を野生型マウスとRag2ノックアウトマウスとで比較したところ,Rag2ノックアウトマウスはコロニー形成能および生体における長期にわたる髄質の再構成能ともに,野生型マウスと比較して有意に高かった.以上の結果から,髄質上皮幹細胞の活性の低下の原因は,加齢そのものではなく,出生の前後の活発なT細胞の産生によるものである可能性が強く示唆された.
おわりに
この研究は,機能的な胸腺の髄質上皮細胞の産生,および,その機能であるT細胞の中枢性の自己寛容を生涯にわたり維持しうる胸腺の髄質上皮幹細胞の存在をはじめて証明した(図2).また,髄質上皮幹細胞の移植により髄質の機能不全をともなう臓器に特異的な自己免疫疾患の発症を抑制しうること,および,髄質上皮幹細胞の活性の制御機構の一端を明らかにすることができた.近年,胸腺組織の発生および分化の機構が分子レベルで明らかになるにつれ,多くの自己免疫疾患の発症は胸腺組織の異常をともなうことがわかってきた.また,胸腺組織は化学療法や放射線治療にともない顕著な傷害をうけ,これが治療ののちの正常な免疫系の回復を困難にする一因である可能性も示唆されている.以上の背景から,この研究は,今後,自己免疫疾患の発症機構の解明とその制御法の確立のみならず,ながらく不明であった胸腺の退縮の機構とその意義の理解,化学療法や放射線治療などにより傷害をうけた胸腺および免疫系の早期の機能回復法の確立に大きく寄与するものと考えられる.
文 献
- Anderson, G., Lane, P. J. & Jenkinson, E. J.: Generating intrathymic microenvironments to establish T-cell tolerance. Nat. Rev. Immunol., 7, 954-963 (2007)[PubMed]
- Anderson, M. S., Venanzi, E. S., Klein, L. et al.: Projection of an immunological self shadow within the thymus by the aire protein. Science, 298, 1395-1401 (2002)[PubMed]
- Kajiura, F., Sun, S., Nomura, T. et al.: NF-κB-inducing kinase establishes self-tolerance in a thymic stroma-dependent manner. J. Immunol., 172, 2067-2075 (2004)[PubMed]
- Rodewald, H. R., Paul, S., Haller, C. et al.: Thymus medulla consisting of epithelial islets each derived from a single progenitor. Nature, 414, 763-768 (2001)[PubMed]
- Hamazaki, Y., Fujita, H., Kobayashi, T. et al.: Medullary thymic epithelial cells expressing Aire represent a unique lineage derived from cells expressing claudin. Nat. Immunol., 8, 304-311 (2007)[PubMed]
- Gray, D. H., Seach, N., Ueno, T. et al.: Developmental kinetics, turnover, and stimulatory capacity of thymic epithelial cells. Blood, 108, 3777-3785 (2006)[PubMed]
- van Ewijk, W., Shores, E. W. & Singer, A.: Crosstalk in the mouse thymus. Immunol. Today, 15, 214-217 (1994)[PubMed]
- Anderson, G. & Talahama, Y.: Thymic epithelial cells: working class heroes for T cell development and repertoire selection. Trends. Immunol., 33, 256-263 (2012)[PubMed]
- Akiyama, T., Shinzawa, M. & Akiyama, N.: TNF receptor family signaling in the development and functions of medullary thymic epithelial cells. Front. Immunol., 3, 278 (2012)[PubMed]
著者プロフィール
京都大学大学院医学研究科 助教.
濱崎 洋子(Yoko Hamazaki)
京都大学大学院医学研究科 准教授.
湊 長博(Nagahiro Minato)
京都大学大学院医学研究科 教授.
© 2015 瀬海美穂・濱崎洋子・湊 長博 Licensed under CC 表示 2.1 日本