カイコの細菌感染モデルを利用して同定された新規の抗生物質ライソシンE
浜本 洋・関水和久
(東京大学大学院薬学系研究科 微生物薬品化学教室)
email:浜本 洋,関水和久
DOI: 10.7875/first.author.2015.005
Lysocin E is a new antibiotic that targets menaquinone in the bacterial membrane.
Hiroshi Hamamoto, Makoto Urai, Kenichi Ishii, Jyunichiro Yasukawa, Atmika Paudel, Motoki Murai, Takuya Kaji, Takefumi Kuranaga, Kenji Hamase, Takashi Katsu, Jie Su, Tatsuo Adachi, Ryuji Uchida, Hiroshi Tomoda, Maki Yamada, Manabu Souma, Hiroki Kurihara, Masayuki Inoue, Kazuhisa Sekimizu
Nature Chemical Biology, 11, 127-133 (2015)
多剤耐性細菌に対し有効な治療効果のある新規の抗生物質の新しい探索法が必要とされている.カイコの細菌感染モデルは,治療に必要な抗生物質の用量が哺乳動物における値とよく一致することから,抗生物質の薬物動態を反映した治療効果の評価が可能である.筆者らは,カイコの黄色ブドウ球菌感染モデルを用いて,土壌細菌の培養抽出物を対象に治療効果を指標として抗生物質を探索した.その結果,すでにこの手法により見い出されていたノソコマイシンにくわえ,新規の抗生物質ライソシンEを見い出した.これらの抗生物質はマウスの黄色ブドウ球菌感染モデルにおいても治療効果を示した.さらに,ライソシンEは黄色ブドウ球菌の細胞膜に存在するメナキノンに結合して細胞膜の破壊をひき起こすという新規の作用機序をもつことが判明した.カイコの細菌感染モデルは哺乳動物において治療効果を示す新規の抗生物質の探索系として有用と考えられる.
多剤耐性細菌の蔓延は臨床の現場において深刻な問題になっており,既存の抗菌薬とは異なる作用機序をもつ治療薬がもとめられている.一方で,近年,治療効果を示す新規の作用機序をもつ治療薬の開発は停滞している.この原因として,従来の試験管内における細菌の増殖の阻害を指標とした天然物からの探索,あるいは,細菌の増殖に必須のタンパク質に対するハイスループットスクリーニングによる化合物ライブラリーからの探索は,治療効果を示す化合物を得る効率が非常に低いことが指摘されている.この問題を克服するためには,探索の早い段階において治療効果を評価することが必要である.しかしながら,探索の初期の段階において哺乳動物を利用することは費用や動物愛護の視点から問題がある.そこで,費用が安く倫理的な問題がなく取り扱いの容易なモデル生物としてカイコに着目した.これまでに,筆者らは,カイコの細菌感染モデル1) を用いて抗生物質の定量的な評価が可能であり,体重あたりの治療に必要な薬剤量はカイコとマウスでほぼ一致していること2),また,カイコにおいても哺乳動物と同様に,外来の化合物はP450および抱合反応による代謝をうけ排泄されることを見い出していた3).さらに,カイコを用いて化合物の毒性も同時に評価が可能である.そこで,土壌細菌の培養抽出物からカイコモデルにおける治療効果を指標として抗生物質を探索した.
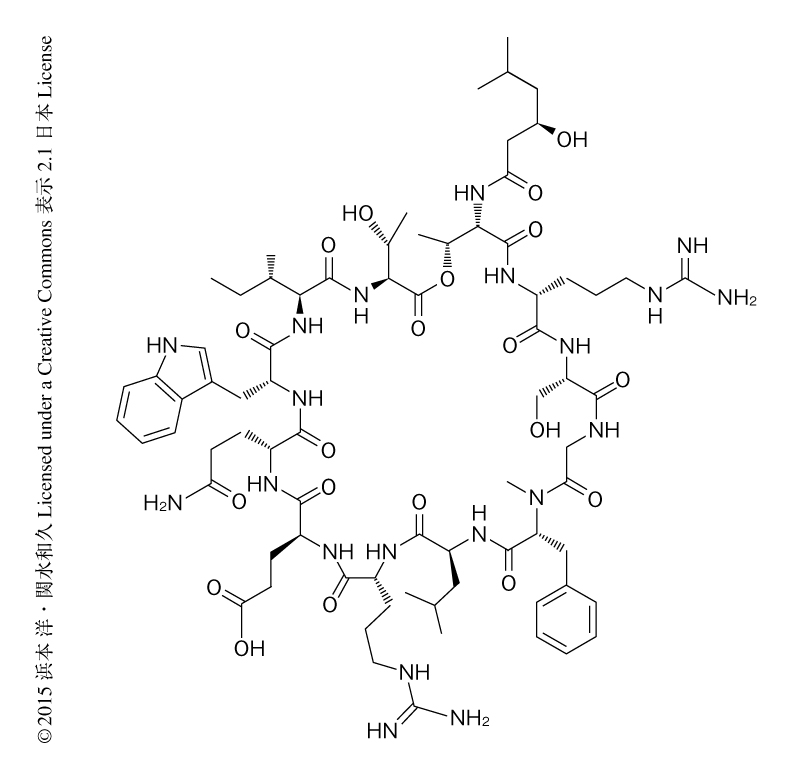
これまでに,カイコの黄色ブドウ球菌感染モデルを利用してカイコにおいて治療効果を示す新規の抗生物質ノソコマイシンが見い出されている4).さらに,14,651株の土壌細菌の培養抽出物を調製し抗生物質を探索した.2794個が抗菌活性を示し,そのうち23個がカイコの黄色ブドウ球菌感染モデルにおいて治療効果を示した.そのなかで,系統分析によりLysobacter属細菌であると推定されたRH2180-5株の培養抽出物から,カイコの黄色ブドウ球菌感染モデルにおける治療効果を指標として抗生物質を精製した.最終段階のODSカラムによるHPLCにおいて,紫外線スペクトルのパターンの類似した9個のピークが認められた.もっとも回収量の多かったピークの構造を解析し,新規の構造をもつ抗生物質であることを見い出し,ライソシンEと命名した(図1).この抗生物質は,12個のD体あるいはL体のアミノ酸残基,および,脂肪酸鎖から構成される環状リポペプチドであった.
カイコの黄色ブドウ球菌感染モデルにおける探索により発見された2つの新規の抗生物質,ノソコマイシンおよびライソシンEについて,マウスの黄色ブドウ球菌感染モデルにおける治療効果について検討した.その結果,ノソコマイシンの50%効果量は静脈注射で12 mg/kg,ライソシンEの50%効果量は皮下投与で0.5 mg/kgであった.すなわち,カイコの細菌感染モデルにおける治療効果を指標に探索された2つの新規の抗生物質は,マウスの細菌感染モデルにおいても治療効果を示した.さらに,ライソシンEについては,単回投与における急性毒性は400 mg/kg以上,かつ,50 mg/kgの投与でも臓器毒性は認められなかった.したがって,ライソシンEは安全性の高い抗生物質と考えられ,臨床への応用が期待できた.
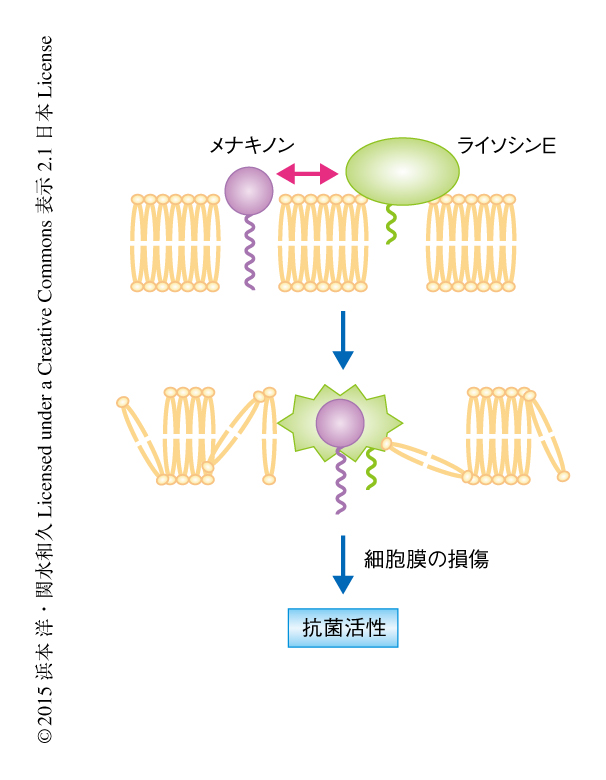
ライソシンEの抗菌スペクトラムをもとめたところ,メチシリン耐性黄色ブドウ球菌(MRSA)を含むグラム陽性細菌の一部に対し有効であることがわかった.一方で,グラム陰性細菌および真菌に対しては無効であった.ライソシンEの黄色ブドウ球菌に対する作用は殺菌的であり,生菌数が1分間で99.99%も減少するという,既存の抗生物質にはみられないほど短時間で強力なものであった.また,ライソシンEは黄色ブドウ球菌の細胞膜に対する障害性をもっていた.ライソシンEの作用標的を同定するため,ライソシンEの耐性株を取得しその責任遺伝子を解析した結果,細菌の電子伝達系の補酵素であるメナキノンの合成にかかわる遺伝子が同定された.メナキノンの合成にかかわるmenA遺伝子およびmenB遺伝子を破壊するとライソシンEに対し高度の耐性を示すようになり,細胞膜の障害に対する感受性も消失した.また,ライソシンEの黄色ブドウ球菌に対する抗菌活性は培地にメナキノンを添加することにより阻害され,ライソシンEとメナキノンの混合により沈殿の形成が認められた.さらに,マイクロカロリメトリーによる定量的な解析から,ライソシンEとメナキノンは1対1で相互作用することが示された.哺乳動物において用いられている電子伝達系の補酵素はユビキノンであるが,ライソシンEはユビキノンとは相互作用しなかった.これらの結果から,ライソシンEが細菌の細胞膜に存在するメナキノンと直接に結合して細胞膜の破壊をひき起こす可能性を考えた.人工リポソームの破壊においてメナキノンの効果を検討したところ,ライソシンEはメナキノンを含有する人工リポソームを選択的に破壊することが判明した.したがって,ライソシンEは細胞膜のメナキノンに特異的に結合して細胞膜の破壊をひき起こすと考えられた(図2).一方,細胞膜に対する障害性をもつことが知られているダプトマイシンは,人工リポソームを破壊したがメナキノンの有無による差は認められなかった.以上の結果から,ライソシンEは細胞膜に存在するメナキノンを特異的に標的とし,細胞膜の破壊をひき起こすことが示された.
この論文においては,新規の抗生物質の探索系として治療効果を指標としたカイコの細菌感染モデルの有用性が明らかにされた.カイコの魅力は,ショウジョウバエや線虫とは異なり,人間の手で自在に扱えるほど個体が大きいため,定量的かつ再現性の高い実験が可能である点にある.それにくわえ,カイコは万頭の単位での飼育が可能で,費用も安く倫理的な問題がないため,マウスでは不可能な治療効果を指標とした探索が可能である.カイコを用いた高血糖モデル5) やSPR欠損症モデル6) なども提案されており,最近では,遺伝子組換えを用いた疾患モデル7) の構築も可能であることが示されるなど,さまざまな疾患に対する治療薬の探索系として応用が可能である.
さらに,今回,見い出された新規の構造をもつ抗生物質ライソシンEは,これまでの抗生物質とは異なり,作用標的が細胞膜に存在するメナキノンであり,すぐれた殺菌活性を示した.治療効果も高く毒性も低いため臨床への応用が期待される.この研究が,臨床の現場において深刻な問題になっている多剤耐性細菌に対する問題の解決の一助になれば幸いである.
略歴:2006年 東京大学大学院薬学系研究科にて博士号取得,ゲノム創薬研究所 主任研究員を経て,2008年より東京大学大学院薬学系研究科 助教.
研究テーマ:カイコを用いた病態モデル,および,それを利用した創薬法の確立.
抱負:開発の停滞している微生物感染症に対する新しい治療薬の開発に対し貢献したい.
関水 和久(Kazuhisa Sekimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~bisei/
© 2015 浜本 洋・関水和久 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 微生物薬品化学教室)
email:浜本 洋,関水和久
DOI: 10.7875/first.author.2015.005
Lysocin E is a new antibiotic that targets menaquinone in the bacterial membrane.
Hiroshi Hamamoto, Makoto Urai, Kenichi Ishii, Jyunichiro Yasukawa, Atmika Paudel, Motoki Murai, Takuya Kaji, Takefumi Kuranaga, Kenji Hamase, Takashi Katsu, Jie Su, Tatsuo Adachi, Ryuji Uchida, Hiroshi Tomoda, Maki Yamada, Manabu Souma, Hiroki Kurihara, Masayuki Inoue, Kazuhisa Sekimizu
Nature Chemical Biology, 11, 127-133 (2015)
要 約
多剤耐性細菌に対し有効な治療効果のある新規の抗生物質の新しい探索法が必要とされている.カイコの細菌感染モデルは,治療に必要な抗生物質の用量が哺乳動物における値とよく一致することから,抗生物質の薬物動態を反映した治療効果の評価が可能である.筆者らは,カイコの黄色ブドウ球菌感染モデルを用いて,土壌細菌の培養抽出物を対象に治療効果を指標として抗生物質を探索した.その結果,すでにこの手法により見い出されていたノソコマイシンにくわえ,新規の抗生物質ライソシンEを見い出した.これらの抗生物質はマウスの黄色ブドウ球菌感染モデルにおいても治療効果を示した.さらに,ライソシンEは黄色ブドウ球菌の細胞膜に存在するメナキノンに結合して細胞膜の破壊をひき起こすという新規の作用機序をもつことが判明した.カイコの細菌感染モデルは哺乳動物において治療効果を示す新規の抗生物質の探索系として有用と考えられる.
はじめに
多剤耐性細菌の蔓延は臨床の現場において深刻な問題になっており,既存の抗菌薬とは異なる作用機序をもつ治療薬がもとめられている.一方で,近年,治療効果を示す新規の作用機序をもつ治療薬の開発は停滞している.この原因として,従来の試験管内における細菌の増殖の阻害を指標とした天然物からの探索,あるいは,細菌の増殖に必須のタンパク質に対するハイスループットスクリーニングによる化合物ライブラリーからの探索は,治療効果を示す化合物を得る効率が非常に低いことが指摘されている.この問題を克服するためには,探索の早い段階において治療効果を評価することが必要である.しかしながら,探索の初期の段階において哺乳動物を利用することは費用や動物愛護の視点から問題がある.そこで,費用が安く倫理的な問題がなく取り扱いの容易なモデル生物としてカイコに着目した.これまでに,筆者らは,カイコの細菌感染モデル1) を用いて抗生物質の定量的な評価が可能であり,体重あたりの治療に必要な薬剤量はカイコとマウスでほぼ一致していること2),また,カイコにおいても哺乳動物と同様に,外来の化合物はP450および抱合反応による代謝をうけ排泄されることを見い出していた3).さらに,カイコを用いて化合物の毒性も同時に評価が可能である.そこで,土壌細菌の培養抽出物からカイコモデルにおける治療効果を指標として抗生物質を探索した.
1.カイコの細菌感染モデルを利用した抗生物質の探索および同定
これまでに,カイコの黄色ブドウ球菌感染モデルを利用してカイコにおいて治療効果を示す新規の抗生物質ノソコマイシンが見い出されている4).さらに,14,651株の土壌細菌の培養抽出物を調製し抗生物質を探索した.2794個が抗菌活性を示し,そのうち23個がカイコの黄色ブドウ球菌感染モデルにおいて治療効果を示した.そのなかで,系統分析によりLysobacter属細菌であると推定されたRH2180-5株の培養抽出物から,カイコの黄色ブドウ球菌感染モデルにおける治療効果を指標として抗生物質を精製した.最終段階のODSカラムによるHPLCにおいて,紫外線スペクトルのパターンの類似した9個のピークが認められた.もっとも回収量の多かったピークの構造を解析し,新規の構造をもつ抗生物質であることを見い出し,ライソシンEと命名した(図1).この抗生物質は,12個のD体あるいはL体のアミノ酸残基,および,脂肪酸鎖から構成される環状リポペプチドであった.
2.カイコにおいて治療効果を示す抗生物質のマウスにおける治療効果
カイコの黄色ブドウ球菌感染モデルにおける探索により発見された2つの新規の抗生物質,ノソコマイシンおよびライソシンEについて,マウスの黄色ブドウ球菌感染モデルにおける治療効果について検討した.その結果,ノソコマイシンの50%効果量は静脈注射で12 mg/kg,ライソシンEの50%効果量は皮下投与で0.5 mg/kgであった.すなわち,カイコの細菌感染モデルにおける治療効果を指標に探索された2つの新規の抗生物質は,マウスの細菌感染モデルにおいても治療効果を示した.さらに,ライソシンEについては,単回投与における急性毒性は400 mg/kg以上,かつ,50 mg/kgの投与でも臓器毒性は認められなかった.したがって,ライソシンEは安全性の高い抗生物質と考えられ,臨床への応用が期待できた.
3.ライソシンEの作用機序
ライソシンEの抗菌スペクトラムをもとめたところ,メチシリン耐性黄色ブドウ球菌(MRSA)を含むグラム陽性細菌の一部に対し有効であることがわかった.一方で,グラム陰性細菌および真菌に対しては無効であった.ライソシンEの黄色ブドウ球菌に対する作用は殺菌的であり,生菌数が1分間で99.99%も減少するという,既存の抗生物質にはみられないほど短時間で強力なものであった.また,ライソシンEは黄色ブドウ球菌の細胞膜に対する障害性をもっていた.ライソシンEの作用標的を同定するため,ライソシンEの耐性株を取得しその責任遺伝子を解析した結果,細菌の電子伝達系の補酵素であるメナキノンの合成にかかわる遺伝子が同定された.メナキノンの合成にかかわるmenA遺伝子およびmenB遺伝子を破壊するとライソシンEに対し高度の耐性を示すようになり,細胞膜の障害に対する感受性も消失した.また,ライソシンEの黄色ブドウ球菌に対する抗菌活性は培地にメナキノンを添加することにより阻害され,ライソシンEとメナキノンの混合により沈殿の形成が認められた.さらに,マイクロカロリメトリーによる定量的な解析から,ライソシンEとメナキノンは1対1で相互作用することが示された.哺乳動物において用いられている電子伝達系の補酵素はユビキノンであるが,ライソシンEはユビキノンとは相互作用しなかった.これらの結果から,ライソシンEが細菌の細胞膜に存在するメナキノンと直接に結合して細胞膜の破壊をひき起こす可能性を考えた.人工リポソームの破壊においてメナキノンの効果を検討したところ,ライソシンEはメナキノンを含有する人工リポソームを選択的に破壊することが判明した.したがって,ライソシンEは細胞膜のメナキノンに特異的に結合して細胞膜の破壊をひき起こすと考えられた(図2).一方,細胞膜に対する障害性をもつことが知られているダプトマイシンは,人工リポソームを破壊したがメナキノンの有無による差は認められなかった.以上の結果から,ライソシンEは細胞膜に存在するメナキノンを特異的に標的とし,細胞膜の破壊をひき起こすことが示された.
おわりに
この論文においては,新規の抗生物質の探索系として治療効果を指標としたカイコの細菌感染モデルの有用性が明らかにされた.カイコの魅力は,ショウジョウバエや線虫とは異なり,人間の手で自在に扱えるほど個体が大きいため,定量的かつ再現性の高い実験が可能である点にある.それにくわえ,カイコは万頭の単位での飼育が可能で,費用も安く倫理的な問題がないため,マウスでは不可能な治療効果を指標とした探索が可能である.カイコを用いた高血糖モデル5) やSPR欠損症モデル6) なども提案されており,最近では,遺伝子組換えを用いた疾患モデル7) の構築も可能であることが示されるなど,さまざまな疾患に対する治療薬の探索系として応用が可能である.
さらに,今回,見い出された新規の構造をもつ抗生物質ライソシンEは,これまでの抗生物質とは異なり,作用標的が細胞膜に存在するメナキノンであり,すぐれた殺菌活性を示した.治療効果も高く毒性も低いため臨床への応用が期待される.この研究が,臨床の現場において深刻な問題になっている多剤耐性細菌に対する問題の解決の一助になれば幸いである.
文 献
- Kaito, C., Akimitsu, N., Watanabe, H. et al.: Silkworm larvae as an animal model of bacterial infection pathogenic to humans. Microb. Pathog., 32, 183-190 (2002)[PubMed]
- Hamamoto, H., Kurokawa, K., Kaito, C. et al.: Quantitative evaluation of the therapeutic effects of antibiotics using silkworms infected with human pathogenic microorganisms. Antimicrob. Agents Chemother., 48, 774-779 (2004)[PubMed]
- Hamamoto, H., Tonoike, A., Narushima, K. et al.: Silkworm as a model animal to evaluate drug candidate toxicity and metabolism. Comp. Biochem. Physiol. C Toxicol. Pharmacol., 149, 334-339 (2009)[PubMed]
- Uchida, R., Iwatsuki, M., Kim, Y. P. et al.: Nosokomycins, new antibiotics discovered in an in vivo-mimic infection model using silkworm larvae. I: Fermentation, isolation and biological properties. J. Antibiot., 63, 151-155 (2010)[PubMed]
- Matsumoto, Y., Sumiya, E., Sugita, T. et al.: An invertebrate hyperglycemic model for the identification of anti-diabetic drugs. PLoS One, 6, e18292 (2011)[PubMed]
- Meng, Y., Katsuma, S. & Daimon, T.: The silkworm mutant lemon (lemon lethal) is a potential insect model for human sepiapterin reductase deficiency. J. Biol. Chem., 284, 11698-11705 (2009)[PubMed]
- Matsumoto, Y., Ishii, M., Ishii, K. et al.: Transgenic silkworms expressing human insulin receptors for evaluation of therapeutically active insulin receptor agonists. Biochem. Biophys. Res. Commun., 455, 159-164 (2014)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院薬学系研究科にて博士号取得,ゲノム創薬研究所 主任研究員を経て,2008年より東京大学大学院薬学系研究科 助教.
研究テーマ:カイコを用いた病態モデル,および,それを利用した創薬法の確立.
抱負:開発の停滞している微生物感染症に対する新しい治療薬の開発に対し貢献したい.
関水 和久(Kazuhisa Sekimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~bisei/
© 2015 浜本 洋・関水和久 Licensed under CC 表示 2.1 日本