健康な人に存在する免疫不応答の状態の自己反応性のCD8陽性T細胞の同定
西川博嘉・坂口志文
(大阪大学免疫学フロンティア研究センター 実験免疫学研究室)
email:西川博嘉
DOI: 10.7875/first.author.2015.001
Detection of self-reactive CD8+ T cells with an anergic phenotype in healthy individuals.
Yuka Maeda, Hiroyoshi Nishikawa, Daisuke Sugiyama, Danbee Ha, Masahide Hamaguchi, Takuro Saito, Megumi Nishioka, James B. Wing, Dennis Adeegbe, Ichiro Katayama, Shimon Sakaguchi
Science, 346, 1536-1540 (2014)
CD4陽性制御性T細胞は自己免疫反応を回避するうえで重要な役割をはたしている.制御性T細胞がCD8陽性T細胞などエフェクターT細胞の機能を抑制することは明らかにされていたが,制御性T細胞に抑制された自己抗原に特異的なCD8陽性T細胞の動態,また,それら抑制されたT細胞はどのような表現型をもつのかは不明であった.この研究において,筆者らは,制御性T細胞は自己抗原に特異的なCD8陽性T細胞の増殖を抑制し,これらT細胞を抗原による刺激に対し反応しない免疫不応答の状態にすることを明らかにした.制御性T細胞は抗原提示細胞の共刺激分子の発現を低下させることにより,自己抗原に特異的なCD8陽性T細胞を免疫不応答の状態にしていた.これらの自己抗原に特異的なCD8陽性T細胞は,自己抗原に対するT細胞受容体の親和性が低く,ナイーブ表現型を示しつつ,免疫抑制分子を高発現していた.さらに,健康な人の体内に免疫不応答の状態で存在する自己抗原に特異的なCD8陽性T細胞は,自己免疫疾患の患者では活性化されており,この免疫抑制の機構が自己免疫疾患を制御するうえで重要であることが示された.
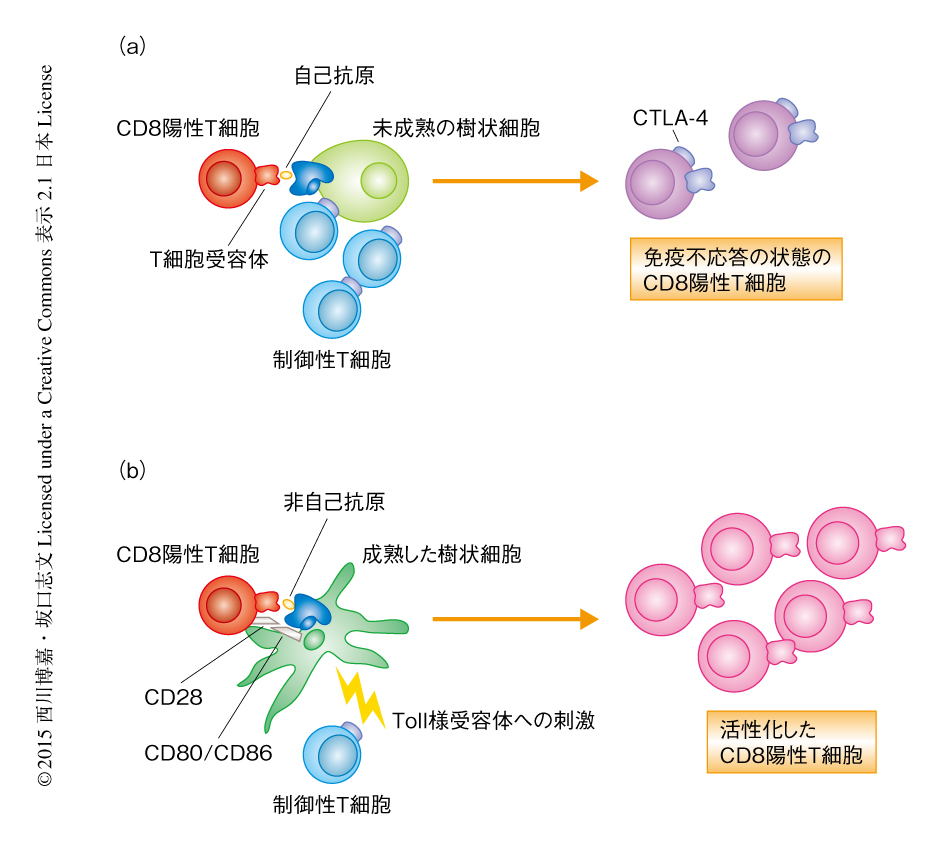
免疫系はウイルスなどの異物に対し反応して免疫応答をひき起こし,これらの異物を排除する.一方で,自己に対しては免疫応答を起こさないためのさまざまな機構を備えている.この自己に対する免疫寛容は,おもに胸腺における自己抗原に特異的なT細胞の排除(中枢性の免疫寛容),および,末梢における自己抗原に特異的なT細胞に対する免疫不応答性の誘導(末梢性の免疫寛容)により成立している.末梢性の免疫寛容において重要なはたらきをしているのが,胸腺に由来する制御性T細胞である1).制御性T細胞を欠損した動物では自己免疫が誘導されることや,制御性T細胞を除去したCD4陽性T細胞の移入によりマウスに自己免疫が誘導されることから,制御性T細胞は自己抗原に特異的なエフェクターT細胞の活性化を抑制することにより,免疫寛容の維持に重要な役割をはたすことが明らかにされている2).しかしながら,免疫寛容を安定的に維持するには自己抗原に特異的なエフェクターT細胞を長期間にわたり抑制する必要があるが,制御性T細胞はどのように自己反応性のT細胞を安定的に抑制しているのか,また,それらの抑制されたT細胞は生体においてどのような表現型をもつのかなど,不明な点が多く残されていた.この研究では,ヒトの試料を用いて,制御性T細胞が自己抗原に特異的なCD8陽性T細胞を特徴的な表現型をもつ免疫不応答の状態3,4) にすることを示した.これにより,末梢性の免疫寛容における制御性T細胞の重要性がさらに明確にされた.
制御性T細胞がメラノサイト関連自己抗原であるMelan-A 5,6) に特異的なCD8陽性T細胞を活性化する際に制御性T細胞がどのように影響するかを検討した.健康な人の末梢血単核球から,CD8陽性T細胞,CD25陽性CD4陽性の制御性T細胞,T細胞を除去した末梢血単核球(抗原提示細胞)を分離した.CD8陽性T細胞と自己抗原(Melan-A)を提示させた抗原提示細胞を共培養し,自己抗原に特異的なCD8陽性T細胞を誘導した.制御性T細胞をさまざまな比率で添加したところ,その量に依存して自己抗原に特異的なCD8陽性T細胞の誘導が低下した.さらに重要なことに,誘導された自己抗原に特異的なCD8陽性T細胞は細胞分裂が1回で停止していた.また,制御性T細胞により抑制され細胞分裂が1回で停止したT細胞は,制御性T細胞の非存在下において誘導された自己抗原に特異的なCD8陽性T細胞に比べ,自己抗原に対するT細胞受容体が低親和性であった.また,2次的な抗原の刺激に対しサイトカインの産生や細胞の増殖を示さず,免疫不応答の状態であった.
免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞における遺伝子発現を遺伝子チップを用いて網羅的に解析したところ,制御性T細胞の非存在下において活性化したCD8陽性T細胞と比較して,約3000の遺伝子において発現の上昇あるいは低下が認められた.細胞表面分子の発現に着目したところ,ナイーブ表現型を示しつつ,免疫抑制分子であるCTLA-4およびPD-1を発現するという特徴的な表現型をもっていた.とりわけ,免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞は,CTLA-4陽性CCR7陽性により定義されることが示された.また,これらの自己抗原に特異的なCD8陽性T細胞はBcl2の発現が低下しており,アポトーシスにおちいりやすいことが明らかになった.
免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞はどのような分子機構により誘導されるのかを解明するため,制御性T細胞の重要な抑制機構のひとつである抗原提示細胞の成熟の抑制に着目した.制御性T細胞の存在のもとでの培養では抗原提示細胞の成熟が阻害されていた.このことにもとづき,成熟した樹状細胞あるいは未成熟な樹状細胞を抗原提示細胞として用い,健康な人の末梢血単核球から分離したCD8陽性T細胞を刺激することにより,免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞を誘導することが可能かどうか検討した.成熟した樹状細胞を用いると自己抗原に特異的なCD8陽性T細胞が効率よく誘導され,細胞分裂も活発であった.一方,未成熟な樹状細胞を用いると自己抗原に特異的なCD8陽性T細胞の誘導が低下するとともに,細胞分裂は1回で停止し,制御性T細胞により抑制された自己抗原に対する親和性の低いT細胞受容体をもつCD8陽性T細胞と同様のT細胞が誘導された.さらに,成熟した樹状細胞にCTLA-4免疫グロブリンを添加して抗原提示細胞からの共刺激をブロックすると,用量に依存的に自己抗原に特異的なCD8陽性T細胞の誘導が低下するとともに,細胞分裂が1回で停止し,自己抗原に対する親和性の低いT細胞受容体をもつCD8陽性T細胞の誘導が上昇した.また,未成熟な樹状細胞およびCTLA-4免疫グロブリンが添加された樹状細胞による誘導により免疫不応答の状態になった自己抗原に特異的なCD8陽性T細胞はCTLA-4陽性CCR7陽性であった.以上より,制御性T細胞による免疫抑制の分子機構として,抗原提示細胞の不活性化の重要性が示された.
健康な人の末梢血に自己抗原に対し免疫不応答の状態の自己反応性のCD8陽性T細胞が存在するかどうか検討した.健康な人の末梢血単核球において,自己抗原に特異的な自己反応性のCD8陽性T細胞の存在が確認された.しかし,これらのT細胞は,in vitroにおいて制御性T細胞の存在のもとで誘導されたT細胞と同じく,CTLA-4陽性CCR7陽性で,抗原の刺激に対し免疫不応答の状態であった.一方,自己抗原Melan-Aに対する免疫寛容が破綻している自己免疫疾患である白斑症7,8) の患者の試料を用いたところ,自己抗原に特異的なCD8陽性T細胞は健康な人と比較して,親和性の高いT細胞受容体をもち,CTLA-4陰性CCR7陰性であり,免疫不応答の状態が破綻していた.また,健康な人においてCTLA-4陽性CCR7陽性の表現型をもつT細胞は,特異的な自己抗原のみでなくポリクローナルな抗原の刺激に対しても免疫不応答性であり,ひろく自己抗原に対する末梢性の免疫寛容の機構として重要であると考えられた.
この研究により,免疫不応答の状態のT細胞がCTLA-4陽性CCR7陽性により定義されることが示され,末梢性の自己寛容における制御性T細胞の重要性が明確になった(図1).これまで,長年にわたり不明であった末梢性の免疫寛容の機構が明確にされていくと考えられた.また,自己免疫や移植免疫における新たな治療戦略にもつながると考えられた.一方,がん免疫においては多くのがん抗原が自己抗原であることから,がん抗原に特異的なT細胞の効率的な活性化をめざした新たなT細胞の活性化法の開発,ひいては,がん免疫療法の開発につながることが期待される.
略歴:2002年 三重大学大学院医学系研究科 修了,2003年 米国Memorial Sloan Kettering Cancer Centerリサーチフェロー,2006年 三重大学大学院医学系研究科 講師を経て,2010年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:がん免疫療法の開発,とくに,がん患者における免疫抑制の機構の解明にもとづく治療法の開発.
抱負:免疫抑制の機構を解明することにより腫瘍に対する免疫応答を制御し,がん免疫療法を効果的な治療法にしたい.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://exp.immunol.ifrec.osaka-u.ac.jp/
© 2015 西川博嘉・坂口志文 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 実験免疫学研究室)
email:西川博嘉
DOI: 10.7875/first.author.2015.001
Detection of self-reactive CD8+ T cells with an anergic phenotype in healthy individuals.
Yuka Maeda, Hiroyoshi Nishikawa, Daisuke Sugiyama, Danbee Ha, Masahide Hamaguchi, Takuro Saito, Megumi Nishioka, James B. Wing, Dennis Adeegbe, Ichiro Katayama, Shimon Sakaguchi
Science, 346, 1536-1540 (2014)
要 約
CD4陽性制御性T細胞は自己免疫反応を回避するうえで重要な役割をはたしている.制御性T細胞がCD8陽性T細胞などエフェクターT細胞の機能を抑制することは明らかにされていたが,制御性T細胞に抑制された自己抗原に特異的なCD8陽性T細胞の動態,また,それら抑制されたT細胞はどのような表現型をもつのかは不明であった.この研究において,筆者らは,制御性T細胞は自己抗原に特異的なCD8陽性T細胞の増殖を抑制し,これらT細胞を抗原による刺激に対し反応しない免疫不応答の状態にすることを明らかにした.制御性T細胞は抗原提示細胞の共刺激分子の発現を低下させることにより,自己抗原に特異的なCD8陽性T細胞を免疫不応答の状態にしていた.これらの自己抗原に特異的なCD8陽性T細胞は,自己抗原に対するT細胞受容体の親和性が低く,ナイーブ表現型を示しつつ,免疫抑制分子を高発現していた.さらに,健康な人の体内に免疫不応答の状態で存在する自己抗原に特異的なCD8陽性T細胞は,自己免疫疾患の患者では活性化されており,この免疫抑制の機構が自己免疫疾患を制御するうえで重要であることが示された.
はじめに
免疫系はウイルスなどの異物に対し反応して免疫応答をひき起こし,これらの異物を排除する.一方で,自己に対しては免疫応答を起こさないためのさまざまな機構を備えている.この自己に対する免疫寛容は,おもに胸腺における自己抗原に特異的なT細胞の排除(中枢性の免疫寛容),および,末梢における自己抗原に特異的なT細胞に対する免疫不応答性の誘導(末梢性の免疫寛容)により成立している.末梢性の免疫寛容において重要なはたらきをしているのが,胸腺に由来する制御性T細胞である1).制御性T細胞を欠損した動物では自己免疫が誘導されることや,制御性T細胞を除去したCD4陽性T細胞の移入によりマウスに自己免疫が誘導されることから,制御性T細胞は自己抗原に特異的なエフェクターT細胞の活性化を抑制することにより,免疫寛容の維持に重要な役割をはたすことが明らかにされている2).しかしながら,免疫寛容を安定的に維持するには自己抗原に特異的なエフェクターT細胞を長期間にわたり抑制する必要があるが,制御性T細胞はどのように自己反応性のT細胞を安定的に抑制しているのか,また,それらの抑制されたT細胞は生体においてどのような表現型をもつのかなど,不明な点が多く残されていた.この研究では,ヒトの試料を用いて,制御性T細胞が自己抗原に特異的なCD8陽性T細胞を特徴的な表現型をもつ免疫不応答の状態3,4) にすることを示した.これにより,末梢性の免疫寛容における制御性T細胞の重要性がさらに明確にされた.
1.制御性T細胞の存在のもとで抗原による刺激をうけた自己抗原に特異的なCD8陽性T細胞は免疫不応答性におちいる
制御性T細胞がメラノサイト関連自己抗原であるMelan-A 5,6) に特異的なCD8陽性T細胞を活性化する際に制御性T細胞がどのように影響するかを検討した.健康な人の末梢血単核球から,CD8陽性T細胞,CD25陽性CD4陽性の制御性T細胞,T細胞を除去した末梢血単核球(抗原提示細胞)を分離した.CD8陽性T細胞と自己抗原(Melan-A)を提示させた抗原提示細胞を共培養し,自己抗原に特異的なCD8陽性T細胞を誘導した.制御性T細胞をさまざまな比率で添加したところ,その量に依存して自己抗原に特異的なCD8陽性T細胞の誘導が低下した.さらに重要なことに,誘導された自己抗原に特異的なCD8陽性T細胞は細胞分裂が1回で停止していた.また,制御性T細胞により抑制され細胞分裂が1回で停止したT細胞は,制御性T細胞の非存在下において誘導された自己抗原に特異的なCD8陽性T細胞に比べ,自己抗原に対するT細胞受容体が低親和性であった.また,2次的な抗原の刺激に対しサイトカインの産生や細胞の増殖を示さず,免疫不応答の状態であった.
2.制御性T細胞の存在のもとで誘導された免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞は特徴的な表現型をもつ
免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞における遺伝子発現を遺伝子チップを用いて網羅的に解析したところ,制御性T細胞の非存在下において活性化したCD8陽性T細胞と比較して,約3000の遺伝子において発現の上昇あるいは低下が認められた.細胞表面分子の発現に着目したところ,ナイーブ表現型を示しつつ,免疫抑制分子であるCTLA-4およびPD-1を発現するという特徴的な表現型をもっていた.とりわけ,免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞は,CTLA-4陽性CCR7陽性により定義されることが示された.また,これらの自己抗原に特異的なCD8陽性T細胞はBcl2の発現が低下しており,アポトーシスにおちいりやすいことが明らかになった.
3.抗原提示細胞からの共刺激の低下により免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞が誘導される
免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞はどのような分子機構により誘導されるのかを解明するため,制御性T細胞の重要な抑制機構のひとつである抗原提示細胞の成熟の抑制に着目した.制御性T細胞の存在のもとでの培養では抗原提示細胞の成熟が阻害されていた.このことにもとづき,成熟した樹状細胞あるいは未成熟な樹状細胞を抗原提示細胞として用い,健康な人の末梢血単核球から分離したCD8陽性T細胞を刺激することにより,免疫不応答の状態の自己抗原に特異的なCD8陽性T細胞を誘導することが可能かどうか検討した.成熟した樹状細胞を用いると自己抗原に特異的なCD8陽性T細胞が効率よく誘導され,細胞分裂も活発であった.一方,未成熟な樹状細胞を用いると自己抗原に特異的なCD8陽性T細胞の誘導が低下するとともに,細胞分裂は1回で停止し,制御性T細胞により抑制された自己抗原に対する親和性の低いT細胞受容体をもつCD8陽性T細胞と同様のT細胞が誘導された.さらに,成熟した樹状細胞にCTLA-4免疫グロブリンを添加して抗原提示細胞からの共刺激をブロックすると,用量に依存的に自己抗原に特異的なCD8陽性T細胞の誘導が低下するとともに,細胞分裂が1回で停止し,自己抗原に対する親和性の低いT細胞受容体をもつCD8陽性T細胞の誘導が上昇した.また,未成熟な樹状細胞およびCTLA-4免疫グロブリンが添加された樹状細胞による誘導により免疫不応答の状態になった自己抗原に特異的なCD8陽性T細胞はCTLA-4陽性CCR7陽性であった.以上より,制御性T細胞による免疫抑制の分子機構として,抗原提示細胞の不活性化の重要性が示された.
4.健康な人の末梢血には自己抗原に対し親和性の低いT細胞受容体をもつ自己反応性のCD8陽性T細胞が存在する
健康な人の末梢血に自己抗原に対し免疫不応答の状態の自己反応性のCD8陽性T細胞が存在するかどうか検討した.健康な人の末梢血単核球において,自己抗原に特異的な自己反応性のCD8陽性T細胞の存在が確認された.しかし,これらのT細胞は,in vitroにおいて制御性T細胞の存在のもとで誘導されたT細胞と同じく,CTLA-4陽性CCR7陽性で,抗原の刺激に対し免疫不応答の状態であった.一方,自己抗原Melan-Aに対する免疫寛容が破綻している自己免疫疾患である白斑症7,8) の患者の試料を用いたところ,自己抗原に特異的なCD8陽性T細胞は健康な人と比較して,親和性の高いT細胞受容体をもち,CTLA-4陰性CCR7陰性であり,免疫不応答の状態が破綻していた.また,健康な人においてCTLA-4陽性CCR7陽性の表現型をもつT細胞は,特異的な自己抗原のみでなくポリクローナルな抗原の刺激に対しても免疫不応答性であり,ひろく自己抗原に対する末梢性の免疫寛容の機構として重要であると考えられた.
おわりに
この研究により,免疫不応答の状態のT細胞がCTLA-4陽性CCR7陽性により定義されることが示され,末梢性の自己寛容における制御性T細胞の重要性が明確になった(図1).これまで,長年にわたり不明であった末梢性の免疫寛容の機構が明確にされていくと考えられた.また,自己免疫や移植免疫における新たな治療戦略にもつながると考えられた.一方,がん免疫においては多くのがん抗原が自己抗原であることから,がん抗原に特異的なT細胞の効率的な活性化をめざした新たなT細胞の活性化法の開発,ひいては,がん免疫療法の開発につながることが期待される.
文 献
- Sakaguchi, S., Miyara, M., Costantino, C. M. et al.: FOXP3+ regulatory T cells in the human immune system. Nat. Rev. Immunol., 10, 490-500 (2010)[PubMed]
- Sakaguchi, S.: Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses. Annu. Rev. Immunol., 22, 531-562 (2004)[PubMed]
- Jenkins, M. K. & Schwartz, R. H.: Antigen presentation by chemically modified splenocytes induces antigen-specific T cell unresponsiveness in vitro and in vivo. J. Exp. Med., 165, 302-319 (1987)[PubMed]
- Schwartz, R. H.: T cell anergy. Annu. Rev. Immunol., 21, 305-334 (2003)[PubMed]
- Coulie, P. G., Brichard, V., Van Pel, A. et al.: A new gene coding for a differentiation antigen recognized by autologous cytolytic T lymphocytes on HLA-A2 melanomas. J. Exp. Med., 180, 35-42 (1994)[PubMed]
- Kawakami, Y., Eliyahu, S., Delgado, C. H. et al.: Identification of a human melanoma antigen recognized by tumor-infiltrating lymphocytes associated with in vivo tumor rejection. Proc. Natl. Acad. Sci. USA, 91, 6458-6462 (1994)[PubMed]
- Ogg, G. S., Rod Dunbar, P., Romero, P. et al.: High frequency of skin-homing melanocyte-specific cytotoxic T lymphocytes in autoimmune vitiligo. J. Exp. Med., 188, 1203-1208 (1998)[PubMed]
- Pittet, M. J., Valmori, D., Dunbar, P. R. et al.: High frequencies of naive Melan-A/MART-1-specific CD8+ T cells in a large proportion of human histocompatibility leukocyte antigen (Hla)-A2 individuals. J. Exp. Med., 190, 705-715 (1999)[PubMed]
著者プロフィール
略歴:2002年 三重大学大学院医学系研究科 修了,2003年 米国Memorial Sloan Kettering Cancer Centerリサーチフェロー,2006年 三重大学大学院医学系研究科 講師を経て,2010年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:がん免疫療法の開発,とくに,がん患者における免疫抑制の機構の解明にもとづく治療法の開発.
抱負:免疫抑制の機構を解明することにより腫瘍に対する免疫応答を制御し,がん免疫療法を効果的な治療法にしたい.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://exp.immunol.ifrec.osaka-u.ac.jp/
© 2015 西川博嘉・坂口志文 Licensed under CC 表示 2.1 日本