フェムト秒X線レーザーにより明らかにされた1.95Å分解能における光化学系II複合体の天然状態の構造
菅 倫寛・秋田総理・沈 建仁
(岡山大学大学院自然科学研究科 地球生命物質科学専攻構造生物学分野)
email:沈 建仁
DOI: 10.7875/first.author.2014.154
Native structure of photosystem II at 1.95Å resolution viewed by femtosecond X-ray pulses.
Michihiro Suga, Fusamichi Akita, Kunio Hirata, Go Ueno, Hironori Murakami, Yoshiki Nakajima, Tetsuya Shimizu, Keitaro Yamashita, Masaki Yamamoto, Hideo Ago, Jian-Ren Shen
Nature, 517, 99-103 (2015)
光化学系II複合体は光エネルギーを利用して水分子から酸素分子を発生させることのできる唯一の天然触媒であり,この触媒を模倣した人工触媒ができれば,太陽光からクリーンなエネルギーを無尽蔵に産出することが可能になるため,エネルギー問題や環境問題を解決する糸口として期待されている.しかしながら,これまで報告された光化学系II複合体の結晶構造はシンクロトロンのX線を用いて解析されたものであり,反応を触媒する部分が放射線の影響をうけて天然状態とはわずかに異なった構造になっていることが示唆されていた.今回,筆者らは,自由電子レーザー施設を利用して光化学系II複合体のフェムト秒X線結晶構造解析を行い,水分解反応の触媒である酸素発生中心の構造を天然状態のまま1.95Å分解能で決定した.得られた酸素発生中心の構造はX線吸収微細構造の測定および理論計算により提唱されていたMn-Mnの距離とその長さが一致しており,放射線による損傷のまったくない構造であることが示唆された.構造にもとづき,水分解反応の開始状態では酸素発生中心を構成するMnの価数はMn1Dが+3,Mn2Cが+4,Mn3Bが+4,Mn4Aが+3であること,水分解反応における基質分子O5の化学種はOH-であること,および,その反応機構を提唱した.
光合成は植物や各種の藻類の行う,太陽光を利用してCO2と水から有機物をつくる反応であり,その副産物である酸素分子はわれわれ人類を含む地球上のすべての好気性生物の生存をささえている.光合成において最初に起こるのは光エネルギーの吸収,一連の電子伝達,水分解反応であり,これらの反応は光化学系II複合体により触媒されている.光化学系II複合体は20個のタンパク質サブユニットと多数の補欠因子から構成される700 kDaの巨大な膜タンパク質複合体であり,その“心臓”部分である酸素発生中心においては文字どおり水分子が水素原子,酸素原子,電子へと分解され最終的に酸素分子が発生する.酸素発生中心の触媒する水分解反応は人工光合成への応用が期待されており,エネルギー問題がクローズアップされる昨今において加速度的に注目が高まっている.2011年,光化学系II複合体の1.9Å分解能でのX線結晶構造解析が成功し,酸素発生中心が“ゆがんだイス型構造”のMn4CaO5クラスターであることがつきとめられた1).この酸素発生中心の構造は水分子を含む詳細な構造情報を提供し水分解反応の理解を大きく進展させたが,これまで報告されていたX線吸収微細構造を用いて決定されたMn-Mnの距離と比べると0.1~0.2Å長くなっており,シンクロトロンのX線を用いて決定した結晶構造は放射線による損傷の影響をうけている可能性を否定できなかった.とくに,Mn4CaO5クラスターの5つの酸素原子のうち,O5とよばれる酸素原子はそのまわりのMnとの結合距離がきわめて長く,このような長い結合距離が放射線による損傷に由来するのか,あるいは,本来の特徴を示しているのか不明であった.
しかし近年,X線自由電子レーザーとよばれる新しい技術が生まれたことにより,これまで不可能とされていた放射線による損傷をうけていない結晶構造を決定する方法が実現した.X線自由電子レーザーでは従来のシンクロトロンの100兆倍もの明るいX線を10フェムト秒の露光時間に試料に入射することができる.このようなX線自由電子レーザーのパルスを利用すれば,ピコ秒単位で起こるといわれている放射線損傷により構造変化の起こるまえにX線回折データを収集することができるので,損傷をうけていない天然状態の構造を決定することができる.
一般に,酵素による触媒反応は触媒中心の官能基と基質の構造や相互作用がごくわずかずつ変化することにより進行する.このごくわずかな構造や相互作用の変化と放射線損傷による構造の変化とを区別することは困難なため,触媒反応を完全に理解するには放射線損傷による構造変化が起こらない方法での構造解析が不可欠である.また,わずかな構造や相互作用の変化を正確に検知するためには高分解能の構造解析が必要である.放射線損傷の影響のまったくない光化学系II複合体の高分解能の結晶構造を得ることを目的として,何千個にもおよぶ光化学系II複合体の大型の結晶を調製し,X線自由電子レーザーを用いてフェムト秒X線結晶構造解析を行った.X線自由電子レーザーの特性を活かした構造解析の例としてはナノサイズの微結晶を用いるシリアルフェムト秒結晶構造解析がよく知られているが,結晶格子のサイズが8 MÅ3にもおよぶ光化学系II複合体などの巨大な膜タンパク質では,シリアルフェムト秒結晶構造解析を適用した場合の回折分解能に限界がある2-4).大型の結晶を用いたフェムト秒X線結晶構造解析の最大の特長は,回折に寄与する結晶の体積を大きくすることにより回折分解能を確保し,かつ,振動領域の連続した一連の静止回折写真を取得することにより既存の構造解析の手法の適用が可能なところにある5).結晶においてビームの照射位置をそれぞれ50μm以上あけ,巨大な結晶において放射線損傷のおよんでいない場所へビームの照射位置を移動させながら一連の回折写真を取得することにより,無損傷の回折データを収集した.得られた回折データは1.95Å分解能で構造解析され,その構造はシンクロトロンのX線を用いて決定した結晶構造の分解能とほぼ同等であり,水分解反応の機構を議論するのに十分な精度をもっていた(図1a,PDB ID:4UB6,4UB8).
X線自由電子レーザーにより得られた酸素発生中心の全体構造はこれまでに報告されていたシンクロトロンのX線を用いて得られた構造と非常によく似ていたが,Mn-Mnの距離およびMn-Oの距離に顕著な違いがみられた.Mn-Mnの距離はMn1D-Mn2Cが2.7Å,Mn1D-Mn3Bが3.2Å,Mn1D-Mn4Aが5.0Å,Mn2C-Mn3Bが2.7Å,Mn2C-Mn4Aが5.2Å,Mn3B-Mn4Aが2.9Åとなっており,すべてのMn-Mnの距離がシンクロトロンのX線による構造と比べ0.1~0.2Å短くなっていた(図1b).これらの距離はX線吸収微細構造により報告されていたものともよく一致しており,X線自由電子レーザーにより放射線損傷のない構造の得られたことが支持された.一方で,Mn-Caの距離はMn1D-Caが3.5Å,Mn2C-Caが3.3Å,Mn3B-Caが3.4Å,Mn4A-Caが3.8Åとなっており,シンクロトロンのX線による構造と大きな差はみられなかった(図1c).
シンクロトロンのX線により得られた酸素発生中心の構造においてもっとも特徴的な点は,O5がほかの酸素原子と比べ異常に長い結合距離をもつ点であった.シンクロトロンのX線による構造では,O5とMn1D,Mn3B,Mn4A,Caとの結合距離は2.4Åから2.7Åであり,換言すると,O5は周囲との結合がとくに弱く不安定な状態で存在していた.X線自由電子レーザーにより得られた酸素発生中心の構造では,Mn3B-O5が2.2Å,Mn4A-O5が2.3Å,Mn1D-O5が2.7Å,Ca-O5が2.5Åとなっており,Mn3B,Mn4A,Caとの結合は0.2Å短くなり,Mn1Dとの結合は逆に0.1Å長くなっていた(図1d).これまでのシンクロトロンのX線による構造解析では,長い結合距離をもつO5の性質は放射線損傷によるアーティファクトである可能性が否定できなかったが,X線自由電子レーザーによる構造解析によりこの性質が酸素発生中心に固有のものであり,したがって,O5が水分解反応の基質分子として反応機構に深くかかわっていることがあらためて示された.
これまでのシンクロトロンのX線による構造をもとにした理論計算から,O5の化学種をO2-とした場合,O5はMn4AあるいはMn1Dのいずれかにひき寄せられ,右型構造あるいは左型構造となることがわかっており,X線自由電子レーザーによる構造においてみられたような長い結合距離は再現できない.一方,O5の化学種をOH-とすると結合距離は少しだけ長くなり,X線自由電子レーザーによる構造においてみられた特徴をある程度まで反映する6).このような先行研究の結果にもとづき,水分解反応の開始状態ではO5がOH-であり,なおかつ,Mn1DおよびMn4Aがそれぞれ+3の価数をもち,Mn1D-O5とMn4A-O5の方向にMn+3に特有のJahn-Teller軸が存在することによりO5の長い結合距離が現われることを提案した.この提案は,55Mn-電子核スピン共鳴法および理論計算により示された,S2状態でMn1Dが+3の価数をもつという実験の結果とも一致した7).
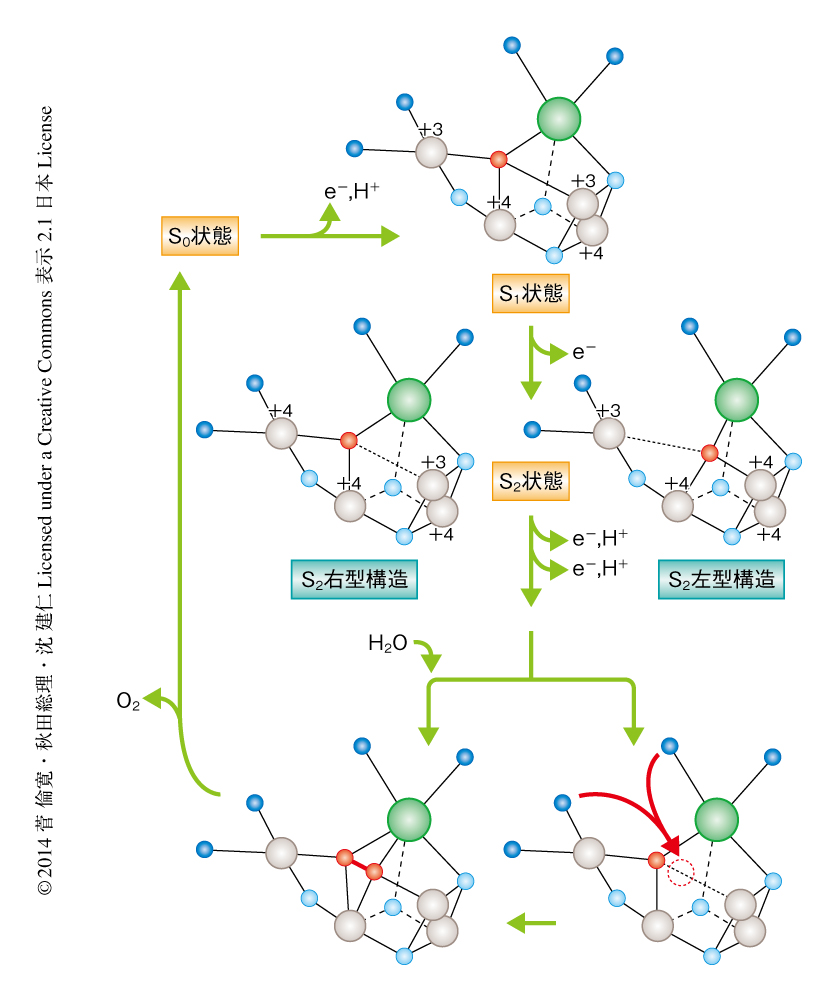
X線自由電子レーザーを用いて決定された水分解反応の開始状態の構造にもとづき,O5の化学種がOH-であり基質分子である可能性の高いことが示唆されたので,この知見から水分解反応の機構を提唱した(図2).まず,S1状態においてはMn1DおよびMn4Aが同じ+3の価数をもち,さらに,Jahn-Teller効果によりMn1D-O5とMn4A-O5は長い結合距離をもつ.電子がひき抜かれS2状態になるとMn1DあるいはMn4Aのいずれかが+4の価数をもつことになり,O5は一方のMnの正の電荷が高くなったこと,および,Jahn-Teller軸の消失により,+4の価数をもつMnの側にひき寄せられる.このとき,Mn4Aの価数が+4になればO5はMn4Aの側にひき寄せられMn3CaO4のキュバンの部分は開いた構造をとり,その結果,Mn1Dの側にスペースができる(O5の右にスペースができるので右型構造とよばれる).逆に,Mn1Dの価数が+4になればO5はMn1Dの側にひき寄せられMn3CaO4のキュバンの部分の閉じた左型構造になる.つづくS3状態およびS4状態では,この開いたスペースに新しい水分子が入りO5とO=O結合を形成する.生成された酸素分子は排出され酸素発生中心はS0状態にもどり,新たな水分子がO5の位置へと取り込まれる.つづくS0状態からS1状態への遷移にともない,水分子からプロトンが抜き取られることによりO5はOH-になり,S1状態へもどる.これらの一連の反応機構は理論計算の結果8),および,最近の電子スピン共鳴による結果9) とも大方で一致していた.
この研究により,水分解反応を触媒する酸素発生中心の天然状態における構造が明らかになり,その構造にもとづき,O5がOH-であることだけでなく,O5を基質分子のひとつとする水分解反応の機構を提唱した.これらの知見は,水分解反応の基本原理を提供し,人工光合成を行う触媒のデザインのためのモデルテンプレートとなることが期待される.
しかしながら,今回,決定されたのは水分解反応の開始状態の構造であり,基質分子となるもう1つの水分子がどこから供給されるのか,O5を中心とする反応機構が本当に機能しているのか,H+の放出場所はどこかなど,解明すべき点は多く残っている.反応機構の全貌を解明するためには,光化学系II複合体の中間状態での高分解能の構造情報が必須であり,これらの中間体の構造解析にもX線自由電子レーザーは大きな威力を発揮すると考えられる.X線自由電子レーザーを利用した構造生物学的な研究はまさに産声をあげたばかりであり,今後の展開が注目される.
略歴:2009年 大阪大学大学院理学研究科 修了,大阪大学蛋白質研究所 研究員,米国Oregon Health & Science大学 研究員を経て,岡山大学大学院自然科学研究科 特任助教(現 助教).
研究テーマ:膜タンパク質の構造生物学.
秋田 総理(Fusamichi Akita)
岡山大学大学院自然科学研究科 助教.
沈 建仁(Jian-Ren Shen)
岡山大学大学院自然科学研究科 教授.
© 2014 菅 倫寛・秋田総理・沈 建仁 Licensed under CC 表示 2.1 日本
(岡山大学大学院自然科学研究科 地球生命物質科学専攻構造生物学分野)
email:沈 建仁
DOI: 10.7875/first.author.2014.154
Native structure of photosystem II at 1.95Å resolution viewed by femtosecond X-ray pulses.
Michihiro Suga, Fusamichi Akita, Kunio Hirata, Go Ueno, Hironori Murakami, Yoshiki Nakajima, Tetsuya Shimizu, Keitaro Yamashita, Masaki Yamamoto, Hideo Ago, Jian-Ren Shen
Nature, 517, 99-103 (2015)
要 約
光化学系II複合体は光エネルギーを利用して水分子から酸素分子を発生させることのできる唯一の天然触媒であり,この触媒を模倣した人工触媒ができれば,太陽光からクリーンなエネルギーを無尽蔵に産出することが可能になるため,エネルギー問題や環境問題を解決する糸口として期待されている.しかしながら,これまで報告された光化学系II複合体の結晶構造はシンクロトロンのX線を用いて解析されたものであり,反応を触媒する部分が放射線の影響をうけて天然状態とはわずかに異なった構造になっていることが示唆されていた.今回,筆者らは,自由電子レーザー施設を利用して光化学系II複合体のフェムト秒X線結晶構造解析を行い,水分解反応の触媒である酸素発生中心の構造を天然状態のまま1.95Å分解能で決定した.得られた酸素発生中心の構造はX線吸収微細構造の測定および理論計算により提唱されていたMn-Mnの距離とその長さが一致しており,放射線による損傷のまったくない構造であることが示唆された.構造にもとづき,水分解反応の開始状態では酸素発生中心を構成するMnの価数はMn1Dが+3,Mn2Cが+4,Mn3Bが+4,Mn4Aが+3であること,水分解反応における基質分子O5の化学種はOH-であること,および,その反応機構を提唱した.
はじめに
光合成は植物や各種の藻類の行う,太陽光を利用してCO2と水から有機物をつくる反応であり,その副産物である酸素分子はわれわれ人類を含む地球上のすべての好気性生物の生存をささえている.光合成において最初に起こるのは光エネルギーの吸収,一連の電子伝達,水分解反応であり,これらの反応は光化学系II複合体により触媒されている.光化学系II複合体は20個のタンパク質サブユニットと多数の補欠因子から構成される700 kDaの巨大な膜タンパク質複合体であり,その“心臓”部分である酸素発生中心においては文字どおり水分子が水素原子,酸素原子,電子へと分解され最終的に酸素分子が発生する.酸素発生中心の触媒する水分解反応は人工光合成への応用が期待されており,エネルギー問題がクローズアップされる昨今において加速度的に注目が高まっている.2011年,光化学系II複合体の1.9Å分解能でのX線結晶構造解析が成功し,酸素発生中心が“ゆがんだイス型構造”のMn4CaO5クラスターであることがつきとめられた1).この酸素発生中心の構造は水分子を含む詳細な構造情報を提供し水分解反応の理解を大きく進展させたが,これまで報告されていたX線吸収微細構造を用いて決定されたMn-Mnの距離と比べると0.1~0.2Å長くなっており,シンクロトロンのX線を用いて決定した結晶構造は放射線による損傷の影響をうけている可能性を否定できなかった.とくに,Mn4CaO5クラスターの5つの酸素原子のうち,O5とよばれる酸素原子はそのまわりのMnとの結合距離がきわめて長く,このような長い結合距離が放射線による損傷に由来するのか,あるいは,本来の特徴を示しているのか不明であった.
しかし近年,X線自由電子レーザーとよばれる新しい技術が生まれたことにより,これまで不可能とされていた放射線による損傷をうけていない結晶構造を決定する方法が実現した.X線自由電子レーザーでは従来のシンクロトロンの100兆倍もの明るいX線を10フェムト秒の露光時間に試料に入射することができる.このようなX線自由電子レーザーのパルスを利用すれば,ピコ秒単位で起こるといわれている放射線損傷により構造変化の起こるまえにX線回折データを収集することができるので,損傷をうけていない天然状態の構造を決定することができる.
1.光化学系II複合体のフェムト秒X線結晶構造解析
一般に,酵素による触媒反応は触媒中心の官能基と基質の構造や相互作用がごくわずかずつ変化することにより進行する.このごくわずかな構造や相互作用の変化と放射線損傷による構造の変化とを区別することは困難なため,触媒反応を完全に理解するには放射線損傷による構造変化が起こらない方法での構造解析が不可欠である.また,わずかな構造や相互作用の変化を正確に検知するためには高分解能の構造解析が必要である.放射線損傷の影響のまったくない光化学系II複合体の高分解能の結晶構造を得ることを目的として,何千個にもおよぶ光化学系II複合体の大型の結晶を調製し,X線自由電子レーザーを用いてフェムト秒X線結晶構造解析を行った.X線自由電子レーザーの特性を活かした構造解析の例としてはナノサイズの微結晶を用いるシリアルフェムト秒結晶構造解析がよく知られているが,結晶格子のサイズが8 MÅ3にもおよぶ光化学系II複合体などの巨大な膜タンパク質では,シリアルフェムト秒結晶構造解析を適用した場合の回折分解能に限界がある2-4).大型の結晶を用いたフェムト秒X線結晶構造解析の最大の特長は,回折に寄与する結晶の体積を大きくすることにより回折分解能を確保し,かつ,振動領域の連続した一連の静止回折写真を取得することにより既存の構造解析の手法の適用が可能なところにある5).結晶においてビームの照射位置をそれぞれ50μm以上あけ,巨大な結晶において放射線損傷のおよんでいない場所へビームの照射位置を移動させながら一連の回折写真を取得することにより,無損傷の回折データを収集した.得られた回折データは1.95Å分解能で構造解析され,その構造はシンクロトロンのX線を用いて決定した結晶構造の分解能とほぼ同等であり,水分解反応の機構を議論するのに十分な精度をもっていた(図1a,PDB ID:4UB6,4UB8).
2.酸素発生中心の構造
X線自由電子レーザーにより得られた酸素発生中心の全体構造はこれまでに報告されていたシンクロトロンのX線を用いて得られた構造と非常によく似ていたが,Mn-Mnの距離およびMn-Oの距離に顕著な違いがみられた.Mn-Mnの距離はMn1D-Mn2Cが2.7Å,Mn1D-Mn3Bが3.2Å,Mn1D-Mn4Aが5.0Å,Mn2C-Mn3Bが2.7Å,Mn2C-Mn4Aが5.2Å,Mn3B-Mn4Aが2.9Åとなっており,すべてのMn-Mnの距離がシンクロトロンのX線による構造と比べ0.1~0.2Å短くなっていた(図1b).これらの距離はX線吸収微細構造により報告されていたものともよく一致しており,X線自由電子レーザーにより放射線損傷のない構造の得られたことが支持された.一方で,Mn-Caの距離はMn1D-Caが3.5Å,Mn2C-Caが3.3Å,Mn3B-Caが3.4Å,Mn4A-Caが3.8Åとなっており,シンクロトロンのX線による構造と大きな差はみられなかった(図1c).
シンクロトロンのX線により得られた酸素発生中心の構造においてもっとも特徴的な点は,O5がほかの酸素原子と比べ異常に長い結合距離をもつ点であった.シンクロトロンのX線による構造では,O5とMn1D,Mn3B,Mn4A,Caとの結合距離は2.4Åから2.7Åであり,換言すると,O5は周囲との結合がとくに弱く不安定な状態で存在していた.X線自由電子レーザーにより得られた酸素発生中心の構造では,Mn3B-O5が2.2Å,Mn4A-O5が2.3Å,Mn1D-O5が2.7Å,Ca-O5が2.5Åとなっており,Mn3B,Mn4A,Caとの結合は0.2Å短くなり,Mn1Dとの結合は逆に0.1Å長くなっていた(図1d).これまでのシンクロトロンのX線による構造解析では,長い結合距離をもつO5の性質は放射線損傷によるアーティファクトである可能性が否定できなかったが,X線自由電子レーザーによる構造解析によりこの性質が酸素発生中心に固有のものであり,したがって,O5が水分解反応の基質分子として反応機構に深くかかわっていることがあらためて示された.
これまでのシンクロトロンのX線による構造をもとにした理論計算から,O5の化学種をO2-とした場合,O5はMn4AあるいはMn1Dのいずれかにひき寄せられ,右型構造あるいは左型構造となることがわかっており,X線自由電子レーザーによる構造においてみられたような長い結合距離は再現できない.一方,O5の化学種をOH-とすると結合距離は少しだけ長くなり,X線自由電子レーザーによる構造においてみられた特徴をある程度まで反映する6).このような先行研究の結果にもとづき,水分解反応の開始状態ではO5がOH-であり,なおかつ,Mn1DおよびMn4Aがそれぞれ+3の価数をもち,Mn1D-O5とMn4A-O5の方向にMn+3に特有のJahn-Teller軸が存在することによりO5の長い結合距離が現われることを提案した.この提案は,55Mn-電子核スピン共鳴法および理論計算により示された,S2状態でMn1Dが+3の価数をもつという実験の結果とも一致した7).
3.水分解の反応機構
X線自由電子レーザーを用いて決定された水分解反応の開始状態の構造にもとづき,O5の化学種がOH-であり基質分子である可能性の高いことが示唆されたので,この知見から水分解反応の機構を提唱した(図2).まず,S1状態においてはMn1DおよびMn4Aが同じ+3の価数をもち,さらに,Jahn-Teller効果によりMn1D-O5とMn4A-O5は長い結合距離をもつ.電子がひき抜かれS2状態になるとMn1DあるいはMn4Aのいずれかが+4の価数をもつことになり,O5は一方のMnの正の電荷が高くなったこと,および,Jahn-Teller軸の消失により,+4の価数をもつMnの側にひき寄せられる.このとき,Mn4Aの価数が+4になればO5はMn4Aの側にひき寄せられMn3CaO4のキュバンの部分は開いた構造をとり,その結果,Mn1Dの側にスペースができる(O5の右にスペースができるので右型構造とよばれる).逆に,Mn1Dの価数が+4になればO5はMn1Dの側にひき寄せられMn3CaO4のキュバンの部分の閉じた左型構造になる.つづくS3状態およびS4状態では,この開いたスペースに新しい水分子が入りO5とO=O結合を形成する.生成された酸素分子は排出され酸素発生中心はS0状態にもどり,新たな水分子がO5の位置へと取り込まれる.つづくS0状態からS1状態への遷移にともない,水分子からプロトンが抜き取られることによりO5はOH-になり,S1状態へもどる.これらの一連の反応機構は理論計算の結果8),および,最近の電子スピン共鳴による結果9) とも大方で一致していた.
おわりに
この研究により,水分解反応を触媒する酸素発生中心の天然状態における構造が明らかになり,その構造にもとづき,O5がOH-であることだけでなく,O5を基質分子のひとつとする水分解反応の機構を提唱した.これらの知見は,水分解反応の基本原理を提供し,人工光合成を行う触媒のデザインのためのモデルテンプレートとなることが期待される.
しかしながら,今回,決定されたのは水分解反応の開始状態の構造であり,基質分子となるもう1つの水分子がどこから供給されるのか,O5を中心とする反応機構が本当に機能しているのか,H+の放出場所はどこかなど,解明すべき点は多く残っている.反応機構の全貌を解明するためには,光化学系II複合体の中間状態での高分解能の構造情報が必須であり,これらの中間体の構造解析にもX線自由電子レーザーは大きな威力を発揮すると考えられる.X線自由電子レーザーを利用した構造生物学的な研究はまさに産声をあげたばかりであり,今後の展開が注目される.
文 献
- Umena, Y., Kawakami, K., Shen, J. R. et al.: Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9Å. Nature, 473, 55-60 (2011)[PubMed]
- Kern, J., Alonso-Mori, R., Tran, R. et al.: Simultaneous femtosecond X-ray spectroscopy and diffraction of photosystem II at room temperature. Science, 340, 491-495 (2013)[PubMed]
- Kern, J., Tran, R., Alonso-Mori, R. et al.: Taking snapshots of photosynthetic water oxidation using femtosecond X-ray diffraction and spectroscopy. Nat. Commun., 5, 4371 (2014)[PubMed]
- Kupitz, C., Basu, S., Grotjohann, I. et al.: Serial time-resolved crystallography of photosystem II using a femtosecond X-ray laser. Nature, 513, 261-265 (2014)[PubMed]
- Hirata, K., Shinzawa-Itoh, K., Yano, N. et al.: Determination of damage-free crystal structure of an X-ray-sensitive protein using an XFEL. Nat. Methods, 11, 734-736 (2014)[PubMed]
- Shoji, M., Isobe, H., Yamanaka, S. et al.: Theoretical modelling of biomolecular systems I. Large-scale QM/MM calculations of hydrogen-bonding networks of the oxygen evolving complex of photosystem II. Mol. Phys., 113, 359-384 (2015)
- Cox, N., Rapatskiy, L., Su, J. H. et al.: Effect of Ca2+/Sr2+ substitution on the electronic structure of the oxygen-evolving complex of photosystem II: a combined multifrequency EPR, 55Mn-ENDOR, and DFT study of the S2 state. J. Am. Chem. Soc., 133, 3635-3648 (2011)[PubMed]
- Siegbahn, P. E.: Water oxidation mechanism in photosystem II, including oxidations, proton release pathways, O-O bond formation and O2 release. Biochim. Biophys. Acta, 1827, 1003-1019 (2013)[PubMed]
- Cox, N., Retegan, M., Neese, F. et al.: Electronic structure of the oxygen-evolving complex in photosystem II prior to O-O bond formation. Science, 345, 804-808 (2014)[PubMed]
著者プロフィール
略歴:2009年 大阪大学大学院理学研究科 修了,大阪大学蛋白質研究所 研究員,米国Oregon Health & Science大学 研究員を経て,岡山大学大学院自然科学研究科 特任助教(現 助教).
研究テーマ:膜タンパク質の構造生物学.
秋田 総理(Fusamichi Akita)
岡山大学大学院自然科学研究科 助教.
沈 建仁(Jian-Ren Shen)
岡山大学大学院自然科学研究科 教授.
© 2014 菅 倫寛・秋田総理・沈 建仁 Licensed under CC 表示 2.1 日本