ブロモドメインタンパク質BRD4は転写の開始から完了までのさまざまなステップにおいて多角的に転写を促進する
菅野由香1・尾里啓子2・菅野智彦3
(1米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch,2米国NIH National Institute of Child Health and Human Development,Program in Genomics of Differentiation,3米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Immunology)
email:菅野智彦
DOI: 10.7875/first.author.2014.151
BRD4 assists elongation of both coding and enhancer RNAs by interacting with acetylated histones.
Tomohiko Kanno, Yuka Kanno, Gary LeRoy, Eric Campos, Hong-Wei Sun, Stephen R. Brooks, Golnaz Vahedi, Tom D. Heightman, Benjamin A. Garcia, Danny Reinberg, Ulrich Siebenlist, John J. O'Shea, Keiko Ozato
Nature Structural & Molecular Biology, 21, 1047-1057 (2014)
BET阻害薬はブロモドメインタンパク質とアセチル化修飾をうけたヒストンとの結合を阻害することにより,がん細胞の増殖を抑制する.BET系のブロモドメインタンパク質の代表であるBRD4の作用機序として,転写開始点の近傍において一時停止しているRNAポリメラーゼIIをP-TEFbを動員することにより解放するはたらきが知られている.この研究では,BRD4の新たな役割について解析し,転写開始点から遠く離れたエンハンサー領域や構造遺伝子の領域にもBRD4は存在し,転写伸長を直接に促進していることを確認した.BRD4はRNAポリメラーゼII転写伸長複合体と結合し,RNAポリメラーゼIIがヌクレオソームを効率よく通過するのを助けた.これは,アセチル化修飾をうけたヒストンを認識するブロモドメインを介したはたらきであった.さらに,BET阻害薬は活性化したエンハンサー領域において産生されるエンハンサーRNAの量を抑制していた.したがって,BRD4は転写の開始から完了までのさまざまなステップにおいて従来の認識をこえて多角的に機能しており,とくに,転写伸長におけるRNAポリメラーゼIIの進行ガイド役としてゲノムの広い範囲ではたらく新たな作用機序が明らかになった.
JQ1は最近,もっとも注目されている抗がん剤あるいは治験薬のひとつであり1),エピゲノム創薬の一環を担う期待の新薬である.がん細胞に由来する培養細胞の培地での増殖実験,および,マウスの体内へ移植したのちの増殖能をみた実験から,JQ1は多発性骨髄腫2),急性骨髄性白血病,混合性白血病3),びまん性大細胞型B細胞性リンパ腫4),NUT正中線がん1),肺がん,前立腺がんにおいて,細胞の増殖を抑制することが報告されている.JQ1は細胞膜に対し透過性をもつ低分子化合物で,Lysのアセチル化修飾を模倣した構造をもち,細胞においてBET系のブロモドメインタンパク質のもつ,アセチル化修飾をうけたLysに対する結合ポケットに結合する拮抗阻害剤である1).
JQ1により阻害されるBET系のブロモドメインタンパク質としてもっとも注目されているのがBRD4である1-3).BRD4の構造の特徴としては,アセチル化修飾をうけたLysに結合するブロモドメインユニットを2つもつことにくわえ5),C末端側にP-TEFbと結合する領域の存在することがあげられる6,7).RNAポリメラーゼIIによる転写においては,転写を開始してすぐに抑制タンパク質によりRNAポリメラーゼIIが一時停止し,転写開始点の数十塩基ほど下流にとどまることがある.P-TEFbはリン酸化酵素であり,この抑制タンパク質を不活性化しRNAポリメラーゼIIを一時停止の状態から解放する.この作用からP-TEFbは転写の活性化タンパク質と考えられている6,8).一方で,核においてDNAはヒストンとの複合体であるヌクレオソームを構成し,多くの場合,ヒストンのアセチル化が転写活性と正に相関している.このことから,ヒストンのアセチル化修飾をうけたLysに結合するBRD4は,P-TEFbを動員してRNAポリメラーゼIIを一時停止の状態から解放することにより転写の促進に寄与していると考えられてきた2-4,6,8,9).しかし,このような一時停止の解除作用が起動したのちの転写伸長の段階においては,BRD4の関与は明らかではなかった.転写伸長においては,RNAポリメラーゼIIは単独ではヌクレオソームを排除して転写伸長をつづけることはできず,なんらかの補助が必要である.BET系のブロモドメインタンパク質のひとつであるBRD2には,アセチル化したヒストンとの結合能によりRNAポリメラーゼIIの転写伸長を促進するというin vitroにおけるヒストンシャペロン活性について報告があり10),BRD4に関しても同様のヒストンシャペロン機能の存在が予想された.
この研究では,BRD4がP-TEFbを介さずに直接に転写伸長の促進に寄与していること,したがって,JQ1の作用機序も,BRD4およびP-TEFbを介した転写伸長の一時停止の解除を阻害することにとどまらず,より直接的に転写伸長複合体との連携を抑制する作用のあることを明らかにした.さらに,BRD4による転写伸長の促進はエンハンサー領域においても確認され,これがBRD4によるエンハンサー機能の亢進,ひいては,標的遺伝子の転写開始の促進に寄与しているものと考えられた.
JQ1による転写の抑制については多くの報告があるが,そのほとんどにおいて,標的はBRD4であるとされている1-3,8,9).さらに,既報では,JQ1の作用機序はBRD4を介したP-TEFbの動員を抑制することと説明されている2-4,8,9).実際に,その根拠として,クロマチン免疫沈降法やクロマチン免疫沈降-シークエンシング法によるRNAポリメラーゼIIのゲノムにおける局在が提示されていたが,JQ1によるP-TEFbの動員の阻止を支持するようなRNAポリメラーゼIIの局在の変化は明らかとはいえなかった.
そこで,転写伸長の途中にありクロマチンと強く結合しているRNAの3’末端をRNAシークエンシング法により選択的に同定し,転写伸長を直接に観察した.モデルとしてマウスの線維芽細胞を使い,血清を除去したのち再刺激する方法により,刺激応答遺伝子の転写開始および転写伸長に対するJQ1の抑制効果を詳細に解析した.その結果,もっとも著明な変化は転写開始の直後に検出される短いRNAが減少したことであった.さらに,転写伸長の抑制効果の分布には不均衡があり,転写開始点の近傍においては著明ではなく,転写伸長の進行にともない顕著になった.これらの結果は,JQ1の阻害効果は転写開始点の近傍における転写伸長の一時停止の解除に対してであるという従来の説では説明しきれないものであった.
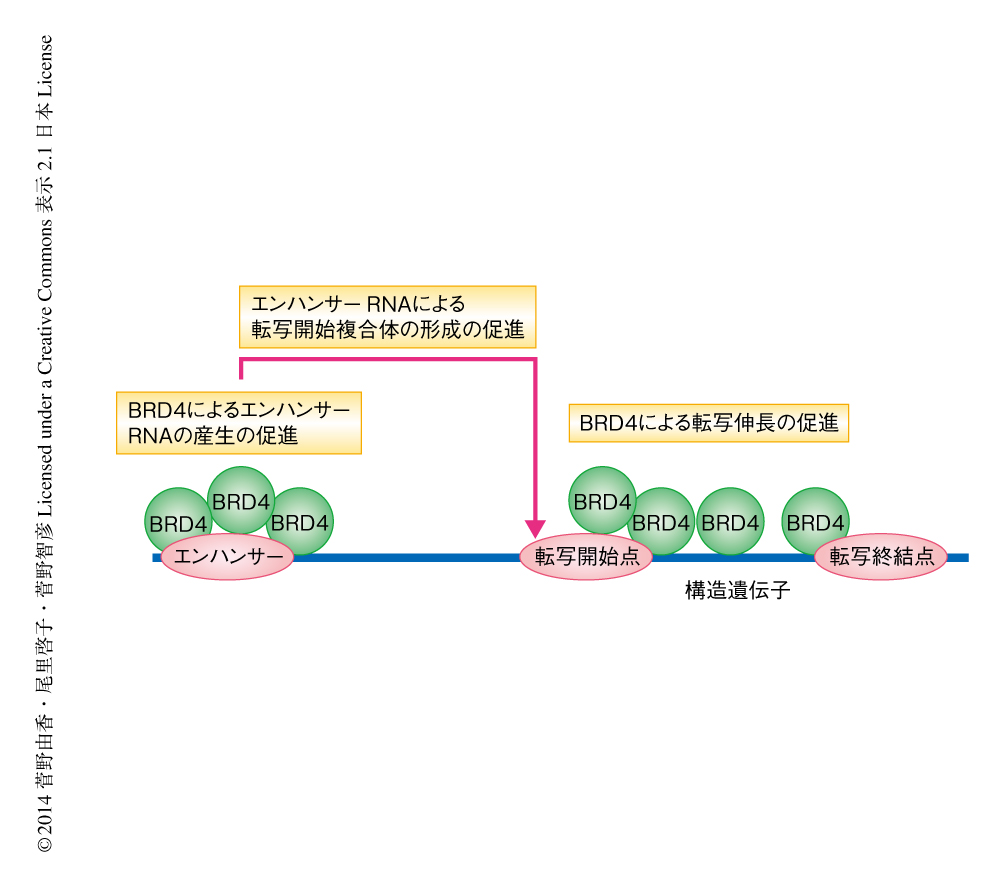
BRD4が転写開始点の近傍に限局せず広くほかの領域にも分布したことから,JQ1による転写開始の抑制はBRD4のエンハンサー領域における機能に対する抑制である可能性が考えられた.そこで,さきのRNAシークエンシング法によるデータとクロマチン免疫沈降-シークエンシング法によるRNAポリメラーゼII,BRD4,P-TEFbの局在のデータを詳細に比較し,統計学的な相関関係をもとめた.その結果,BRD4の局在はエンハンサー領域および構造遺伝子の領域の両方において,RNAポリメラーゼIIの局在や伸長しているRNAと正に相関し,これらはJQ1により阻害された.一方,P-TEFbの局在はエンハンサー領域においてはRNAポリメラーゼIIの局在と負の相関を示し,構造遺伝子の領域においてはRNAポリメラーゼIIの局在や伸長しているRNAと弱い相関を示したが,これらの相関関係はJQ1の影響をうけず,BRD4に依存しないP-TEFb独自の転写促進活性と判断された.さらに,エンハンサー領域におけるBRD4の局在,エンハンサーRNAの産生量,標的遺伝子の転写活性には相関があり,これはJQ1により阻害された.エンハンサーRNAによる標的遺伝子の転写の活性化の分子機構は十分に確立されたわけではないものの,BRD4がエンハンサーRNAの産生を促進することにより標的遺伝子の転写を活性化している可能性が強く示唆された(図1).さらには,エンハンサーRNAの産生をともなわないBRD4の局在と,その近傍にある標的遺伝子の転写活性とは相関を示さなかった.この結果は,最近,提唱された抗転写停止エンハンサーの仮説9) を支持するものではなかった.
[Download]
JQ1の作用機序をBRD4に限定して解明するため,ブロモドメインに点変異を導入した変異型BRD4を,BRD4をノックダウンした細胞に再導入し発現させた.野生型BRD4を再導入したときはBRD4に依存性した転写活性はもとのレベルにまで回復したが,ブロモドメインに点変異をもつ変異型BRD4を再導入しても転写活性は十分には回復しなかった.代表的なBRD4依存性の遺伝子であるKLF4遺伝子についてさらに詳細に解析すると,ブロモドメインを必要としJQ1に感受性のある転写の段階は,BRD4が転写開始点に動員される転写開始の段階ではなく,そののちの転写伸長の段階であることが明らかになった.一般に,ヒストンのアセチル化などのエピゲノム修飾は,それを認識するドメインをもつタンパク質を動員するための標識と考えられており,BRD4のブロモドメインの機能についても単なる解読の機能のみが論じられているなかで,BRD4のブロモドメインが解読の機能にとどまらず,このタンパク質に内在する生理的な活性そのものにかかわっていることが明らかにされた.
BRD4はヒストンのアセチル化に依存したヒストンシャペロン活性をもち,精製タンパク質によるin vitro再構築系において転写伸長を促進した.この反応系にはP-TEFbは含まれておらず,認められた活性はBRD4それ自体の機能と考えられた.BRD4が転写伸長を促進する機能は培養細胞を使った実験系においても示された.実験方法として,クロマチンRNAシークエンシング法,Ser5がリン酸化された転写開始型のRNAポリメラーゼIIおよびSer2がリン酸化された転写伸長型のRNAポリメラーゼIIに対するクロマチン免疫沈降法,伸長しているRNAの末端をブロモ化UTPを用いて標識,細断化,RNA免疫沈降したのち,DNAに逆転写してRNAの末端の局在をゲノムにおいてマップする方法,の3つを行った.いずれの実験においても,BRD4をノックダウンした細胞にP-TEFbと結合できない変異型BRD4を再導入すると転写伸長がみられ,さらに,ブロモドメインに点変異を導入した変異型BRD4の再導入では転写伸長はみられなかった.この結果から,BRD4それ自体がブロモドメインに依存して転写伸長を促進する機能をもつこと,その機能はアセチル化したヒストンに依存したBRD4のヒストンシャペロン活性によることが結論づけられた.
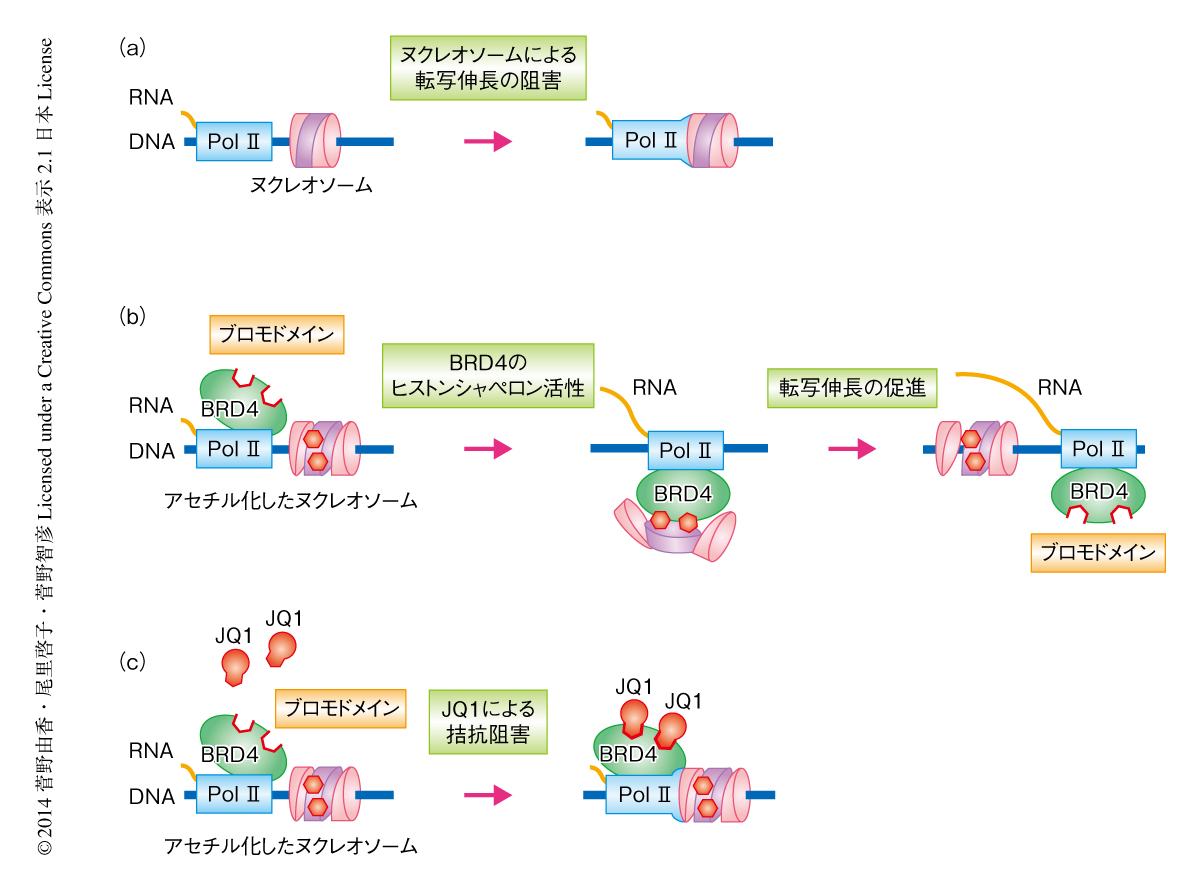
さらに,伸長しているブロモUTP標識RNAとBRD4を含む転写伸長複合体に対する連続免疫沈降法により,BRD4がRNAポリメラーゼII転写伸長複合体と物理的に接触し,ゲノムの転写領域において複合体として共存していることが確認された.一方で,BRD4は転写開始点およびエンハンサー領域において転写メディエーター複合体と物理的に接触していた.したがって,BRD4は複数のステップによりRNAポリメラーゼII複合体に取り込まれるものと推察された.転写開始においてRNAポリメラーゼIIは転写開始複合体へと動員され,そこでメディエーター複合体により独自に動員されたBRD4と物理的に接触し,2つのタンパク質を含んだ転写伸長複合体となると考えられた(図2).
(a)転写伸長において,RNAポリメラーゼIIは単独ではヌクレオソームを排除して転写伸長をつづけることはできない.
(b)BRD4はブロモドメインによるアセチル化ヒストンへの接触に依存したヒストンシャペロン活性をもち,転写伸長を促進する.
(c)BET阻害薬であるJQ1は,BRD4のブロモドメインのもつアセチル化修飾をうけたLysに対する結合ポケットに結合し,ブロモドメインとアセチル化ヌクレオソームとの結合を拮抗阻害することにより,転写伸長を抑制する.
Pol II:RNAポリメラーゼII,六角形はヒストンのアセチル化を示す.
[Download]
今回の結果は,BRD4はP-TEFbを動員するアダプターとしてではなく,適切な環境において自らRNAポリメラーゼIIの転写伸長を促進する活性を備えたタンパク質であることを示した.さらに,エンハンサーを活性化することにより転写開始をも促進することが示された.このことは,アダプター説および転写停止解除説をとなえるほかの多くの報告を否定するものではないが,それらの仮説のみでは十分に理解できない現象を説明できる作用機序であるといえた.アセチル化ヒストンに依存したヒストンシャペロン活性はBRD2,BRD3,BRD4に共通している.このことは,JQ1による抑制効果がBRD2,BRD3,BRD4の個別のノックダウンにより模倣されたという報告を支持する4,11).JQ1はBET系のブロモドメインタンパク質にかぎれば選択性がなく,選択性のある改良型の薬剤の開発と応用が展望される.
略歴:1987年 東北大学大学院医学研究科 修了,1995年 京都大学ウイルス研究所 助手を経て,2004年より米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases常任研究員.
研究テーマ:T細胞におけるエンハンサーのエピジェネティクス.
尾里 啓子(Keiko Ozato)
米国NIH National Institute of Child Health and Human Development部門主任.
菅野 智彦(Tomohiko Kanno)
米国NIH National Institute of Allergy and Infectious Diseases研究員.
© 2014 菅野由香・尾里啓子・菅野智彦 Licensed under CC 表示 2.1 日本
(1米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch,2米国NIH National Institute of Child Health and Human Development,Program in Genomics of Differentiation,3米国NIH National Institute of Allergy and Infectious Diseases,Laboratory of Molecular Immunology)
email:菅野智彦
DOI: 10.7875/first.author.2014.151
BRD4 assists elongation of both coding and enhancer RNAs by interacting with acetylated histones.
Tomohiko Kanno, Yuka Kanno, Gary LeRoy, Eric Campos, Hong-Wei Sun, Stephen R. Brooks, Golnaz Vahedi, Tom D. Heightman, Benjamin A. Garcia, Danny Reinberg, Ulrich Siebenlist, John J. O'Shea, Keiko Ozato
Nature Structural & Molecular Biology, 21, 1047-1057 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
ブロモドメインタンパク質BRD4(Q9ESU6), BRD4(Q9ESU6), histone, ブロモドメインタンパク質, ヒストン, RNAポリメラーゼII, P-TEFb, RNAポリメラーゼII転写伸長複合体, BRD2(P25440), KLF4(Q60793), 転写メディエーター複合体, 転写開始複合体, メディエーター複合体, 転写伸長複合体, BRD3(Q8K2F0), Pol II
要 約
BET阻害薬はブロモドメインタンパク質とアセチル化修飾をうけたヒストンとの結合を阻害することにより,がん細胞の増殖を抑制する.BET系のブロモドメインタンパク質の代表であるBRD4の作用機序として,転写開始点の近傍において一時停止しているRNAポリメラーゼIIをP-TEFbを動員することにより解放するはたらきが知られている.この研究では,BRD4の新たな役割について解析し,転写開始点から遠く離れたエンハンサー領域や構造遺伝子の領域にもBRD4は存在し,転写伸長を直接に促進していることを確認した.BRD4はRNAポリメラーゼII転写伸長複合体と結合し,RNAポリメラーゼIIがヌクレオソームを効率よく通過するのを助けた.これは,アセチル化修飾をうけたヒストンを認識するブロモドメインを介したはたらきであった.さらに,BET阻害薬は活性化したエンハンサー領域において産生されるエンハンサーRNAの量を抑制していた.したがって,BRD4は転写の開始から完了までのさまざまなステップにおいて従来の認識をこえて多角的に機能しており,とくに,転写伸長におけるRNAポリメラーゼIIの進行ガイド役としてゲノムの広い範囲ではたらく新たな作用機序が明らかになった.
はじめに
JQ1は最近,もっとも注目されている抗がん剤あるいは治験薬のひとつであり1),エピゲノム創薬の一環を担う期待の新薬である.がん細胞に由来する培養細胞の培地での増殖実験,および,マウスの体内へ移植したのちの増殖能をみた実験から,JQ1は多発性骨髄腫2),急性骨髄性白血病,混合性白血病3),びまん性大細胞型B細胞性リンパ腫4),NUT正中線がん1),肺がん,前立腺がんにおいて,細胞の増殖を抑制することが報告されている.JQ1は細胞膜に対し透過性をもつ低分子化合物で,Lysのアセチル化修飾を模倣した構造をもち,細胞においてBET系のブロモドメインタンパク質のもつ,アセチル化修飾をうけたLysに対する結合ポケットに結合する拮抗阻害剤である1).
JQ1により阻害されるBET系のブロモドメインタンパク質としてもっとも注目されているのがBRD4である1-3).BRD4の構造の特徴としては,アセチル化修飾をうけたLysに結合するブロモドメインユニットを2つもつことにくわえ5),C末端側にP-TEFbと結合する領域の存在することがあげられる6,7).RNAポリメラーゼIIによる転写においては,転写を開始してすぐに抑制タンパク質によりRNAポリメラーゼIIが一時停止し,転写開始点の数十塩基ほど下流にとどまることがある.P-TEFbはリン酸化酵素であり,この抑制タンパク質を不活性化しRNAポリメラーゼIIを一時停止の状態から解放する.この作用からP-TEFbは転写の活性化タンパク質と考えられている6,8).一方で,核においてDNAはヒストンとの複合体であるヌクレオソームを構成し,多くの場合,ヒストンのアセチル化が転写活性と正に相関している.このことから,ヒストンのアセチル化修飾をうけたLysに結合するBRD4は,P-TEFbを動員してRNAポリメラーゼIIを一時停止の状態から解放することにより転写の促進に寄与していると考えられてきた2-4,6,8,9).しかし,このような一時停止の解除作用が起動したのちの転写伸長の段階においては,BRD4の関与は明らかではなかった.転写伸長においては,RNAポリメラーゼIIは単独ではヌクレオソームを排除して転写伸長をつづけることはできず,なんらかの補助が必要である.BET系のブロモドメインタンパク質のひとつであるBRD2には,アセチル化したヒストンとの結合能によりRNAポリメラーゼIIの転写伸長を促進するというin vitroにおけるヒストンシャペロン活性について報告があり10),BRD4に関しても同様のヒストンシャペロン機能の存在が予想された.
この研究では,BRD4がP-TEFbを介さずに直接に転写伸長の促進に寄与していること,したがって,JQ1の作用機序も,BRD4およびP-TEFbを介した転写伸長の一時停止の解除を阻害することにとどまらず,より直接的に転写伸長複合体との連携を抑制する作用のあることを明らかにした.さらに,BRD4による転写伸長の促進はエンハンサー領域においても確認され,これがBRD4によるエンハンサー機能の亢進,ひいては,標的遺伝子の転写開始の促進に寄与しているものと考えられた.
1.JQ1は転写開始および転写伸長の両方を阻害する
JQ1による転写の抑制については多くの報告があるが,そのほとんどにおいて,標的はBRD4であるとされている1-3,8,9).さらに,既報では,JQ1の作用機序はBRD4を介したP-TEFbの動員を抑制することと説明されている2-4,8,9).実際に,その根拠として,クロマチン免疫沈降法やクロマチン免疫沈降-シークエンシング法によるRNAポリメラーゼIIのゲノムにおける局在が提示されていたが,JQ1によるP-TEFbの動員の阻止を支持するようなRNAポリメラーゼIIの局在の変化は明らかとはいえなかった.
そこで,転写伸長の途中にありクロマチンと強く結合しているRNAの3’末端をRNAシークエンシング法により選択的に同定し,転写伸長を直接に観察した.モデルとしてマウスの線維芽細胞を使い,血清を除去したのち再刺激する方法により,刺激応答遺伝子の転写開始および転写伸長に対するJQ1の抑制効果を詳細に解析した.その結果,もっとも著明な変化は転写開始の直後に検出される短いRNAが減少したことであった.さらに,転写伸長の抑制効果の分布には不均衡があり,転写開始点の近傍においては著明ではなく,転写伸長の進行にともない顕著になった.これらの結果は,JQ1の阻害効果は転写開始点の近傍における転写伸長の一時停止の解除に対してであるという従来の説では説明しきれないものであった.
2.BRD4はエンハンサー領域および構造遺伝子の領域の両方において転写を促進する
BRD4が転写開始点の近傍に限局せず広くほかの領域にも分布したことから,JQ1による転写開始の抑制はBRD4のエンハンサー領域における機能に対する抑制である可能性が考えられた.そこで,さきのRNAシークエンシング法によるデータとクロマチン免疫沈降-シークエンシング法によるRNAポリメラーゼII,BRD4,P-TEFbの局在のデータを詳細に比較し,統計学的な相関関係をもとめた.その結果,BRD4の局在はエンハンサー領域および構造遺伝子の領域の両方において,RNAポリメラーゼIIの局在や伸長しているRNAと正に相関し,これらはJQ1により阻害された.一方,P-TEFbの局在はエンハンサー領域においてはRNAポリメラーゼIIの局在と負の相関を示し,構造遺伝子の領域においてはRNAポリメラーゼIIの局在や伸長しているRNAと弱い相関を示したが,これらの相関関係はJQ1の影響をうけず,BRD4に依存しないP-TEFb独自の転写促進活性と判断された.さらに,エンハンサー領域におけるBRD4の局在,エンハンサーRNAの産生量,標的遺伝子の転写活性には相関があり,これはJQ1により阻害された.エンハンサーRNAによる標的遺伝子の転写の活性化の分子機構は十分に確立されたわけではないものの,BRD4がエンハンサーRNAの産生を促進することにより標的遺伝子の転写を活性化している可能性が強く示唆された(図1).さらには,エンハンサーRNAの産生をともなわないBRD4の局在と,その近傍にある標的遺伝子の転写活性とは相関を示さなかった.この結果は,最近,提唱された抗転写停止エンハンサーの仮説9) を支持するものではなかった.
[Download]
3.BRD4のブロモドメインは転写開始点へのBRD4の動員には必須ではないが転写伸長には必須である
JQ1の作用機序をBRD4に限定して解明するため,ブロモドメインに点変異を導入した変異型BRD4を,BRD4をノックダウンした細胞に再導入し発現させた.野生型BRD4を再導入したときはBRD4に依存性した転写活性はもとのレベルにまで回復したが,ブロモドメインに点変異をもつ変異型BRD4を再導入しても転写活性は十分には回復しなかった.代表的なBRD4依存性の遺伝子であるKLF4遺伝子についてさらに詳細に解析すると,ブロモドメインを必要としJQ1に感受性のある転写の段階は,BRD4が転写開始点に動員される転写開始の段階ではなく,そののちの転写伸長の段階であることが明らかになった.一般に,ヒストンのアセチル化などのエピゲノム修飾は,それを認識するドメインをもつタンパク質を動員するための標識と考えられており,BRD4のブロモドメインの機能についても単なる解読の機能のみが論じられているなかで,BRD4のブロモドメインが解読の機能にとどまらず,このタンパク質に内在する生理的な活性そのものにかかわっていることが明らかにされた.
4.BRD4はRNAポリメラーゼII複合体と会合して転写伸長を促進する
BRD4はヒストンのアセチル化に依存したヒストンシャペロン活性をもち,精製タンパク質によるin vitro再構築系において転写伸長を促進した.この反応系にはP-TEFbは含まれておらず,認められた活性はBRD4それ自体の機能と考えられた.BRD4が転写伸長を促進する機能は培養細胞を使った実験系においても示された.実験方法として,クロマチンRNAシークエンシング法,Ser5がリン酸化された転写開始型のRNAポリメラーゼIIおよびSer2がリン酸化された転写伸長型のRNAポリメラーゼIIに対するクロマチン免疫沈降法,伸長しているRNAの末端をブロモ化UTPを用いて標識,細断化,RNA免疫沈降したのち,DNAに逆転写してRNAの末端の局在をゲノムにおいてマップする方法,の3つを行った.いずれの実験においても,BRD4をノックダウンした細胞にP-TEFbと結合できない変異型BRD4を再導入すると転写伸長がみられ,さらに,ブロモドメインに点変異を導入した変異型BRD4の再導入では転写伸長はみられなかった.この結果から,BRD4それ自体がブロモドメインに依存して転写伸長を促進する機能をもつこと,その機能はアセチル化したヒストンに依存したBRD4のヒストンシャペロン活性によることが結論づけられた.
さらに,伸長しているブロモUTP標識RNAとBRD4を含む転写伸長複合体に対する連続免疫沈降法により,BRD4がRNAポリメラーゼII転写伸長複合体と物理的に接触し,ゲノムの転写領域において複合体として共存していることが確認された.一方で,BRD4は転写開始点およびエンハンサー領域において転写メディエーター複合体と物理的に接触していた.したがって,BRD4は複数のステップによりRNAポリメラーゼII複合体に取り込まれるものと推察された.転写開始においてRNAポリメラーゼIIは転写開始複合体へと動員され,そこでメディエーター複合体により独自に動員されたBRD4と物理的に接触し,2つのタンパク質を含んだ転写伸長複合体となると考えられた(図2).
(a)転写伸長において,RNAポリメラーゼIIは単独ではヌクレオソームを排除して転写伸長をつづけることはできない.
(b)BRD4はブロモドメインによるアセチル化ヒストンへの接触に依存したヒストンシャペロン活性をもち,転写伸長を促進する.
(c)BET阻害薬であるJQ1は,BRD4のブロモドメインのもつアセチル化修飾をうけたLysに対する結合ポケットに結合し,ブロモドメインとアセチル化ヌクレオソームとの結合を拮抗阻害することにより,転写伸長を抑制する.
Pol II:RNAポリメラーゼII,六角形はヒストンのアセチル化を示す.
[Download]
おわりに
今回の結果は,BRD4はP-TEFbを動員するアダプターとしてではなく,適切な環境において自らRNAポリメラーゼIIの転写伸長を促進する活性を備えたタンパク質であることを示した.さらに,エンハンサーを活性化することにより転写開始をも促進することが示された.このことは,アダプター説および転写停止解除説をとなえるほかの多くの報告を否定するものではないが,それらの仮説のみでは十分に理解できない現象を説明できる作用機序であるといえた.アセチル化ヒストンに依存したヒストンシャペロン活性はBRD2,BRD3,BRD4に共通している.このことは,JQ1による抑制効果がBRD2,BRD3,BRD4の個別のノックダウンにより模倣されたという報告を支持する4,11).JQ1はBET系のブロモドメインタンパク質にかぎれば選択性がなく,選択性のある改良型の薬剤の開発と応用が展望される.
文 献
- Filippakopoulos, P., Qi, J., Picaud, S. et al.: Selective inhibition of BET bromodomains. Nature, 468, 1067-1073 (2010)[PubMed]
- Delmore, J. E., Issa, G. G., Lemieux, M. E. et al.: BET bromodomain inhibition as a therapeutic strategy to target c-Myc. Cell, 146, 904-917 (2011)[PubMed]
- Dawson, M. A., Prinjha, R. K., Dittmann, A. et al.: Inhibition of BET recruitment to chromatin as an effective treatment for MLL-fusion leukaemia. Nature, 478, 529-533 (2011)[PubMed]
- Chapuy, B., McKeown, M. R., Lin, C. Y. et al.: Discovery and characterization of super-enhancer-associated dependencies in diffuse large B cell lymphoma. Cancer Cell, 24, 777-790 (2013)[PubMed]
- Kanno, T., Kanno, Y., Siegel, R. M. et al.: Selective recognition of acetylated histones by bromodomain proteins visualized in living cells. Mol. Cell, 13, 33-43 (2004)[PubMed]
- Jang, M. K., Mochizuki, K., Zhou, M. et al.: The bromodomain protein Brd4 is a positive regulatory component of P-TEFb and stimulates RNA polymerase II-dependent transcription. Mol. Cell, 19, 523-534 (2005)[PubMed]
- Bisgrove, D. A., Mahmoudi, T., Henklein, P. et al.: Conserved P-TEFb-interacting domain of BRD4 inhibits HIV transcription. Proc. Natl. Acad. Sci. USA, 104, 13690-13695 (2007)[PubMed]
- Patel, M. C., Debrosse, M., Smith, M. et al.: BRD4 coordinates recruitment of pause release factor P-TEFb and the pausing complex NELF/DSIF to regulate transcription elongation of interferon-stimulated genes. Mol. Cell. Biol., 33, 2497-2507 (2013)[PubMed]
- Liu, W., Ma, Q., Wong, K. et al.: Brd4 and JMJD6-associated anti-pause enhancers in regulation of transcriptional pause release. Cell, 155, 1581-1595 (2013)[PubMed]
- LeRoy, G., Rickards, B. & Flint, S. J.: The double bromodomain proteins Brd2 and Brd3 couple histone acetylation to transcription. Mol. Cell, 30, 51-60 (2008)[PubMed]
- Nicodeme, E., Jeffrey, K. L., Schaefer, U. et al.: Suppression of inflammation by a synthetic histone mimic. Nature, 468, 1119-1123 (2010)[PubMed]
著者プロフィール
略歴:1987年 東北大学大学院医学研究科 修了,1995年 京都大学ウイルス研究所 助手を経て,2004年より米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases常任研究員.
研究テーマ:T細胞におけるエンハンサーのエピジェネティクス.
尾里 啓子(Keiko Ozato)
米国NIH National Institute of Child Health and Human Development部門主任.
菅野 智彦(Tomohiko Kanno)
米国NIH National Institute of Allergy and Infectious Diseases研究員.
© 2014 菅野由香・尾里啓子・菅野智彦 Licensed under CC 表示 2.1 日本