HIF-1α量の精密な調節は造血幹細胞の維持に重要である
田久保圭誉・須田年生
(慶應義塾大学医学部 発生・分化生物学教室)
email:田久保圭誉
DOI: 10.7875/first.author.2010.023
Regulation of the HIF-1α level is essential for hematopoietic stem cells.
Keiyo Takubo, Nobuhito Goda, Wakako Yamada, Hirono Iriuchishima, Eiji Ikeda, Yoshiaki Kubota, Haruko Shima, Randall S. Johnson, Atsushi Hirao, Makoto Suematsu, Toshio Suda
Cell Stem Cell, 7, 391-402 (2010)
幹細胞は“幹細胞ニッチ”とよばれる特別な微小環境によって維持されている.哺乳類の成体における造血の場である骨髄では,造血幹細胞は内骨膜の近傍領域の微小環境によって細胞周期が静止状態であるG0期にある.この研究では,最初に,造血幹細胞は骨髄ニッチでは低酸素状態にあり低酸素応答転写因子を構成するHIF-1αを活性化していることを見い出した.HIF-1αを欠損した造血幹細胞は細胞周期を静止状態にとどめることができなくなり,各種のストレスに対して脆弱で細胞老化シグナルp16Ink4a/p19Arfの活性化を介して幹細胞活性を失った.一方,HIF-1αを基質とするユビキチンリガーゼVHLを両方の対立遺伝子において欠損した造血幹細胞および造血前駆細胞は細胞周期の静止期化が亢進したものの,HIF-1αの過剰活性化により骨髄移植能を完全に失った.片方の対立遺伝子だけのVHLの欠損でも造血幹細胞および造血前駆細胞の細胞周期の静止期化がみられたが,野生型に比べて移植後のより良好な骨髄生着と加齢後の幹細胞画分の維持とが認められた.これらの結果から,造血幹細胞はHIF-1α量を精密に調節することでその細胞周期と幹細胞活性を制御しているものと考えられた.
造血幹細胞はすべての血球細胞を産み出す能力をもつ,いわば,造血ヒエラルキーの最上位に位置する細胞である1).哺乳類の主たる造血の場である骨髄では造血幹細胞は内骨膜領域のニッチに存在し細胞周期をG0期に止めている2).これによって造血幹細胞は過剰な細胞分裂による細胞老化から防護されつつ,適切な時期に分裂することで生涯にわたる造血を維持する.これまでに,内骨膜領域のさまざまな支持細胞やサイトカイン,接着分子,細胞外マトリックスなどがニッチの構成要素となることが知られている.
一方,古典的に内骨膜領域は低酸素環境であると考えられており3),造血幹細胞を生体外に取り出して低酸素培養すると幹細胞活性が維持されることも知られている4).そのため,既存のニッチ構成タンパク質にくわえて,低酸素環境が造血幹細胞ニッチの重要な構成要素になるのではないかと考えられていた.しかし,造血幹細胞が実際に骨髄ニッチで低酸素環境にあるかどうかは不明であった.また,低酸素環境からいかなる機構で自らの維持を図っているかも明らかとはなっていなかった.
この研究で,筆者らはまず,造血幹細胞は低酸素状態にありHIF-1αを発現していることを見い出した.HIF-1αは細胞レベルあるいは個体レベルの低酸素応答のマスターレギュレーターのひとつである5).低酸素分圧下ではHIF-1αは安定化し,酸素分圧非依存性のサブユニットHIF-1βとヘテロ2量体をつくり核内で転写因子として各種の低酸素応答に必要な遺伝子の転写活性化を行う.一方,通常の酸素分圧下ではHIF-1αの酸素依存性分解ドメイン(oxygen-dependent degradation domain:ODD)のプロリン残基がプロリンヒドロキシラーゼによって水酸化されヒドロキシプロリンとなる.ユビキチンリガーゼVHLはこのヒドロキシプロリン残基を認識し,その結果,HIF-1αはユビキチン-プロテアソーム系により分解され安定化することはできない.筆者らは,造血幹細胞におけるHIF-1αの機能を検討するべくHIF-1αノックアウトマウスの解析を行い,造血幹細胞の細胞周期の静止期維持と幹細胞活性の発揮とに低酸素応答転写因子HIF-1αが必要であることを見い出した.また,HIF-1αを基質とするユビキチンリガーゼVHLを両方のアレル対立遺伝子において欠損した造血幹細胞はHIF-1α依存的に幹細胞活性を失うこと,片方の対立遺伝子でのVHL欠損は幹細胞機能を強化することを見い出した.これらの実験結果から,造血幹細胞はVHL/HIF-1α制御系の精緻な調節によって細胞周期の特性や幹細胞機能を維持しているものと考えられる.
まず,野生型マウスに低酸素マーカーであるピモニダゾールを投与し,細胞表面の抗原染色とピモニダゾールの細胞内染色とを組み合わせて蛍光セルソーターによる解析を行うことで,それぞれの血球画分において低酸素状態にある細胞の割合を検討した.その結果,分化した血球画分に比べより未分化な造血幹細胞・造血前駆細胞の画分であるLSK細胞(lineage marker-negative Sca-1+ c-Kit+)や,そのなかでも長期骨髄再構築能をもつ造血幹細胞の画分であるLT-HSC(long-term hematopoietic stem cell)において,ピモニダゾール陽性度の高いことが明らかになった.すなわち,LT-HSCを含む未分化血球細胞集団は低酸素状態にあることがわかった.
そこで,低酸素環境にある造血幹細胞がいかなる機構で維持されているのか検討するため,造血幹細胞におけるHIF-αサブユニットの発現を定量PCR法と骨髄の免疫染色により検討したところ,HIF-1αが転写レベルでもタンパク質レベルでも高発現していることが明らかになった.実際,造血幹細胞を単離して20%O2と1%O2とでそれぞれ培養すると,低酸素条件にすることでLT-HSCにおいてHIF-1αの安定化が認められた.興味深いことに,前駆細胞画分でもHIF-1αの安定化は認められたものの,その程度はLT-HSCに比べ軽度であった.また,HIF-1αの安定化を誘導することが知られているサイトカインである幹細胞因子(stem cell factor:SCF)およびトロンボポエチンは,逆に,前駆細胞画分でのHIF-1αの安定化をより強く誘導した.
HIF-1αノックアウトマウスは胚性致死である6).そこで,成体の造血幹細胞でHIF-1αのはたしている役割を解析するため,Mx1-Cre:HIF-1αflox/floxマウスを用いて誘導的にHIF-1αをホモ欠失した造血幹細胞をもつコンディショナルノックアウトマウス(HIF-1αΔ/Δマウス)を作製した.このマウスでは合成2本鎖RNAポリI:ポリCを投与することでMx1プロモーターが活性化し,プロモーター下に挿入されたCreリコンビナーゼが発現する.その結果,誘導的にHIF-1αのfloxアレルが欠損する.Creリコンビナーゼの誘導は造血器だけでなく肝臓など全身で認められた.このマウスの血液検査や末梢血分化の検討を行ったところ,軽度の白血球数の上昇と平均赤血球容積の低下を認めたものの,分化細胞画分での著明な異常は認めなかった.また,造血前駆細胞の機能を各種の前駆細胞アッセイで検討したが有意な差は認めなかった.
そこで,当初の目的どおり造血幹細胞活性を検討するため,HIF-1αΔ/ΔマウスからLSK細胞を分取し骨髄移植実験を行った.末梢血のドナー由来の血球細胞の割合(キメリズム)はHIF-1αΔ/Δマウスに由来するLSK細胞を移植されたレシピエントマウスで顕著に高かった.ところが,移植後4か月目に骨髄のLSK画分のキメリズムを解析したところ,末梢血とは逆に,HIF-1αΔ/Δマウス由来のキメリズムは著明な低下を認めた.この際,HIF-1αΔ/Δマウスに由来するLSK細胞では,老化した幹細胞で発現上昇することが知られているInk4a遺伝子座の産物であるp16Ink4aとp19Arf 7) の発現の上昇していることが定量PCR法で認められた.そこで,この老化傾向が実際に造血幹細胞の機能に影響をあたえているかどうかを検証するため,1次移植レシピエントからドナーに由来するLSK細胞を分取して2次移植レシピエントへの連続骨髄移植実験を行った.すると,HIF-1αΔ/Δマウスに由来するLSK細胞は完全に骨髄再構築能を失い末梢血キメリズムも低いままであった.
つぎに,p16Ink4aとp19Arfの発現が実際にHIF-1αΔ/Δマウスの造血幹細胞の異常に寄与しているかどうかを検討するため,造血幹細胞でp16Ink4aとp19Arfの発現を抑制できるポリコーム遺伝子Bmi1遺伝子8) をレトロウイルスベクターにより過剰発現させた.Bmi1を過剰発現したHIF-1αΔ/Δマウスの造血幹細胞は対照と遜色ない骨髄再構築能を示した.すなわち,HIF-1αの欠損はp16Ink4aとp19Arfの発現を介して造血幹細胞に異常を起こすことが実際に確認された.また,老化や抗がん剤の連続投与など,骨髄移植実験以外の造血幹細胞にストレスを負荷する系でもHIF-1αの欠損により幹細胞の減少や造血不全が認められたため,HIF-1αは造血幹細胞にストレス耐性を付与するはたらきをすることがわかった.
ついで,HIF-1αを欠損した造血幹細胞が老化傾向を示す原因を検討した.本来,造血幹細胞は静止状態にあることが知られている.ところが,HIF-1αの欠損によって造血幹細胞画分の細胞周期が亢進しG0期の細胞が減少していることが蛍光セルソーターによる解析で明らかになった.
それでは,HIF-1αのタンパク質量を増加させることで造血幹細胞にストレス耐性を付与できるかどうかをつぎに検討した.ヒトの常染色体優性の遺伝性疾患であるvon Hippel-Lindau病の原因遺伝子であるVHL遺伝子のヘテロ欠損あるいはホモ欠損によりHIF-1αタンパク質の量が増加することが知られている.そこで,Mx1-Cre:VHL+/floxマウスを準備し,ポリI:ポリCを投与してVHLを片方の対立遺伝子において欠損したVHL+/Δマウスを作製し造血幹細胞を解析した.すると,造血幹細胞(CD34- LSK)画分の細胞周期は,たしかに対照に比べ静止期になっていた.興味深いことに,造血前駆細胞(CD34+ LSK)画分は,通常,G0期にある細胞は少ないが,VHL+/ΔマウスではG0期にある造血前駆細胞が著明に増加していた.その増加の程度はVHL+/Δマウスの造血幹細胞画分に比べてより強度であった.これは,通常,造血前駆細胞にはHIF-1αは存在しないが,VHLのヘテロ欠損により安定化したHIF-1αによって静止期化しうることを示していた.
さてつぎに,VHLの両方の対立遺伝子の欠損によってHIF-1αを最大限に活性化させた際に造血幹細胞に起こる影響を検討するため,Mx1-Cre:VHLflox/floxマウスを用意しポリI:ポリCを投与した.ところが,1週間のうちにすべてのマウスが死亡してしまい解析が不可能であった.そこで,Mx1-Cre:VHLflox/floxマウスの骨髄を移植し骨髄だけが置き換わったマウスを用意してからこのマウスにポリI:ポリCを投与した.骨髄置き換えマウスはポリI:ポリCの投与で死亡することなく,VHLΔ/Δマウスの造血幹細胞の解析が可能であった.VHLΔ/Δマウスの造血幹細胞は予想どおり細胞周期は静止期化したが,骨髄置き換えマウスから取り出したVHL欠損LSK細胞を骨髄移植しても末梢血再構築能は完全に障害されていた.さらに,骨髄中のLT-HSCの頻度も減少していた.これらの減少は完全にHIF-1αに依存的であり,HIF-1αΔ/ΔとVHLΔ/Δとのダブルノックアウト細胞では細胞周期の抑制も移植再構築能も回復していた.VHLΔ/Δマウスの造血幹細胞は骨髄移植ののちの骨髄へのホーミングが低下しており,これが移植後の造血再構築能の障害の少なくとも一部を説明できる可能性がある.
VHLの両方の対立遺伝子における欠損では,移植生着能が障害されたうえ末梢血の分化能も障害されていることが見い出され,HIF-1αの過剰な安定化は造血幹細胞機能を障害することがわかった.そこでつぎに,VHLを片方の対立遺伝子において欠損したVHL+/Δマウスの造血幹細胞の動態を解析した.まず,生理的なストレス条件である加齢後のVHL+/Δマウスの骨髄を解析したところ,LT-HSCの割合と細胞数が野生型に比べて多く保たれていることが見い出された.さらに,幹細胞に老化を誘導するミトコンドリアの活性酸素種の産生能を比較したところ,VHL+/Δマウスの造血幹細胞画分では活性酸素の産生が低下していることがわかった.また,若いVHL+/ΔマウスからLSK細胞を単離して移植再構築能を検討すると,対照に比較して移植4か月後の骨髄キメリズムが向上していることが確認された.
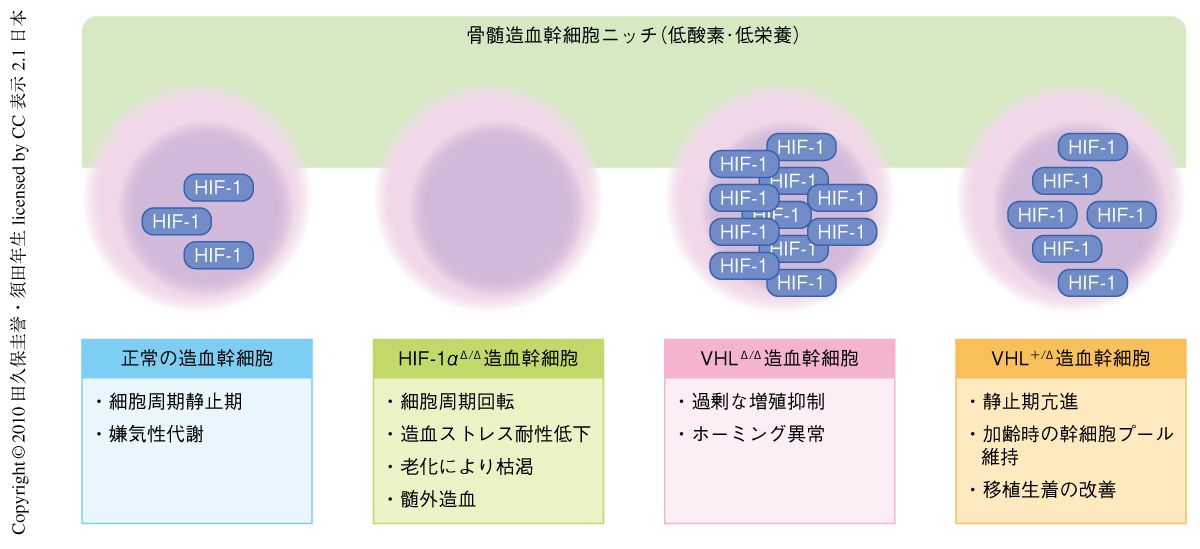
今回の検討からVHL/HIF-1α制御系による造血幹細胞の維持機構が見い出された(図1).HIF-1αは細胞周期の静止期維持を介して,p16Ink4a/p19Arfによる老化から造血幹細胞を護る.一方,VHLは過剰なHIF-1αの活性化を抑制することで造血幹細胞機能を維持する.VHLを片方の対立遺伝子において欠損した造血幹細胞は幹細胞機能が向上しており,老化や移植ストレスに対して抵抗性であった.すでに,恒常活性化型のHIF-1αの過剰発現により造血幹細胞機能が完全に障害されることが示されており9),今後は,VHLヘテロ欠損状態を再現するような“ちょうどよい塩梅”のHIF-1α量を化合物などによって実現することで造血幹細胞の体外での増幅を図れるかもしれない.一方,筆者らの解析において,造血幹細胞はHIF-1αの量とミトコンドリアの活性酸素種の産生が逆相関すること,HIF-1αの欠損でより高度な低酸素状態にある画分が特異的に減少することから,HIF-1αは造血幹細胞の代謝特性も規定する可能性が示唆されている.
筆者らの報告と同時に出版された論文でも造血幹細胞の嫌気的な代謝特性を示唆するデータが報告されているが10),HIF-1αによって転写活性化される膨大な下流タンパク質のリストのなかで,いったいどれが幹細胞活性の制御や代謝特性の維持に寄与しているのか,また,こうした特性が造血幹細胞維持にはたす役割は,今後,解明されるべき課題である.
また,低酸素応答系ががん幹細胞ヒエラルキーではたす役割についても,近年,注目が集まっている11).幹細胞レベルのより詳細なHIF-1α調節機構の解明は,造血幹細胞の理解のみならず,がん幹細胞に特異的な治療法の開発のための一助となるものと考えられる.
略歴:2007年 慶應義塾大学大学院医学研究科 修了,日本学術振興会 特別研究員を経て,2008年より慶應義塾大学医学部 助教.
研究テーマ:造血幹細胞と生殖幹細胞をモデルとした,幹細胞と周囲の環境との相互作用の解明.
抱負:成体の幹細胞解析を手がかりにして,難解な生命現象からシンプルな法則を見い出したい.
須田 年生(Toshio Suda)
慶應義塾大学医学部 教授.
研究室URL:http://web.sc.itc.keio.ac.jp/celldiff
© 2010 田久保圭誉・須田年生 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 発生・分化生物学教室)
email:田久保圭誉
DOI: 10.7875/first.author.2010.023
Regulation of the HIF-1α level is essential for hematopoietic stem cells.
Keiyo Takubo, Nobuhito Goda, Wakako Yamada, Hirono Iriuchishima, Eiji Ikeda, Yoshiaki Kubota, Haruko Shima, Randall S. Johnson, Atsushi Hirao, Makoto Suematsu, Toshio Suda
Cell Stem Cell, 7, 391-402 (2010)
要 約
幹細胞は“幹細胞ニッチ”とよばれる特別な微小環境によって維持されている.哺乳類の成体における造血の場である骨髄では,造血幹細胞は内骨膜の近傍領域の微小環境によって細胞周期が静止状態であるG0期にある.この研究では,最初に,造血幹細胞は骨髄ニッチでは低酸素状態にあり低酸素応答転写因子を構成するHIF-1αを活性化していることを見い出した.HIF-1αを欠損した造血幹細胞は細胞周期を静止状態にとどめることができなくなり,各種のストレスに対して脆弱で細胞老化シグナルp16Ink4a/p19Arfの活性化を介して幹細胞活性を失った.一方,HIF-1αを基質とするユビキチンリガーゼVHLを両方の対立遺伝子において欠損した造血幹細胞および造血前駆細胞は細胞周期の静止期化が亢進したものの,HIF-1αの過剰活性化により骨髄移植能を完全に失った.片方の対立遺伝子だけのVHLの欠損でも造血幹細胞および造血前駆細胞の細胞周期の静止期化がみられたが,野生型に比べて移植後のより良好な骨髄生着と加齢後の幹細胞画分の維持とが認められた.これらの結果から,造血幹細胞はHIF-1α量を精密に調節することでその細胞周期と幹細胞活性を制御しているものと考えられた.
はじめに
造血幹細胞はすべての血球細胞を産み出す能力をもつ,いわば,造血ヒエラルキーの最上位に位置する細胞である1).哺乳類の主たる造血の場である骨髄では造血幹細胞は内骨膜領域のニッチに存在し細胞周期をG0期に止めている2).これによって造血幹細胞は過剰な細胞分裂による細胞老化から防護されつつ,適切な時期に分裂することで生涯にわたる造血を維持する.これまでに,内骨膜領域のさまざまな支持細胞やサイトカイン,接着分子,細胞外マトリックスなどがニッチの構成要素となることが知られている.
一方,古典的に内骨膜領域は低酸素環境であると考えられており3),造血幹細胞を生体外に取り出して低酸素培養すると幹細胞活性が維持されることも知られている4).そのため,既存のニッチ構成タンパク質にくわえて,低酸素環境が造血幹細胞ニッチの重要な構成要素になるのではないかと考えられていた.しかし,造血幹細胞が実際に骨髄ニッチで低酸素環境にあるかどうかは不明であった.また,低酸素環境からいかなる機構で自らの維持を図っているかも明らかとはなっていなかった.
この研究で,筆者らはまず,造血幹細胞は低酸素状態にありHIF-1αを発現していることを見い出した.HIF-1αは細胞レベルあるいは個体レベルの低酸素応答のマスターレギュレーターのひとつである5).低酸素分圧下ではHIF-1αは安定化し,酸素分圧非依存性のサブユニットHIF-1βとヘテロ2量体をつくり核内で転写因子として各種の低酸素応答に必要な遺伝子の転写活性化を行う.一方,通常の酸素分圧下ではHIF-1αの酸素依存性分解ドメイン(oxygen-dependent degradation domain:ODD)のプロリン残基がプロリンヒドロキシラーゼによって水酸化されヒドロキシプロリンとなる.ユビキチンリガーゼVHLはこのヒドロキシプロリン残基を認識し,その結果,HIF-1αはユビキチン-プロテアソーム系により分解され安定化することはできない.筆者らは,造血幹細胞におけるHIF-1αの機能を検討するべくHIF-1αノックアウトマウスの解析を行い,造血幹細胞の細胞周期の静止期維持と幹細胞活性の発揮とに低酸素応答転写因子HIF-1αが必要であることを見い出した.また,HIF-1αを基質とするユビキチンリガーゼVHLを両方のアレル対立遺伝子において欠損した造血幹細胞はHIF-1α依存的に幹細胞活性を失うこと,片方の対立遺伝子でのVHL欠損は幹細胞機能を強化することを見い出した.これらの実験結果から,造血幹細胞はVHL/HIF-1α制御系の精緻な調節によって細胞周期の特性や幹細胞機能を維持しているものと考えられる.
1.造血幹細胞は低酸素状態にあってHIF-1αを発現している
まず,野生型マウスに低酸素マーカーであるピモニダゾールを投与し,細胞表面の抗原染色とピモニダゾールの細胞内染色とを組み合わせて蛍光セルソーターによる解析を行うことで,それぞれの血球画分において低酸素状態にある細胞の割合を検討した.その結果,分化した血球画分に比べより未分化な造血幹細胞・造血前駆細胞の画分であるLSK細胞(lineage marker-negative Sca-1+ c-Kit+)や,そのなかでも長期骨髄再構築能をもつ造血幹細胞の画分であるLT-HSC(long-term hematopoietic stem cell)において,ピモニダゾール陽性度の高いことが明らかになった.すなわち,LT-HSCを含む未分化血球細胞集団は低酸素状態にあることがわかった.
そこで,低酸素環境にある造血幹細胞がいかなる機構で維持されているのか検討するため,造血幹細胞におけるHIF-αサブユニットの発現を定量PCR法と骨髄の免疫染色により検討したところ,HIF-1αが転写レベルでもタンパク質レベルでも高発現していることが明らかになった.実際,造血幹細胞を単離して20%O2と1%O2とでそれぞれ培養すると,低酸素条件にすることでLT-HSCにおいてHIF-1αの安定化が認められた.興味深いことに,前駆細胞画分でもHIF-1αの安定化は認められたものの,その程度はLT-HSCに比べ軽度であった.また,HIF-1αの安定化を誘導することが知られているサイトカインである幹細胞因子(stem cell factor:SCF)およびトロンボポエチンは,逆に,前駆細胞画分でのHIF-1αの安定化をより強く誘導した.
2.HIF-1αを欠損した造血幹細胞はストレスに対して脆弱である
HIF-1αノックアウトマウスは胚性致死である6).そこで,成体の造血幹細胞でHIF-1αのはたしている役割を解析するため,Mx1-Cre:HIF-1αflox/floxマウスを用いて誘導的にHIF-1αをホモ欠失した造血幹細胞をもつコンディショナルノックアウトマウス(HIF-1αΔ/Δマウス)を作製した.このマウスでは合成2本鎖RNAポリI:ポリCを投与することでMx1プロモーターが活性化し,プロモーター下に挿入されたCreリコンビナーゼが発現する.その結果,誘導的にHIF-1αのfloxアレルが欠損する.Creリコンビナーゼの誘導は造血器だけでなく肝臓など全身で認められた.このマウスの血液検査や末梢血分化の検討を行ったところ,軽度の白血球数の上昇と平均赤血球容積の低下を認めたものの,分化細胞画分での著明な異常は認めなかった.また,造血前駆細胞の機能を各種の前駆細胞アッセイで検討したが有意な差は認めなかった.
そこで,当初の目的どおり造血幹細胞活性を検討するため,HIF-1αΔ/ΔマウスからLSK細胞を分取し骨髄移植実験を行った.末梢血のドナー由来の血球細胞の割合(キメリズム)はHIF-1αΔ/Δマウスに由来するLSK細胞を移植されたレシピエントマウスで顕著に高かった.ところが,移植後4か月目に骨髄のLSK画分のキメリズムを解析したところ,末梢血とは逆に,HIF-1αΔ/Δマウス由来のキメリズムは著明な低下を認めた.この際,HIF-1αΔ/Δマウスに由来するLSK細胞では,老化した幹細胞で発現上昇することが知られているInk4a遺伝子座の産物であるp16Ink4aとp19Arf 7) の発現の上昇していることが定量PCR法で認められた.そこで,この老化傾向が実際に造血幹細胞の機能に影響をあたえているかどうかを検証するため,1次移植レシピエントからドナーに由来するLSK細胞を分取して2次移植レシピエントへの連続骨髄移植実験を行った.すると,HIF-1αΔ/Δマウスに由来するLSK細胞は完全に骨髄再構築能を失い末梢血キメリズムも低いままであった.
つぎに,p16Ink4aとp19Arfの発現が実際にHIF-1αΔ/Δマウスの造血幹細胞の異常に寄与しているかどうかを検討するため,造血幹細胞でp16Ink4aとp19Arfの発現を抑制できるポリコーム遺伝子Bmi1遺伝子8) をレトロウイルスベクターにより過剰発現させた.Bmi1を過剰発現したHIF-1αΔ/Δマウスの造血幹細胞は対照と遜色ない骨髄再構築能を示した.すなわち,HIF-1αの欠損はp16Ink4aとp19Arfの発現を介して造血幹細胞に異常を起こすことが実際に確認された.また,老化や抗がん剤の連続投与など,骨髄移植実験以外の造血幹細胞にストレスを負荷する系でもHIF-1αの欠損により幹細胞の減少や造血不全が認められたため,HIF-1αは造血幹細胞にストレス耐性を付与するはたらきをすることがわかった.
3.造血幹細胞の細胞周期はVHL/HIF-1α制御系によって調節される
ついで,HIF-1αを欠損した造血幹細胞が老化傾向を示す原因を検討した.本来,造血幹細胞は静止状態にあることが知られている.ところが,HIF-1αの欠損によって造血幹細胞画分の細胞周期が亢進しG0期の細胞が減少していることが蛍光セルソーターによる解析で明らかになった.
それでは,HIF-1αのタンパク質量を増加させることで造血幹細胞にストレス耐性を付与できるかどうかをつぎに検討した.ヒトの常染色体優性の遺伝性疾患であるvon Hippel-Lindau病の原因遺伝子であるVHL遺伝子のヘテロ欠損あるいはホモ欠損によりHIF-1αタンパク質の量が増加することが知られている.そこで,Mx1-Cre:VHL+/floxマウスを準備し,ポリI:ポリCを投与してVHLを片方の対立遺伝子において欠損したVHL+/Δマウスを作製し造血幹細胞を解析した.すると,造血幹細胞(CD34- LSK)画分の細胞周期は,たしかに対照に比べ静止期になっていた.興味深いことに,造血前駆細胞(CD34+ LSK)画分は,通常,G0期にある細胞は少ないが,VHL+/ΔマウスではG0期にある造血前駆細胞が著明に増加していた.その増加の程度はVHL+/Δマウスの造血幹細胞画分に比べてより強度であった.これは,通常,造血前駆細胞にはHIF-1αは存在しないが,VHLのヘテロ欠損により安定化したHIF-1αによって静止期化しうることを示していた.
4.VHLの両方の対立遺伝子の欠損は造血幹細胞の骨髄移植能を失わせる
さてつぎに,VHLの両方の対立遺伝子の欠損によってHIF-1αを最大限に活性化させた際に造血幹細胞に起こる影響を検討するため,Mx1-Cre:VHLflox/floxマウスを用意しポリI:ポリCを投与した.ところが,1週間のうちにすべてのマウスが死亡してしまい解析が不可能であった.そこで,Mx1-Cre:VHLflox/floxマウスの骨髄を移植し骨髄だけが置き換わったマウスを用意してからこのマウスにポリI:ポリCを投与した.骨髄置き換えマウスはポリI:ポリCの投与で死亡することなく,VHLΔ/Δマウスの造血幹細胞の解析が可能であった.VHLΔ/Δマウスの造血幹細胞は予想どおり細胞周期は静止期化したが,骨髄置き換えマウスから取り出したVHL欠損LSK細胞を骨髄移植しても末梢血再構築能は完全に障害されていた.さらに,骨髄中のLT-HSCの頻度も減少していた.これらの減少は完全にHIF-1αに依存的であり,HIF-1αΔ/ΔとVHLΔ/Δとのダブルノックアウト細胞では細胞周期の抑制も移植再構築能も回復していた.VHLΔ/Δマウスの造血幹細胞は骨髄移植ののちの骨髄へのホーミングが低下しており,これが移植後の造血再構築能の障害の少なくとも一部を説明できる可能性がある.
5.VHLの片方の対立遺伝子における欠損は加齢時も幹細胞プールを維持し骨髄生着能を向上させる
VHLの両方の対立遺伝子における欠損では,移植生着能が障害されたうえ末梢血の分化能も障害されていることが見い出され,HIF-1αの過剰な安定化は造血幹細胞機能を障害することがわかった.そこでつぎに,VHLを片方の対立遺伝子において欠損したVHL+/Δマウスの造血幹細胞の動態を解析した.まず,生理的なストレス条件である加齢後のVHL+/Δマウスの骨髄を解析したところ,LT-HSCの割合と細胞数が野生型に比べて多く保たれていることが見い出された.さらに,幹細胞に老化を誘導するミトコンドリアの活性酸素種の産生能を比較したところ,VHL+/Δマウスの造血幹細胞画分では活性酸素の産生が低下していることがわかった.また,若いVHL+/ΔマウスからLSK細胞を単離して移植再構築能を検討すると,対照に比較して移植4か月後の骨髄キメリズムが向上していることが確認された.
おわりに
今回の検討からVHL/HIF-1α制御系による造血幹細胞の維持機構が見い出された(図1).HIF-1αは細胞周期の静止期維持を介して,p16Ink4a/p19Arfによる老化から造血幹細胞を護る.一方,VHLは過剰なHIF-1αの活性化を抑制することで造血幹細胞機能を維持する.VHLを片方の対立遺伝子において欠損した造血幹細胞は幹細胞機能が向上しており,老化や移植ストレスに対して抵抗性であった.すでに,恒常活性化型のHIF-1αの過剰発現により造血幹細胞機能が完全に障害されることが示されており9),今後は,VHLヘテロ欠損状態を再現するような“ちょうどよい塩梅”のHIF-1α量を化合物などによって実現することで造血幹細胞の体外での増幅を図れるかもしれない.一方,筆者らの解析において,造血幹細胞はHIF-1αの量とミトコンドリアの活性酸素種の産生が逆相関すること,HIF-1αの欠損でより高度な低酸素状態にある画分が特異的に減少することから,HIF-1αは造血幹細胞の代謝特性も規定する可能性が示唆されている.
筆者らの報告と同時に出版された論文でも造血幹細胞の嫌気的な代謝特性を示唆するデータが報告されているが10),HIF-1αによって転写活性化される膨大な下流タンパク質のリストのなかで,いったいどれが幹細胞活性の制御や代謝特性の維持に寄与しているのか,また,こうした特性が造血幹細胞維持にはたす役割は,今後,解明されるべき課題である.
また,低酸素応答系ががん幹細胞ヒエラルキーではたす役割についても,近年,注目が集まっている11).幹細胞レベルのより詳細なHIF-1α調節機構の解明は,造血幹細胞の理解のみならず,がん幹細胞に特異的な治療法の開発のための一助となるものと考えられる.
文 献
- Orkin, S. H. & Zon, L. I.: Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 132, 631-644 (2008)[PubMed]
- Trumpp, A., Essers, M. & Wilson, A.: Awakening dormant haematopoietic stem cells. Nat. Rev. Immunol., 10, 201-209 (2010)[PubMed]
- Brookes, M.: The Blood Supply of Bone. Butterworth, London (1971)
- Danet, G. H., Pan, Y., Luongo, J. L. et al.: Expansion of human SCID-repopulating cells under hypoxic conditions. J. Clin. Invest., 112, 126-135 (2003)[PubMed]
- Semenza, G. L.: Hypoxia-inducible factor 1 (HIF-1) pathway. Sci. STKE, 2007, cm8 (2007)[PubMed]
- Ryan, H. E., Lo, J., Johnson, R. S.: HIF-1α is required for solid tumor formation and embryonic vascularization. EMBO J., 17, 3005-3015 (1998)[PubMed]
- Naka, K., Muraguchi, T., Hoshii, T. et al.: Regulation of reactive oxygen species and genomic stability in hematopoietic stem cells. Antioxid. Redox Signal., 10, 1883-1894 (2008)[PubMed]
- Iwama, A., Oguro, H., Negishi, M. et al.: Enhanced self-renewal of hematopoietic stem cells mediated by the polycomb gene product Bmi-1. Immunity, 21, 843-851 (2004)[PubMed]
- Eliasson, P., Rehn, M., Hammar, P. et al.: Hypoxia mediates low cell-cycle activity and increases the proportion of long-term-reconstituting hematopoietic stem cells during in vitro culture. Exp. Hematol., 38, 301-310 (2010)[PubMed]
- Simsek, T., Kocabas, F., Zheng, J. et al.: The distinct metabolic profile of hematopoietic stem cells reflects their location in a hypoxic niche. Cell Stem Cell, 7, 380-390 (2010)[PubMed]
- Mohyeldin, A., Garzon-Muvdi, T., Quinones-Hinojosa, A.: Oxygen in stem cell biology: a critical component of the stem cell niche. Cell Stem Cell, 7, 150-161 (2010)[PubMed]
著者プロフィール
略歴:2007年 慶應義塾大学大学院医学研究科 修了,日本学術振興会 特別研究員を経て,2008年より慶應義塾大学医学部 助教.
研究テーマ:造血幹細胞と生殖幹細胞をモデルとした,幹細胞と周囲の環境との相互作用の解明.
抱負:成体の幹細胞解析を手がかりにして,難解な生命現象からシンプルな法則を見い出したい.
須田 年生(Toshio Suda)
慶應義塾大学医学部 教授.
研究室URL:http://web.sc.itc.keio.ac.jp/celldiff
© 2010 田久保圭誉・須田年生 Licensed under CC 表示 2.1 日本