腸内細菌科細菌のもつLonプロテアーゼのレドックススイッチ
西井 亘・横山茂之
(理化学研究所 横山構造生物学研究室)
email:西井 亘,横山茂之
DOI: 10.7875/first.author.2014.152
A redox switch shapes the Lon protease exit pore to facultatively regulate proteolysis.
Wataru Nishii, Mutsuko Kukimoto-Niino, Takaho Terada, Mikako Shirouzu, Tomonari Muramatsu, Masaki Kojima, Hiroshi Kihara, Shigeyuki Yokoyama
Nature Chemical Biology, 11, 46-51 (2015)
細菌感染症の主要な原因である腸内細菌科の細菌は通性嫌気性をもち,嫌気的な環境である宿主の腸内および好気的な環境である体外のいずれにおいても生育することができる.宿主の腸内および体外において,細胞に生じる異常なタンパク質を分解するのはおもにLonプロテアーゼである.興味深いことに,腸内細菌科細菌のもつLonプロテアーゼには保存された2つのCysが存在し,ジスルフィド結合を形成することが知られている.筆者らは,この研究において,これらのCysが可逆的なジスルフィド結合の形成および解離を介してLonプロテアーゼの活性を制御する“レドックススイッチ”であることを発見した.すなわち,ジスルフィド結合の解離した還元型Lonプロテアーゼにおいては,分解産物であるペプチドを放出する出口がせまくなり活性は約20%に低下した.一方,ジスルフィド結合の形成された酸化型Lonプロテアーゼにおいては,分解産物の放出される出口は広くなり活性は回復した.このレドックスイッチは宿主の腸内と体外との中間の酸化還元環境において作用し,細胞に存在する異常なタンパク質の分解レベルをそれぞれの環境に最適化していた.
AAA+プロテアーゼは生合成の誤りや細胞外からのストレスにより生じる異常なタンパク質の分解をとおして細胞におけるタンパク質の品質管理に貢献する1).細菌における主要なAAA+プロテアーゼはLonプロテアーゼであり,細胞に生じた異常なタンパク質の約50%を分解している2).Lonプロテアーゼの活性は諸刃の剣であり,細胞を防衛するうえできわめて重要である一方,過剰に発現した場合には細胞に致命的な損傷をあたえる3).したがって,異常なタンパク質の量に応じて適切に制御されなければならない.
Lonプロテアーゼの1次構造はN末端ドメイン,ATPaseドメイン,プロテアーゼドメインからなり,リング状に六量体化するATPaseドメインからなるリングとプロテアーゼドメインからなるリングが分子内チャンバーを形成する.基質となるタンパク質はATPaseドメインからなるリングの入口から取り込まれ,分子内チャンバーにおいて約10残基のペプチドにまで分解され,プロテアーゼドメインからなるリングの出口から放出される.興味深いことに,大腸菌のLonプロテアーゼの結晶構造において,Cys617とCys691とのあいだに分子内ジスルフィド結合の形成されることが知られている4).Lonプロテアーゼは細胞質に局在するが,細胞質は強い還元的な環境であるので,一般に,ジスルフィド結合は安定には形成されない.これらのCysは腸内細菌科(Enterobacteriaceae)の細菌において特徴的に保存され,ほかの生物種においてはみられない.
腸内細菌科は大腸菌,クレブシエラ菌,サルモネラ菌,赤痢菌,セラチア菌,ペスト菌などからなり,通常は無害な腸内共生細菌として存在する一方,細菌感染症のじつに半数をひき起こす,もっとも頻繁に遭遇する病原細菌でもある5).このことは,腸内細菌科細菌が嫌気的な環境である宿主の腸内と好気的な環境である体外のいずれにおいても強健に生育する通性嫌気性細菌であることに由来すると考えられる.実際,宿主の腸内の嫌気的な環境でしか生育できない偏性嫌気性細菌は,腸内フローラの99%以上をしめるにもかかわらず感染性はほとんどない.したがって,腸内細菌科細菌が宿主の腸内あるいは体外の環境の違いに適応する機構を知ることは非常に重要である.
宿主の腸内の嫌気的な環境ではタンパク質の生合成量は少なく,さらに,酸化などにより損傷をうけることも少ないため,細胞における異常なタンパク質の生成は低いレベルにある.一方,体外の好気的な環境ではタンパク質の生合成量は多く,合成されたタンパク質はつねに酸化ストレスにさらされる.したがって,異常なタンパク質の生成は高いレベルにある.細菌の細胞において異常なタンパク質を分解するのはおもにLonプロテアーゼであるので,腸内細菌科細菌は宿主の腸内と体外の2つの環境のあいだの違いに対応してLonプロテアーゼの活性を制御する必要がある.しかし,その分子機構はこれまで謎であった.筆者らは,この謎を解く鍵が腸内細菌科細菌のLonプロテアーゼに固有のジスルフィド結合にあるのではないかと考え,研究をスタートした.
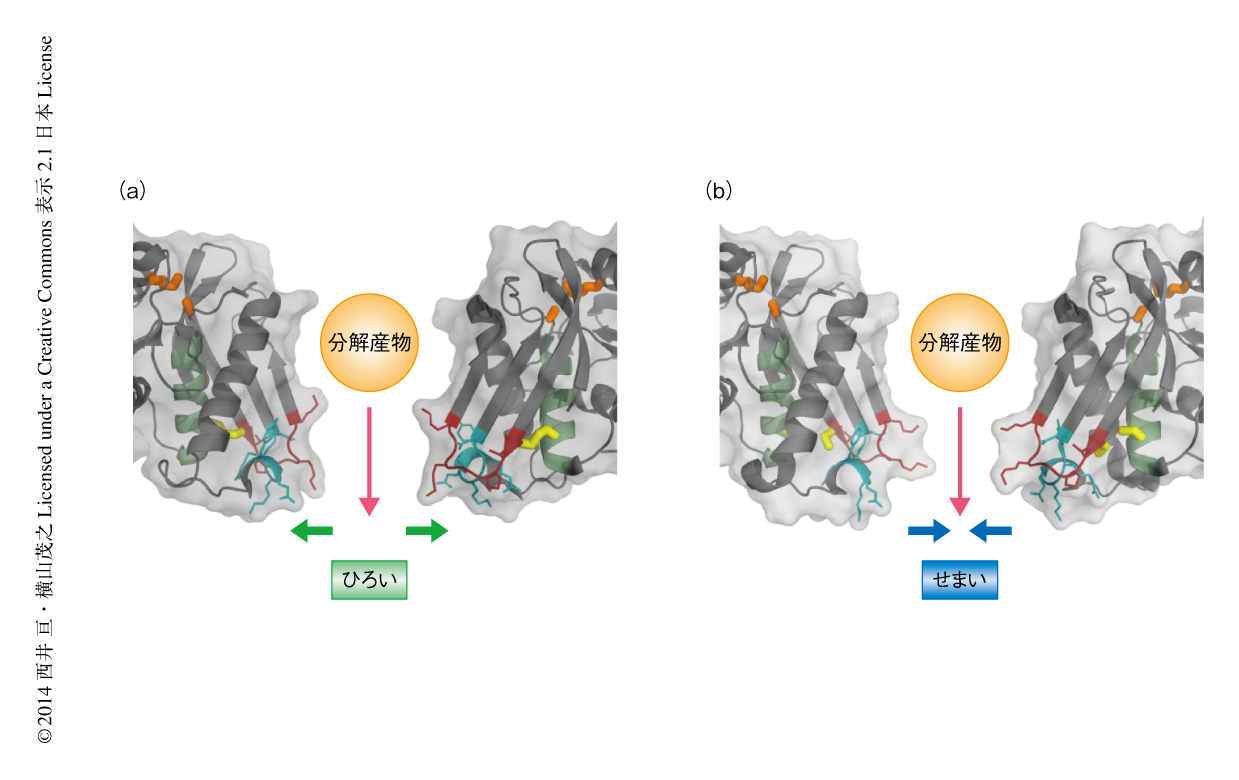
すでに,Cys617とCys691とのあいだにジスルフィド結合をもつLonプロテアーゼのプロテアーゼドメインからなるリングの構造は報告されている4)(PDB ID:1RR9).この研究では新たに,この“酸化型”のプロテアーゼドメインのリングに対し,ジスルフィド結合をもたない“還元型”のプロテアーゼドメインのリングの結晶構造を決定した(PDB ID:3WU3,図1).この2つの全体の構造はよく似ており,また,結晶において酸化あるいは還元することにより互いに可逆的に変換した.
唯一,酸化型と還元型とのあいだで異なっていたのは,分子内チャンバーから分解産物であるペプチドを放出する出口の大きさであった.すなわち,出口の断面積は,酸化型が230Å2,還元型が160Å2であった.出口を通過するペプチドは平均10残基であり6,7),その推定の投影面積は150Å2であるので,酸化型と還元型とのあいだの出口の大きさの違いはペプチドの通過に大きく影響すると考えられた.
酸化型と還元型とのあいだの構造変化は,ジスルフィド結合の形成および解離のひき起こす,きわめて精妙かつ簡潔なものであった.すなわち,Cys617とCys691とのあいだのジスルフィド結合が解離する際には,出口を構成する2つの部位の主鎖が出口の中心にむかい移動する.同時に,Cys617の側鎖が回転し,出口を構成する部位のいくつかの残基において側鎖のコンフォメーションが変化する.これら主鎖および側鎖の動きが協調的に起こることにより出口がせまくなる.Cys617とCys691とがジスルフィド結合を形成する際の構造変化はこの逆になる.
in vitroにおいてLonプロテアーゼによる異常なタンパク質の分解の活性を解析した.その結果,還元的な環境においてLonプロテアーゼの活性は酸化的な環境の約20%にまで低下することを発見した.また,低下した活性は,さらに酸化剤により処理することで回復した.すなわち,この酸化還元に応じたLonプロテアーゼの活性の変化は,構造の変化と同様に可逆的であった.
化学修飾法および部位特異的な変異法により,この活性の変化はCys617およびCys691の酸化還元によることが確かめられた.さらに,分子内チャンバーから分解産物を放出する出口の表面を構成するLys621およびLys623のAlaへの二重変異体の解析,および,ストップトフロー法による前定常状態における酵素反応の解析から,活性の変化は出口の大きさの変化によることが確かめられた.したがって,Cys617およびCys691は可逆的なジスルフィド結合の形成および解離をとおして出口の大きさを変更し,そのことによりLonプロテアーゼの活性を制御する“レドックススイッチ”であるといえた.
Lonプロテアーゼの活性が中点となる標準状態における酸化還元電位は-227 mVと決定された.細胞質における酸化還元電位は,休止状態では-280~-250 mVであり,高濃度の活性酸素などによる特殊な酸化ストレス環境においては-150 mV程度にまで上昇するとされる8).一方,宿主の腸内は酸化還元電位が-300~-200 mVの嫌気的な環境であり9),体外の好気的な環境は酸化的ではあるが,通常は,特殊な酸化ストレス環境ほどではない.したがって,Lonプロテアーゼのレドックススイッチは宿主の腸内と体外のまさに中間の酸化還元環境において作用するよう,正確にデザインされていた.
大腸菌においてLonプロテアーゼによる異常なタンパク質の分解の活性を解析した.その結果,好気的な環境においては,Lonプロテアーゼを発現する株では異常なタンパク質はほとんど蓄積せず,Lonプロテアーゼを欠損する株では蓄積した.一方,嫌気的な環境においては,Lonプロテアーゼを発現する株および欠損する株とも異常なタンパク質を蓄積した.すなわち,Lonプロテアーゼの活性は,in vitroと同様に,in vivoにおいても好気的な環境において高く嫌気的な環境において低かった.さらに,好気的な環境において,ジスルフィド結合を形成できない変異型Lonプロテアーゼを発現する株による異常なタンパク質の分解の活性は,野生型のLonプロテアーゼを発現する株より低いことがわかった.以上の結果から,大腸菌においてレドックススイッチが実際に機能し,好気的な環境においてLonプロテアーゼを高活性の酸化型へとスイッチすることが確かめられた.
一方,好気的な環境において野生型のLonプロテアーゼを過剰に発現させると,変異型Lonプロテアーゼを過剰に発現させた場合と比べ,細胞の増殖がいちじるしく阻害されることがわかった.対照的に,野生型Lonプロテアーゼの過剰発現株は,変異型Lonプロテアーゼの過剰発現株より,紫外線の照射に対する細胞の生存能が顕著に上昇した.すなわち,好気的な環境において酸化型にスイッチしたLonプロテアーゼの活性は,細胞外からのストレスから細胞を強力に防御する一方,細胞それ自体を損傷させた.このような諸刃の剣ともいえる酸化型Lonプロテアーゼの活性は,高エネルギー生産かつ高ストレスである体外の好気的な環境に最適である.反対に,低エネルギー生産かつ低ストレスである宿主の腸内においてLonプロテアーゼは還元型へとスイッチされる.
以上の結果から,腸内細菌科の細菌のもつLonプロテアーゼに固有の2つのCysが,環境に応じてLonプロテアーゼの活性を制御するレドックススイッチであることが明らかにされた.このレドックススイッチは可逆的なジスルフィド結合の形成および解離を介し,分子内チャンバーから分解産物を放出する出口の大きさを変更する.その結果,細胞における異常なタンパク質の分解活性は,宿主の腸内の嫌気的な環境と体外の好気的な環境のそれぞれに応じて最適化される.
腸内細菌科細菌が高い感染性をもつことの基本にこのように単純明快な分子機構の存在することは驚くべきことであった.この発見は,生物の環境への適応の機構を理解するうえで重要であるとともに,細菌感染症の対策において鍵になる可能性がある.腸内細菌科細菌による感染症はほぼすべての人類にかかわる重要な問題であり,そのなかには,たとえば,近年,急速に被害の広がりつつあるカルバペネム耐性腸内細菌科細菌などによる,有効な治療法のない深刻な疾病も多く含まれる.この研究が,このような問題を解決あるいは改善する端緒になれば幸いである.
略歴:理化学研究所 研究員.
研究テーマ:細胞内プロテアーゼの機能と構造.
抱負:細胞においてタンパク質が最終的に分解される過程から逆算することにより,生命を理解したい.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
© 2014 西井 亘・横山茂之 Licensed under CC 表示 2.1 日本
(理化学研究所 横山構造生物学研究室)
email:西井 亘,横山茂之
DOI: 10.7875/first.author.2014.152
A redox switch shapes the Lon protease exit pore to facultatively regulate proteolysis.
Wataru Nishii, Mutsuko Kukimoto-Niino, Takaho Terada, Mikako Shirouzu, Tomonari Muramatsu, Masaki Kojima, Hiroshi Kihara, Shigeyuki Yokoyama
Nature Chemical Biology, 11, 46-51 (2015)
要 約
細菌感染症の主要な原因である腸内細菌科の細菌は通性嫌気性をもち,嫌気的な環境である宿主の腸内および好気的な環境である体外のいずれにおいても生育することができる.宿主の腸内および体外において,細胞に生じる異常なタンパク質を分解するのはおもにLonプロテアーゼである.興味深いことに,腸内細菌科細菌のもつLonプロテアーゼには保存された2つのCysが存在し,ジスルフィド結合を形成することが知られている.筆者らは,この研究において,これらのCysが可逆的なジスルフィド結合の形成および解離を介してLonプロテアーゼの活性を制御する“レドックススイッチ”であることを発見した.すなわち,ジスルフィド結合の解離した還元型Lonプロテアーゼにおいては,分解産物であるペプチドを放出する出口がせまくなり活性は約20%に低下した.一方,ジスルフィド結合の形成された酸化型Lonプロテアーゼにおいては,分解産物の放出される出口は広くなり活性は回復した.このレドックスイッチは宿主の腸内と体外との中間の酸化還元環境において作用し,細胞に存在する異常なタンパク質の分解レベルをそれぞれの環境に最適化していた.
はじめに
AAA+プロテアーゼは生合成の誤りや細胞外からのストレスにより生じる異常なタンパク質の分解をとおして細胞におけるタンパク質の品質管理に貢献する1).細菌における主要なAAA+プロテアーゼはLonプロテアーゼであり,細胞に生じた異常なタンパク質の約50%を分解している2).Lonプロテアーゼの活性は諸刃の剣であり,細胞を防衛するうえできわめて重要である一方,過剰に発現した場合には細胞に致命的な損傷をあたえる3).したがって,異常なタンパク質の量に応じて適切に制御されなければならない.
Lonプロテアーゼの1次構造はN末端ドメイン,ATPaseドメイン,プロテアーゼドメインからなり,リング状に六量体化するATPaseドメインからなるリングとプロテアーゼドメインからなるリングが分子内チャンバーを形成する.基質となるタンパク質はATPaseドメインからなるリングの入口から取り込まれ,分子内チャンバーにおいて約10残基のペプチドにまで分解され,プロテアーゼドメインからなるリングの出口から放出される.興味深いことに,大腸菌のLonプロテアーゼの結晶構造において,Cys617とCys691とのあいだに分子内ジスルフィド結合の形成されることが知られている4).Lonプロテアーゼは細胞質に局在するが,細胞質は強い還元的な環境であるので,一般に,ジスルフィド結合は安定には形成されない.これらのCysは腸内細菌科(Enterobacteriaceae)の細菌において特徴的に保存され,ほかの生物種においてはみられない.
腸内細菌科は大腸菌,クレブシエラ菌,サルモネラ菌,赤痢菌,セラチア菌,ペスト菌などからなり,通常は無害な腸内共生細菌として存在する一方,細菌感染症のじつに半数をひき起こす,もっとも頻繁に遭遇する病原細菌でもある5).このことは,腸内細菌科細菌が嫌気的な環境である宿主の腸内と好気的な環境である体外のいずれにおいても強健に生育する通性嫌気性細菌であることに由来すると考えられる.実際,宿主の腸内の嫌気的な環境でしか生育できない偏性嫌気性細菌は,腸内フローラの99%以上をしめるにもかかわらず感染性はほとんどない.したがって,腸内細菌科細菌が宿主の腸内あるいは体外の環境の違いに適応する機構を知ることは非常に重要である.
宿主の腸内の嫌気的な環境ではタンパク質の生合成量は少なく,さらに,酸化などにより損傷をうけることも少ないため,細胞における異常なタンパク質の生成は低いレベルにある.一方,体外の好気的な環境ではタンパク質の生合成量は多く,合成されたタンパク質はつねに酸化ストレスにさらされる.したがって,異常なタンパク質の生成は高いレベルにある.細菌の細胞において異常なタンパク質を分解するのはおもにLonプロテアーゼであるので,腸内細菌科細菌は宿主の腸内と体外の2つの環境のあいだの違いに対応してLonプロテアーゼの活性を制御する必要がある.しかし,その分子機構はこれまで謎であった.筆者らは,この謎を解く鍵が腸内細菌科細菌のLonプロテアーゼに固有のジスルフィド結合にあるのではないかと考え,研究をスタートした.
1.ジスルフィド結合の形成および解離にともなう出口の大きさの変化
すでに,Cys617とCys691とのあいだにジスルフィド結合をもつLonプロテアーゼのプロテアーゼドメインからなるリングの構造は報告されている4)(PDB ID:1RR9).この研究では新たに,この“酸化型”のプロテアーゼドメインのリングに対し,ジスルフィド結合をもたない“還元型”のプロテアーゼドメインのリングの結晶構造を決定した(PDB ID:3WU3,図1).この2つの全体の構造はよく似ており,また,結晶において酸化あるいは還元することにより互いに可逆的に変換した.
唯一,酸化型と還元型とのあいだで異なっていたのは,分子内チャンバーから分解産物であるペプチドを放出する出口の大きさであった.すなわち,出口の断面積は,酸化型が230Å2,還元型が160Å2であった.出口を通過するペプチドは平均10残基であり6,7),その推定の投影面積は150Å2であるので,酸化型と還元型とのあいだの出口の大きさの違いはペプチドの通過に大きく影響すると考えられた.
酸化型と還元型とのあいだの構造変化は,ジスルフィド結合の形成および解離のひき起こす,きわめて精妙かつ簡潔なものであった.すなわち,Cys617とCys691とのあいだのジスルフィド結合が解離する際には,出口を構成する2つの部位の主鎖が出口の中心にむかい移動する.同時に,Cys617の側鎖が回転し,出口を構成する部位のいくつかの残基において側鎖のコンフォメーションが変化する.これら主鎖および側鎖の動きが協調的に起こることにより出口がせまくなる.Cys617とCys691とがジスルフィド結合を形成する際の構造変化はこの逆になる.
2.in vitroにおけるLonプロテアーゼの活性の酸化還元による制御
in vitroにおいてLonプロテアーゼによる異常なタンパク質の分解の活性を解析した.その結果,還元的な環境においてLonプロテアーゼの活性は酸化的な環境の約20%にまで低下することを発見した.また,低下した活性は,さらに酸化剤により処理することで回復した.すなわち,この酸化還元に応じたLonプロテアーゼの活性の変化は,構造の変化と同様に可逆的であった.
化学修飾法および部位特異的な変異法により,この活性の変化はCys617およびCys691の酸化還元によることが確かめられた.さらに,分子内チャンバーから分解産物を放出する出口の表面を構成するLys621およびLys623のAlaへの二重変異体の解析,および,ストップトフロー法による前定常状態における酵素反応の解析から,活性の変化は出口の大きさの変化によることが確かめられた.したがって,Cys617およびCys691は可逆的なジスルフィド結合の形成および解離をとおして出口の大きさを変更し,そのことによりLonプロテアーゼの活性を制御する“レドックススイッチ”であるといえた.
Lonプロテアーゼの活性が中点となる標準状態における酸化還元電位は-227 mVと決定された.細胞質における酸化還元電位は,休止状態では-280~-250 mVであり,高濃度の活性酸素などによる特殊な酸化ストレス環境においては-150 mV程度にまで上昇するとされる8).一方,宿主の腸内は酸化還元電位が-300~-200 mVの嫌気的な環境であり9),体外の好気的な環境は酸化的ではあるが,通常は,特殊な酸化ストレス環境ほどではない.したがって,Lonプロテアーゼのレドックススイッチは宿主の腸内と体外のまさに中間の酸化還元環境において作用するよう,正確にデザインされていた.
3.in vivoにおけるレドックススイッチの機能の検証
大腸菌においてLonプロテアーゼによる異常なタンパク質の分解の活性を解析した.その結果,好気的な環境においては,Lonプロテアーゼを発現する株では異常なタンパク質はほとんど蓄積せず,Lonプロテアーゼを欠損する株では蓄積した.一方,嫌気的な環境においては,Lonプロテアーゼを発現する株および欠損する株とも異常なタンパク質を蓄積した.すなわち,Lonプロテアーゼの活性は,in vitroと同様に,in vivoにおいても好気的な環境において高く嫌気的な環境において低かった.さらに,好気的な環境において,ジスルフィド結合を形成できない変異型Lonプロテアーゼを発現する株による異常なタンパク質の分解の活性は,野生型のLonプロテアーゼを発現する株より低いことがわかった.以上の結果から,大腸菌においてレドックススイッチが実際に機能し,好気的な環境においてLonプロテアーゼを高活性の酸化型へとスイッチすることが確かめられた.
一方,好気的な環境において野生型のLonプロテアーゼを過剰に発現させると,変異型Lonプロテアーゼを過剰に発現させた場合と比べ,細胞の増殖がいちじるしく阻害されることがわかった.対照的に,野生型Lonプロテアーゼの過剰発現株は,変異型Lonプロテアーゼの過剰発現株より,紫外線の照射に対する細胞の生存能が顕著に上昇した.すなわち,好気的な環境において酸化型にスイッチしたLonプロテアーゼの活性は,細胞外からのストレスから細胞を強力に防御する一方,細胞それ自体を損傷させた.このような諸刃の剣ともいえる酸化型Lonプロテアーゼの活性は,高エネルギー生産かつ高ストレスである体外の好気的な環境に最適である.反対に,低エネルギー生産かつ低ストレスである宿主の腸内においてLonプロテアーゼは還元型へとスイッチされる.
おわりに
以上の結果から,腸内細菌科の細菌のもつLonプロテアーゼに固有の2つのCysが,環境に応じてLonプロテアーゼの活性を制御するレドックススイッチであることが明らかにされた.このレドックススイッチは可逆的なジスルフィド結合の形成および解離を介し,分子内チャンバーから分解産物を放出する出口の大きさを変更する.その結果,細胞における異常なタンパク質の分解活性は,宿主の腸内の嫌気的な環境と体外の好気的な環境のそれぞれに応じて最適化される.
腸内細菌科細菌が高い感染性をもつことの基本にこのように単純明快な分子機構の存在することは驚くべきことであった.この発見は,生物の環境への適応の機構を理解するうえで重要であるとともに,細菌感染症の対策において鍵になる可能性がある.腸内細菌科細菌による感染症はほぼすべての人類にかかわる重要な問題であり,そのなかには,たとえば,近年,急速に被害の広がりつつあるカルバペネム耐性腸内細菌科細菌などによる,有効な治療法のない深刻な疾病も多く含まれる.この研究が,このような問題を解決あるいは改善する端緒になれば幸いである.
文 献
- Sauer, R. T. & Baker, T. A.: AAA+ proteases: ATP-fueled machines of protein destruction. Annu. Rev. Biochem., 80, 587-612 (2011)[PubMed]
- Van Melderen, L. & Aertsen, A.: Regulation and quality control by Lon-dependent proteolysis. Res. Microbiol., 160, 645-651 (2009)[PubMed]
- Goff, S. A. & Goldberg, A. L.: An increased content of protease La, the lon gene product, increases protein degradation and blocks growth in Escherichia coli. J. Biol. Chem., 262, 4508-4515 (1987)[PubMed]
- Botos, I., Melnikov, E. E., Cherry, S. et al.: The catalytic domain of Escherichia coli Lon protease has a unique fold and a Ser-Lys dyad in the active site. J. Biol. Chem., 279, 8140-8148 (2004)[PubMed]
- Versalovic, J.: Manual of Clinical Microbiology. ASM Press, Washington, D.C. (2011)
- Nishii, W., Maruyama, T., Matsuoka, R. et al.: The unique sites in SulA protein preferentially cleaved by ATP-dependent Lon protease from Escherichia coli. Eur. J. Biochem., 269, 451-457 (2002)[PubMed]
- Nishii, W., Suzuki, T., Nakada, M. et al.: Cleavage mechanism of ATP-dependent Lon protease toward ribosomal S2 protein. FEBS Lett., 579, 6846-6850 (2005)[PubMed]
- Ruddock, L. W. & Klappa, P.: Oxidative stress: protein folding with a novel redox switch. Curr. Biol., 9, R400-R402 (1999)[PubMed]
- Wilson, M.: Bacteriology of Humans: An Ecological Perspective. Wiley-Blackwell, Hoboken (2008)
著者プロフィール
略歴:理化学研究所 研究員.
研究テーマ:細胞内プロテアーゼの機能と構造.
抱負:細胞においてタンパク質が最終的に分解される過程から逆算することにより,生命を理解したい.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
研究室URL:http://sbl.riken.jp/
© 2014 西井 亘・横山茂之 Licensed under CC 表示 2.1 日本