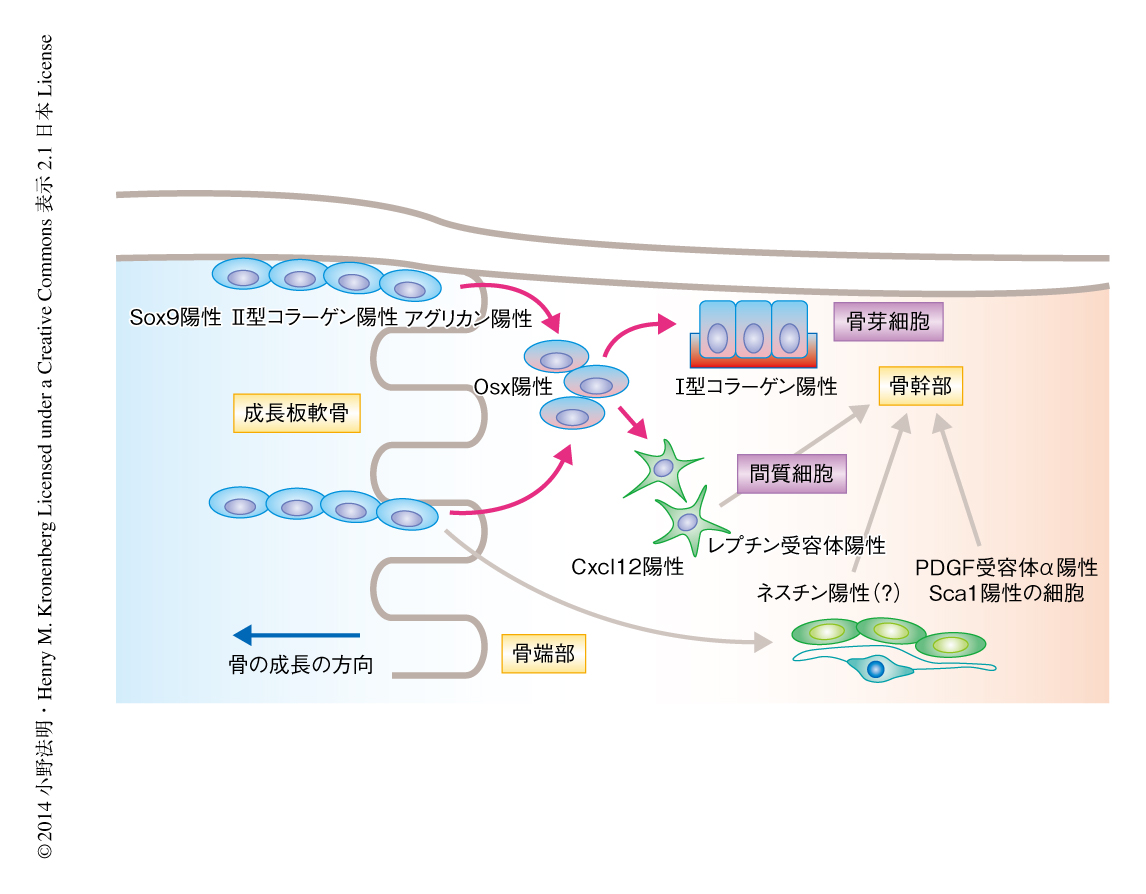
成長している長管骨における早期の間葉系前駆細胞は軟骨を形成する細胞の一部に由来する
小野法明・Henry M. Kronenberg
(米国Massachusetts General Hospital,Endocrine Unit)
email:小野法明
DOI: 10.7875/first.author.2014.148
A subset of chondrogenic cells provides early mesenchymal progenitors in growing bones.
Noriaki Ono, Wanida Ono, Takashi Nagasawa, Henry M. Kronenberg
Nature Cell Biology, 16, 1157-1167 (2014)
内軟骨性骨化の特徴は軟骨原基の存在であり,その内部に石灰化基質を形成する骨芽細胞および骨髄における造血を支持する間質細胞が形成される.一方で,これらの間葉系細胞の究極的な由来は明らかにされていない.細胞系譜の解析の結果,II型コラーゲンの遺伝子プロモーターにより標識される細胞は軟骨細胞のみならずRunx2を発現していない早期の傍軟骨膜細胞に寄与し,さらに,生後の骨芽細胞,Cxcl12陽性の間質細胞,および,骨髄間質の間葉系前駆細胞の大部分に寄与することが明らかになった.さらに,軟骨の形成に関連するII型コラーゲン,Sox9,アグリカンの遺伝子プロモーターにより標識される細胞は複数の細胞系譜をもつ間葉系細胞に寄与し,自己複製しながら生後の長期にわたり子孫細胞を供給することが明らかになった.これらの細胞は成体の骨髄に存在する間葉系前駆細胞とは明確に区別され,哺乳類における活発な成長に寄与すると考えられた.
骨の大部分は内軟骨性骨化により形成される.その発生の過程において,まず,未分化の間葉系細胞が集合し骨となる領域を決定し,さらに,これらの細胞が軟骨細胞へと分化し増殖して成長軟骨が形成される.成長軟骨の中心部の細胞は増殖を停止し肥大化軟骨細胞へと分化し,つづいて,間葉系細胞が軟骨基質へと遊走し骨芽細胞および間質細胞へと分化する1).転写因子Osxを発現する傍軟骨膜の骨芽前駆細胞は血管をともない軟骨原基へと侵入し,骨芽細胞および間質細胞へと分化する2).一方で,Osxを発現する細胞よりさらに早期の骨芽細胞系を構成する間葉系細胞についてはこれまで明らかにされていない.転写因子Sox9は間葉に集合する未分化な間葉系細胞に発現し,すべての骨軟骨の前駆細胞はSox9を発現する細胞に由来する3).Sox9はII型コラーゲンやアグリカンなど主要な軟骨基質をコードする遺伝子の制御領域に結合し,これらの発現を直接的に制御する.これら発生の初期の骨軟骨の前駆細胞と成体における間葉系幹細胞との関連は明らかにされていない.成体の長管骨の骨髄に存在する間葉系幹細胞あるいは骨髄間質の間葉系前駆細胞は,一般的にin vitroにおけるコロニー形成能をもち,培養皿においてあるいは成体に移植したのちに多分化能をもつ細胞と定義される.このコロニー形成能は,マウスにおけるネスチン陽性細胞4),非血球系のPDGF受容体α陽性Sca1陽性の細胞5),レプチン受容体陽性細胞6),ヒトにおけるCD146陽性の周皮細胞7) などに存在する.この研究においては,成長している長管骨の骨端部において骨芽細胞および間質細胞を供給する細胞の同定を試み,これらの細胞と,成体の骨髄における間葉系幹細胞あるいは間葉系前駆細胞との関連について探索した.
主要な軟骨基質であるII型コラーゲンの遺伝子プロモーターにより標識される細胞の細胞運命について解析した.胎生12.5日齢においてII型コラーゲンを発現する細胞は,成長軟骨のみならず傍軟骨膜に認められた.胎生14.5日齢において傍軟骨膜の中央部に出現した骨芽細胞は,ほぼすべてがII型コラーゲン陽性細胞に由来した.胎生15.5日齢においてII型コラーゲン陽性細胞に由来する細胞は,骨髄腔において増殖し1次骨化中心を占有した.つぎに,転写因子Osxの遺伝子プロモーターにより標識される細胞の細胞運命について解析した.胎生12.5日齢においてOsx陽性細胞は成長軟骨および傍軟骨膜に認められ,その領域はII型コラーゲン陽性細胞よりも狭い領域をしめていた.胎生14.5日齢においてOsx陽性細胞は骨芽細胞系であることを示す細胞よりも広い領域の傍軟骨膜の内面をしめた.胎生15.5日齢において1次骨化中心に出現した間葉系細胞は大多数がOsx陽性細胞であった.これらの細胞運命の解析の結果,II型コラーゲン陽性細胞の運命のひとつは傍軟骨膜および骨髄腔のOsx陽性細胞であることが示唆された.
転写因子Runx2は骨芽細胞の分化において必須であり,遺伝学的には転写因子Osxの上流に位置する.II型コラーゲン陽性細胞とRunx2の発現を位置づけるため,Runx2の欠損をもつマウスにおいてII型コラーゲン陽性細胞の細胞運命を解析した.胎生14.5日齢の傍軟骨膜において骨芽細胞系であることを示す細胞の出現は認められなかった一方,II型コラーゲン陽性細胞が傍軟骨膜および成長軟骨に認められた.すなわち,II型コラーゲン陽性細胞は傍軟骨膜においてRunx2の発現の上流に位置することが示唆された.つづいて,骨髄における造血が確立された生後3日齢においてII型コラーゲン陽性細胞に由来する細胞の分布を検討した結果,軟骨細胞および傍軟骨細胞のみならず,海綿骨および皮質骨の骨芽細胞および骨細胞,さらに,骨髄腔のCxcl12陽性の間質細胞に寄与することが明らかになった.Osx陽性細胞に由来する細胞も同様にこれらの細胞に寄与した.すなわち,長管骨における大部分の骨芽細胞およびCxcl12陽性の間質細胞は,ある時点でII型コラーゲン陽性細胞およびOsx陽性細胞である間葉系前駆細胞に由来することが明らかになった.
II型コラーゲン陽性細胞とOsx陽性細胞との関連をより詳細に検討した.胎生11.5日齢および胎生13.5日齢におけるII型コラーゲン陽性細胞(傍軟骨細胞および軟骨細胞)の子孫細胞は,長期にわたり成長軟骨,傍軟骨膜,1次骨化中心および2次骨化中心の骨芽細胞および間質細胞に寄与した.一方で,Osx陽性細胞は胎生13.5日齢の前後に傍軟骨膜に出現し,1次骨化中心に移転し一時的に増殖を示す一方,そののちの数週間で骨よりほぼ完全に消失した.すなわち,胎生期におけるOsx陽性細胞は一過性であり,II型コラーゲン陽性細胞に由来する前駆細胞によりつねに補給される必要のあることが示唆された.
生後の長管骨の形成においてもII型コラーゲン陽性細胞が骨芽細胞系の早期の細胞を含むかどうかを検討した.生後3日齢におけるII型コラーゲン陽性細胞は成長板および傍軟骨膜の直下の軟骨細胞に認められ,1週間後にはさらに成長板および傍軟骨膜の直下の内骨膜の表面を含む1次海綿骨領域に寄与した.さらに1カ月後には,II型コラーゲン陽性細胞に由来する細胞は骨端部の骨芽細胞および間質細胞に寄与し,そののち少なくとも1年半の長期にわたり,骨端部の骨芽細胞および間質細胞にくわえ,骨髄脂肪細胞に間断なく貢献した.一方で,生後3日齢におけるOsx陽性細胞の大部分は骨の表面と傍軟骨膜に認められ,1カ月後には骨の表面にくわえさらに骨髄腔の間質細胞に寄与した.そののち,Osx陽性細胞に由来する細胞は徐々に骨端部から消失する一方,骨幹部の骨髄の間質細胞および内骨膜の表面の骨芽細胞として残存した.すなわち,生後,Osx陽性細胞は骨端部では一過性に存在しのちに消失する一方,骨髄間質においては長期にわたり間質細胞として残存することが明らかになった.
II型コラーゲン陽性細胞である成長に関連する骨格系の前駆細胞と成体の骨髄における間葉系前駆細胞との関係を明らかにすることを試みた.生後5日齢の骨髄細胞を用いてコロニー形成能を検討した結果,Osx陽性細胞と比較して,II型コラーゲン陽性細胞が有意に高い割合でコロニー形成細胞に寄与した.一方で,これらのコロニー形成細胞それ自体はOsx陽性細胞あるいはII型コラーゲン陽性細胞ではなく,むしろ,II型コラーゲン陽性細胞の子孫細胞であることが示唆された.コロニー形成細胞が豊富に含まれる非血球系細胞のPDGF受容体α陽性Sca1陽性の画分について検討した結果,同様に,II型コラーゲン陽性細胞が有意に高い割合でこの画分に寄与した.しかし,胎生期および生後のOsx陽性細胞およびII型コラーゲン陽性細胞ともにPDGF受容体α陽性Sca1陽性の画分とは重複せず,また,のちの貢献はまれであった一方,ネスチン陽性細胞はこの画分と重複し,のちに高い割合で間断なく寄与した.よって,生後のII型コラーゲン陽性細胞が骨端部の骨芽細胞および間質細胞に寄与する過程において,PDGF受容体α陽性Sca1陽性の画分は必須な中間体ではないことが示唆された.
軟骨に関連するそのほかの遺伝子のプロモーターにより標識される細胞がII型コラーゲン陽性細胞と同様の挙動を示すかどうかを検討するため,転写因子Sox9および主要な軟骨基質であるアグリカンについて同様に細胞系譜の解析した.生後3日齢においてSox9陽性細胞およびアグリカン陽性細胞は成長板および傍軟骨膜に認められ,1週間後にはさらに成長板および傍軟骨膜の直下の内骨膜の表面を含む1次海綿骨領域に寄与した.そののち少なくとも6カ月,Sox9陽性細胞およびアグリカン陽性細胞は,II型コラーゲン陽性細胞と同様に,骨端部の骨芽細胞および間質細胞に間断なく貢献した.
以上の結果より,軟骨の形成に関連するSox9,II型コラーゲン,アグリカンの遺伝子プロモーターにより標識される細胞は早期の間葉系前駆細胞を含み,長管骨の形成の過程において軟骨細胞,骨芽細胞,間質細胞,脂肪細胞へと分化することが明らかになった.一方で,転写因子Osxの遺伝子プロモーターにより標識される細胞はより限定的な自己複製能および分化能をもつ下流の集団であり,骨端部で消失する一方で,骨幹部の骨髄に間質細胞として長期に残存した(図1).また,これら成長に関連する骨格系の前駆細胞が骨端部において骨芽細胞および間質細胞に分化する過程において,骨髄間質の間葉系前駆細胞は必須な中間体ではないことが推察された.レプチン受容体により標識される骨髄間質細胞がPDGF受容体α陽性Sca1陽性の画分といちじるしい重複を示し成体の骨幹部の骨髄において漸進的に骨芽細胞に寄与することが報告されている6).筆者らがこの研究において同定した,軟骨の形成に関連する遺伝子プロモーターにより標識される成長に関連する間葉系前駆細胞は,長管骨が急激に成長する時期に骨芽細胞および間質細胞の主要な供給源となり,一方で,そののち,成体におけるより緩慢な骨リモデリング期においては,レプチン受容体により標識される骨髄間質の間葉系前駆細胞がその役割をとって代わることが推察された.成体における骨髄間質の間葉系前駆細胞は,成長に関連する間葉系前駆細胞に由来するが,成長期における前駆細胞からの成体における前駆細胞への変換は非常にまれであると考えられた.このように,明確に区別される2種類の骨格系の前駆細胞の存在は,初期の急激な成長と,のちの成体におけるより緩慢な骨リモデリングを明確に制御する機序の一助になっていると考えられた.
略歴:2007年 東京医科歯科大学大学院医歯学総合研究科 修了,東京医科歯科大学歯学部附属病院 医員,2009年 米国Massachusetts General Hospital研究員,2012年 同 講師を経て,2014年より米国Michigan大学 助教授.
研究テーマ:骨および軟骨の幹細胞とその分子制御機構.
関心事:ここ米国Michigan大学で研究室をたちあげ,骨軟骨の未知の課題にいどむ複数の未完のプロジェクトに取り組んでいます.興味ある方はぜひご連絡ください.
Henry M. Kronenberg
米国Massachusetts General HospitalにてChief.
© 2014 小野法明・Henry M. Kronenberg Licensed under CC 表示 2.1 日本
(米国Massachusetts General Hospital,Endocrine Unit)
email:小野法明
DOI: 10.7875/first.author.2014.148
A subset of chondrogenic cells provides early mesenchymal progenitors in growing bones.
Noriaki Ono, Wanida Ono, Takashi Nagasawa, Henry M. Kronenberg
Nature Cell Biology, 16, 1157-1167 (2014)
要 約
内軟骨性骨化の特徴は軟骨原基の存在であり,その内部に石灰化基質を形成する骨芽細胞および骨髄における造血を支持する間質細胞が形成される.一方で,これらの間葉系細胞の究極的な由来は明らかにされていない.細胞系譜の解析の結果,II型コラーゲンの遺伝子プロモーターにより標識される細胞は軟骨細胞のみならずRunx2を発現していない早期の傍軟骨膜細胞に寄与し,さらに,生後の骨芽細胞,Cxcl12陽性の間質細胞,および,骨髄間質の間葉系前駆細胞の大部分に寄与することが明らかになった.さらに,軟骨の形成に関連するII型コラーゲン,Sox9,アグリカンの遺伝子プロモーターにより標識される細胞は複数の細胞系譜をもつ間葉系細胞に寄与し,自己複製しながら生後の長期にわたり子孫細胞を供給することが明らかになった.これらの細胞は成体の骨髄に存在する間葉系前駆細胞とは明確に区別され,哺乳類における活発な成長に寄与すると考えられた.
はじめに
骨の大部分は内軟骨性骨化により形成される.その発生の過程において,まず,未分化の間葉系細胞が集合し骨となる領域を決定し,さらに,これらの細胞が軟骨細胞へと分化し増殖して成長軟骨が形成される.成長軟骨の中心部の細胞は増殖を停止し肥大化軟骨細胞へと分化し,つづいて,間葉系細胞が軟骨基質へと遊走し骨芽細胞および間質細胞へと分化する1).転写因子Osxを発現する傍軟骨膜の骨芽前駆細胞は血管をともない軟骨原基へと侵入し,骨芽細胞および間質細胞へと分化する2).一方で,Osxを発現する細胞よりさらに早期の骨芽細胞系を構成する間葉系細胞についてはこれまで明らかにされていない.転写因子Sox9は間葉に集合する未分化な間葉系細胞に発現し,すべての骨軟骨の前駆細胞はSox9を発現する細胞に由来する3).Sox9はII型コラーゲンやアグリカンなど主要な軟骨基質をコードする遺伝子の制御領域に結合し,これらの発現を直接的に制御する.これら発生の初期の骨軟骨の前駆細胞と成体における間葉系幹細胞との関連は明らかにされていない.成体の長管骨の骨髄に存在する間葉系幹細胞あるいは骨髄間質の間葉系前駆細胞は,一般的にin vitroにおけるコロニー形成能をもち,培養皿においてあるいは成体に移植したのちに多分化能をもつ細胞と定義される.このコロニー形成能は,マウスにおけるネスチン陽性細胞4),非血球系のPDGF受容体α陽性Sca1陽性の細胞5),レプチン受容体陽性細胞6),ヒトにおけるCD146陽性の周皮細胞7) などに存在する.この研究においては,成長している長管骨の骨端部において骨芽細胞および間質細胞を供給する細胞の同定を試み,これらの細胞と,成体の骨髄における間葉系幹細胞あるいは間葉系前駆細胞との関連について探索した.
1.胎生の初期において骨芽細胞系の細胞はII型コラーゲンを発現する
主要な軟骨基質であるII型コラーゲンの遺伝子プロモーターにより標識される細胞の細胞運命について解析した.胎生12.5日齢においてII型コラーゲンを発現する細胞は,成長軟骨のみならず傍軟骨膜に認められた.胎生14.5日齢において傍軟骨膜の中央部に出現した骨芽細胞は,ほぼすべてがII型コラーゲン陽性細胞に由来した.胎生15.5日齢においてII型コラーゲン陽性細胞に由来する細胞は,骨髄腔において増殖し1次骨化中心を占有した.つぎに,転写因子Osxの遺伝子プロモーターにより標識される細胞の細胞運命について解析した.胎生12.5日齢においてOsx陽性細胞は成長軟骨および傍軟骨膜に認められ,その領域はII型コラーゲン陽性細胞よりも狭い領域をしめていた.胎生14.5日齢においてOsx陽性細胞は骨芽細胞系であることを示す細胞よりも広い領域の傍軟骨膜の内面をしめた.胎生15.5日齢において1次骨化中心に出現した間葉系細胞は大多数がOsx陽性細胞であった.これらの細胞運命の解析の結果,II型コラーゲン陽性細胞の運命のひとつは傍軟骨膜および骨髄腔のOsx陽性細胞であることが示唆された.
転写因子Runx2は骨芽細胞の分化において必須であり,遺伝学的には転写因子Osxの上流に位置する.II型コラーゲン陽性細胞とRunx2の発現を位置づけるため,Runx2の欠損をもつマウスにおいてII型コラーゲン陽性細胞の細胞運命を解析した.胎生14.5日齢の傍軟骨膜において骨芽細胞系であることを示す細胞の出現は認められなかった一方,II型コラーゲン陽性細胞が傍軟骨膜および成長軟骨に認められた.すなわち,II型コラーゲン陽性細胞は傍軟骨膜においてRunx2の発現の上流に位置することが示唆された.つづいて,骨髄における造血が確立された生後3日齢においてII型コラーゲン陽性細胞に由来する細胞の分布を検討した結果,軟骨細胞および傍軟骨細胞のみならず,海綿骨および皮質骨の骨芽細胞および骨細胞,さらに,骨髄腔のCxcl12陽性の間質細胞に寄与することが明らかになった.Osx陽性細胞に由来する細胞も同様にこれらの細胞に寄与した.すなわち,長管骨における大部分の骨芽細胞およびCxcl12陽性の間質細胞は,ある時点でII型コラーゲン陽性細胞およびOsx陽性細胞である間葉系前駆細胞に由来することが明らかになった.
II型コラーゲン陽性細胞とOsx陽性細胞との関連をより詳細に検討した.胎生11.5日齢および胎生13.5日齢におけるII型コラーゲン陽性細胞(傍軟骨細胞および軟骨細胞)の子孫細胞は,長期にわたり成長軟骨,傍軟骨膜,1次骨化中心および2次骨化中心の骨芽細胞および間質細胞に寄与した.一方で,Osx陽性細胞は胎生13.5日齢の前後に傍軟骨膜に出現し,1次骨化中心に移転し一時的に増殖を示す一方,そののちの数週間で骨よりほぼ完全に消失した.すなわち,胎生期におけるOsx陽性細胞は一過性であり,II型コラーゲン陽性細胞に由来する前駆細胞によりつねに補給される必要のあることが示唆された.
2.生後の初期において骨芽細胞系の早期の細胞は複数の系譜の間葉系細胞を供給する
生後の長管骨の形成においてもII型コラーゲン陽性細胞が骨芽細胞系の早期の細胞を含むかどうかを検討した.生後3日齢におけるII型コラーゲン陽性細胞は成長板および傍軟骨膜の直下の軟骨細胞に認められ,1週間後にはさらに成長板および傍軟骨膜の直下の内骨膜の表面を含む1次海綿骨領域に寄与した.さらに1カ月後には,II型コラーゲン陽性細胞に由来する細胞は骨端部の骨芽細胞および間質細胞に寄与し,そののち少なくとも1年半の長期にわたり,骨端部の骨芽細胞および間質細胞にくわえ,骨髄脂肪細胞に間断なく貢献した.一方で,生後3日齢におけるOsx陽性細胞の大部分は骨の表面と傍軟骨膜に認められ,1カ月後には骨の表面にくわえさらに骨髄腔の間質細胞に寄与した.そののち,Osx陽性細胞に由来する細胞は徐々に骨端部から消失する一方,骨幹部の骨髄の間質細胞および内骨膜の表面の骨芽細胞として残存した.すなわち,生後,Osx陽性細胞は骨端部では一過性に存在しのちに消失する一方,骨髄間質においては長期にわたり間質細胞として残存することが明らかになった.
3.成長に関連する骨格系の前駆細胞と成体の骨髄における間葉系前駆細胞との関連
II型コラーゲン陽性細胞である成長に関連する骨格系の前駆細胞と成体の骨髄における間葉系前駆細胞との関係を明らかにすることを試みた.生後5日齢の骨髄細胞を用いてコロニー形成能を検討した結果,Osx陽性細胞と比較して,II型コラーゲン陽性細胞が有意に高い割合でコロニー形成細胞に寄与した.一方で,これらのコロニー形成細胞それ自体はOsx陽性細胞あるいはII型コラーゲン陽性細胞ではなく,むしろ,II型コラーゲン陽性細胞の子孫細胞であることが示唆された.コロニー形成細胞が豊富に含まれる非血球系細胞のPDGF受容体α陽性Sca1陽性の画分について検討した結果,同様に,II型コラーゲン陽性細胞が有意に高い割合でこの画分に寄与した.しかし,胎生期および生後のOsx陽性細胞およびII型コラーゲン陽性細胞ともにPDGF受容体α陽性Sca1陽性の画分とは重複せず,また,のちの貢献はまれであった一方,ネスチン陽性細胞はこの画分と重複し,のちに高い割合で間断なく寄与した.よって,生後のII型コラーゲン陽性細胞が骨端部の骨芽細胞および間質細胞に寄与する過程において,PDGF受容体α陽性Sca1陽性の画分は必須な中間体ではないことが示唆された.
4.生後の初期のSox9陽性細胞およびアグリカン陽性細胞は骨芽細胞系の早期の細胞を含む
軟骨に関連するそのほかの遺伝子のプロモーターにより標識される細胞がII型コラーゲン陽性細胞と同様の挙動を示すかどうかを検討するため,転写因子Sox9および主要な軟骨基質であるアグリカンについて同様に細胞系譜の解析した.生後3日齢においてSox9陽性細胞およびアグリカン陽性細胞は成長板および傍軟骨膜に認められ,1週間後にはさらに成長板および傍軟骨膜の直下の内骨膜の表面を含む1次海綿骨領域に寄与した.そののち少なくとも6カ月,Sox9陽性細胞およびアグリカン陽性細胞は,II型コラーゲン陽性細胞と同様に,骨端部の骨芽細胞および間質細胞に間断なく貢献した.
おわりに
以上の結果より,軟骨の形成に関連するSox9,II型コラーゲン,アグリカンの遺伝子プロモーターにより標識される細胞は早期の間葉系前駆細胞を含み,長管骨の形成の過程において軟骨細胞,骨芽細胞,間質細胞,脂肪細胞へと分化することが明らかになった.一方で,転写因子Osxの遺伝子プロモーターにより標識される細胞はより限定的な自己複製能および分化能をもつ下流の集団であり,骨端部で消失する一方で,骨幹部の骨髄に間質細胞として長期に残存した(図1).また,これら成長に関連する骨格系の前駆細胞が骨端部において骨芽細胞および間質細胞に分化する過程において,骨髄間質の間葉系前駆細胞は必須な中間体ではないことが推察された.レプチン受容体により標識される骨髄間質細胞がPDGF受容体α陽性Sca1陽性の画分といちじるしい重複を示し成体の骨幹部の骨髄において漸進的に骨芽細胞に寄与することが報告されている6).筆者らがこの研究において同定した,軟骨の形成に関連する遺伝子プロモーターにより標識される成長に関連する間葉系前駆細胞は,長管骨が急激に成長する時期に骨芽細胞および間質細胞の主要な供給源となり,一方で,そののち,成体におけるより緩慢な骨リモデリング期においては,レプチン受容体により標識される骨髄間質の間葉系前駆細胞がその役割をとって代わることが推察された.成体における骨髄間質の間葉系前駆細胞は,成長に関連する間葉系前駆細胞に由来するが,成長期における前駆細胞からの成体における前駆細胞への変換は非常にまれであると考えられた.このように,明確に区別される2種類の骨格系の前駆細胞の存在は,初期の急激な成長と,のちの成体におけるより緩慢な骨リモデリングを明確に制御する機序の一助になっていると考えられた.
文 献
- Kronenberg, H. M.: Developmental regulation of the growth plate. Nature, 423, 332-336 (2003)[PubMed]
- Maes, C., Kobayashi, T., Selig, M. K. et al.: Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels. Dev. Cell., 19, 329-344 (2010)[PubMed]
- Akiyama, H., Kim, J. E., Nakashima, K. et al.: Osteo-chondroprogenitor cells are derived from Sox9 expressing precursors. Proc. Natl. Acad. Sci. USA, 102, 14665-14670 (2005)[PubMed]
- Mendez-Ferrer, S., Michurina, T. V., Ferraro, F. et al.: Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature, 466, 829-834 (2010)[PubMed]
- Morikawa, S., Mabuchi, Y., Kubota, Y. et al.: Prospective identification, isolation, and systemic transplantation of multipotent mesenchymal stem cells in murine bone marrow. J. Exp. Med., 206, 2483-2496 (2009)[PubMed]
- Zhou, B. O., Yue, R., Murphy, M. M. et al.: Leptin-receptorexpressing mesenchymal stromal cells represent the main source of bone formed by adult bone marrow. Cell Stem Cell, 15, 154-168 (2014)[PubMed]
- Sacchetti, B., Funari, A., Michienzi, S. et al.: Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment. Cell, 131, 324-336 (2007)[PubMed]
著者プロフィール
略歴:2007年 東京医科歯科大学大学院医歯学総合研究科 修了,東京医科歯科大学歯学部附属病院 医員,2009年 米国Massachusetts General Hospital研究員,2012年 同 講師を経て,2014年より米国Michigan大学 助教授.
研究テーマ:骨および軟骨の幹細胞とその分子制御機構.
関心事:ここ米国Michigan大学で研究室をたちあげ,骨軟骨の未知の課題にいどむ複数の未完のプロジェクトに取り組んでいます.興味ある方はぜひご連絡ください.
Henry M. Kronenberg
米国Massachusetts General HospitalにてChief.
© 2014 小野法明・Henry M. Kronenberg Licensed under CC 表示 2.1 日本