エボラ出血熱の病原性および抵抗性は宿主のもつ遺伝子の多様性による
奥村 敦
(米国Washington大学Department of Microbiology)
email:奥村 敦
DOI: 10.7875/first.author.2014.150
Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance.
Angela L. Rasmussen, Atsushi Okumura, Martin T. Ferris, Richard Green, Friederike Feldmann, Sara M. Kelly, Dana P. Scott, David Safronetz, Elaine Haddock, Rachel LaCasse, Matthew J. Thomas, Pavel Sova, Victoria S. Carter, Jeffrey M. Weiss, Darla R. Miller, Ginger D. Shaw, Marcus J. Korth, Mark T. Heise, Ralph S. Baric, Fernando Pardo Manuel de Villena, Heinz Feldmann, Michael G. Katze
Science, 346, 987-991 (2014)
既存のマウスにおけるエボラウイルスの感染モデルは出血,血液凝固不全などヒトで認められるような症状を示さず,ヒト以外の動物でこれらの症状を呈するのは霊長類およびハムスターなど一部にかぎられている.筆者らは,遺伝的に多様性な背景をもつ共同交配マウスにエボラウイルスを感染させると,異なる表現型を呈することを示した.エボラウイルスの感染による表現型は,まったく症状のない完全な抵抗型から,血液凝固不全により100%の死亡率を示すものまで多様であった.また,これらのマウスにおいて宿主のもつ遺伝子を解析したところ,炎症性シグナルの活性化が血管内皮細胞の活性化や血管の透過性と関係しており,リンパ球の分化および細胞接着の活性化により致死に対する抵抗性になっていること,Tek遺伝子の対立遺伝子が感受性に関与していることが示された.これらのことは,宿主のもつ遺伝的な背景がエボラ出血熱の罹病性に関与することを示した.
マウスに対するエボラウイルス-マウス適応株の感染は致死的であるにもかかわらず血液凝固不全などヒトで認められるような症状を示さない.このことから,エボラウイルスに対するワクチンあるいは治療法の開発するうえでマウスを使用することはできず,エボラ出血熱の病因の研究にはアカゲザル1-4),モルモット5,6),シリアンハムスター7) が使用されていた.これらのモデル動物はエボラ出血熱の特徴を正確に示すが,その利用には費用,動物愛護,倫理の観点から多くの制限がある.
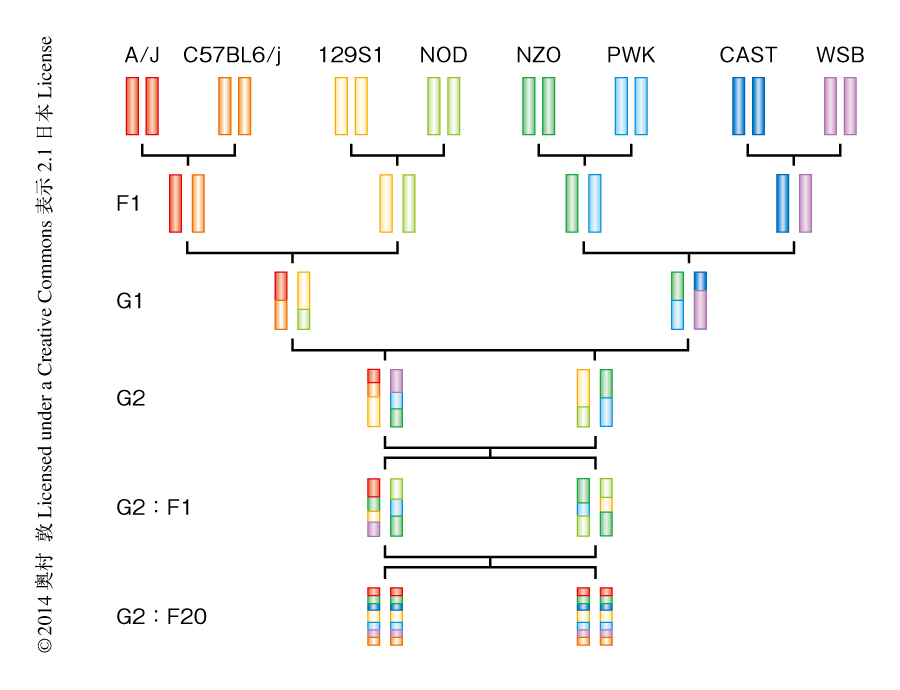
8系統のファウンダーマウスから作製された,遺伝的に多様な共同交配(collaborative cross)マウス(図1)を用いて,エボラ出血熱ウイルス性疾患において宿主の遺伝的な背景の役割について解析した.8系統のうち5系統は近交系マウス,ほかの3系統は野生系統8) であった.これら8系統のマウスは,3つの主要なマウス亜種9),Mus musculus musculus,M. m. domesticus,M. m. castaneusに共通する遺伝的な多様性の90%を代表していた.8系統のファウンダーマウスの腹膜にエボラウイルス-マウス適応株あるいは野生型エボラウイルスMayinga株を接種し,その表現型について検討した.その結果,エボラウイルス-マウス適応株の接種においては複数の投与量にて25~100%の死亡率が観察されたにもかかわらず,野生型エボラウイルスの接種では血液凝固不全などの所見は認められず致死にはいたらなかった.つづいて,作製された47系統の共同交配マウスの腹膜にエボラウイルス-マウス適応株を接種し,表現型について評価した.エボラウイルス-マウス適応株はモルモットおよびアカゲザル1) において病原性を示し,シリアンハムスター7) においては致死性のエボラ出血熱をひき起こすことが知られている.共同交配マウスへの投与においては,抵抗性を示す系統,エボラ出血熱の徴候は示さないが肝臓の変色が観察され致死となる系統,感受性を示す系統が認められた.
これらの共同交配マウスのうち,感受性を示す系統のマウスおよび抵抗性を示す系統のマウスについて詳細に解析した.感受性を示す系統のマウスは,感染から5日後には体重が15%減少し,感染から6日後にすべてのマウスが死亡した.また,血液凝固時間の延長,臓器における出血,血液の黒褐色化,脾腫および肝臓の変色を含む,エボラ出血熱と一致した肉眼的な病理所見を示した.抵抗性を示す系統のマウスは,一時的に体重の減少が認められたものの,14日目には完全に体重を回復した.体重の減少のほかには明白な肉眼的な病理所見はなかった.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスともに,野生型エボラウイルスの感染では,臨床的な所見および肉眼的な病理所見は認められず,感染から3日後に肝臓においてウイルスが検出されたものの,その量はエボラウイルス-マウス適応株を接種した場合と比べ1/100~1/1000であった.感染から5日後にはウイルスは検出されなかったことから,野生型エボラウイルスはマウスの体内では複製できないことが示唆された.肝臓および脾臓において定量RT-PCR法およびフォーカス形成アッセイによりウイルスを測定した結果,感染から3日後のフォーカス形成アッセイでは,感受性を示す系統のマウスにおけるウイルスの量は,抵抗性を示す系統のマウスに比べ10~100倍も多かった.このことから,エボラウイルスに対する抵抗性はウイルスのアセンブリーあるいは分泌など転写後のプロセスの欠損と関係していることが示唆された.
感受性を示す系統のマウスおよび抵抗性を示す系統のマウスの肝臓をウイルスのもつタンパク質のひとつVP40により免疫組織染色した結果,抵抗性を示す系統のマウスはVP40の量の少ないことが観察された.また,臓器から抽出したウイルスの遺伝子配列を確認した結果,配列に変化は認められず,また,どちらの系統でも配列に違いはなかった.感受性を示す系統のマウスと抵抗性を示す系統のマウスの脾臓および肝臓ではウイルスの力価に有意な差が認められたにもかかわらず,炎症あるいはアポトーシスを示す組織学的な所見においては2つの系統のあいだで差は認められなかった.臓器に対する同様の指向性を示すにもかかわらず,2つの系統のマウスは肝臓において異なる細胞に感染することが観察された.感受性を示す系統のマウスはあらゆる肝細胞においてウイルス抗原を観察できたが,抵抗性を示す系統のマウスでは血管内皮細胞およびクッパー細胞でのみウイルス抗原が観察された.このことから,抵抗性を示す系統のマウスにおいて,肝臓の血管内皮細胞およびマクロファージの感染に対する反応がウイルスの産生を制限し全身性の炎症および血液凝固の障害を制御しているものと考えられた.
エボラ出血熱ウイルス性疾患の症状のひとつである血液凝固不全について観察したところ,感染から5日後および6日後,感受性を示す系統のマウスでは,抵抗性を示す系統のマウスおよび対照となるマウスと比較して,血液凝固不全を示す所見が認められた.また,感受性を示す系統のマウスでは,感染から3日後に血清フィブリノーゲン値のピーク,そののちの急激な低下が観察された.肝臓における細胞死とそれにともなう血液凝固因子の減少に対し,これを補う目的のためにフィブリノーゲンが産生されたのかもしれない.高度の出血および血液凝固不全が死亡の48時間前にピークを示す現象は,ほかのエボラ出血熱のモデルでも観察されている3,7).
症状と宿主のもつ遺伝子との関係について検討するため,感受性を示す系統のマウスおよび抵抗性を示す系統のマウスにエボラウイルス-マウス適応株を感染させ,遺伝子発現の変動について比較した.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスともに,脾臓および肝臓において,感染により発現の上昇した遺伝子は,感染していないマウスと比較して10~100倍も多かった.この結果は,エボラ出血熱が感染の初期に多くの遺伝子の発現を誘導することによると思われた.感受性を示す系統のマウスの脾臓において,感染から1日後にMAPキナーゼの活性化が認められた.また,炎症性サイトカインやNF-κBの産生の誘導に関連する遺伝子の発現が上昇していた.また,感染から3日後には,アポトーシスおよび炎症性サイトカインの誘導に関連する遺伝子の発現が上昇していた.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスにおいて,感染から5日後までに発現の変動した遺伝子の数はピークとなり,それらのあいだの発現する遺伝子の違いは,発症する過程の違いを表わすと考えられた.
感受性を示す系統のマウスの肝臓において発現の変動する遺伝子を詳細に解析した結果,感染から3日後および5日後に,血管内皮細胞におけるチロシンリン酸化に関係するTie1遺伝子およびTek遺伝子(Tie2遺伝子)を含む,血管の修復に関する遺伝子の発現の変化が認められた.Tie1遺伝子およびTek遺伝子の発現は,感染していないマウスと比較して,感染から5日後には低下していた.これは,感受性を示す系統のマウスにおいて血液凝固不全が発症するのと同じ時期であった.感受性を示す系統のマウスの肝臓における血管および血管内皮細胞の維持に関連したタンパク質の活性化について,とくに,インターロイキン6に関連した炎症,血管内皮細胞の活性化,血管の分化の活性化の過程,血管新生や炎症の制御の過程について予測した.TIE1シグナル伝達系およびTEKシグナル伝達系は血液凝固因子の活性を促進し,エボラウイルスの感染による血液凝固の障害に関与している.Tie1遺伝子およびTek遺伝子の発現は抵抗性を示す系統のマウスの脾臓において上昇しており,このことから,感受性を示す系統のマウスにおいて,血管内皮細胞におけるシグナル伝達系がエボラ出血熱の発症に関与していることが示唆された.抵抗性を示す系統のマウスの肝臓において,感染から5日後に血管の再生および修復に関係する遺伝子の発現が上昇していたことから,血管の再生および修復が効果的に行われていることが示唆された.抵抗性を示す系統のマウスにおける血管内皮細胞およびクッパー細胞へのエボラウイルス-マウス適応株の感染の制限が,肝細胞における炎症性サイトカインおよび血小板の減少,血液凝固不全に関するタンパク質の発現の誘導をさまたげていることが示唆された.
使用した8系統のファウンダーマウスのゲノムを解析し,Tie1遺伝子の対立遺伝子は3種のすべての亜種に由来し,また,その分子進化には多くの分岐が認められ,Tie1対立遺伝子と表現型とのあいだに有意な違いは認められなかった.これとは対照的に,作製された47系統の共同交配マウスでは,Tek遺伝子の対立遺伝子は2つの亜種のみに由来し,多様性を示した.異なるTek対立遺伝子は炎症性の血液凝固の障害および血管機能の障害と関連していた.
2014年の西アフリカにおける大流行では,エボラ出血熱ウイルス性疾患の患者の30~50%において出血の徴候が現われており,エボラ出血熱ウイルス性疾患において観察される病態,および,作製した47系統の共同交配マウスにおいても同様の傾向が認められた.生存者がエボラウイルスあるいは関連したウイルスに対し既存の免疫をもつ可能性を除外することができないが,筆者らにより示された遺伝的な要因がエボラウイルス感染症の発症において重要であることが示唆された.
略歴:1992年 麻布大学大学院獣医学研究科 修了,2000年 米国Johns Hopkins大学,2006年 米国Pennsylvania大学Research Associateを経て,2011年より米国Washington大学Research Scientist.
研究テーマ:ウイルス感染症における免疫反応.実験動物学.
© 2014 奥村 敦 Licensed under CC 表示 2.1 日本
(米国Washington大学Department of Microbiology)
email:奥村 敦
DOI: 10.7875/first.author.2014.150
Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance.
Angela L. Rasmussen, Atsushi Okumura, Martin T. Ferris, Richard Green, Friederike Feldmann, Sara M. Kelly, Dana P. Scott, David Safronetz, Elaine Haddock, Rachel LaCasse, Matthew J. Thomas, Pavel Sova, Victoria S. Carter, Jeffrey M. Weiss, Darla R. Miller, Ginger D. Shaw, Marcus J. Korth, Mark T. Heise, Ralph S. Baric, Fernando Pardo Manuel de Villena, Heinz Feldmann, Michael G. Katze
Science, 346, 987-991 (2014)
要 約
既存のマウスにおけるエボラウイルスの感染モデルは出血,血液凝固不全などヒトで認められるような症状を示さず,ヒト以外の動物でこれらの症状を呈するのは霊長類およびハムスターなど一部にかぎられている.筆者らは,遺伝的に多様性な背景をもつ共同交配マウスにエボラウイルスを感染させると,異なる表現型を呈することを示した.エボラウイルスの感染による表現型は,まったく症状のない完全な抵抗型から,血液凝固不全により100%の死亡率を示すものまで多様であった.また,これらのマウスにおいて宿主のもつ遺伝子を解析したところ,炎症性シグナルの活性化が血管内皮細胞の活性化や血管の透過性と関係しており,リンパ球の分化および細胞接着の活性化により致死に対する抵抗性になっていること,Tek遺伝子の対立遺伝子が感受性に関与していることが示された.これらのことは,宿主のもつ遺伝的な背景がエボラ出血熱の罹病性に関与することを示した.
はじめに
マウスに対するエボラウイルス-マウス適応株の感染は致死的であるにもかかわらず血液凝固不全などヒトで認められるような症状を示さない.このことから,エボラウイルスに対するワクチンあるいは治療法の開発するうえでマウスを使用することはできず,エボラ出血熱の病因の研究にはアカゲザル1-4),モルモット5,6),シリアンハムスター7) が使用されていた.これらのモデル動物はエボラ出血熱の特徴を正確に示すが,その利用には費用,動物愛護,倫理の観点から多くの制限がある.
1.エボラウイルス感染症の新たなモデル動物としての共同交配マウス
8系統のファウンダーマウスから作製された,遺伝的に多様な共同交配(collaborative cross)マウス(図1)を用いて,エボラ出血熱ウイルス性疾患において宿主の遺伝的な背景の役割について解析した.8系統のうち5系統は近交系マウス,ほかの3系統は野生系統8) であった.これら8系統のマウスは,3つの主要なマウス亜種9),Mus musculus musculus,M. m. domesticus,M. m. castaneusに共通する遺伝的な多様性の90%を代表していた.8系統のファウンダーマウスの腹膜にエボラウイルス-マウス適応株あるいは野生型エボラウイルスMayinga株を接種し,その表現型について検討した.その結果,エボラウイルス-マウス適応株の接種においては複数の投与量にて25~100%の死亡率が観察されたにもかかわらず,野生型エボラウイルスの接種では血液凝固不全などの所見は認められず致死にはいたらなかった.つづいて,作製された47系統の共同交配マウスの腹膜にエボラウイルス-マウス適応株を接種し,表現型について評価した.エボラウイルス-マウス適応株はモルモットおよびアカゲザル1) において病原性を示し,シリアンハムスター7) においては致死性のエボラ出血熱をひき起こすことが知られている.共同交配マウスへの投与においては,抵抗性を示す系統,エボラ出血熱の徴候は示さないが肝臓の変色が観察され致死となる系統,感受性を示す系統が認められた.
2.エボラ出血熱ウイルス性疾患の症状を示すマウスの発見
これらの共同交配マウスのうち,感受性を示す系統のマウスおよび抵抗性を示す系統のマウスについて詳細に解析した.感受性を示す系統のマウスは,感染から5日後には体重が15%減少し,感染から6日後にすべてのマウスが死亡した.また,血液凝固時間の延長,臓器における出血,血液の黒褐色化,脾腫および肝臓の変色を含む,エボラ出血熱と一致した肉眼的な病理所見を示した.抵抗性を示す系統のマウスは,一時的に体重の減少が認められたものの,14日目には完全に体重を回復した.体重の減少のほかには明白な肉眼的な病理所見はなかった.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスともに,野生型エボラウイルスの感染では,臨床的な所見および肉眼的な病理所見は認められず,感染から3日後に肝臓においてウイルスが検出されたものの,その量はエボラウイルス-マウス適応株を接種した場合と比べ1/100~1/1000であった.感染から5日後にはウイルスは検出されなかったことから,野生型エボラウイルスはマウスの体内では複製できないことが示唆された.肝臓および脾臓において定量RT-PCR法およびフォーカス形成アッセイによりウイルスを測定した結果,感染から3日後のフォーカス形成アッセイでは,感受性を示す系統のマウスにおけるウイルスの量は,抵抗性を示す系統のマウスに比べ10~100倍も多かった.このことから,エボラウイルスに対する抵抗性はウイルスのアセンブリーあるいは分泌など転写後のプロセスの欠損と関係していることが示唆された.
3.肝臓におけるウイルスの指向性がエボラ出血熱の発症と関係する
感受性を示す系統のマウスおよび抵抗性を示す系統のマウスの肝臓をウイルスのもつタンパク質のひとつVP40により免疫組織染色した結果,抵抗性を示す系統のマウスはVP40の量の少ないことが観察された.また,臓器から抽出したウイルスの遺伝子配列を確認した結果,配列に変化は認められず,また,どちらの系統でも配列に違いはなかった.感受性を示す系統のマウスと抵抗性を示す系統のマウスの脾臓および肝臓ではウイルスの力価に有意な差が認められたにもかかわらず,炎症あるいはアポトーシスを示す組織学的な所見においては2つの系統のあいだで差は認められなかった.臓器に対する同様の指向性を示すにもかかわらず,2つの系統のマウスは肝臓において異なる細胞に感染することが観察された.感受性を示す系統のマウスはあらゆる肝細胞においてウイルス抗原を観察できたが,抵抗性を示す系統のマウスでは血管内皮細胞およびクッパー細胞でのみウイルス抗原が観察された.このことから,抵抗性を示す系統のマウスにおいて,肝臓の血管内皮細胞およびマクロファージの感染に対する反応がウイルスの産生を制限し全身性の炎症および血液凝固の障害を制御しているものと考えられた.
4.エボラ出血熱感染症に対し感受性を示す系統のマウスは血液凝固不全を呈する
エボラ出血熱ウイルス性疾患の症状のひとつである血液凝固不全について観察したところ,感染から5日後および6日後,感受性を示す系統のマウスでは,抵抗性を示す系統のマウスおよび対照となるマウスと比較して,血液凝固不全を示す所見が認められた.また,感受性を示す系統のマウスでは,感染から3日後に血清フィブリノーゲン値のピーク,そののちの急激な低下が観察された.肝臓における細胞死とそれにともなう血液凝固因子の減少に対し,これを補う目的のためにフィブリノーゲンが産生されたのかもしれない.高度の出血および血液凝固不全が死亡の48時間前にピークを示す現象は,ほかのエボラ出血熱のモデルでも観察されている3,7).
5.宿主のもつTei1遺伝子およびTek遺伝子が感受性に関与する
症状と宿主のもつ遺伝子との関係について検討するため,感受性を示す系統のマウスおよび抵抗性を示す系統のマウスにエボラウイルス-マウス適応株を感染させ,遺伝子発現の変動について比較した.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスともに,脾臓および肝臓において,感染により発現の上昇した遺伝子は,感染していないマウスと比較して10~100倍も多かった.この結果は,エボラ出血熱が感染の初期に多くの遺伝子の発現を誘導することによると思われた.感受性を示す系統のマウスの脾臓において,感染から1日後にMAPキナーゼの活性化が認められた.また,炎症性サイトカインやNF-κBの産生の誘導に関連する遺伝子の発現が上昇していた.また,感染から3日後には,アポトーシスおよび炎症性サイトカインの誘導に関連する遺伝子の発現が上昇していた.感受性を示す系統のマウスおよび抵抗性を示す系統のマウスにおいて,感染から5日後までに発現の変動した遺伝子の数はピークとなり,それらのあいだの発現する遺伝子の違いは,発症する過程の違いを表わすと考えられた.
感受性を示す系統のマウスの肝臓において発現の変動する遺伝子を詳細に解析した結果,感染から3日後および5日後に,血管内皮細胞におけるチロシンリン酸化に関係するTie1遺伝子およびTek遺伝子(Tie2遺伝子)を含む,血管の修復に関する遺伝子の発現の変化が認められた.Tie1遺伝子およびTek遺伝子の発現は,感染していないマウスと比較して,感染から5日後には低下していた.これは,感受性を示す系統のマウスにおいて血液凝固不全が発症するのと同じ時期であった.感受性を示す系統のマウスの肝臓における血管および血管内皮細胞の維持に関連したタンパク質の活性化について,とくに,インターロイキン6に関連した炎症,血管内皮細胞の活性化,血管の分化の活性化の過程,血管新生や炎症の制御の過程について予測した.TIE1シグナル伝達系およびTEKシグナル伝達系は血液凝固因子の活性を促進し,エボラウイルスの感染による血液凝固の障害に関与している.Tie1遺伝子およびTek遺伝子の発現は抵抗性を示す系統のマウスの脾臓において上昇しており,このことから,感受性を示す系統のマウスにおいて,血管内皮細胞におけるシグナル伝達系がエボラ出血熱の発症に関与していることが示唆された.抵抗性を示す系統のマウスの肝臓において,感染から5日後に血管の再生および修復に関係する遺伝子の発現が上昇していたことから,血管の再生および修復が効果的に行われていることが示唆された.抵抗性を示す系統のマウスにおける血管内皮細胞およびクッパー細胞へのエボラウイルス-マウス適応株の感染の制限が,肝細胞における炎症性サイトカインおよび血小板の減少,血液凝固不全に関するタンパク質の発現の誘導をさまたげていることが示唆された.
使用した8系統のファウンダーマウスのゲノムを解析し,Tie1遺伝子の対立遺伝子は3種のすべての亜種に由来し,また,その分子進化には多くの分岐が認められ,Tie1対立遺伝子と表現型とのあいだに有意な違いは認められなかった.これとは対照的に,作製された47系統の共同交配マウスでは,Tek遺伝子の対立遺伝子は2つの亜種のみに由来し,多様性を示した.異なるTek対立遺伝子は炎症性の血液凝固の障害および血管機能の障害と関連していた.
おわりに
2014年の西アフリカにおける大流行では,エボラ出血熱ウイルス性疾患の患者の30~50%において出血の徴候が現われており,エボラ出血熱ウイルス性疾患において観察される病態,および,作製した47系統の共同交配マウスにおいても同様の傾向が認められた.生存者がエボラウイルスあるいは関連したウイルスに対し既存の免疫をもつ可能性を除外することができないが,筆者らにより示された遺伝的な要因がエボラウイルス感染症の発症において重要であることが示唆された.
文 献
- Bray, M., Hatfill, S., Hensley, L. M. et al.: Haematological, biochemical and coagulation changes in mice, guinea-pigs and monkeys infected with a mouse-adapted variant of Ebola Zaire virus. J. Comp. Pathol., 125, 243-253 (2001)[PubMed]
- Yen, J. Y., Garamszegi, S., Geisbert, J. B. et al.: Therapeutics of Ebola hemorrhagic fever: whole-genome transcriptional analysis of successful disease mitigation. J. Infect. Dis., 204(suppl.3), S1043-S1052 (2011)[PubMed]
- Ebihara, H., Rockx, B., Marzi, A. et al.: Host response dynamics following lethal infection of rhesus macaques with Zaire ebolavirus. J. Infect. Dis., 204(suppl.3), S991-S999 (2011)[PubMed]
- Geisbert, T. W., Young, H. A., Jahrling, P. B. et al.: Mechanisms underlying coagulation abnormalities in ebola hemorrhagic fever: overexpression of tissue factor in primate monocytes/macrophages is a key event. J. Infect. Dis., 188, 1618-1629 (2003)[PubMed]
- Connolly, B. M., Steele, K. E., Davis, K. J. et al.: Pathogenesis of experimental Ebola virus infection in guinea pigs. J. Infect. Dis., 179(suppl.1), S203-S217 (1999)[PubMed]
- Ryabchikova, E., Kolesnikova, L., Smolina, M. et al.: Ebola virus infection in guinea pigs: presumable role of granulomatous inflammation in pathogenesis. Arch. Virol., 141, 909-921 (1996)[PubMed]
- Ebihara, H., Zivcec, M., Gardner, D. et al.: A Syrian golden hamster model recapitulating ebola hemorrhagic fever. J. Infect. Dis., 207, 306-318 (2013)[PubMed]
- Collaborative Cross Consortium: The genome architecture of the Collaborative Cross mouse genetic reference population. Genetics, 190, 389-401 (2012)[PubMed]
- Roberts, A., Pardo-Manuel de Villena, F., Wang, W. et al.: The polymorphism architecture of mouse genetic resources elucidated using genome-wide resequencing data: implications for QTL discovery and systems genetics. Mamm. Genome, 18, 473-481 (2007)[PubMed]
著者プロフィール
略歴:1992年 麻布大学大学院獣医学研究科 修了,2000年 米国Johns Hopkins大学,2006年 米国Pennsylvania大学Research Associateを経て,2011年より米国Washington大学Research Scientist.
研究テーマ:ウイルス感染症における免疫反応.実験動物学.
© 2014 奥村 敦 Licensed under CC 表示 2.1 日本