エンドサイトーシス経路によるN-カドヘリンの細胞内輸送は放射状突起にそったニューロンの移動を制御する
川内 健史
(慶應義塾大学医学部 解剖学教室)
email:川内健史
DOI: 10.7875/first.author.2010.022
Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking.
Takeshi Kawauchi, Katsutoshi Sekine, Mima Shikanai, Kaori Chihama, Kenji Tomita, Ken-ichiro Kubo, Kazunori Nakajima, Yo-ichi Nabeshima, Mikio Hoshino
Neuron, 67, 588-602 (2010)
大脳皮質の形成において,ニューロンが適切に移動することは脳が正しく機能するために必須な発生段階である.ニューロンの移動は多段階に分けられるが,その大部分は放射状突起とよばれる長い突起をつたうように移動する様式である.この移動様式はすでに約40年前に観察されていたが,ニューロンがどのように放射状突起と接着しその上を移動しているのかについては謎に包まれていた.この研究では,ニューロンは発生期の大脳皮質において細胞接着分子N-カドヘリン依存的に放射状突起の上を移動することを示した.さらに,ニューロンはRab5依存的なエンドサイトーシスによってN-カドヘリンを細胞内に取り込み,Rab11依存的な輸送経路によって細胞膜へとリサイクルすることにより,あたかも足を踏み出すようにして移動していることが示唆された.この結果は,解析が遅れている細胞内の膜輸送経路の生理的な役割をin vivoで示したという点でも重要である.
細胞が移動するという現象は,発生過程における形態形成,炎症部位へのリンパ球の遊走,がん細胞の転移など,多くの生理的および病理的な過程に関与する.脳の発生過程においても,ニューロンの移動は哺乳類に特徴的な大脳皮質の6層構造の形成に必須であることが知られており,このニューロン移動が破綻すると,てんかん,精神遅滞をともなう滑脳症や脳室周囲異所性灰白質(periventricular heterotopia:PVH)病など,重篤な脳奇形がひき起こされる.さらに,最近の研究により,ニューロン移動の異常は失読症などの高次脳機能疾患とも関連のあることが示唆されており,ニューロン移動は脳が正しく機能するために重要な発生過程であるものと考えられている1).
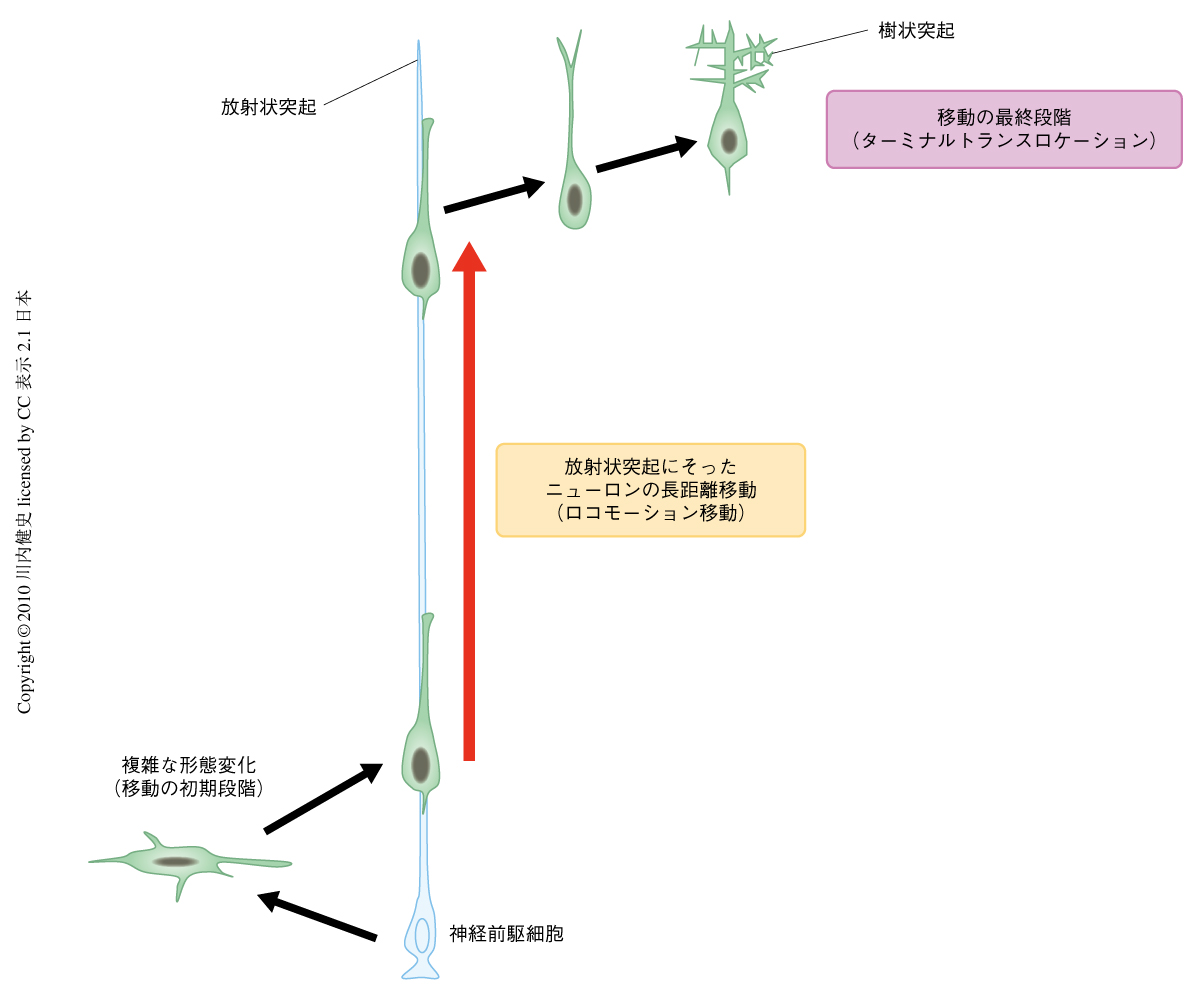
発生期の大脳皮質において,神経前駆細胞は放射状突起とよばれる非常に長い突起を脳の表層側まで伸ばしているが,その細胞体は脳室の近辺に限局して存在している(図1).神経前駆細胞から産み出されたニューロンは,複雑な形態変化を示したのち,先導突起とよばれる太い突起を形成して“ロコモーション細胞”とよばれる双極性の移動ニューロンとなり,放射状突起をつたうようにして中間帯から皮質板の表層近くまでの長い距離を移動する1,2)(図1).すなわち,神経前駆細胞はニューロンを産生するだけでなく,産み出されたニューロンが脳の表層側へと移動するための道筋(放射状突起)をも提供している.ロコモーション細胞は移動の最終段階において,その移動様式を“ロコモーション移動”から“ターミナルトランスロケーション移動”へと変換させ,先導突起を樹状突起へと成熟させながら移動を終了する(図1).
これまでに,筆者らを含めた国内外のグループにより,ニューロン移動の初期段階における複雑な形態変化を制御するタンパク質および分子経路が報告され,この過程に細胞骨格制御タンパク質が重要な役割をはたすことが明らかとなりつつある3,4).これに対して,ニューロン移動の大半をしめるロコモーション移動に関しては,ロコモーション細胞が放射状突起にそって移動することは1972年にRakicによって観察されていたが5),ロコモーション細胞がどのようなタンパク質を使って放射状突起と接着し,さらに,どのようにして放射状突起の上を移動しているのかについてはほとんどわかっていなかった.
近年,PVH病の原因遺伝子として同定されたArfGEF2/Big2遺伝子の遺伝子産物は細胞内の膜輸送系の制御に関与することが示され6,7),ニューロン移動における膜輸送系の制御の重要性が示唆された.しかし,細胞内の膜輸送経路は非常に多岐にわたり,その制御にかかわるタンパク質の数も非常に多いため8),組織および個体における細胞内輸送の生理的な役割については未解明な点が多いのが現状である.
この研究では,大脳皮質の形成におけるエンドサイトーシス経路(エンドサイトーシスを起点とする複数の細胞内の膜輸送経路の総称)の役割に着目し,放射状突起にそったロコモーション移動の分子機構の解明をめざした.
まず,簡便に個体への遺伝子導入を行うことができる“子宮内エレクトロポレーション法”を用いて3),多くのタイプのエンドサイトーシスに関与することが知られているダイナミンとRab5のドミナントネガティブ体を胎生14日目のマウス大脳皮質に発現させたところ,どちらの場合も遺伝子導入されたニューロンの移動が強く阻害された.さらに,子宮内エレクトロポレーション法を応用したin vivo RNA干渉法を用い4),Rab5のノックダウン実験を行うと,やはり,ニューロンの移動が阻害された.この表現型は野生型Rab5の共発現によりレスキューされたことから,Rab5依存性のエンドサイトーシスはニューロンの移動に必須であることが示唆された.また,ニューロンに特異的なプロモーターを用いてRab5ドミナントネガティブ体を発現させてもニューロンの移動が抑制されたことから,少なくともニューロンにおけるRab5の機能がその移動に必要であることが示された.
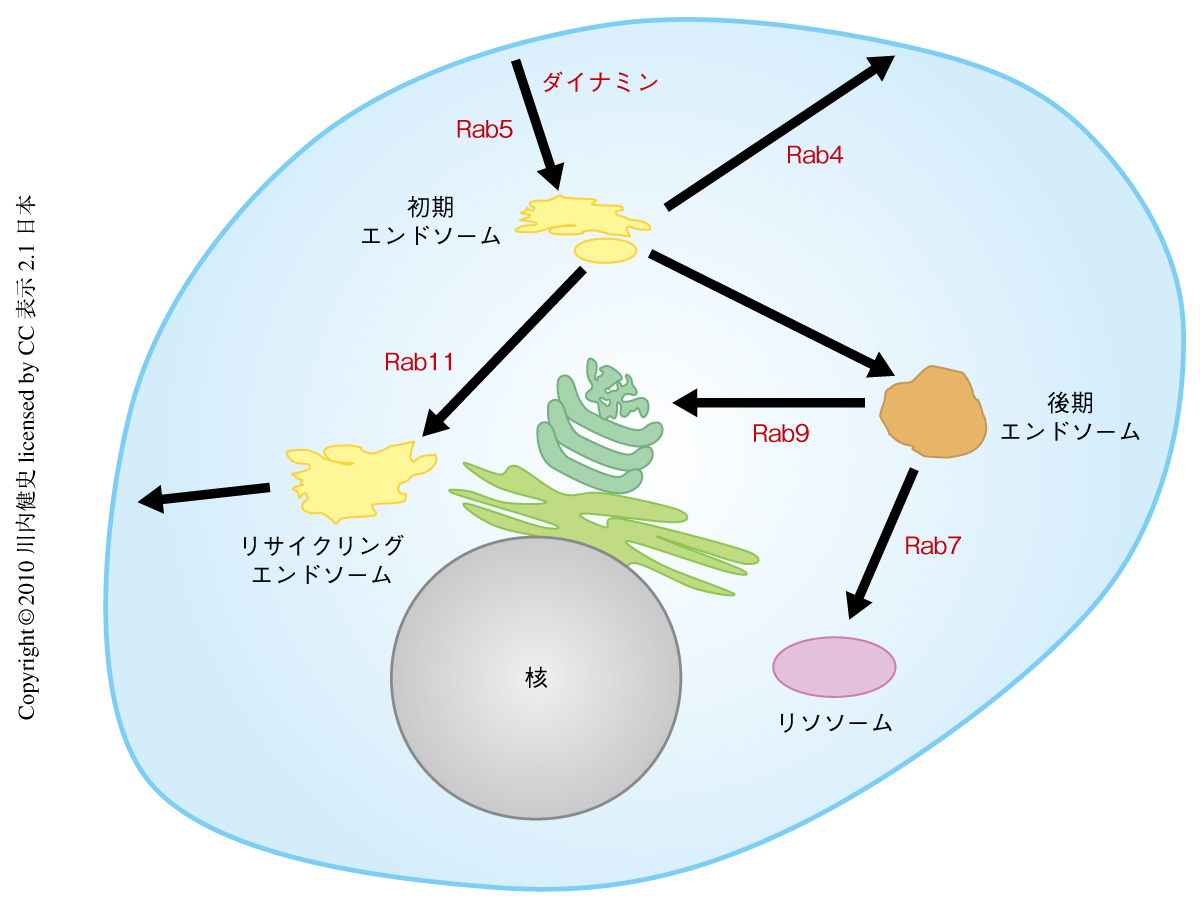
Rab5はエンドサイトーシスと初期エンドソームの形成に関与していることが知られているが,細胞膜から初期エンドソームへ運ばれた膜タンパク質は複数の細胞内の膜輸送経路のうちのいずれかを選択して細胞内のさまざまな場所へと運ばれる8)(図2).これらの輸送経路はそれぞれ異なるRabファミリー低分子量Gタンパク質によって制御されていることが知られているので,子宮内エレクトロポレーション法を用いて個々のRabタンパク質の機能を抑制することにより,初期エンドソームから細胞の各所へとつづく膜輸送経路を系統的に遮断する実験を行った.
エンドサイトーシスされて初期エンドソームへと運ばれた膜タンパク質は,直接もしくはリサイクリングエンドソームを介して再び細胞膜へとリサイクルされる経路,後期エンドソームを介してリソソームへと運ばれる分解経路,ゴルジ体へと運ばれる経路など,複数の輸送経路のいずれかを選択する8)(図2).そこで,子宮内エレクトロポレーション法を用いてこれら輸送経路に関与するRabタンパク質のドミナントネガティブ体を発生期の大脳皮質に発現させた.Rab11ドミナントネガティブ体を発現したニューロンは移動が抑制され,この結果はRab11のノックダウンによっても確認された.これに対して,Rab4,Rab7,Rab9のドミナントネガティブ体をそれぞれ発現させた場合はロコモーション移動にはほとんど影響がみられなかった.ただし,Rab7ドミナントネガティブ体を発現させたニューロンでは移動の最終段階であるターミナルトランスロケーションに異常がみられた.
以上の結果より,Rab5の下流としてはたらきうる輸送経路のうち,Rab11依存性の経路,つまり,リサイクリングエンドソームを介する細胞膜へのリサイクル経路がニューロン移動に深く関与している可能性が示唆された.
Rab5をノックダウンしたニューロンのごく一部は先導突起が過剰に分岐するなどの形態異常を示したが,大部分は正常なロコモーション細胞の形態を示し,少なくとも,光学顕微鏡の解像度では放射状突起にも接着しているようにみえた.細胞が移動するためには,接着して足場を形成するとともに,細胞の後方では接着構造を壊して“足”を引っ込めなければならない.そこで,Rab5ノックダウンニューロンは放射状突起と接着することはできるが,その接着が異常に強くなっているため表層へと移動できないのではないかと考えた.
この仮説を検証するため,放射状突起のマーカーであるネスチンを発現する細胞と初代培養ニューロンとの共培養実験を行った.対照ニューロンはその突起をネスチン陽性細胞にそって伸ばしていたことから,ニューロンとネスチン陽性細胞とのあいだにはなんらかの細胞間相互作用があることが示唆された.これに対して,Rab5をノックダウンしたニューロンはネスチン陽性細胞と接触したときのみ活発に突起を伸ばし,ネスチン陽性細胞を覆い囲むように突起をからませていたことから,細胞間相互作用が亢進していることが示唆された.
そこで,蛍光セルソーターを用いて代表的な細胞接着分子の細胞表面量を測定したところ,Rab5ノックダウンニューロンにおいてN-カドヘリンの細胞表面量が増加していることがわかった.さらに,対照ニューロンでは細胞表面のN-カドヘリンは突起に濃縮していたが,Rab5ノックダウンニューロンでは突起への濃縮はみられなかった.これらの結果より,Rab5はN-カドヘリンの輸送に関与していることが明らかとなった.
つぎに,Rab11もN-カドヘリンの輸送に関与しているのかどうかについて検討を行った.初代培養ニューロンにおいてRab11の機能を抑制したところ,細胞内にN-カドヘリンの異常な集積が観察された.このN-カドヘリンの集積はリサイクリングエンドソームのマーカーと共局在したことから,Rab11はリサイクリングエンドソームを介したN-カドヘリンの輸送に関与していることが示された.
そこで,in vivoにおいてRab11の機能抑制を行ってN-カドヘリンの局在を調べようと試みた.しかし,発生期の大脳皮質において,N-カドヘリンは移動ニューロンだけではなく,放射状突起や移動を終了した成熟ニューロン,軸索の束にも発現していることから,Rab11ノックダウンニューロンのみでN-カドヘリンの細胞内局在を調べることは困難であった.そこで,HAタグをつけた野生型N-カドヘリンを移動ニューロンに弱く発現させ,HAタグに対する抗体を用いて免疫染色をすることによりN-カドヘリンの細胞内局在を検出した.その結果,Rab11の機能抑制を行った移動ニューロンでは,初代培養ニューロンの実験と同様,細胞内に異常なN-カドヘリンの蓄積が観察された.
以上の結果より,Rab5とRab11は,それぞれN-カドヘリンのエンドサイトーシスおよびリサイクリングに関与することが示された.
N-カドヘリンがニューロンの移動に必要かどうかを調べるため,子宮内エレクトロポレーション法を用いてin vivoでN-カドヘリンをノックダウンしたところニューロンの移動が阻害された.反対に,N-カドヘリンを過剰に発現させたニューロンも表層への移動が抑制されたことから,ニューロンの移動にはN-カドヘリンのタンパク質量の適切な制御が重要であることが示唆された.
さらに,Rab5ノックダウンニューロンにおいてN-カドヘリンの量を弱く減少させたところ,Rab5ノックダウンによるニューロン移動の異常がレスキューされることがわかった.すなわち,Rab5ノックダウンニューロンが表層へ移動できない主要な原因はN-カドヘリンの細胞表面量の増加であると考えられた.
さきに述べたように,Rab7ドミナントネガティブ体の発現はニューロン移動の大部分には影響をあたえなかったが,移動の最終段階であるターミナルトランスロケーションと樹状突起の形態のみに異常を示した.さらに,Rab7のin vivoノックダウンによってもターミナルトランスロケーションが阻害された.Rab7はリソソームへむかう分解経路を制御していることからRab7依存的に分解される基質を探索したところ,Rab7の機能抑制によりN-カドヘリンのタンパク質量が増加していることがわかった.以上より,移動の最終段階においてはRab7依存性の分解経路に対する依存度が大きく上昇し,Rab5およびRab11に依存的に細胞膜へとリサイクルされていたN-カドヘリンの分解が促進することが示唆された.ターミナルトランスロケーションは放射状突起に依存しないと考えられていることから,移動の最終段階ではN-カドヘリンの量が減少する必要があるのかもしれない.
大脳皮質形成におけるニューロンの移動と形態変化に関与するタンパク質はこれまでいくつか同定されてきたが1),その多くは移動の初期段階にかかわるタンパク質であり,ニューロン移動の大部分をしめるロコモーション移動の分子機構はほとんどわかっていなかった.ごく最近,筆者らは,ロコモーション移動を直接に解析することができる実験系を確立しロコモーション移動にかかわるタンパク質をはじめて同定したが9),ロコモーション細胞がどのようにして放射状突起と接着しどのようにして動いているかについては,ロコモーション細胞が放射状突起をつたって移動することが報告された1972年以来,謎に包まれたままであった5).
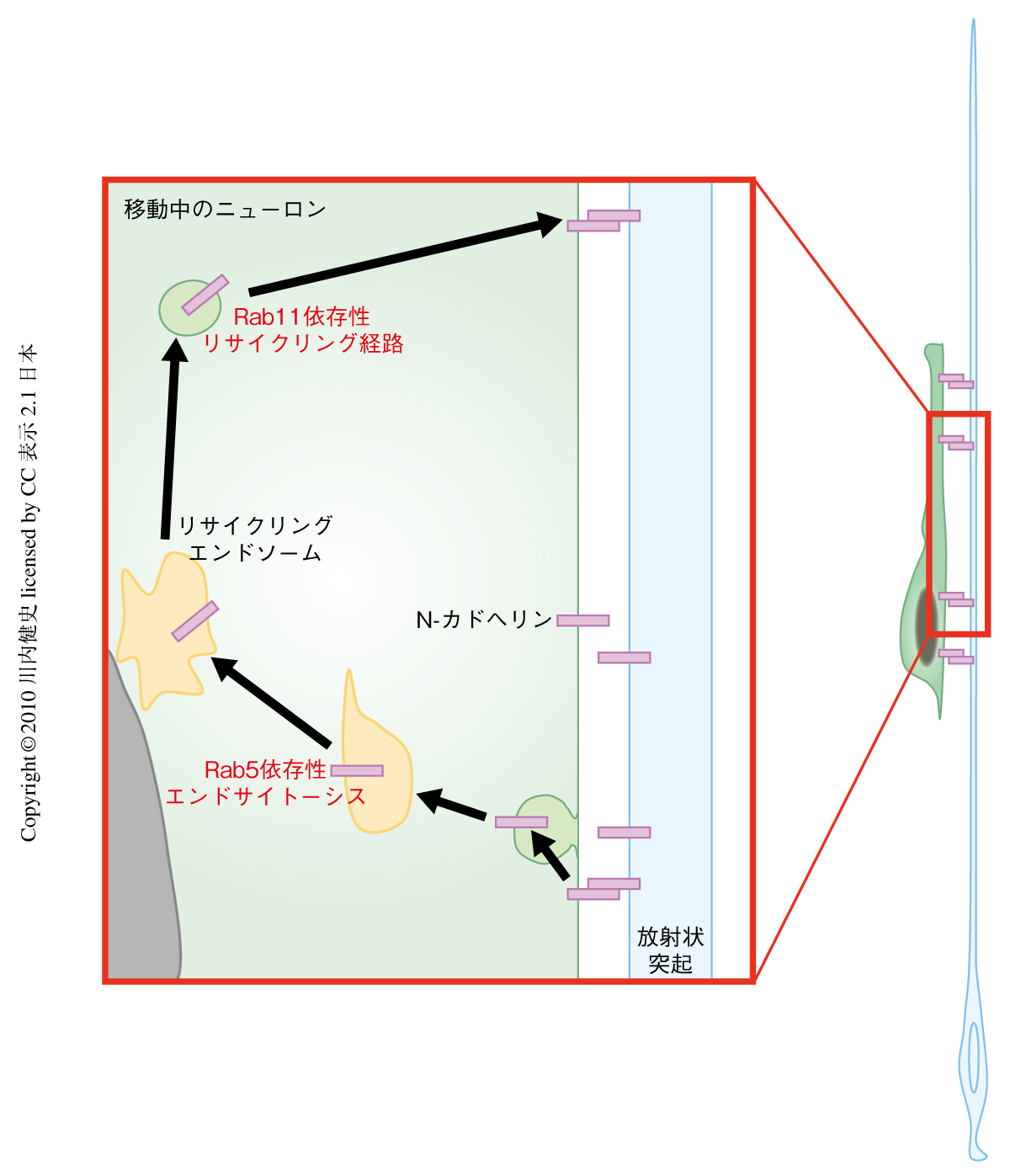
この研究により,ロコモーション移動には細胞接着分子N-カドヘリンが必須であること,N-カドヘリンがRab5依存的にエンドサイトーシスされ,Rab11依存的に再び細胞表面へとリサイクルされることにより,N-カドヘリンという“足”を前へ“踏み出して”いることが示唆された(図3).
さらに,移動の最終段階においてRab7依存性の分解経路の必要性が高まることも示し,個々の細胞内輸送経路はそれぞれ移動の異なる段階を制御している可能性も示唆された.Rab5およびRab11に依存性の輸送経路によってリサイクルされていたN-カドヘリンがどのような刺激によって分解経路にむかうのかについて,この研究ではSrcファミリーキナーゼのひとつFynの活性上昇が関与することを示唆するデータを得ているが,その詳細な機構は今後の課題であるものと考える.
略歴:2004年 京都大学大学院医学研究科 修了,科学技術振興機構さきがけ 博士研究員,京都大学大学院医学研究科 博士研究員および助手を経て,2007年より慶應義塾大学医学部 特別研究講師.
研究テーマ:細胞生物学的な観点から大脳皮質の発生とその異常による脳疾患の機構を明らかにすること.
抱負:任期制,研究者の就職難,研究費の縮減などのプレッシャーに屈することなく(現実には振り回されていますが),神経科学や細胞生物学を含めた広い研究分野において,それぞれの分野の専門家から高く評価されるような研究成果を出すことをめざしたい.
© 2010 川内 健史 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 解剖学教室)
email:川内健史
DOI: 10.7875/first.author.2010.022
Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking.
Takeshi Kawauchi, Katsutoshi Sekine, Mima Shikanai, Kaori Chihama, Kenji Tomita, Ken-ichiro Kubo, Kazunori Nakajima, Yo-ichi Nabeshima, Mikio Hoshino
Neuron, 67, 588-602 (2010)
要 約
大脳皮質の形成において,ニューロンが適切に移動することは脳が正しく機能するために必須な発生段階である.ニューロンの移動は多段階に分けられるが,その大部分は放射状突起とよばれる長い突起をつたうように移動する様式である.この移動様式はすでに約40年前に観察されていたが,ニューロンがどのように放射状突起と接着しその上を移動しているのかについては謎に包まれていた.この研究では,ニューロンは発生期の大脳皮質において細胞接着分子N-カドヘリン依存的に放射状突起の上を移動することを示した.さらに,ニューロンはRab5依存的なエンドサイトーシスによってN-カドヘリンを細胞内に取り込み,Rab11依存的な輸送経路によって細胞膜へとリサイクルすることにより,あたかも足を踏み出すようにして移動していることが示唆された.この結果は,解析が遅れている細胞内の膜輸送経路の生理的な役割をin vivoで示したという点でも重要である.
はじめに
細胞が移動するという現象は,発生過程における形態形成,炎症部位へのリンパ球の遊走,がん細胞の転移など,多くの生理的および病理的な過程に関与する.脳の発生過程においても,ニューロンの移動は哺乳類に特徴的な大脳皮質の6層構造の形成に必須であることが知られており,このニューロン移動が破綻すると,てんかん,精神遅滞をともなう滑脳症や脳室周囲異所性灰白質(periventricular heterotopia:PVH)病など,重篤な脳奇形がひき起こされる.さらに,最近の研究により,ニューロン移動の異常は失読症などの高次脳機能疾患とも関連のあることが示唆されており,ニューロン移動は脳が正しく機能するために重要な発生過程であるものと考えられている1).
発生期の大脳皮質において,神経前駆細胞は放射状突起とよばれる非常に長い突起を脳の表層側まで伸ばしているが,その細胞体は脳室の近辺に限局して存在している(図1).神経前駆細胞から産み出されたニューロンは,複雑な形態変化を示したのち,先導突起とよばれる太い突起を形成して“ロコモーション細胞”とよばれる双極性の移動ニューロンとなり,放射状突起をつたうようにして中間帯から皮質板の表層近くまでの長い距離を移動する1,2)(図1).すなわち,神経前駆細胞はニューロンを産生するだけでなく,産み出されたニューロンが脳の表層側へと移動するための道筋(放射状突起)をも提供している.ロコモーション細胞は移動の最終段階において,その移動様式を“ロコモーション移動”から“ターミナルトランスロケーション移動”へと変換させ,先導突起を樹状突起へと成熟させながら移動を終了する(図1).
これまでに,筆者らを含めた国内外のグループにより,ニューロン移動の初期段階における複雑な形態変化を制御するタンパク質および分子経路が報告され,この過程に細胞骨格制御タンパク質が重要な役割をはたすことが明らかとなりつつある3,4).これに対して,ニューロン移動の大半をしめるロコモーション移動に関しては,ロコモーション細胞が放射状突起にそって移動することは1972年にRakicによって観察されていたが5),ロコモーション細胞がどのようなタンパク質を使って放射状突起と接着し,さらに,どのようにして放射状突起の上を移動しているのかについてはほとんどわかっていなかった.
近年,PVH病の原因遺伝子として同定されたArfGEF2/Big2遺伝子の遺伝子産物は細胞内の膜輸送系の制御に関与することが示され6,7),ニューロン移動における膜輸送系の制御の重要性が示唆された.しかし,細胞内の膜輸送経路は非常に多岐にわたり,その制御にかかわるタンパク質の数も非常に多いため8),組織および個体における細胞内輸送の生理的な役割については未解明な点が多いのが現状である.
1.大脳皮質形成におけるエンドサイトーシスの役割
この研究では,大脳皮質の形成におけるエンドサイトーシス経路(エンドサイトーシスを起点とする複数の細胞内の膜輸送経路の総称)の役割に着目し,放射状突起にそったロコモーション移動の分子機構の解明をめざした.
まず,簡便に個体への遺伝子導入を行うことができる“子宮内エレクトロポレーション法”を用いて3),多くのタイプのエンドサイトーシスに関与することが知られているダイナミンとRab5のドミナントネガティブ体を胎生14日目のマウス大脳皮質に発現させたところ,どちらの場合も遺伝子導入されたニューロンの移動が強く阻害された.さらに,子宮内エレクトロポレーション法を応用したin vivo RNA干渉法を用い4),Rab5のノックダウン実験を行うと,やはり,ニューロンの移動が阻害された.この表現型は野生型Rab5の共発現によりレスキューされたことから,Rab5依存性のエンドサイトーシスはニューロンの移動に必須であることが示唆された.また,ニューロンに特異的なプロモーターを用いてRab5ドミナントネガティブ体を発現させてもニューロンの移動が抑制されたことから,少なくともニューロンにおけるRab5の機能がその移動に必要であることが示された.
2.Rab11依存性経路によるニューロン移動の制御
Rab5はエンドサイトーシスと初期エンドソームの形成に関与していることが知られているが,細胞膜から初期エンドソームへ運ばれた膜タンパク質は複数の細胞内の膜輸送経路のうちのいずれかを選択して細胞内のさまざまな場所へと運ばれる8)(図2).これらの輸送経路はそれぞれ異なるRabファミリー低分子量Gタンパク質によって制御されていることが知られているので,子宮内エレクトロポレーション法を用いて個々のRabタンパク質の機能を抑制することにより,初期エンドソームから細胞の各所へとつづく膜輸送経路を系統的に遮断する実験を行った.
エンドサイトーシスされて初期エンドソームへと運ばれた膜タンパク質は,直接もしくはリサイクリングエンドソームを介して再び細胞膜へとリサイクルされる経路,後期エンドソームを介してリソソームへと運ばれる分解経路,ゴルジ体へと運ばれる経路など,複数の輸送経路のいずれかを選択する8)(図2).そこで,子宮内エレクトロポレーション法を用いてこれら輸送経路に関与するRabタンパク質のドミナントネガティブ体を発生期の大脳皮質に発現させた.Rab11ドミナントネガティブ体を発現したニューロンは移動が抑制され,この結果はRab11のノックダウンによっても確認された.これに対して,Rab4,Rab7,Rab9のドミナントネガティブ体をそれぞれ発現させた場合はロコモーション移動にはほとんど影響がみられなかった.ただし,Rab7ドミナントネガティブ体を発現させたニューロンでは移動の最終段階であるターミナルトランスロケーションに異常がみられた.
以上の結果より,Rab5の下流としてはたらきうる輸送経路のうち,Rab11依存性の経路,つまり,リサイクリングエンドソームを介する細胞膜へのリサイクル経路がニューロン移動に深く関与している可能性が示唆された.
3.Rab5によるN-カドヘリンの細胞表面量と分布の制御
Rab5をノックダウンしたニューロンのごく一部は先導突起が過剰に分岐するなどの形態異常を示したが,大部分は正常なロコモーション細胞の形態を示し,少なくとも,光学顕微鏡の解像度では放射状突起にも接着しているようにみえた.細胞が移動するためには,接着して足場を形成するとともに,細胞の後方では接着構造を壊して“足”を引っ込めなければならない.そこで,Rab5ノックダウンニューロンは放射状突起と接着することはできるが,その接着が異常に強くなっているため表層へと移動できないのではないかと考えた.
この仮説を検証するため,放射状突起のマーカーであるネスチンを発現する細胞と初代培養ニューロンとの共培養実験を行った.対照ニューロンはその突起をネスチン陽性細胞にそって伸ばしていたことから,ニューロンとネスチン陽性細胞とのあいだにはなんらかの細胞間相互作用があることが示唆された.これに対して,Rab5をノックダウンしたニューロンはネスチン陽性細胞と接触したときのみ活発に突起を伸ばし,ネスチン陽性細胞を覆い囲むように突起をからませていたことから,細胞間相互作用が亢進していることが示唆された.
そこで,蛍光セルソーターを用いて代表的な細胞接着分子の細胞表面量を測定したところ,Rab5ノックダウンニューロンにおいてN-カドヘリンの細胞表面量が増加していることがわかった.さらに,対照ニューロンでは細胞表面のN-カドヘリンは突起に濃縮していたが,Rab5ノックダウンニューロンでは突起への濃縮はみられなかった.これらの結果より,Rab5はN-カドヘリンの輸送に関与していることが明らかとなった.
4.Rab11依存性経路によるN-カドヘリンのリサイクリング
つぎに,Rab11もN-カドヘリンの輸送に関与しているのかどうかについて検討を行った.初代培養ニューロンにおいてRab11の機能を抑制したところ,細胞内にN-カドヘリンの異常な集積が観察された.このN-カドヘリンの集積はリサイクリングエンドソームのマーカーと共局在したことから,Rab11はリサイクリングエンドソームを介したN-カドヘリンの輸送に関与していることが示された.
そこで,in vivoにおいてRab11の機能抑制を行ってN-カドヘリンの局在を調べようと試みた.しかし,発生期の大脳皮質において,N-カドヘリンは移動ニューロンだけではなく,放射状突起や移動を終了した成熟ニューロン,軸索の束にも発現していることから,Rab11ノックダウンニューロンのみでN-カドヘリンの細胞内局在を調べることは困難であった.そこで,HAタグをつけた野生型N-カドヘリンを移動ニューロンに弱く発現させ,HAタグに対する抗体を用いて免疫染色をすることによりN-カドヘリンの細胞内局在を検出した.その結果,Rab11の機能抑制を行った移動ニューロンでは,初代培養ニューロンの実験と同様,細胞内に異常なN-カドヘリンの蓄積が観察された.
以上の結果より,Rab5とRab11は,それぞれN-カドヘリンのエンドサイトーシスおよびリサイクリングに関与することが示された.
5.N-カドヘリンはニューロンの移動に必須である
N-カドヘリンがニューロンの移動に必要かどうかを調べるため,子宮内エレクトロポレーション法を用いてin vivoでN-カドヘリンをノックダウンしたところニューロンの移動が阻害された.反対に,N-カドヘリンを過剰に発現させたニューロンも表層への移動が抑制されたことから,ニューロンの移動にはN-カドヘリンのタンパク質量の適切な制御が重要であることが示唆された.
さらに,Rab5ノックダウンニューロンにおいてN-カドヘリンの量を弱く減少させたところ,Rab5ノックダウンによるニューロン移動の異常がレスキューされることがわかった.すなわち,Rab5ノックダウンニューロンが表層へ移動できない主要な原因はN-カドヘリンの細胞表面量の増加であると考えられた.
6.Rab7依存性の分解経路による移動の最終段階と樹状突起の形成の制御
さきに述べたように,Rab7ドミナントネガティブ体の発現はニューロン移動の大部分には影響をあたえなかったが,移動の最終段階であるターミナルトランスロケーションと樹状突起の形態のみに異常を示した.さらに,Rab7のin vivoノックダウンによってもターミナルトランスロケーションが阻害された.Rab7はリソソームへむかう分解経路を制御していることからRab7依存的に分解される基質を探索したところ,Rab7の機能抑制によりN-カドヘリンのタンパク質量が増加していることがわかった.以上より,移動の最終段階においてはRab7依存性の分解経路に対する依存度が大きく上昇し,Rab5およびRab11に依存的に細胞膜へとリサイクルされていたN-カドヘリンの分解が促進することが示唆された.ターミナルトランスロケーションは放射状突起に依存しないと考えられていることから,移動の最終段階ではN-カドヘリンの量が減少する必要があるのかもしれない.
おわりに
大脳皮質形成におけるニューロンの移動と形態変化に関与するタンパク質はこれまでいくつか同定されてきたが1),その多くは移動の初期段階にかかわるタンパク質であり,ニューロン移動の大部分をしめるロコモーション移動の分子機構はほとんどわかっていなかった.ごく最近,筆者らは,ロコモーション移動を直接に解析することができる実験系を確立しロコモーション移動にかかわるタンパク質をはじめて同定したが9),ロコモーション細胞がどのようにして放射状突起と接着しどのようにして動いているかについては,ロコモーション細胞が放射状突起をつたって移動することが報告された1972年以来,謎に包まれたままであった5).
この研究により,ロコモーション移動には細胞接着分子N-カドヘリンが必須であること,N-カドヘリンがRab5依存的にエンドサイトーシスされ,Rab11依存的に再び細胞表面へとリサイクルされることにより,N-カドヘリンという“足”を前へ“踏み出して”いることが示唆された(図3).
さらに,移動の最終段階においてRab7依存性の分解経路の必要性が高まることも示し,個々の細胞内輸送経路はそれぞれ移動の異なる段階を制御している可能性も示唆された.Rab5およびRab11に依存性の輸送経路によってリサイクルされていたN-カドヘリンがどのような刺激によって分解経路にむかうのかについて,この研究ではSrcファミリーキナーゼのひとつFynの活性上昇が関与することを示唆するデータを得ているが,その詳細な機構は今後の課題であるものと考える.
文 献
- Kawauchi, T. & Hoshino, M.: Molecular pathways regulating cytoskeletal organization and morphological changes in migrating neurons. Dev. Neurosci., 30, 36-46 (2008)[PubMed]
- Gupta, A., Tsai, L. H., Wynshaw-Boris, A.: Life is a journey: a genetic look at neocortical development. Nat. Rev. Genet., 3, 342-355 (2002)[PubMed]
- Kawauchi, T., Chihama, K., Nabeshima, Y. et al.: The in vivo roles of STEF/Tiam1, Rac1 and JNK in cortical neuronal migration. EMBO J, 22, 4190-4201 (2003)[PubMed]
- Kawauchi, T., Chihama, K., Nabeshima, Y. et al.: Cdk5 phosphorylates and stabilizes p27kip1 contributing to actin organization and cortical neuronal migration. Nat. Cell Biol., 8, 17-26 (2006)[PubMed]
- Rakic, P.: Mode of cell migration to the superficial layers of fetal monkey neocortex. J. Comp. Neurol., 145, 61-83 (1972)[PubMed]
- Sheen, V. L., Ganesh, V. S., Topcu, M. et al.: Mutations in ARFGEF2 implicate vesicle trafficking in neural progenitor proliferation and migration in the human cerebral cortex. Nat. Genet., 36, 69-76 (2004)[PubMed]
- Shin, H. W., Morinaga, N., Noda, M. et al.: BIG2, a guanine nucleotide exchange factor for ADP-ribosylation factors: its localization to recycling endosomes and implication in the endosome integrity. Mol. Biol. Cell, 15, 5283-5294 (2004)[PubMed]
- Zerial, M. & McBride, H.: Rab proteins as membrane organizers. Nat. Rev. Mol. Cell Biol., 2, 107-117 (2001)[PubMed]
- Nishimura, Y. V., Sekine, K., Chihama, K. et al.: Dissecting the factors involved in the locomotion mode of neuronal migration in the developing cerebral cortex. J. Biol. Chem., 285, 5878-5887 (2010)[PubMed]
著者プロフィール
略歴:2004年 京都大学大学院医学研究科 修了,科学技術振興機構さきがけ 博士研究員,京都大学大学院医学研究科 博士研究員および助手を経て,2007年より慶應義塾大学医学部 特別研究講師.
研究テーマ:細胞生物学的な観点から大脳皮質の発生とその異常による脳疾患の機構を明らかにすること.
抱負:任期制,研究者の就職難,研究費の縮減などのプレッシャーに屈することなく(現実には振り回されていますが),神経科学や細胞生物学を含めた広い研究分野において,それぞれの分野の専門家から高く評価されるような研究成果を出すことをめざしたい.
© 2010 川内 健史 Licensed under CC 表示 2.1 日本