腸内細菌はノロウイルスのB細胞への感染を促進する
渡辺 真紀子
(米国Florida大学College of Medicine,Department of Molecular Genetics and Microbiology)
email:渡辺真紀子
DOI: 10.7875/first.author.2014.145
Enteric bacteria promote human and mouse norovirus infection of B cells.
Melissa K. Jones, Makiko Watanabe, Shu Zhu, Christina L. Graves, Lisa R. Keyes, Katrina R. Grau, Mariam B. Gonzalez-Hernandez, Nicole M. Iovine, Christiane E. Wobus, Jan Vinjé, Scott A. Tibbetts, Shannon M. Wallet, Stephanie M. Karst
Science, 346, 755-759 (2014)
ヒトにおいてノロウイルスの標的となる細胞の解明および実験的な感染モデルの確立は多くの研究者の努力にもかかわらずあまり進展していない.一方で,宿主の組織血液型抗原の発現パターンにより,異なるウイルス株に対し異なる感受性を示すことが知られているが,その生物学的な根拠は知られていない.今回の研究において,ヒトおよびマウスのノロウイルスがB細胞に感染すること,さらに,ヒトのノロウイルスがB細胞に感染するには組織血液型抗原を発現する細菌の存在を必要とすることが明らかにされた.また,抗生物質の投与により腸内細菌を除去したマウスにおいてはノロウイルスの増殖性が低下することも示された.この研究により,B細胞がノロウイルスの標的細胞であること,腸内細菌がノロウイルスの感染における刺激因子であることが明らかになり,実験的な感染モデルの開発に成功した.
ノロウイルスは感染性胃腸炎の主要な原因であり,世界中で感染が確認されている1).長年の試みにもかかわらず,ヒトのノロウイルスの実験的な感染モデルの確立は成功しておらず,抗ウイルス薬やワクチンの開発における大きな障害となっている.感染モデルを確立するには標的細胞を知ることが重要である.当初は,胃腸炎を起こすことから腸管上皮細胞がノロウイルスの標的細胞ではないかと考えられたが,腸管上皮細胞を使った感染実験はすべて失敗におわった.マウスのノロウイルスはマクロファージや樹状細胞といった免疫細胞でのみ増殖することにくわえ,ヒトのノロウイルスの感染者および実験動物の組織の分析により,近年,免疫細胞がヒトにおけるノロウイルスの標的ではないかという考えが強まった.しかし,マクロファージや樹状細胞を使った感染実験ではヒトのノロウイルスは増殖しなかった2).一方で,ヒトのノロウイルスが組織血液型抗原に親和性のあることはすでに知られているが3),組織血液型抗原はヒトの細胞だけでなく細菌の表面にも発現している.この研究では,過去に試みられたことのないB細胞を用い,さらに,組織血液型抗原を発現している腸内細菌をくわえることにより,培養細胞におけるノロウイルスの増殖に成功した.
マクロファージおよび樹状細胞がマウスにおけるノロウイルスの標的細胞であることはすでに明らかにされていたが,それ以外の免疫細胞についてはノロウイルスに対する感受性は不明であった.B細胞がノロウイルスの標的細胞である可能性は,ノロウイルスに感染したインターフェロン欠損マウスにおいてB細胞の豊富なパイエル板の胚中心にてウイルス抗原が検出されたこと4),B細胞を欠損したマウスにおいては野生型のマウスと比べウイルスの増殖性が低いこと5),ヒトのノロウイルスに感染させたチンパンジーにおいてB細胞にてウイルス抗原が検出されたこと6),などから示唆されている.
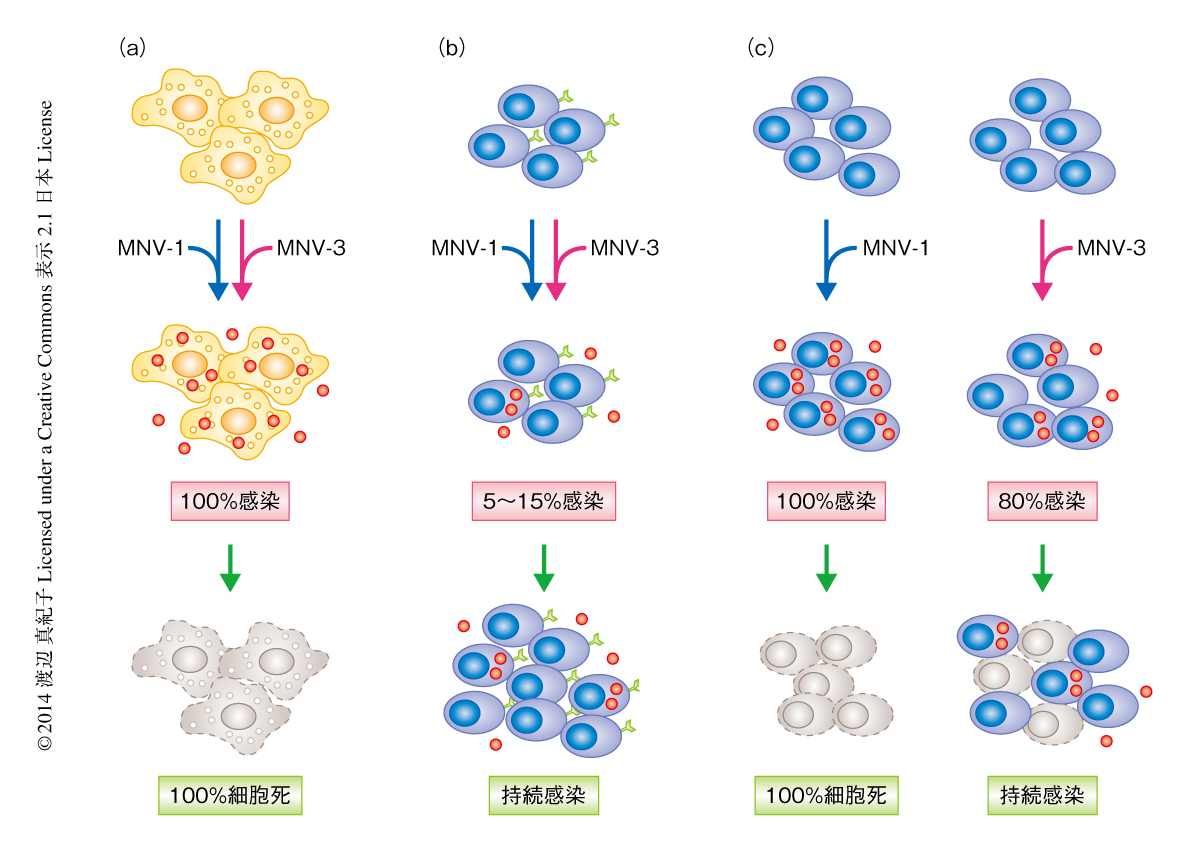
細胞への感染実験にはマウスノロウイルス1型(MNV-1)およびマウスノロウイルス3型(MNV-3)を使用した.MNV-1は病原性が高く,急性感染を起こし,防御免疫を誘導しない.一方で,MNV-3は病原性が低く,持続感染し,防御免疫を誘導する7,8).MNV-1およびMNV-3をマウスの成熟したB細胞に由来するM12細胞およびマウスの未成熟のB細胞に由来するWEHI-231細胞に感染させ,培養上清にてウイルスを測定した.マウスのノロウイルスの研究に広く使用されているマウスのマクロファージ細胞に由来するRAW264.7細胞と比べ,B細胞に由来する細胞に感染したノロウイルスの増殖は遅く,ピーク時のウイルスの産生量も少なかったものの,ウイルスの増殖が確認された.さらに,マウスのノロウイルスに感染したRAW264.7細胞は48時間以内にすべて死滅するが,M12細胞への感染では5~15%の細胞のみが感染し細胞死は認められなかった.生存した細胞は50日間にわたり培養が可能であり,そのあいだ,ウイルスを産生しつづけた.一方,MNV-1に感染したWEHI-231細胞はすべて死滅したが,MNV-3に感染したWEHI-231の一部は生存した.生存したウイルスは20日間にわたり培養が可能であり,そのあいだ,ウイルスを産生しつづけた(図1).このことから,マウスにおけるノロウイルスの持続感染にはB細胞が関与する可能性が示唆された.
B細胞を欠損しているマウスの腸におけるノロウイルスの産生は,野生型のマウスに比べ有意に減少する.このB細胞の欠損によりみられるウイルス量の減少は小腸において観察されたが,大腸からは野生型マウスと同じ量のウイルスが検出された.さらに,小腸にのみ存在するリンパ組織であるパイエル板から精製されたB細胞において,ノロウイルスのゲノム遺伝子が定量PCR法により検出された.このことにより,マウスにおいてノロウイルスは小腸のB細胞,とくに,パイエル板のB細胞に感染していることが確認された.
マウスのノロウイルスにおける結果から,これまで試みられていないB細胞を使うことにより,ヒトのノロウイルスの感染モデルを作製できるのではないかと考えた.実験には,現在,世界中に感染の広まっているノロウイルスGII.4株9) に感染した患者の糞便,および,ヒトのB細胞に由来するBJAB細胞を使用した.感染ののち,ノロウイルスのゲノム遺伝子を定量PCR法により測定したところ,感染の直後に比べ,感染ののち3日目には10倍,5日目には25倍の増加を示した.ウェスタンブロット法および間接蛍光抗体法により,ウイルスタンパク質の増加も確認された.ゲノム遺伝子の増加は感染のまえにウイルス源に紫外線を照射することによりさまたげられた.さらに,感染ののち3日目の培養上清を感染していないBJAB細胞に投与したところ,5日目までにウイルスのゲノム遺伝子は20倍に増加し,感染したB細胞が感染能をもつノロウイルスを産生していることが証明された.ヒトのノロウイルスがマウスのノロウイルスと同じように培養細胞において持続感染を成立させることができるかどうかを確かめるため,ヒトのノロウイルスに感染したBJAB細胞の培養を継続したが,ウイルスのゲノム遺伝子は細胞の継代ごとに減少し,持続感染は成立しなかった.
ノロウイルスが腸管においてB細胞に感染するためには腸管上皮細胞を通り抜ける必要がある.ヒトの腸管の条件を再現するため,腸管上皮細胞に由来するHT-29細胞をトランスウェルにおいて培養し極性化させて感染実験を行った.HT-29細胞の基底側にBJAB細胞をくわえ,頂端側から未精製のウイルス源を用い感染を行った.感染ののち3日目にBJAB細胞にてノロウイルスのゲノム遺伝子を測定したところ,感染の直後に比べおよそ600倍のウイルスのゲノム遺伝子が認められた.基底側にBJAB細胞をくわえずに感染を行った場合には,基底側においてウイルスのゲノム遺伝子は増加しなかった.このことから,実際に,ヒトの腸管においてB細胞がノロウイルスの標的細胞になっている可能性が示された.
培養細胞を用いた感染実験において,ウイルス源となる患者の糞便を孔径0.2μmのフィルターによりろ過するとノロウイルスの増殖性は大幅に低下した.このことから,ヒトのノロウイルスは感染に補助因子を必要とすること,また,それはろ過により除去されるものであることが明らかになった.
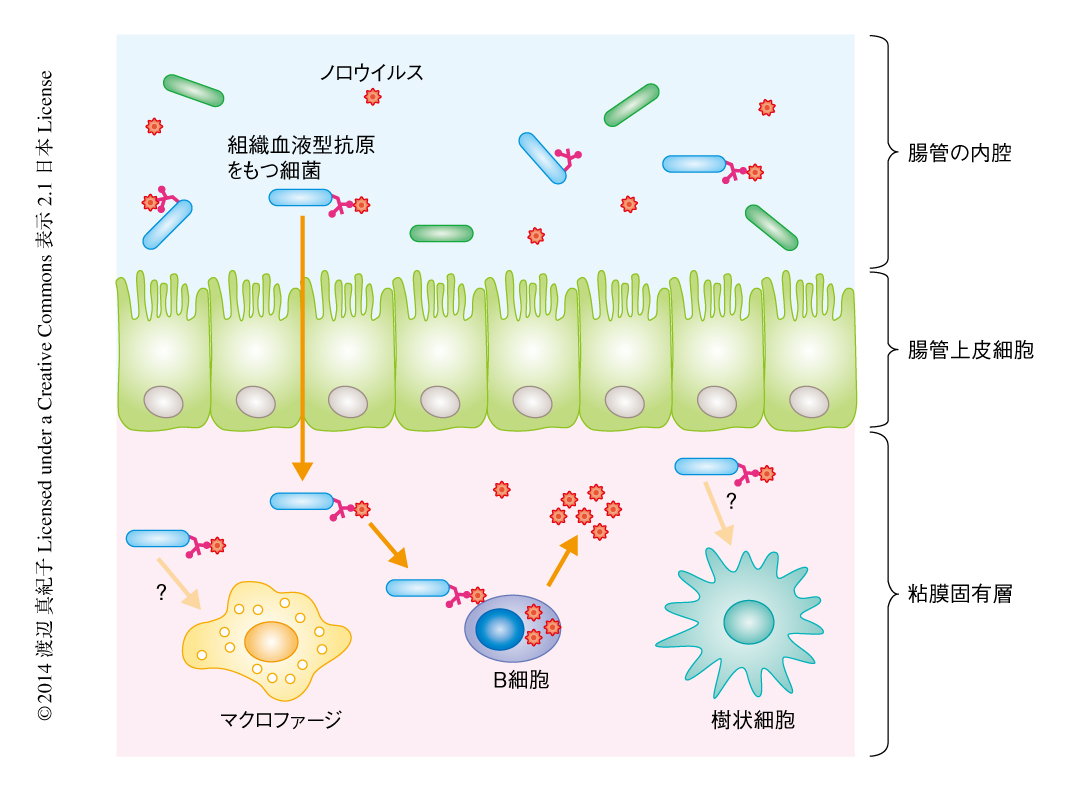
抗生物質により腸内細菌を除去したマウスにおいてはノロウイルスの増殖性が低下したことから,ノロウイルスの増殖には腸内細菌が貢献していることが示唆された.ヒトのノロウイルスは組織血液型抗原に対し結合性をもつことから,組織血液型抗原を発現する細菌が補助因子である可能性が考えられた.実験に使用したノロウイルスGII.4株はH型の組織血液型抗原に結合すること,H型組織血液型抗原を発現する腸内細菌のひとつであるEnterobacter cloacaeはノロウイルスに結合すること12) がすでに知られている.そこで,ろ過により精製したウイルス源をE. cloacaeとともにB細胞に感染させたところ,未精製のウイルス源による感染と同じ程度のウイルスの増殖が観察された(2014年12月4日 著者からの依頼により,以上の2センテンスを一部修正,および,文献12) を追加).H型組織血液型抗原を発現していない大腸菌をともに感染させても,このようなウイルスの増殖はみられなかった.細菌の代わりに精製したH型組織血液型抗原をろ過精製したウイルス源にくわえた場合には,E. cloacaeをくわえたときと同じ程度のウイルスの増殖が観察され,腸内細菌によるノロウイルスの感染の促進は組織血液型抗原を介することが示唆された(図2).この結果は,ポリオウイルスにおいて知られていた腸内細菌の存在が腸管系ウイルスの感染を促進するという過去の研究とも一致した10,11).
現在,ヒトへのノロウイルスの感染は世界中で問題になっているが,いまだ効果的な抗ウイルス薬やワクチンは開発されていない.この研究において,ノロウイルスの感染に必要な補助因子の同定,および,感染を許容する標的細胞の発見により,これまで成功していなかったヒトのノロウイルスの実験的な培養モデルの開発に成功した.現在の系では増殖率がまだ低く,理想的な培養法の確立にむけさらなる改善が必要であるが,今回の培養モデルの確立が今後のノロウイルスの増殖機構の解明およびノロウイルス感染症の治療法の開発にむけた大きな一歩であることはまちがいないだろう.
略歴:2001年 大阪大学大学院医学研究科 修了,同年 米国GTx社 Research Scientist,2005年 米国St. Jude Children’s Research HospitalにてResearch Lab Specialistなどを経て,2011年より米国Florida大学College of MedicineにてScientific Research Manager.
研究テーマ:RNAウイルスの病原性および増殖機構.
抱負:ウイルスや感染症に対する一般の人々の認識を深めることに貢献したい.
© 2014 渡辺 真紀子 Licensed under CC 表示 2.1 日本
(米国Florida大学College of Medicine,Department of Molecular Genetics and Microbiology)
email:渡辺真紀子
DOI: 10.7875/first.author.2014.145
Enteric bacteria promote human and mouse norovirus infection of B cells.
Melissa K. Jones, Makiko Watanabe, Shu Zhu, Christina L. Graves, Lisa R. Keyes, Katrina R. Grau, Mariam B. Gonzalez-Hernandez, Nicole M. Iovine, Christiane E. Wobus, Jan Vinjé, Scott A. Tibbetts, Shannon M. Wallet, Stephanie M. Karst
Science, 346, 755-759 (2014)
要 約
ヒトにおいてノロウイルスの標的となる細胞の解明および実験的な感染モデルの確立は多くの研究者の努力にもかかわらずあまり進展していない.一方で,宿主の組織血液型抗原の発現パターンにより,異なるウイルス株に対し異なる感受性を示すことが知られているが,その生物学的な根拠は知られていない.今回の研究において,ヒトおよびマウスのノロウイルスがB細胞に感染すること,さらに,ヒトのノロウイルスがB細胞に感染するには組織血液型抗原を発現する細菌の存在を必要とすることが明らかにされた.また,抗生物質の投与により腸内細菌を除去したマウスにおいてはノロウイルスの増殖性が低下することも示された.この研究により,B細胞がノロウイルスの標的細胞であること,腸内細菌がノロウイルスの感染における刺激因子であることが明らかになり,実験的な感染モデルの開発に成功した.
はじめに
ノロウイルスは感染性胃腸炎の主要な原因であり,世界中で感染が確認されている1).長年の試みにもかかわらず,ヒトのノロウイルスの実験的な感染モデルの確立は成功しておらず,抗ウイルス薬やワクチンの開発における大きな障害となっている.感染モデルを確立するには標的細胞を知ることが重要である.当初は,胃腸炎を起こすことから腸管上皮細胞がノロウイルスの標的細胞ではないかと考えられたが,腸管上皮細胞を使った感染実験はすべて失敗におわった.マウスのノロウイルスはマクロファージや樹状細胞といった免疫細胞でのみ増殖することにくわえ,ヒトのノロウイルスの感染者および実験動物の組織の分析により,近年,免疫細胞がヒトにおけるノロウイルスの標的ではないかという考えが強まった.しかし,マクロファージや樹状細胞を使った感染実験ではヒトのノロウイルスは増殖しなかった2).一方で,ヒトのノロウイルスが組織血液型抗原に親和性のあることはすでに知られているが3),組織血液型抗原はヒトの細胞だけでなく細菌の表面にも発現している.この研究では,過去に試みられたことのないB細胞を用い,さらに,組織血液型抗原を発現している腸内細菌をくわえることにより,培養細胞におけるノロウイルスの増殖に成功した.
1.マウスのノロウイルスはB細胞に由来する培養細胞に感染する
マクロファージおよび樹状細胞がマウスにおけるノロウイルスの標的細胞であることはすでに明らかにされていたが,それ以外の免疫細胞についてはノロウイルスに対する感受性は不明であった.B細胞がノロウイルスの標的細胞である可能性は,ノロウイルスに感染したインターフェロン欠損マウスにおいてB細胞の豊富なパイエル板の胚中心にてウイルス抗原が検出されたこと4),B細胞を欠損したマウスにおいては野生型のマウスと比べウイルスの増殖性が低いこと5),ヒトのノロウイルスに感染させたチンパンジーにおいてB細胞にてウイルス抗原が検出されたこと6),などから示唆されている.
細胞への感染実験にはマウスノロウイルス1型(MNV-1)およびマウスノロウイルス3型(MNV-3)を使用した.MNV-1は病原性が高く,急性感染を起こし,防御免疫を誘導しない.一方で,MNV-3は病原性が低く,持続感染し,防御免疫を誘導する7,8).MNV-1およびMNV-3をマウスの成熟したB細胞に由来するM12細胞およびマウスの未成熟のB細胞に由来するWEHI-231細胞に感染させ,培養上清にてウイルスを測定した.マウスのノロウイルスの研究に広く使用されているマウスのマクロファージ細胞に由来するRAW264.7細胞と比べ,B細胞に由来する細胞に感染したノロウイルスの増殖は遅く,ピーク時のウイルスの産生量も少なかったものの,ウイルスの増殖が確認された.さらに,マウスのノロウイルスに感染したRAW264.7細胞は48時間以内にすべて死滅するが,M12細胞への感染では5~15%の細胞のみが感染し細胞死は認められなかった.生存した細胞は50日間にわたり培養が可能であり,そのあいだ,ウイルスを産生しつづけた.一方,MNV-1に感染したWEHI-231細胞はすべて死滅したが,MNV-3に感染したWEHI-231の一部は生存した.生存したウイルスは20日間にわたり培養が可能であり,そのあいだ,ウイルスを産生しつづけた(図1).このことから,マウスにおけるノロウイルスの持続感染にはB細胞が関与する可能性が示唆された.
2.マウスのノロウイルスは小腸のパイエル板のB細胞に感染する
B細胞を欠損しているマウスの腸におけるノロウイルスの産生は,野生型のマウスに比べ有意に減少する.このB細胞の欠損によりみられるウイルス量の減少は小腸において観察されたが,大腸からは野生型マウスと同じ量のウイルスが検出された.さらに,小腸にのみ存在するリンパ組織であるパイエル板から精製されたB細胞において,ノロウイルスのゲノム遺伝子が定量PCR法により検出された.このことにより,マウスにおいてノロウイルスは小腸のB細胞,とくに,パイエル板のB細胞に感染していることが確認された.
3.ヒトのノロウイルスはB細胞に由来する培養細胞に感染する
マウスのノロウイルスにおける結果から,これまで試みられていないB細胞を使うことにより,ヒトのノロウイルスの感染モデルを作製できるのではないかと考えた.実験には,現在,世界中に感染の広まっているノロウイルスGII.4株9) に感染した患者の糞便,および,ヒトのB細胞に由来するBJAB細胞を使用した.感染ののち,ノロウイルスのゲノム遺伝子を定量PCR法により測定したところ,感染の直後に比べ,感染ののち3日目には10倍,5日目には25倍の増加を示した.ウェスタンブロット法および間接蛍光抗体法により,ウイルスタンパク質の増加も確認された.ゲノム遺伝子の増加は感染のまえにウイルス源に紫外線を照射することによりさまたげられた.さらに,感染ののち3日目の培養上清を感染していないBJAB細胞に投与したところ,5日目までにウイルスのゲノム遺伝子は20倍に増加し,感染したB細胞が感染能をもつノロウイルスを産生していることが証明された.ヒトのノロウイルスがマウスのノロウイルスと同じように培養細胞において持続感染を成立させることができるかどうかを確かめるため,ヒトのノロウイルスに感染したBJAB細胞の培養を継続したが,ウイルスのゲノム遺伝子は細胞の継代ごとに減少し,持続感染は成立しなかった.
ノロウイルスが腸管においてB細胞に感染するためには腸管上皮細胞を通り抜ける必要がある.ヒトの腸管の条件を再現するため,腸管上皮細胞に由来するHT-29細胞をトランスウェルにおいて培養し極性化させて感染実験を行った.HT-29細胞の基底側にBJAB細胞をくわえ,頂端側から未精製のウイルス源を用い感染を行った.感染ののち3日目にBJAB細胞にてノロウイルスのゲノム遺伝子を測定したところ,感染の直後に比べおよそ600倍のウイルスのゲノム遺伝子が認められた.基底側にBJAB細胞をくわえずに感染を行った場合には,基底側においてウイルスのゲノム遺伝子は増加しなかった.このことから,実際に,ヒトの腸管においてB細胞がノロウイルスの標的細胞になっている可能性が示された.
4.腸内細菌はノロウイルスの感染を促進する
培養細胞を用いた感染実験において,ウイルス源となる患者の糞便を孔径0.2μmのフィルターによりろ過するとノロウイルスの増殖性は大幅に低下した.このことから,ヒトのノロウイルスは感染に補助因子を必要とすること,また,それはろ過により除去されるものであることが明らかになった.
抗生物質により腸内細菌を除去したマウスにおいてはノロウイルスの増殖性が低下したことから,ノロウイルスの増殖には腸内細菌が貢献していることが示唆された.ヒトのノロウイルスは組織血液型抗原に対し結合性をもつことから,組織血液型抗原を発現する細菌が補助因子である可能性が考えられた.実験に使用したノロウイルスGII.4株はH型の組織血液型抗原に結合すること,H型組織血液型抗原を発現する腸内細菌のひとつであるEnterobacter cloacaeはノロウイルスに結合すること12) がすでに知られている.そこで,ろ過により精製したウイルス源をE. cloacaeとともにB細胞に感染させたところ,未精製のウイルス源による感染と同じ程度のウイルスの増殖が観察された(2014年12月4日 著者からの依頼により,以上の2センテンスを一部修正,および,文献12) を追加).H型組織血液型抗原を発現していない大腸菌をともに感染させても,このようなウイルスの増殖はみられなかった.細菌の代わりに精製したH型組織血液型抗原をろ過精製したウイルス源にくわえた場合には,E. cloacaeをくわえたときと同じ程度のウイルスの増殖が観察され,腸内細菌によるノロウイルスの感染の促進は組織血液型抗原を介することが示唆された(図2).この結果は,ポリオウイルスにおいて知られていた腸内細菌の存在が腸管系ウイルスの感染を促進するという過去の研究とも一致した10,11).
おわりに
現在,ヒトへのノロウイルスの感染は世界中で問題になっているが,いまだ効果的な抗ウイルス薬やワクチンは開発されていない.この研究において,ノロウイルスの感染に必要な補助因子の同定,および,感染を許容する標的細胞の発見により,これまで成功していなかったヒトのノロウイルスの実験的な培養モデルの開発に成功した.現在の系では増殖率がまだ低く,理想的な培養法の確立にむけさらなる改善が必要であるが,今回の培養モデルの確立が今後のノロウイルスの増殖機構の解明およびノロウイルス感染症の治療法の開発にむけた大きな一歩であることはまちがいないだろう.
文 献
- Koo, H. L., Ajami, N., Atmar, R. L. et al.: Noroviruses: The leading cause of gastroenteritis worldwide. Discov. Med., 10, 61-70 (2010)[PubMed]
- Lay, M. K., Atmar, R. L., Guix, S. et al.: Norwalk virus does not replicate in human macrophages or dendritic cells derived from the peripheral blood of susceptible humans. Virology, 406, 1-11 (2010)[PubMed]
- Huang, P., Farkas, T., Marionneau, S. et al.: Noroviruses bind to human ABO, Lewis, and secretor histo-blood group antigens: identification of 4 distinct strain-specific patterns. J. Infect. Dis., 188, 19-31 (2003)[PubMed]
- Mumphrey, S. M., Changotra, H., Moore, T. N. et al.: Murine norovirus 1 infection is associated with histopathological changes in immunocompetent hosts, but clinical disease is prevented by STAT1-dependent interferon responses. J. Virol., 81, 3251-3263 (2007)[PubMed]
- Zhu, S., Regev, D., Watanabe, M. et al.: Identification of immune and viral correlates of norovirus protective immunity through comparative study of intra-cluster norovirus strains. PLoS Pathog., 9, e1003592 (2013)[PubMed]
- Bok, K., Parra, G. I., Mitra, T. et al.: Chimpanzees as an animal model for human norovirus infection and vaccine development. Proc. Natl. Acad. Sci. USA, 108, 325-330 (2011)[PubMed]
- Hsu, C. C., Riley, L. K., Wills, H. M. et al.: Persistent infection with and serologic cross-reactivity of three novel murine noroviruses. Comp. Med., 56, 247-251 (2006)[PubMed]
- Kahan, S. M., Liu, G., Reinhard, M. K. et al.: Comparative murine norovirus studies reveal a lack of correlation between intestinal virus titers and enteric pathology. Virology, 421, 202-210 (2011)[PubMed]
- Eden, J. S., Tanaka, M. M., Boni, M. F. et al.: Recombination within the pandemic norovirus GII.4 lineage. J. Virol., 87, 6270-6282 (2013)[PubMed]
- Kuss, S. K., Best, G. T., Etheredge, C. A. et al.: Intestinal microbiota promote enteric virus replication and systemic pathogenesis. Science, 334, 249-252 (2011)[PubMed]
- Robinson, C. M., Jesudhasan, P. R. & Pfeiffer, J. K.: Bacterial lipopolysaccharide binding enhances virion stability and promotes environmental fitness of an enteric virus. Cell Host Microbe, 15, 36-46 (2014)[PubMed]
- Miura, T., Sano, D., Sunaga, A. et al.: Histo-blood group antigen-like substances of human enteric bacteria as specific adsorbents for human noroviruses. J. Virol., 87, 9441-9451 (2013)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院医学研究科 修了,同年 米国GTx社 Research Scientist,2005年 米国St. Jude Children’s Research HospitalにてResearch Lab Specialistなどを経て,2011年より米国Florida大学College of MedicineにてScientific Research Manager.
研究テーマ:RNAウイルスの病原性および増殖機構.
抱負:ウイルスや感染症に対する一般の人々の認識を深めることに貢献したい.
© 2014 渡辺 真紀子 Licensed under CC 表示 2.1 日本