転写因子Bach2およびBach1による骨髄系細胞において発現する遺伝子の発現の抑制はB細胞の分化を促進する
伊藤亜里・五十嵐和彦
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2014.143
The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program.
Ari Itoh-Nakadai, Reina Hikota, Akihiko Muto, Kohei Kometani, Miki Watanabe-Matsui, Yuki Sato, Masahiro Kobayashi, Atsushi Nakamura, Yuichi Miura, Yoko Yano, Satoshi Tashiro, Jiying Sun, Tomokatsu Ikawa, Kyoko Ochiai, Tomohiro Kurosaki, Kazuhiko Igarashi
Nature Immunology, 15, 1171-1180 (2014)
血球細胞の分化は,多分化能をもつ造血幹細胞にはじまり,数段階の前駆細胞をへて分化の方向が徐々にせばまり,最終的にひとつの細胞系列に運命が決定する.液性免疫を担うB細胞の直前の前駆細胞は骨髄に存在するリンパ球前駆細胞とよばれる集団だと考えられており,B細胞のマスター制御因子である転写因子EBF1の遺伝子発現もリンパ球前駆細胞にてはじまる.EBF1はリンパ球前駆細胞において転写因子Pax5やB細胞受容体の構成タンパク質などをコードするB細胞に特異的な遺伝子の発現を促進し,細胞の運命をB細胞へと決定する.さらに,EBF1は骨髄系細胞などほかの細胞系列において発現する遺伝子の発現を抑制するとされてきたが,その機構は不明であった.筆者らは,B細胞において高い発現を示す転写因子Bach2がB細胞の初期の分化にも関与する可能性を考え,Bach2およびその類縁の転写因子であるBach1を欠損したマウスを作製し解析した.その結果,それぞれ単独のノックアウトマウスにおいては骨髄におけるB細胞の初期の分化に異常は認められなかったのに対し,ダブルノックアウトマウスにおいてはもっとも未熟なB細胞であるプロB細胞の段階で細胞の数が減少していることを見い出した.Bach1およびBach2を欠損したリンパ球前駆細胞はプロB細胞への分化能が低下し,逆に,骨髄系細胞への分化能が亢進していた.単一の細胞における遺伝子発現の解析やBach2レポーターマウスの解析により,Bach2は骨髄系細胞において発現する複数の遺伝子の発現を直接に抑制すること,それが結果として,リンパ球前駆細胞のB細胞への分化の促進につながることが明らかにされた.B細胞における遺伝子制御ネットワークは骨髄系細胞における遺伝子制御ネットワークと競合することが知られているが,その競合においてBach2およびBach1が重要だと考えられた.
細胞の分化の際には,細胞周期や分化した細胞の機能に必須の遺伝子など,さまざまな遺伝子の発現が変動する.それらの遺伝子の発現を制御しているのは転写因子である.転写因子は,分化の末梢に位置する遺伝子の発現を制御するだけでなく,転写因子をコードする遺伝子の発現も制御する.このような転写因子のあいだの制御を中心として,細胞系列を特徴づける遺伝子制御ネットワークが形成される.前駆細胞においては複数の遺伝子制御ネットワークが始動し,これらが互いに競合し最終的にそのなかのひとつが強化され,細胞の運命が決定されると考えられる.B細胞の分化は骨髄において起こり,造血幹細胞から,多能性前駆細胞,リンパ球-ミエロイド前駆細胞,リンパ球前駆細胞をへて,もっとも初期のB細胞であるプロB細胞が分化し,それがプレB細胞,未熟B細胞,成熟B細胞と多段階をへて成熟する1).前駆細胞からプロB細胞への分化の決定は,リンパ球前駆細胞にてインターロイキン7シグナルの下流において転写因子EBF1の遺伝子発現が開始することにより行われる2).EBF1はほかの転写因子であるE2AやFoxo1とB細胞に特異的な遺伝子制御ネットワークを形成し,B細胞の分化に必須の転写因子Pax5,クラススイッチを制御する転写因子Bach2,B細胞受容体の構成タンパク質など,B細胞に特異的なさまざまな遺伝子の発現を促進しプロB細胞への分化を進行させる3).当初は,リンパ球前駆細胞はB細胞とT細胞に分化するとされたが,実際は,B細胞,T細胞,ナチュラルキラー細胞,形質細胞様樹状細胞に分化する能力をもち,in vitroでは骨髄系細胞にも分化する4).また,EBF1を発現している細胞はリンパ球前駆細胞の一部であることから,リンパ球前駆細胞は非常にヘテロな集団,あるいは,多能性をもつ集団であると考えられている4).EBF1はB細胞において発現する遺伝子の発現を促進するだけでなく,骨髄系細胞への分化のマスター制御因子とされる転写因子C/EBPαおよびC/EBPβの遺伝子発現を抑制し,骨髄系細胞への分化を抑制すると考えられている3,5).しかし,その機構は明らかではなかった.
転写因子Bach2はB細胞およびT細胞において高く発現し,B細胞における抗体遺伝子のクラススイッチ組換えや,抑制性T細胞の分化,肺胞マクロファージの恒常性において重要である6-8).成熟したB細胞におけるBach2の機能については多くの研究がなされているが,B細胞の初期の分化における機能は不明であった.筆者らは,この点を追求するため,Bach2の類縁の転写因子であるBach1がBach2の機能を代償する可能性も視野にいれ,Bach1 Bach2ダブルノックアウトマウスを作製した.このダブルノックアウトマウスの解析や単一の細胞における遺伝子発現の解析などの結果,Bach2はEBF1の上流においても機能していることが明らかにされた.Bach2はB細胞における遺伝子制御ネットワークと骨髄系細胞における遺伝子制御ネットワークとの拮抗にかかわり,骨髄系細胞における遺伝子制御ネットワークを抑制することによりB細胞における遺伝子制御ネットワークの確立を促進すること,この機能の少なくとも一部はBach1も担っていることが明らかにされた.
Bach2の遺伝子発現は転写因子E2A,Foxo1,Pax5により促進され3,9),プロB細胞からB細胞のおのおのの分化の段階において高い発現を示す.これら転写因子のあいだの関係をさらに理解するため,リンパ球前駆細胞におけるBach2,EBF1,Pax5の発現の有無を単一の細胞において多重PCR法を用い評価した.予想外なことに,Bach2はリンパ球前駆細胞の63%において発現していたのに対し,Ebf1およびPax5の発現の頻度はBach2に比べ低かった.リンパ球前駆細胞におけるBach2の初期の発現はEBF1やPax5には依存することなく誘導されると考えられた.しかも,Ebf1やPax5を発現する細胞のほとんどはBach2も発現していたことから,Bach2はB細胞の分化の初期の段階においてもなんらかの機能をもつことが示唆された.
B細胞の初期の分化におけるBach2の機能を探るため,Bach2の類縁の転写因子であるBach1がBach2の機能を代償している可能性も考え,Bach1 Bach2ダブルノックアウトマウスを作製して骨髄におけるB細胞の数を測定した.このダブルノックアウトマウスでは骨髄におけるB細胞の数が野生型のマウスの30%にまで減少し,その減少はプロB細胞の段階からみられた.Bach2あるいはBach1を単独で欠損したマウスではこのような異常は観察されなかったことから,転写因子Bach2およびBach1はB細胞の初期の分化において互いに相補しながら重要な機能を担っていることが考えられた.
Bach1 Bach2ダブルノックアウトマウスにおけるB細胞の分化の異常の原因はプロB細胞にあるのか,あるいは,その上流のリンパ球前駆細胞にあるのかを明らかにするため,それぞれの細胞を単離し培養系を用いてプレB細胞へと分化を誘導した.Bach1およびBach2を欠損したリンパ球前駆細胞は野生型のリンパ球前駆細胞に比べプレB細胞への分化が低下していたが,プロB細胞のプレB細胞への分化能は野生型とBach1 Bach2二重欠損とのあいだで差はなかった.リンパ球前駆細胞は骨髄系細胞への分化能ももつが,Bach1およびBach2を欠損したリンパ球前駆細胞の骨髄系細胞への分化能は野生型に比べ上昇していた.
そこで,Bach2が骨髄系細胞への分化を抑制している可能性を検証するため,B前駆細胞様の性質をもつEBF1を欠損した細胞にBach2遺伝子,Bach1遺伝子,Ebf1遺伝子をそれぞれ導入し,骨髄系細胞に分化する環境において6日間にわたり培養した.その結果,Bach2は骨髄系細胞への分化を抑制したのに対し,Bach1に大きな効果は観察されなかった.驚いたことに,Ebf1遺伝子を導入した細胞では,対照となる導入していない細胞と比べ,骨髄系細胞への分化が顕著に上昇した.一連の実験結果から,リンパ球前駆細胞において骨髄系細胞への分化を抑制するのはおもにBach2であること,逆に,EBF1は骨髄系細胞への分化を誘導するという矛盾する機能をあわせもつことが考えられた.Bach1 Bach2ダブルノックアウトマウスにおける知見をあわせると,転写因子Bach2はリンパ球前駆細胞において骨髄系細胞への分化を抑制し,B細胞への分化を促進している可能性が考えられた.
リンパ球前駆細胞においてBach2がどのような遺伝子の発現を制御しているかを調べるため,EBF1を欠損した細胞にBach2遺伝子,Bach1遺伝子,Ebf1遺伝子をそれぞれ導入し,2日間の培養ののち,マイクロアレイ法および定量PCR法により遺伝子発現を比較した.その結果,Bach2は,Cebpa遺伝子,Cebpb遺伝子,Ahr遺伝子,Adam8遺伝子,Ccl9遺伝子,Ly96遺伝子,Cish遺伝子など,骨髄系細胞において発現する多数の遺伝子の発現を抑制することがわかった.クロマチン免疫沈降法およびゲルシフトアッセイ法の結果から,Cebpb遺伝子,Ahr遺伝子,Ly96遺伝子,Cish遺伝子の遺伝子座にBach2の結合することが示され,Bach2はこれらの遺伝子の発現を直接に抑制していることが示唆された.Bach1による骨髄系細胞において発現する遺伝子の発現の抑制はBach2と比べると限定的であり,調べたなかでは,Cebpb遺伝子およびCcl9遺伝子のみ発現を抑制した.既報のとおり,EBF1は,Cebpa遺伝子の発現を抑制したが5),逆に,Cebpb遺伝子,Ccl9遺伝子,Cish遺伝子,Ly96遺伝子,Spic遺伝子などの骨髄系細胞において発現する遺伝子の発現を促進した.これらの結果は,さきに述べた分化を誘導した実験の結果を裏づけるものであった.調べたかぎりでは,Bach2がB細胞において特異的に発現する遺伝子の発現を直接に促進することを示す結果は得られなかった.これらの結果から,転写因子Bach2は骨髄系細胞において発現する遺伝子の発現を抑制することによりB細胞の分化に貢献していること,これに対し,転写因子EBF1はB細胞において特異的に発現する遺伝子を直接に促進することによりB細胞の分化を促進していることが示唆された.
これまでに,単一の細胞における遺伝子発現の解析により,リンパ球前駆細胞はヘテロな集団でありEbf1遺伝子とその標的遺伝子であるプレB細胞受容体のIgll1遺伝子をともに発現するリンパ球前駆細胞の亜集団はB細胞への分化が決定している細胞である,という報告があった4).リンパ球前駆細胞におけるB細胞にて特異的に発現する遺伝子と骨髄系細胞にて発現する遺伝子の発現の頻度,および,細胞あたりの発現量を比較するため,微小流路技術とPCR法とを組み合わせた装置を用いて解析した.野生型のリンパ球前駆細胞においては,一部の細胞にてEbf1遺伝子が発現し,そのなかの一部はさらにIgll1遺伝子,Pax5遺伝子,Vpreb3遺伝子などB細胞において特異的に発現する複数の遺伝子を同時に発現していた.これらは,B細胞における遺伝子制御ネットワークが確立しB細胞への分化が決定した細胞と考えられた.一方,Bach1およびBach2を欠損したリンパ球前駆細胞においては,Ebf1遺伝子にくわえてB細胞において特異的に発現する複数の遺伝子を発現する細胞は存在しなかった.また,細胞ごとにEbf1遺伝子およびその標的遺伝子の発現量を調べたところ,野生型のリンパ球前駆細胞においては高い相関がみられたが,Bach1およびBach2を欠損したリンパ球前駆細胞においてはその相関は低下していた.Bach1およびBach2を欠損したリンパ球前駆細胞においてはEbf1遺伝子それ自体の発現および頻度に大きな低下がみられなかったことから,Bach2およびBach1はEBF1による標的遺伝子の発現の誘導に寄与している可能性が考えられた.一方,Bach1およびBach2を欠損したリンパ球前駆細胞においては,Spic遺伝子やCebpb遺伝子など骨髄系細胞において発現する遺伝子を発現する細胞の頻度が上昇し,遺伝子によっては細胞あたりの発現量も増加していた.これらの結果から,Bach1およびBach2を欠損したリンパ球前駆細胞においてはB細胞において特異的に発現する遺伝子の発現の頻度が低下し,その一方で,骨髄系細胞において発現する遺伝子の発現の頻度が上昇しその発現量も増加していることが示された.Bach2およびBach1は,EBF1による転写の活性化において障害となる骨髄系細胞において発現する遺伝子の発現を抑制し,B細胞における遺伝子制御ネットワークの確立に寄与していることが考えられた.
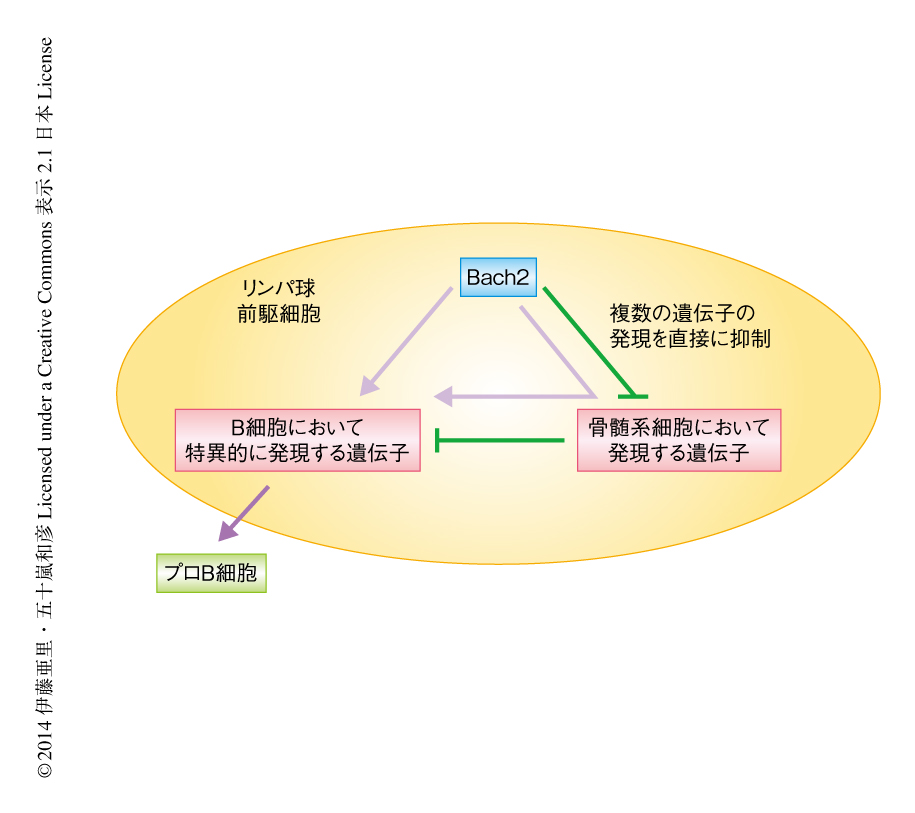
以上の結果から,リンパ球前駆細胞においてはBach2の発現量がB細胞への分化を左右している可能性が考えられた.そこで,Bach2の発現量とB細胞への分化能との関係を調べるため,Bach2レポーターマウスを用いて解析した.Bach2の発現の高いリンパ球前駆細胞と低いリンパ球前駆細胞を分けて遺伝子発現を調べたところ,Bach2の発現の高いリンパ球前駆細胞ではB細胞において特異的に発現する遺伝子の発現が,Bach2の発現の低いリンパ球前駆細胞では骨髄系細胞において発現する遺伝子の発現が,それぞれ高いことがわかった.これは,さきに述べた,単一の細胞における解析の結果と合致した.B細胞への分化能および骨髄系細胞への分化能を比較してみると,Bach2の発現の高いリンパ球前駆細胞はBach2の発現の低いリンパ球前駆細胞に比べ,より迅速にB細胞へと分化した.逆に,Bach2の発現の低いリンパ球前駆細胞は骨髄系細胞への分化能がより高いことも明らかになった.これらの結果は,転写因子Bach2が骨髄系細胞への分化を抑制しB細胞への分化を促進するという説を支持するものであった(図1).
さまざまな生物種において血球細胞を比較すると,骨髄系細胞は進化の過程でもっとも早期に現われたと考えられる.哺乳類の造血系においては,すべての前駆細胞が細胞系列の決定の直前まで骨髄系細胞への分化能を保持するという骨髄系細胞基軸説が提唱されているが10),この説は造血系の系統進化を反映している点でも合理的で魅力がある.今回の筆者らの結果は,B細胞の前駆細胞においても,骨髄系細胞において発現する遺伝子の発現の抑制がB細胞への分化を促進することを示しており,骨髄系細胞基軸説をB細胞の分化へと広げるものであった.より未熟で骨髄系細胞への分化能がより強い多能性前駆細胞やリンパ球-ミエロイド前駆細胞においても,Bach2やBach1が機能し分化の方向性を決めている可能性があり,これは,今後,取り組むべき課題である.Bach2遺伝子の多型は関節リウマチやクローン病などさまざまな免疫関連疾患と関連しているという報告がある.また,白血病においてBach2遺伝子の変異が報告されている.今回,発見したBach2による骨髄系細胞とB細胞との分岐の制御が,このような疾患の理解や治療法の開発の一助となることを期待する.
略歴:2012年 東北大学大学院医学系研究科修了,同年より同 産学官連携研究員.
研究テーマ:転写因子による遺伝子発現の制御および血球細胞の分化.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2014 伊藤亜里・五十嵐和彦 Licensed under CC 表示 2.1 日本
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2014.143
The transcription repressors Bach2 and Bach1 promote B cell development by repressing the myeloid program.
Ari Itoh-Nakadai, Reina Hikota, Akihiko Muto, Kohei Kometani, Miki Watanabe-Matsui, Yuki Sato, Masahiro Kobayashi, Atsushi Nakamura, Yuichi Miura, Yoko Yano, Satoshi Tashiro, Jiying Sun, Tomokatsu Ikawa, Kyoko Ochiai, Tomohiro Kurosaki, Kazuhiko Igarashi
Nature Immunology, 15, 1171-1180 (2014)
要 約
血球細胞の分化は,多分化能をもつ造血幹細胞にはじまり,数段階の前駆細胞をへて分化の方向が徐々にせばまり,最終的にひとつの細胞系列に運命が決定する.液性免疫を担うB細胞の直前の前駆細胞は骨髄に存在するリンパ球前駆細胞とよばれる集団だと考えられており,B細胞のマスター制御因子である転写因子EBF1の遺伝子発現もリンパ球前駆細胞にてはじまる.EBF1はリンパ球前駆細胞において転写因子Pax5やB細胞受容体の構成タンパク質などをコードするB細胞に特異的な遺伝子の発現を促進し,細胞の運命をB細胞へと決定する.さらに,EBF1は骨髄系細胞などほかの細胞系列において発現する遺伝子の発現を抑制するとされてきたが,その機構は不明であった.筆者らは,B細胞において高い発現を示す転写因子Bach2がB細胞の初期の分化にも関与する可能性を考え,Bach2およびその類縁の転写因子であるBach1を欠損したマウスを作製し解析した.その結果,それぞれ単独のノックアウトマウスにおいては骨髄におけるB細胞の初期の分化に異常は認められなかったのに対し,ダブルノックアウトマウスにおいてはもっとも未熟なB細胞であるプロB細胞の段階で細胞の数が減少していることを見い出した.Bach1およびBach2を欠損したリンパ球前駆細胞はプロB細胞への分化能が低下し,逆に,骨髄系細胞への分化能が亢進していた.単一の細胞における遺伝子発現の解析やBach2レポーターマウスの解析により,Bach2は骨髄系細胞において発現する複数の遺伝子の発現を直接に抑制すること,それが結果として,リンパ球前駆細胞のB細胞への分化の促進につながることが明らかにされた.B細胞における遺伝子制御ネットワークは骨髄系細胞における遺伝子制御ネットワークと競合することが知られているが,その競合においてBach2およびBach1が重要だと考えられた.
はじめに
細胞の分化の際には,細胞周期や分化した細胞の機能に必須の遺伝子など,さまざまな遺伝子の発現が変動する.それらの遺伝子の発現を制御しているのは転写因子である.転写因子は,分化の末梢に位置する遺伝子の発現を制御するだけでなく,転写因子をコードする遺伝子の発現も制御する.このような転写因子のあいだの制御を中心として,細胞系列を特徴づける遺伝子制御ネットワークが形成される.前駆細胞においては複数の遺伝子制御ネットワークが始動し,これらが互いに競合し最終的にそのなかのひとつが強化され,細胞の運命が決定されると考えられる.B細胞の分化は骨髄において起こり,造血幹細胞から,多能性前駆細胞,リンパ球-ミエロイド前駆細胞,リンパ球前駆細胞をへて,もっとも初期のB細胞であるプロB細胞が分化し,それがプレB細胞,未熟B細胞,成熟B細胞と多段階をへて成熟する1).前駆細胞からプロB細胞への分化の決定は,リンパ球前駆細胞にてインターロイキン7シグナルの下流において転写因子EBF1の遺伝子発現が開始することにより行われる2).EBF1はほかの転写因子であるE2AやFoxo1とB細胞に特異的な遺伝子制御ネットワークを形成し,B細胞の分化に必須の転写因子Pax5,クラススイッチを制御する転写因子Bach2,B細胞受容体の構成タンパク質など,B細胞に特異的なさまざまな遺伝子の発現を促進しプロB細胞への分化を進行させる3).当初は,リンパ球前駆細胞はB細胞とT細胞に分化するとされたが,実際は,B細胞,T細胞,ナチュラルキラー細胞,形質細胞様樹状細胞に分化する能力をもち,in vitroでは骨髄系細胞にも分化する4).また,EBF1を発現している細胞はリンパ球前駆細胞の一部であることから,リンパ球前駆細胞は非常にヘテロな集団,あるいは,多能性をもつ集団であると考えられている4).EBF1はB細胞において発現する遺伝子の発現を促進するだけでなく,骨髄系細胞への分化のマスター制御因子とされる転写因子C/EBPαおよびC/EBPβの遺伝子発現を抑制し,骨髄系細胞への分化を抑制すると考えられている3,5).しかし,その機構は明らかではなかった.
転写因子Bach2はB細胞およびT細胞において高く発現し,B細胞における抗体遺伝子のクラススイッチ組換えや,抑制性T細胞の分化,肺胞マクロファージの恒常性において重要である6-8).成熟したB細胞におけるBach2の機能については多くの研究がなされているが,B細胞の初期の分化における機能は不明であった.筆者らは,この点を追求するため,Bach2の類縁の転写因子であるBach1がBach2の機能を代償する可能性も視野にいれ,Bach1 Bach2ダブルノックアウトマウスを作製した.このダブルノックアウトマウスの解析や単一の細胞における遺伝子発現の解析などの結果,Bach2はEBF1の上流においても機能していることが明らかにされた.Bach2はB細胞における遺伝子制御ネットワークと骨髄系細胞における遺伝子制御ネットワークとの拮抗にかかわり,骨髄系細胞における遺伝子制御ネットワークを抑制することによりB細胞における遺伝子制御ネットワークの確立を促進すること,この機能の少なくとも一部はBach1も担っていることが明らかにされた.
1.Bach1 Bach2ダブルノックアウトマウスでは骨髄のB細胞が減少する
Bach2の遺伝子発現は転写因子E2A,Foxo1,Pax5により促進され3,9),プロB細胞からB細胞のおのおのの分化の段階において高い発現を示す.これら転写因子のあいだの関係をさらに理解するため,リンパ球前駆細胞におけるBach2,EBF1,Pax5の発現の有無を単一の細胞において多重PCR法を用い評価した.予想外なことに,Bach2はリンパ球前駆細胞の63%において発現していたのに対し,Ebf1およびPax5の発現の頻度はBach2に比べ低かった.リンパ球前駆細胞におけるBach2の初期の発現はEBF1やPax5には依存することなく誘導されると考えられた.しかも,Ebf1やPax5を発現する細胞のほとんどはBach2も発現していたことから,Bach2はB細胞の分化の初期の段階においてもなんらかの機能をもつことが示唆された.
B細胞の初期の分化におけるBach2の機能を探るため,Bach2の類縁の転写因子であるBach1がBach2の機能を代償している可能性も考え,Bach1 Bach2ダブルノックアウトマウスを作製して骨髄におけるB細胞の数を測定した.このダブルノックアウトマウスでは骨髄におけるB細胞の数が野生型のマウスの30%にまで減少し,その減少はプロB細胞の段階からみられた.Bach2あるいはBach1を単独で欠損したマウスではこのような異常は観察されなかったことから,転写因子Bach2およびBach1はB細胞の初期の分化において互いに相補しながら重要な機能を担っていることが考えられた.
2.転写因子Bach2による骨髄系細胞の分化の抑制
Bach1 Bach2ダブルノックアウトマウスにおけるB細胞の分化の異常の原因はプロB細胞にあるのか,あるいは,その上流のリンパ球前駆細胞にあるのかを明らかにするため,それぞれの細胞を単離し培養系を用いてプレB細胞へと分化を誘導した.Bach1およびBach2を欠損したリンパ球前駆細胞は野生型のリンパ球前駆細胞に比べプレB細胞への分化が低下していたが,プロB細胞のプレB細胞への分化能は野生型とBach1 Bach2二重欠損とのあいだで差はなかった.リンパ球前駆細胞は骨髄系細胞への分化能ももつが,Bach1およびBach2を欠損したリンパ球前駆細胞の骨髄系細胞への分化能は野生型に比べ上昇していた.
そこで,Bach2が骨髄系細胞への分化を抑制している可能性を検証するため,B前駆細胞様の性質をもつEBF1を欠損した細胞にBach2遺伝子,Bach1遺伝子,Ebf1遺伝子をそれぞれ導入し,骨髄系細胞に分化する環境において6日間にわたり培養した.その結果,Bach2は骨髄系細胞への分化を抑制したのに対し,Bach1に大きな効果は観察されなかった.驚いたことに,Ebf1遺伝子を導入した細胞では,対照となる導入していない細胞と比べ,骨髄系細胞への分化が顕著に上昇した.一連の実験結果から,リンパ球前駆細胞において骨髄系細胞への分化を抑制するのはおもにBach2であること,逆に,EBF1は骨髄系細胞への分化を誘導するという矛盾する機能をあわせもつことが考えられた.Bach1 Bach2ダブルノックアウトマウスにおける知見をあわせると,転写因子Bach2はリンパ球前駆細胞において骨髄系細胞への分化を抑制し,B細胞への分化を促進している可能性が考えられた.
3.転写因子Bach2は骨髄系細胞において発現する複数の遺伝子の発現を直接に抑制する
リンパ球前駆細胞においてBach2がどのような遺伝子の発現を制御しているかを調べるため,EBF1を欠損した細胞にBach2遺伝子,Bach1遺伝子,Ebf1遺伝子をそれぞれ導入し,2日間の培養ののち,マイクロアレイ法および定量PCR法により遺伝子発現を比較した.その結果,Bach2は,Cebpa遺伝子,Cebpb遺伝子,Ahr遺伝子,Adam8遺伝子,Ccl9遺伝子,Ly96遺伝子,Cish遺伝子など,骨髄系細胞において発現する多数の遺伝子の発現を抑制することがわかった.クロマチン免疫沈降法およびゲルシフトアッセイ法の結果から,Cebpb遺伝子,Ahr遺伝子,Ly96遺伝子,Cish遺伝子の遺伝子座にBach2の結合することが示され,Bach2はこれらの遺伝子の発現を直接に抑制していることが示唆された.Bach1による骨髄系細胞において発現する遺伝子の発現の抑制はBach2と比べると限定的であり,調べたなかでは,Cebpb遺伝子およびCcl9遺伝子のみ発現を抑制した.既報のとおり,EBF1は,Cebpa遺伝子の発現を抑制したが5),逆に,Cebpb遺伝子,Ccl9遺伝子,Cish遺伝子,Ly96遺伝子,Spic遺伝子などの骨髄系細胞において発現する遺伝子の発現を促進した.これらの結果は,さきに述べた分化を誘導した実験の結果を裏づけるものであった.調べたかぎりでは,Bach2がB細胞において特異的に発現する遺伝子の発現を直接に促進することを示す結果は得られなかった.これらの結果から,転写因子Bach2は骨髄系細胞において発現する遺伝子の発現を抑制することによりB細胞の分化に貢献していること,これに対し,転写因子EBF1はB細胞において特異的に発現する遺伝子を直接に促進することによりB細胞の分化を促進していることが示唆された.
4.転写因子Bach1およびBach2を欠損したリンパ球前駆細胞では骨髄系細胞において発現する遺伝子の発現が上昇する
これまでに,単一の細胞における遺伝子発現の解析により,リンパ球前駆細胞はヘテロな集団でありEbf1遺伝子とその標的遺伝子であるプレB細胞受容体のIgll1遺伝子をともに発現するリンパ球前駆細胞の亜集団はB細胞への分化が決定している細胞である,という報告があった4).リンパ球前駆細胞におけるB細胞にて特異的に発現する遺伝子と骨髄系細胞にて発現する遺伝子の発現の頻度,および,細胞あたりの発現量を比較するため,微小流路技術とPCR法とを組み合わせた装置を用いて解析した.野生型のリンパ球前駆細胞においては,一部の細胞にてEbf1遺伝子が発現し,そのなかの一部はさらにIgll1遺伝子,Pax5遺伝子,Vpreb3遺伝子などB細胞において特異的に発現する複数の遺伝子を同時に発現していた.これらは,B細胞における遺伝子制御ネットワークが確立しB細胞への分化が決定した細胞と考えられた.一方,Bach1およびBach2を欠損したリンパ球前駆細胞においては,Ebf1遺伝子にくわえてB細胞において特異的に発現する複数の遺伝子を発現する細胞は存在しなかった.また,細胞ごとにEbf1遺伝子およびその標的遺伝子の発現量を調べたところ,野生型のリンパ球前駆細胞においては高い相関がみられたが,Bach1およびBach2を欠損したリンパ球前駆細胞においてはその相関は低下していた.Bach1およびBach2を欠損したリンパ球前駆細胞においてはEbf1遺伝子それ自体の発現および頻度に大きな低下がみられなかったことから,Bach2およびBach1はEBF1による標的遺伝子の発現の誘導に寄与している可能性が考えられた.一方,Bach1およびBach2を欠損したリンパ球前駆細胞においては,Spic遺伝子やCebpb遺伝子など骨髄系細胞において発現する遺伝子を発現する細胞の頻度が上昇し,遺伝子によっては細胞あたりの発現量も増加していた.これらの結果から,Bach1およびBach2を欠損したリンパ球前駆細胞においてはB細胞において特異的に発現する遺伝子の発現の頻度が低下し,その一方で,骨髄系細胞において発現する遺伝子の発現の頻度が上昇しその発現量も増加していることが示された.Bach2およびBach1は,EBF1による転写の活性化において障害となる骨髄系細胞において発現する遺伝子の発現を抑制し,B細胞における遺伝子制御ネットワークの確立に寄与していることが考えられた.
5.Bach2の発現量がリンパ球前駆細胞のB細胞への分化能を規定する
以上の結果から,リンパ球前駆細胞においてはBach2の発現量がB細胞への分化を左右している可能性が考えられた.そこで,Bach2の発現量とB細胞への分化能との関係を調べるため,Bach2レポーターマウスを用いて解析した.Bach2の発現の高いリンパ球前駆細胞と低いリンパ球前駆細胞を分けて遺伝子発現を調べたところ,Bach2の発現の高いリンパ球前駆細胞ではB細胞において特異的に発現する遺伝子の発現が,Bach2の発現の低いリンパ球前駆細胞では骨髄系細胞において発現する遺伝子の発現が,それぞれ高いことがわかった.これは,さきに述べた,単一の細胞における解析の結果と合致した.B細胞への分化能および骨髄系細胞への分化能を比較してみると,Bach2の発現の高いリンパ球前駆細胞はBach2の発現の低いリンパ球前駆細胞に比べ,より迅速にB細胞へと分化した.逆に,Bach2の発現の低いリンパ球前駆細胞は骨髄系細胞への分化能がより高いことも明らかになった.これらの結果は,転写因子Bach2が骨髄系細胞への分化を抑制しB細胞への分化を促進するという説を支持するものであった(図1).
おわりに
さまざまな生物種において血球細胞を比較すると,骨髄系細胞は進化の過程でもっとも早期に現われたと考えられる.哺乳類の造血系においては,すべての前駆細胞が細胞系列の決定の直前まで骨髄系細胞への分化能を保持するという骨髄系細胞基軸説が提唱されているが10),この説は造血系の系統進化を反映している点でも合理的で魅力がある.今回の筆者らの結果は,B細胞の前駆細胞においても,骨髄系細胞において発現する遺伝子の発現の抑制がB細胞への分化を促進することを示しており,骨髄系細胞基軸説をB細胞の分化へと広げるものであった.より未熟で骨髄系細胞への分化能がより強い多能性前駆細胞やリンパ球-ミエロイド前駆細胞においても,Bach2やBach1が機能し分化の方向性を決めている可能性があり,これは,今後,取り組むべき課題である.Bach2遺伝子の多型は関節リウマチやクローン病などさまざまな免疫関連疾患と関連しているという報告がある.また,白血病においてBach2遺伝子の変異が報告されている.今回,発見したBach2による骨髄系細胞とB細胞との分岐の制御が,このような疾患の理解や治療法の開発の一助となることを期待する.
文 献
- Adolfsson, J., Mansson, R., Buza-Vidas, N. et al.: Identification of Flt3+ lympho-myeloid stem cells lacking erythro-megakaryocytic potential a revised road map for adult blood lineage commitment. Cell, 121, 295-306 (2005)[PubMed]
- Kikuchi, K., Lai, A. Y., Hsu, C. L. et al.: IL-7 receptor signaling is necessary for stage transition in adult B cell development through up-regulation of EBF. J. Exp. Med., 201, 1197-1203 (2005)[PubMed]
- Lin, Y. C., Jhunjhunwala, S., Benner, C. et al.: A global network of transcription factors, involving E2A, EBF1 and Foxo1, that orchestrates B cell fate. Nat. Immunol., 11, 635-643 (2010)[PubMed]
- Mansson, R., Zandi, S., Welinder, E. et al.: Single-cell analysis of the common lymphoid progenitor compartment reveals functional and molecular heterogeneity. Blood, 115, 2601-2609 (2010)[PubMed]
- Pongubala, J. M., Northrup, D. L., Lancki, D. W. et al.: Transcription factor EBF restricts alternative lineage options and promotes B cell fate commitment independently of Pax5. Nat. Immunol., 9, 203-215 (2008)[PubMed]
- Muto, A., Tashiro, S., Nakajima, O. et al.: The transcriptional programme of antibody class switching involves the repressor Bach2. Nature, 429, 566-571 (2004)[PubMed]
- Roychoudhuri, R., Hirahara, K., Mousavi, K. et al.: BACH2 represses effector programs to stabilize Treg-mediated immune homeostasis. Nature, 498, 506-510 (2013)[PubMed]
- Nakamura, A., Ebina-Shibuya, R., Itoh-Nakadai, A. et al.: Transcription repressor Bach2 is required for pulmonary surfactant homeostasis and alveolar macrophage function. J. Exp. Med., 210, 2191-2204 (2013)[PubMed]
- McManus, S., Ebert, A., Salvagiotto, G. et al.: The transcription factor Pax5 regulates its target genes by recruiting chromatin-modifying proteins in committed B cells. EMBO J., 30, 2388-2404 (2011)[PubMed]
- Kawamoto, H., Ikawa, T., Masuda, K. et al.: A map for lineage restriction of progenitors during hematopoiesis: the essence of the myeloid-based model. Immunol. Rev., 238, 23-36 (2010)[PubMed]
著者プロフィール
略歴:2012年 東北大学大学院医学系研究科修了,同年より同 産学官連携研究員.
研究テーマ:転写因子による遺伝子発現の制御および血球細胞の分化.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2014 伊藤亜里・五十嵐和彦 Licensed under CC 表示 2.1 日本