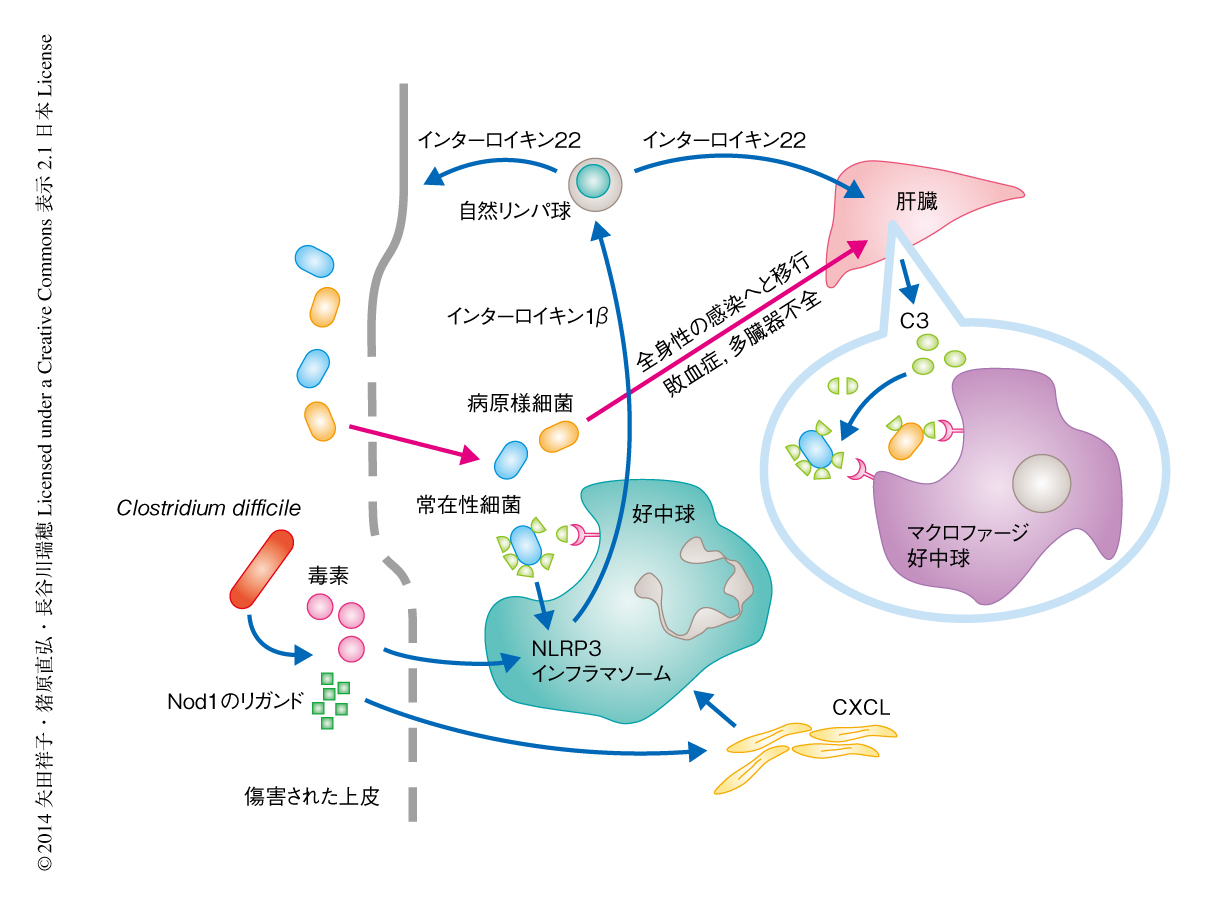
インターロイキン22は補体系を増強することにより腸管上皮の傷害から侵入する細菌に対し抵抗性をあたえる
矢田祥子・猪原直弘・長谷川瑞穂
(米国Michigan大学Medical School,Department of Pathology)
email:猪原直弘
DOI: 10.7875/first.author.2014.140
Interleukin-22 regulates the complement system to promote resistance against pathobionts after pathogen-induced intestinal damage.
Mizuho Hasegawa, Shoko Yada, Meng Zhen Liu, Nobuhiko Kamada, Raúl Muñoz-Planillo, Nhu Do, Gabriel Núñez, Naohiro Inohara
Immunity, 41, 620-632 (2014)
ヒトや動物の腸には多くの常在性の細菌が存在する.共生的な恩恵をあたえる細菌もあれば,ふだんは疾患を起こさないものの特定の条件において有害となる病原様の細菌も存在する.腸管上皮に傷害が生じると腸内細菌が組織に侵入することにより腸炎が起こり,ときには敗血症をひき起こす.とくに,腸内フローラに異常の生じた場合,特定の病原様細菌により疾患は重症化する.抗生物質の投与は細菌Clostridium difficileの異常な増殖の原因となり,その毒素により腸管上皮に傷害がひき起こされる.以前に,筆者らは,マウスモデルにおいて組織に侵入する腸内細菌がC. difficileに感染した際の重症度において重要であることを見い出した.今回は,腸の局所における免疫の主役であるインターロイキン22が,腸から全身へと移行する病原様細菌の除去においても重要であることを示した.インターロイキン22は局所の免疫をかいくぐった病原様細菌に対しても補体系の増強により全身性の自然免疫を強化することで,宿主の生体防御において重要な役割をはたすことが明らかにされた.
ヒトの消化管には数千種類,約百兆個の細菌が棲息する1).常在性の細菌にはビタミンの生産や免疫バランスの制御などの共生的な恩恵をあたえる細菌もある一方で,ふだんは疾患を起こさないものの特定の条件のもとでは有害な病原様の細菌も存在する.日和見感染性の常在性細菌も病原様細菌の一種であり,腸管上皮に傷害が生じると組織への侵入により腸炎や,ときには敗血症をひき起こす.とくに,腸内フローラに異常をきたした場合,特定の病原様細菌により疾患は重症化する.Clostridium difficileはグラム陽性の偏性嫌気細菌であり,健常人の腸にもみつかるが,抗生物質の投与により腸内フローラが変化すると異常に増殖し,産生する毒素により腸管上皮を傷害する.このC. difficileへの感染は特有の組織像から偽膜性大腸炎とよばれるが,下痢や発熱などの軽いものから敗血症や多臓器不全のような重いものまで個人により重症度が異なり,その理由は謎とされてきた.以前に,筆者らは,Nod1やインフラマソームなど自然免疫系を欠損するマウスのモデルを用いて,腸において排除しきれなかった常在性細菌のほかの臓器への移行が疾患の重症化に寄与していることを見い出した2,3).すなわち,C. difficileの感染による疾患において自然免疫がどのように宿主の生体防御に寄与するかを調べていたところ,C. difficile自体よりもむしろ,常在性細菌の組織における存在の有無が宿主の生存率に重要であることを見い出した.このモデルにおける病態はC. difficileと炎症誘発性の常在性細菌との共同作業により説明することができる.C. difficileと腸内細菌科の細菌はいずれもNod1のリガンドを放出し,毒素により傷害をうけた上皮から侵入したNod1のリガンドがCXCLの誘導を介して傷害をうけた組織への好中球の浸潤の引き金となる.しかし,それ単独では炎症あるいは組織に侵入した細菌の除去には不十分であり,この浸潤した好中球がさらに,C. difficileの産生する毒素とともに腸内細菌科の細菌のもつリポ多糖などの成分により刺激されることにより炎症性サイトカインであるインターロイキン1βを分泌し,インターロイキン1βがさらに腸においてケモカインであるCXCLの発現を誘導することにより,好中球が好中球をよぶという正のフィードバック反応が起こる3).こうして集まった十分な量の好中球により組織に侵入した細菌は除去される.このしくみが破綻すると敗血症のリスクが高まる.さらに,腸管上皮に重度の傷害が起こった場合も,腸内細菌は炎症応答では完全には除去できず,全身性の感染症のリスクが高まる.われわれの体はこうした場合の防御の手立てをもたないのだろうか.今回,筆者らは,補体系に対し耐性をもつ特定の腸内細菌のみが全身性の障害を起こして予後に影響をあたえ,腸においてインターロイキン1βに依存的に産生されるインターロイキン22が肝臓などにおいて補体系の中心的なタンパク質であるC3の産生を増加させることにより,この補体系に対し耐性をもつ病原様細菌を除去することを明らかにした.
C. difficileに感染した際のインターロイキン1βの分泌においてはNLRP3インフラマソームが必須の役割をはたしている3).さきに述べたように,インターロイキン1βはC. difficileに感染した際の炎症反応の誘導や宿主の生存に対し必須の役割をはたすため,インフラマソームの構成タンパク質であるASCのノックアウトマウスにおいてC. difficileに感染した際に腸において誘導されるサイトカインのプロファイリングを行っていたところ,インターロイキン1βのみならずインターロイキン22の誘導性も失われることを見い出した.C. difficileに感染した際のインターロイキン22の役割を調べるため,インターロイキン22ノックアウトマウスにC. difficileを感染させたところ,野生型のマウスはほとんど死亡しないにもかかわらず,インターロイキン22ノックアウトマウスには高い死亡率が認められた.C. difficileに感染した際のインターロイキン22の誘導性は成熟したT細胞およびB細胞を欠損するRAG1ノックアウトマウスにおいても失われることはなかったので,インターロイキン1βの産生は自然リンパ球から誘導されるものと思われ,実際に,C. difficileに感染した際のRAG1ノックアウトマウスの生存率は野生型マウスと同じであり,獲得免疫は関係しなかった.
インターロイキン22はRegIIIやαデフェンシンなどの抗菌タンパク質,腸内フローラに影響をあたえるFUT2の発現の誘導や,腸管上皮の傷害の防止,腸管上皮の修復の促進を介して腸内細菌の組織への侵入を防いでいることが報告されている4-6).しかし,インターロイキン22ノックアウトマウスがC. difficileに感染した際の腸管上皮の傷害の程度や腸内フローラは野生型マウスと同じであり,腸の上皮隔壁の消失による大きな分子の透過度もやはり同じであった.さらに,インターロイキン22の誘導性を失ったASCノックアウトマウスでも抗菌タンパク質の誘導性は変わらず,腸におけるC. difficileの数や常在性細菌の数もインターロイキン22ノックアウトマウスと野生型マウスとは同じであった.C. difficileが過剰に増殖して感染した場合,ネックとなるのはC. difficileから放出される毒素による腸管上皮の傷害であり,ほかの感染症とは異なり,腸管上皮から細菌を物理的あるいは化学的に隔絶してどうにかなるものではないのであろう.また,C. difficileに感染した際のインターロイキン22の産生の誘導はインフラマソームの活性化によるインターロイキン1βの分泌によるものだが,正常な常在性細菌の隔離に必要な定常量のインターロイキン22およびその下流のRegIIIの分泌はASCノックアウトマウスにおいても起こっていた.したがって,C. difficileに感染した際のインターロイキン22の役割は定常な状態での腸内環境の維持とは異なる可能性が示唆された.さらに,C. difficileの感染により傷害をうけたインターロイキン22ノックアウトマウスの腸管上皮について組織の解析やフローサイトメトリーによる解析を行ったが,患部の浮腫,好中球やマクロファージなどの炎症細胞の浸潤やそのもとになるケモカインの分泌に違いは認められなかった.
インターロイキン22ノックアウトマウスはなぜC. difficileに感染した際に死亡しやすいのだろうか.肝障害マーカーである血中におけるAST値およびALT値を調べたところ,インターロイキン22ノックアウトマウスには高い肝障害性が認められた.そこで,肝臓を調べたところ大量の腸内細菌が検出された.腸内細菌は肝臓だけでなく,肺,脾臓,間葉リンパ節,腎臓など,全身への感染が認められた.C. difficileの感染による腸の上皮隔壁の消失により腸内細菌の全身への感染がひき起こされているのだろうか.肝臓から得られた生細菌について次世代シークエンサーにより16S rRNA遺伝子を包括的に解析したところ,その大半は腸内細菌科の細菌や乳酸菌目の細菌であることがわかった.C. difficileの感染ののち,これらの細菌によく効くがC. difficileの生存および増殖には影響しない抗生物質であるシプロフロキサシンを投与したところ生存率は改善した.したがって,腸内細菌科の細菌や乳酸菌目の細菌が多臓器に感染を起こすことにより傷害を起こしている可能性が高まった.
そこで,C. difficileに感染したマウスの肝臓においてもっとも多く検出された細菌を単離して培養し,実際にこれらの細菌が宿主の傷害や死亡をひき起こすかどうか調べた.単離した細菌を静脈への注入により感染させたところ,腸内細菌科に属するEnterobacter属細菌,Klebsiella属細菌,Escherichia属細菌は致死性を示したのに対し,乳酸菌目に属するEnterococcus属細菌,Lactobacillus属細菌は致死性を示さなかった.驚いたことにC. difficileに感染したマウスの肝臓から単離した腸内細菌科の細菌は,腸腔からランダムに単離した細菌とたとえ生物学的に同じ種であっても,より強い致死性を示した.さらに,腸腔から単離した細菌と比較し,C. difficileに感染したマウスの肝臓からの単離した同じ種の細菌はマウスに感染させたとき体内における生存率が高かった.同じ種であれば株が違ってもin vitroにおける細胞毒性や炎症性サイトカインの産生の誘導性は変わらなかったことから,マウスの体内における生存率,すなわち,宿主の生体防御応答に対する抵抗性についての株のあいだでの違いが宿主の致死性において重要であり,C. difficileに感染した際の致死性の決定因子になっていると考えられた.
同じ種の細菌であるにもかかわらず,なぜ,宿主の生体防御応答に対する抵抗性が異なるのだろうか.抵抗性をもつ細菌および感受性の細菌に生体防御の要であるマクロファージあるいは好中球をくわえたところ,抵抗性をもつ細菌は貪食に対し耐性であり,その結果,貪食細胞による殺菌に強いことがわかった.貪食においては補体系によるオプソニン化が重要である.実際に,補体系の中心的なタンパク質であるC3のノックアウトマウスから得た血清は感受性の細菌の貪食を起こさなかった.しかし,獲得免疫におけるオプソニン化の主役である免疫グロブリンを欠くRAG1ノックアウトマウスの血清は,野生型マウスの血清と同じ程度の貪食の促進活性やC3の細菌への結合活性を示したため,自然免疫系の補体の活性化の差がこの同じ種の株のあいだの補体への耐性の違いにおいて重要であることがわかった.さらなる解析から,C. difficileに感染したマウスの肝臓から単離した細菌において,宿主における免疫抵抗性に重要なのは補体副経路への抵抗性であることがわかった.
補体副経路に耐性をもつ腸内細菌科の細菌が致死性において重要なのであれば,インターロイキン22による宿主の防御は腸内細菌科の細菌の排除が鍵となるはずである.そこで,腹腔への注射によりインターロイキン22ノックアウトマウスにインターロイキン22を投与したのち,補体副経路に耐性をもつ腸内細菌科の細菌を感染させたところ,生存は劇的に改善された.血中の細菌の数を調べてみると,インターロイキン22を投与したマウスでは補体副経路に耐性をもつ腸内細菌科の細菌の排除が促進されていた.さらに,C. difficileに感染した際にインターロイキン22を投与したところ,生存が改善するとともに腸内細菌の全身性の感染が抑制された.これらのことから,インターロイキン22は補体副経路に耐性をもつ腸内細菌科の細菌の排除を促進することにより,C. difficileの感染による上皮障壁の消失によって組織に侵入した細菌を全身のレベルで排除し予後を改善することがわかった.
インターロイキン22はどうやって補体副経路に耐性をもつ腸内細菌科の細菌の排除を促進するのだろうか.インターロイキン22を投与したマウスの血清を用いると,補体副経路に耐性をもつ腸内細菌科の細菌であっても,対照となる未処理のマウスの血清に比べ,マクロファージや好中球による貪食の促進能の高いことが見い出された.さらに,インターロイキン22を投与したマウスの血清ではC3の細菌への結合活性が明らかに高かった.したがって,インターロイキン22による処理はC3の細菌への結合量を増加させることにより,宿主の免疫に抵抗性の腸内細菌科の細菌の排除を促進していたのである.
つぎなる疑問は,インターロイキン22による処理がどのようにして補体副経路に耐性をもつ腸内細菌科の細菌へのC3の結合量を増加させるのかであった.細菌と血清をin vitroでインキュベーションし補体副経路に耐性をもつ細菌と感受性の細菌とでC3の結合量を比較したところ,さきに述べたように,C3の結合量は感受性の細菌において高かったが,C3の活性化の程度には差は認められなかった.くわえて,血中におけるC3の総量はインターロイキン22を投与したマウスにおいて明らかに高かった.したがって,インターロイキン22はC3の産生を促進することにより補体副経路に耐性をもつ細菌へのC3の結合活性を上昇させているらしいことがわかった.
このインターロイキン22の投与によるC3の産生の誘導は血清を1次元のSDSゲル電気泳動にかけてもわかるほど明確なものであり,既存のマイクロアレイデータベースにおいても確認された.しかし,インターロイキン22がほかのタンパク質の発現を誘導することによりC3の細菌への結合活性を上昇させている可能性もあった.そこで,HPLCを用いたイオンカラムクロマトグラフィーにより血漿を分画し,C3の含まれる画分以外の画分に含まれるタンパク質が好中球による殺菌を促進するかどうか調べた.この分画法ではC3は大多数のタンパク質とは違う挙動を示すためこのような解析が可能であったのであるが,その結果,C3の含まれる画分が好中球による殺菌作用の促進においてもっとも重要であり,インターロイキン22を投与したマウスからの血漿において殺菌作用の促進活性の増強が特異的に認められた.このC3の含まれる画分からコブラ毒素を用いてC3を除去すると殺菌作用の促進活性が認められなくなったことから,血中におけるC3の量の増加こそがインターロイキン22による殺菌作用の促進活性の増強において重要であることがわかった.C3を産生する臓器を同定することを目的に,インターロイキン22を投与したのちの臓器におけるC3の発現量を調べたところ,肝臓においてとくに高い発現が認められた.実際に,肝細胞株をインターロイキン22により処理すると,転写因子STAT3に依存してC3の発現が誘導されることがわかった.
腸管上皮に傷害が生じ病原様細菌が第1防衛線である腸の局所の免疫を突破した場合,腸の局所における炎症はインターロイキン22を産生したのち,血液をとおして補体系の中心的なタンパク質であるC3の産生の誘導という第2防衛線を張ることにより全身性の感染に備えていることが明らかになった(図1).この研究では,腸という局所から誘導される全身性の感染に対する防御機構の一端が明らかにされたが,常在性細菌は腸だけでなく,皮膚,口腔,膣にも多い.また,病原性細菌は呼吸器や泌尿器も感染の標的とするため,局所から全身へのシグナルを伝達するインターロイキン22のようなサイトカインは,ほかの臓器にもあるのかもしれない.今後の研究が待たれる.
腸内細菌におけるわずかな株の差が健康への差に結びつくことが明らかにされたが,同じ種の細菌は代謝プロフィールがたいへん類似していることから生態学的なニッチの競合などが予想される.同じ種の株のあいだの宿主の免疫抵抗の差から,ヒトは腸内細菌により個人のレベルにおいて疾患への異なる感受性をもつと考えられ,今後,C. difficileに感染した際の個人のレベルでの症状の差とC. difficileの株の差との関係の解析が重要である.予備的な解析から,この株ごとの健康への差や宿主応答の誘導性にかかわる因子の構造は非常に多様なものであることが示唆されており,16S rRNA遺伝子やメタゲノムだけといった従来の解析では腸内細菌による疾患感受性の研究という点では限界があることも示唆されている.今後,機能のレベルでの包括的な解析とより共役した腸内フローラのバイオインフォマティクスやゲノミクスがもとめられる.
略歴:山口大学医学部 在学中.
猪原 直弘(Naohiro Inohara)
米国Michigan大学Medical SchoolにてResearch Associate Professor.
長谷川 瑞穂(Mizuho Hasegawa)
米国Michigan大学Medical SchoolにてResearch Staff.
© 2014 矢田祥子・猪原直弘・長谷川瑞穂 Licensed under CC 表示 2.1 日本
(米国Michigan大学Medical School,Department of Pathology)
email:猪原直弘
DOI: 10.7875/first.author.2014.140
Interleukin-22 regulates the complement system to promote resistance against pathobionts after pathogen-induced intestinal damage.
Mizuho Hasegawa, Shoko Yada, Meng Zhen Liu, Nobuhiko Kamada, Raúl Muñoz-Planillo, Nhu Do, Gabriel Núñez, Naohiro Inohara
Immunity, 41, 620-632 (2014)
要 約
ヒトや動物の腸には多くの常在性の細菌が存在する.共生的な恩恵をあたえる細菌もあれば,ふだんは疾患を起こさないものの特定の条件において有害となる病原様の細菌も存在する.腸管上皮に傷害が生じると腸内細菌が組織に侵入することにより腸炎が起こり,ときには敗血症をひき起こす.とくに,腸内フローラに異常の生じた場合,特定の病原様細菌により疾患は重症化する.抗生物質の投与は細菌Clostridium difficileの異常な増殖の原因となり,その毒素により腸管上皮に傷害がひき起こされる.以前に,筆者らは,マウスモデルにおいて組織に侵入する腸内細菌がC. difficileに感染した際の重症度において重要であることを見い出した.今回は,腸の局所における免疫の主役であるインターロイキン22が,腸から全身へと移行する病原様細菌の除去においても重要であることを示した.インターロイキン22は局所の免疫をかいくぐった病原様細菌に対しても補体系の増強により全身性の自然免疫を強化することで,宿主の生体防御において重要な役割をはたすことが明らかにされた.
はじめに
ヒトの消化管には数千種類,約百兆個の細菌が棲息する1).常在性の細菌にはビタミンの生産や免疫バランスの制御などの共生的な恩恵をあたえる細菌もある一方で,ふだんは疾患を起こさないものの特定の条件のもとでは有害な病原様の細菌も存在する.日和見感染性の常在性細菌も病原様細菌の一種であり,腸管上皮に傷害が生じると組織への侵入により腸炎や,ときには敗血症をひき起こす.とくに,腸内フローラに異常をきたした場合,特定の病原様細菌により疾患は重症化する.Clostridium difficileはグラム陽性の偏性嫌気細菌であり,健常人の腸にもみつかるが,抗生物質の投与により腸内フローラが変化すると異常に増殖し,産生する毒素により腸管上皮を傷害する.このC. difficileへの感染は特有の組織像から偽膜性大腸炎とよばれるが,下痢や発熱などの軽いものから敗血症や多臓器不全のような重いものまで個人により重症度が異なり,その理由は謎とされてきた.以前に,筆者らは,Nod1やインフラマソームなど自然免疫系を欠損するマウスのモデルを用いて,腸において排除しきれなかった常在性細菌のほかの臓器への移行が疾患の重症化に寄与していることを見い出した2,3).すなわち,C. difficileの感染による疾患において自然免疫がどのように宿主の生体防御に寄与するかを調べていたところ,C. difficile自体よりもむしろ,常在性細菌の組織における存在の有無が宿主の生存率に重要であることを見い出した.このモデルにおける病態はC. difficileと炎症誘発性の常在性細菌との共同作業により説明することができる.C. difficileと腸内細菌科の細菌はいずれもNod1のリガンドを放出し,毒素により傷害をうけた上皮から侵入したNod1のリガンドがCXCLの誘導を介して傷害をうけた組織への好中球の浸潤の引き金となる.しかし,それ単独では炎症あるいは組織に侵入した細菌の除去には不十分であり,この浸潤した好中球がさらに,C. difficileの産生する毒素とともに腸内細菌科の細菌のもつリポ多糖などの成分により刺激されることにより炎症性サイトカインであるインターロイキン1βを分泌し,インターロイキン1βがさらに腸においてケモカインであるCXCLの発現を誘導することにより,好中球が好中球をよぶという正のフィードバック反応が起こる3).こうして集まった十分な量の好中球により組織に侵入した細菌は除去される.このしくみが破綻すると敗血症のリスクが高まる.さらに,腸管上皮に重度の傷害が起こった場合も,腸内細菌は炎症応答では完全には除去できず,全身性の感染症のリスクが高まる.われわれの体はこうした場合の防御の手立てをもたないのだろうか.今回,筆者らは,補体系に対し耐性をもつ特定の腸内細菌のみが全身性の障害を起こして予後に影響をあたえ,腸においてインターロイキン1βに依存的に産生されるインターロイキン22が肝臓などにおいて補体系の中心的なタンパク質であるC3の産生を増加させることにより,この補体系に対し耐性をもつ病原様細菌を除去することを明らかにした.
1.インターロイキン22はC. difficileの感染による腸管上皮の傷害ののちの腸内細菌の除去を介し重症度に影響する
C. difficileに感染した際のインターロイキン1βの分泌においてはNLRP3インフラマソームが必須の役割をはたしている3).さきに述べたように,インターロイキン1βはC. difficileに感染した際の炎症反応の誘導や宿主の生存に対し必須の役割をはたすため,インフラマソームの構成タンパク質であるASCのノックアウトマウスにおいてC. difficileに感染した際に腸において誘導されるサイトカインのプロファイリングを行っていたところ,インターロイキン1βのみならずインターロイキン22の誘導性も失われることを見い出した.C. difficileに感染した際のインターロイキン22の役割を調べるため,インターロイキン22ノックアウトマウスにC. difficileを感染させたところ,野生型のマウスはほとんど死亡しないにもかかわらず,インターロイキン22ノックアウトマウスには高い死亡率が認められた.C. difficileに感染した際のインターロイキン22の誘導性は成熟したT細胞およびB細胞を欠損するRAG1ノックアウトマウスにおいても失われることはなかったので,インターロイキン1βの産生は自然リンパ球から誘導されるものと思われ,実際に,C. difficileに感染した際のRAG1ノックアウトマウスの生存率は野生型マウスと同じであり,獲得免疫は関係しなかった.
インターロイキン22はRegIIIやαデフェンシンなどの抗菌タンパク質,腸内フローラに影響をあたえるFUT2の発現の誘導や,腸管上皮の傷害の防止,腸管上皮の修復の促進を介して腸内細菌の組織への侵入を防いでいることが報告されている4-6).しかし,インターロイキン22ノックアウトマウスがC. difficileに感染した際の腸管上皮の傷害の程度や腸内フローラは野生型マウスと同じであり,腸の上皮隔壁の消失による大きな分子の透過度もやはり同じであった.さらに,インターロイキン22の誘導性を失ったASCノックアウトマウスでも抗菌タンパク質の誘導性は変わらず,腸におけるC. difficileの数や常在性細菌の数もインターロイキン22ノックアウトマウスと野生型マウスとは同じであった.C. difficileが過剰に増殖して感染した場合,ネックとなるのはC. difficileから放出される毒素による腸管上皮の傷害であり,ほかの感染症とは異なり,腸管上皮から細菌を物理的あるいは化学的に隔絶してどうにかなるものではないのであろう.また,C. difficileに感染した際のインターロイキン22の産生の誘導はインフラマソームの活性化によるインターロイキン1βの分泌によるものだが,正常な常在性細菌の隔離に必要な定常量のインターロイキン22およびその下流のRegIIIの分泌はASCノックアウトマウスにおいても起こっていた.したがって,C. difficileに感染した際のインターロイキン22の役割は定常な状態での腸内環境の維持とは異なる可能性が示唆された.さらに,C. difficileの感染により傷害をうけたインターロイキン22ノックアウトマウスの腸管上皮について組織の解析やフローサイトメトリーによる解析を行ったが,患部の浮腫,好中球やマクロファージなどの炎症細胞の浸潤やそのもとになるケモカインの分泌に違いは認められなかった.
2.特定の病原様細菌の日和見感染がC. difficileに感染したのちの予後を決める
インターロイキン22ノックアウトマウスはなぜC. difficileに感染した際に死亡しやすいのだろうか.肝障害マーカーである血中におけるAST値およびALT値を調べたところ,インターロイキン22ノックアウトマウスには高い肝障害性が認められた.そこで,肝臓を調べたところ大量の腸内細菌が検出された.腸内細菌は肝臓だけでなく,肺,脾臓,間葉リンパ節,腎臓など,全身への感染が認められた.C. difficileの感染による腸の上皮隔壁の消失により腸内細菌の全身への感染がひき起こされているのだろうか.肝臓から得られた生細菌について次世代シークエンサーにより16S rRNA遺伝子を包括的に解析したところ,その大半は腸内細菌科の細菌や乳酸菌目の細菌であることがわかった.C. difficileの感染ののち,これらの細菌によく効くがC. difficileの生存および増殖には影響しない抗生物質であるシプロフロキサシンを投与したところ生存率は改善した.したがって,腸内細菌科の細菌や乳酸菌目の細菌が多臓器に感染を起こすことにより傷害を起こしている可能性が高まった.
そこで,C. difficileに感染したマウスの肝臓においてもっとも多く検出された細菌を単離して培養し,実際にこれらの細菌が宿主の傷害や死亡をひき起こすかどうか調べた.単離した細菌を静脈への注入により感染させたところ,腸内細菌科に属するEnterobacter属細菌,Klebsiella属細菌,Escherichia属細菌は致死性を示したのに対し,乳酸菌目に属するEnterococcus属細菌,Lactobacillus属細菌は致死性を示さなかった.驚いたことにC. difficileに感染したマウスの肝臓から単離した腸内細菌科の細菌は,腸腔からランダムに単離した細菌とたとえ生物学的に同じ種であっても,より強い致死性を示した.さらに,腸腔から単離した細菌と比較し,C. difficileに感染したマウスの肝臓からの単離した同じ種の細菌はマウスに感染させたとき体内における生存率が高かった.同じ種であれば株が違ってもin vitroにおける細胞毒性や炎症性サイトカインの産生の誘導性は変わらなかったことから,マウスの体内における生存率,すなわち,宿主の生体防御応答に対する抵抗性についての株のあいだでの違いが宿主の致死性において重要であり,C. difficileに感染した際の致死性の決定因子になっていると考えられた.
同じ種の細菌であるにもかかわらず,なぜ,宿主の生体防御応答に対する抵抗性が異なるのだろうか.抵抗性をもつ細菌および感受性の細菌に生体防御の要であるマクロファージあるいは好中球をくわえたところ,抵抗性をもつ細菌は貪食に対し耐性であり,その結果,貪食細胞による殺菌に強いことがわかった.貪食においては補体系によるオプソニン化が重要である.実際に,補体系の中心的なタンパク質であるC3のノックアウトマウスから得た血清は感受性の細菌の貪食を起こさなかった.しかし,獲得免疫におけるオプソニン化の主役である免疫グロブリンを欠くRAG1ノックアウトマウスの血清は,野生型マウスの血清と同じ程度の貪食の促進活性やC3の細菌への結合活性を示したため,自然免疫系の補体の活性化の差がこの同じ種の株のあいだの補体への耐性の違いにおいて重要であることがわかった.さらなる解析から,C. difficileに感染したマウスの肝臓から単離した細菌において,宿主における免疫抵抗性に重要なのは補体副経路への抵抗性であることがわかった.
3.インターロイキン22はC3の産生を誘導することにより病原様細菌の排除を促進する
補体副経路に耐性をもつ腸内細菌科の細菌が致死性において重要なのであれば,インターロイキン22による宿主の防御は腸内細菌科の細菌の排除が鍵となるはずである.そこで,腹腔への注射によりインターロイキン22ノックアウトマウスにインターロイキン22を投与したのち,補体副経路に耐性をもつ腸内細菌科の細菌を感染させたところ,生存は劇的に改善された.血中の細菌の数を調べてみると,インターロイキン22を投与したマウスでは補体副経路に耐性をもつ腸内細菌科の細菌の排除が促進されていた.さらに,C. difficileに感染した際にインターロイキン22を投与したところ,生存が改善するとともに腸内細菌の全身性の感染が抑制された.これらのことから,インターロイキン22は補体副経路に耐性をもつ腸内細菌科の細菌の排除を促進することにより,C. difficileの感染による上皮障壁の消失によって組織に侵入した細菌を全身のレベルで排除し予後を改善することがわかった.
インターロイキン22はどうやって補体副経路に耐性をもつ腸内細菌科の細菌の排除を促進するのだろうか.インターロイキン22を投与したマウスの血清を用いると,補体副経路に耐性をもつ腸内細菌科の細菌であっても,対照となる未処理のマウスの血清に比べ,マクロファージや好中球による貪食の促進能の高いことが見い出された.さらに,インターロイキン22を投与したマウスの血清ではC3の細菌への結合活性が明らかに高かった.したがって,インターロイキン22による処理はC3の細菌への結合量を増加させることにより,宿主の免疫に抵抗性の腸内細菌科の細菌の排除を促進していたのである.
つぎなる疑問は,インターロイキン22による処理がどのようにして補体副経路に耐性をもつ腸内細菌科の細菌へのC3の結合量を増加させるのかであった.細菌と血清をin vitroでインキュベーションし補体副経路に耐性をもつ細菌と感受性の細菌とでC3の結合量を比較したところ,さきに述べたように,C3の結合量は感受性の細菌において高かったが,C3の活性化の程度には差は認められなかった.くわえて,血中におけるC3の総量はインターロイキン22を投与したマウスにおいて明らかに高かった.したがって,インターロイキン22はC3の産生を促進することにより補体副経路に耐性をもつ細菌へのC3の結合活性を上昇させているらしいことがわかった.
このインターロイキン22の投与によるC3の産生の誘導は血清を1次元のSDSゲル電気泳動にかけてもわかるほど明確なものであり,既存のマイクロアレイデータベースにおいても確認された.しかし,インターロイキン22がほかのタンパク質の発現を誘導することによりC3の細菌への結合活性を上昇させている可能性もあった.そこで,HPLCを用いたイオンカラムクロマトグラフィーにより血漿を分画し,C3の含まれる画分以外の画分に含まれるタンパク質が好中球による殺菌を促進するかどうか調べた.この分画法ではC3は大多数のタンパク質とは違う挙動を示すためこのような解析が可能であったのであるが,その結果,C3の含まれる画分が好中球による殺菌作用の促進においてもっとも重要であり,インターロイキン22を投与したマウスからの血漿において殺菌作用の促進活性の増強が特異的に認められた.このC3の含まれる画分からコブラ毒素を用いてC3を除去すると殺菌作用の促進活性が認められなくなったことから,血中におけるC3の量の増加こそがインターロイキン22による殺菌作用の促進活性の増強において重要であることがわかった.C3を産生する臓器を同定することを目的に,インターロイキン22を投与したのちの臓器におけるC3の発現量を調べたところ,肝臓においてとくに高い発現が認められた.実際に,肝細胞株をインターロイキン22により処理すると,転写因子STAT3に依存してC3の発現が誘導されることがわかった.
おわりに
腸管上皮に傷害が生じ病原様細菌が第1防衛線である腸の局所の免疫を突破した場合,腸の局所における炎症はインターロイキン22を産生したのち,血液をとおして補体系の中心的なタンパク質であるC3の産生の誘導という第2防衛線を張ることにより全身性の感染に備えていることが明らかになった(図1).この研究では,腸という局所から誘導される全身性の感染に対する防御機構の一端が明らかにされたが,常在性細菌は腸だけでなく,皮膚,口腔,膣にも多い.また,病原性細菌は呼吸器や泌尿器も感染の標的とするため,局所から全身へのシグナルを伝達するインターロイキン22のようなサイトカインは,ほかの臓器にもあるのかもしれない.今後の研究が待たれる.
腸内細菌におけるわずかな株の差が健康への差に結びつくことが明らかにされたが,同じ種の細菌は代謝プロフィールがたいへん類似していることから生態学的なニッチの競合などが予想される.同じ種の株のあいだの宿主の免疫抵抗の差から,ヒトは腸内細菌により個人のレベルにおいて疾患への異なる感受性をもつと考えられ,今後,C. difficileに感染した際の個人のレベルでの症状の差とC. difficileの株の差との関係の解析が重要である.予備的な解析から,この株ごとの健康への差や宿主応答の誘導性にかかわる因子の構造は非常に多様なものであることが示唆されており,16S rRNA遺伝子やメタゲノムだけといった従来の解析では腸内細菌による疾患感受性の研究という点では限界があることも示唆されている.今後,機能のレベルでの包括的な解析とより共役した腸内フローラのバイオインフォマティクスやゲノミクスがもとめられる.
文 献
- Kamada, N., Chen, G. Y., Inohara, N. et al.: Control of pathogens and pathobionts by the gut microbiota. Nat. Immunol., 14, 685-690 (2013)[PubMed]
- Hasegawa, M., Yamazaki, T., Kamada, N. et al.: Nucleotide-binding oligomerization domain 1 mediates recognition of Clostridium difficile and induces neutrophil recruitment and protection against the pathogen. J. Immunol., 186, 4872-4880 (2011)[PubMed]
- Hasegawa, M., Kamada, N., Jiao, Y. et al.: Protective role of commensals against Clostridium difficile infection via an IL-1β-mediated positive-feedback loop. J. Immunol., 189, 3085-3091 (2012)[PubMed]
- Brandl, K., Plitas, G., Schnabl, B. et al.: MyD88-mediated signals induce the bactericidal lectin RegIIIγ and protect mice against intestinal Listeria monocytogenes infection. J. Exp. Med., 204, 1891-1900 (2007)[PubMed]
- Wolk, K., Sabat, R., Iwakura, Y. et al.: Protective immunity to systemic infection with attenuated Salmonella enterica serovar enteritidis in the absence of IL-12 is associated with IL-23-dependent IL-22, but not IL-17. J. Immunol., 181, 7891-7901 (2008)[PubMed]
- Pickard, J. M., Maurice, C. F., Kinnebrew, M. A. et al.: Rapid fucosylation of intestinal epithelium sustains host-commensal symbiosis in sickness. Nature, 514, 638-641 (2014)[PubMed]
著者プロフィール
略歴:山口大学医学部 在学中.
猪原 直弘(Naohiro Inohara)
米国Michigan大学Medical SchoolにてResearch Associate Professor.
長谷川 瑞穂(Mizuho Hasegawa)
米国Michigan大学Medical SchoolにてResearch Staff.
© 2014 矢田祥子・猪原直弘・長谷川瑞穂 Licensed under CC 表示 2.1 日本