シロイヌナズナは組織特異的な概日時計をもつ
遠藤 求
(京都大学大学院生命科学研究科 統合生命科学専攻分子代謝制御学分野)
email:遠藤 求
DOI: 10.7875/first.author.2014.135
Tissue-specific clocks in Arabidopsis show asymmetric coupling.
Motomu Endo, Hanako Shimizu, Maria A. Nohales, Takashi Araki, Steve A. Kay
Nature, 515, 419-422 (2014)
これまで,植物における概日時計の機能は細胞自律的であると考えられていたため,多くの解析は個体レベルあるいは器官レベルで行われ,組織レベルあるいは細胞レベルでの解析はほとんどなされていなかった.筆者らは,概日時計の役割を組織レベルにて明らかにするため,新たに,迅速な組織の単離法,および,組織特異的なレポーターアッセイ法を開発した.こうした方法を用いてシロイヌナズナの子葉の葉肉および維管束における概日リズムを詳細に解析したところ,葉肉と維管束の概日時計の系は大きく異なっていること,維管束から葉肉といった階層性をもつ制御が存在すること,維管束の概日時計は非常に頑健であること,維管束の概日時計はおもに花成の光周性を制御していること,などが明らかになった.こうした結果は,個体レベルでの解析ではかくされていた微小な組織における概日時計の重要性を示唆しており,今後,組織レベルでの解析がますます重要になると予想される.
概日時計は地球の自転による約24時間の明暗周期や季節の変化に対応するための機構であり,多くの遺伝子の発現制御にかかわっている.これまでに,筆者らは,シロイヌナズナにおいて日長刺激の受容体が葉の維管束にて機能し花成を制御していることを明らかにしてきた1).また,概日時計の支配のもとにある花成の光周性の実行遺伝子の発現は葉の維管束に限定されている2,3).こうしたことは,外的符合モデルにおいて日長刺激と概日時計の両方のシグナルの統合が葉の維管束において行われており,概日時計の機能が組織ごとに異なる可能性を示唆するものであった.そこで,概日時計の機能の組織特異性を考慮にいれることにより,これまでのモデルより直感的に理解しやすく正確な概日時計のモデルを構築できるのではないかと考えた.
これまで,植物の概日時計は細胞自律的であると漠然と考えられてきており,組織特異的な概日時計の機能についてはほとんど考えられていられなかった.しかし,花成などの実現には個々の細胞のもつ概日リズムを個体レベルにて統合する必要のあること,ヒト,マウス,ショウジョウバエなどでは脳にある強大な概日時計の中枢(主要時計)と末梢の臓器にある弱い概日時計(末梢時計)というかたちで概日時計の機能の組織特異性が知られていること4),植物においても動物と同様に器官のあいだで概日リズムのシグナルをやりとりしている可能性のあること5),あるタンパク質の発現パターンとそのタンパク質の機能が必要な器官あるいは組織とは必ずしも一致せず,筆者らが明らかにした例も含め,こうした例は決してめずしいものではないこと1),などから,植物においても概日時計の機能に器官特異性あるいは組織特異性の存在することが強く予想された.
動物の主要時計は外科的な手術により中枢を切除し移植するといった実験により発見された6).しかし,植物は脳に対応する明確な中枢をもたず,特定の組織を外科的な方法により取り除くことが困難である.また,周囲の影響から切り離された培養細胞系などでは組織間あるいは細胞間の相互作用は失われ,生命現象を生体におけるコンテクストにおいて解析することは困難である.こうした問題を解決するためには生体における分子動態を高い時間分解能および空間分解能により測定することが必要であり,このことにより植物における概日時計の組織特異性の解析は大幅に進むと考えられた.
これまでも,組織ごとに遺伝子の発現を測定するための方法はいくつか報告があり,代表的なものとして,レーザーを用いた顕微解剖法や,蛍光セルソーターなどを用いた組織あるいは細胞の直接的な単離法が知られていた7,8).しかし,こうした方法による組織あるいは細胞の単離は煩雑であり時間がかかるため,時々刻々と変化する時計遺伝子の発現のリズムを正確には測定できず,また,測定点を増やすことが困難という問題があった.
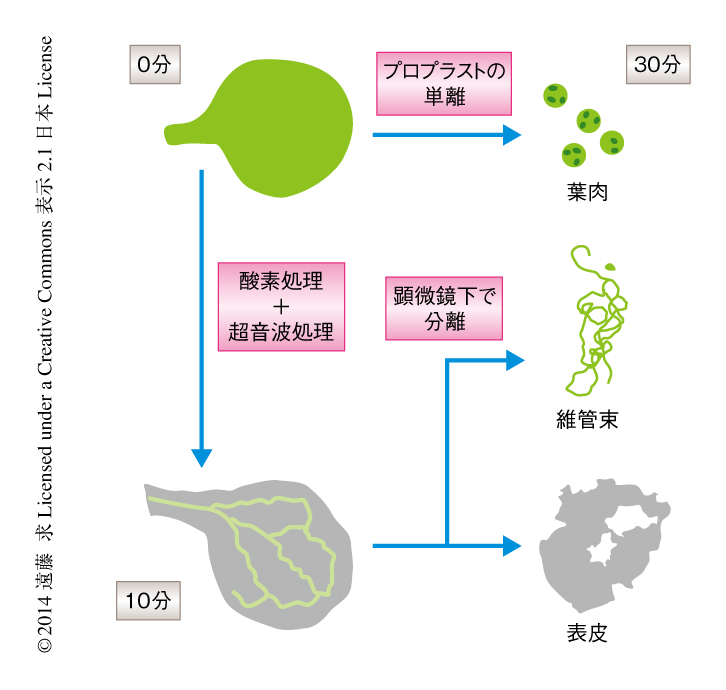
そこで,セルラーゼなどによる酵素処理と超音波処理とを併用することにより,葉を構成するすべての組織を30分以内に高純度で単離する方法を新たに開発した(図1).この方法により単離した組織は,葉肉および表皮については純度80%以上,維管束については純度90%以上であり,時間分解能だけでなく空間分解能にもすぐれていた.単離した組織を用いて葉におけるおのおのの組織の寄与率を計算したところ,RNAの約80%は葉肉に由来することが明らかになり,これまで,葉の全体を用いてきた概日リズムの解析はおもに葉肉における挙動を扱っていて,維管束における概日リズムについては平均化によりかくされていたことが示された.
維管束における概日時計の役割をより詳細に明らかにするため,葉の全体,単離した葉肉,単離した維管束を用いてマイクロアレイ解析を行った.発現の振動しているすべての遺伝子のうち,維管束において高い発現をもつ遺伝子は葉の全体また葉肉において発現が低く,逆に,維管束において発現の低かった遺伝子は葉の全体また葉肉において高く発現していた.さらに,発現の振動している遺伝子の発現の位相や制御されている遺伝子の構成なども,維管束と葉肉(および,葉の全体)とでは大きく異なっていた.さらに,個々の時計遺伝子に着目すると,朝に発現する遺伝子は葉肉において,また,夕方に発現する遺伝子は維管束において,それぞれ発現が高く,維管束と葉肉では概日時計の系がまったく異なる可能性が考えられた.
このことを確かめるため,葉の全体および維管束における時計遺伝子の発現をリアルタイムPCR法により測定したところ,連続明条件では葉の全体における時計遺伝子の発現のリズムは徐々に弱まり1週間後にはほとんど振幅がみられなくなった一方,維管束における時計遺伝子の発現は1週間後でも明確な振動が観察された.こうしたことから,維管束の概日時計は葉肉とは異なる特性をもつことが示唆された.
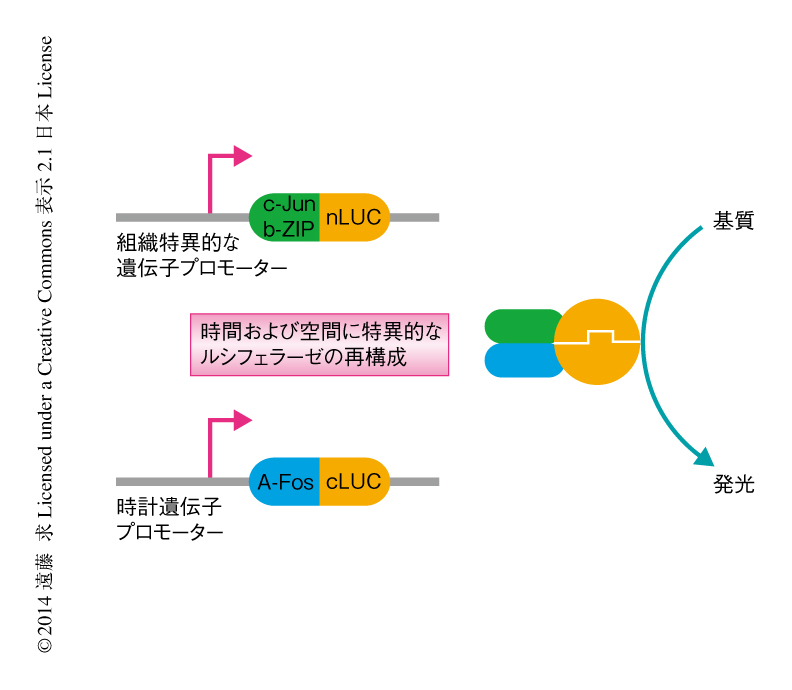
マイクロアレイによる結果をさらに確かめるため,マイクロアレイとはまったく異なる原理による遺伝子発現の解析法として,ルシフェラーゼを用いたレポーターアッセイを行うことにした.しかし,従来の単純な方法では,すべての組織において発現しているような時計遺伝子について,特定の組織(とくに,維管束系のような深部の組織)に由来する発現のリズムのみを測定することは困難であった.そこで,特定の組織における遺伝子プロモーターの活性を正確に測定するための方法として,分割したルシフェラーゼおよび特異的なヘテロ二量体の形成を利用したTSLA(tissue-specific luciferase assay)法を新たに開発した(図2).この方法では,N末端側とC末端側に分割したルシフェラーゼに対し,それぞれ,特異的に二量体化するドメインとしてJunおよびFos 9) を融合させたものを,それぞれ,組織特異的な遺伝子プロモーターおよび時計遺伝子プロモーターにより発現させることで,両者の発現が重なる時間および空間においてのみルシフェラーゼが再構成され,組織特異的および時間特異的な発現のリズムが検出される.
この方法を用いて,維管束および葉の全体において時計遺伝子であるTOC1遺伝子の発現のリズムを測定したところ,維管束におけるTOC1遺伝子の発現の位相は葉の全体とはまったく異なっており,維管束と葉肉では異なる概日時計の系の存在する可能性がさらに支持された.
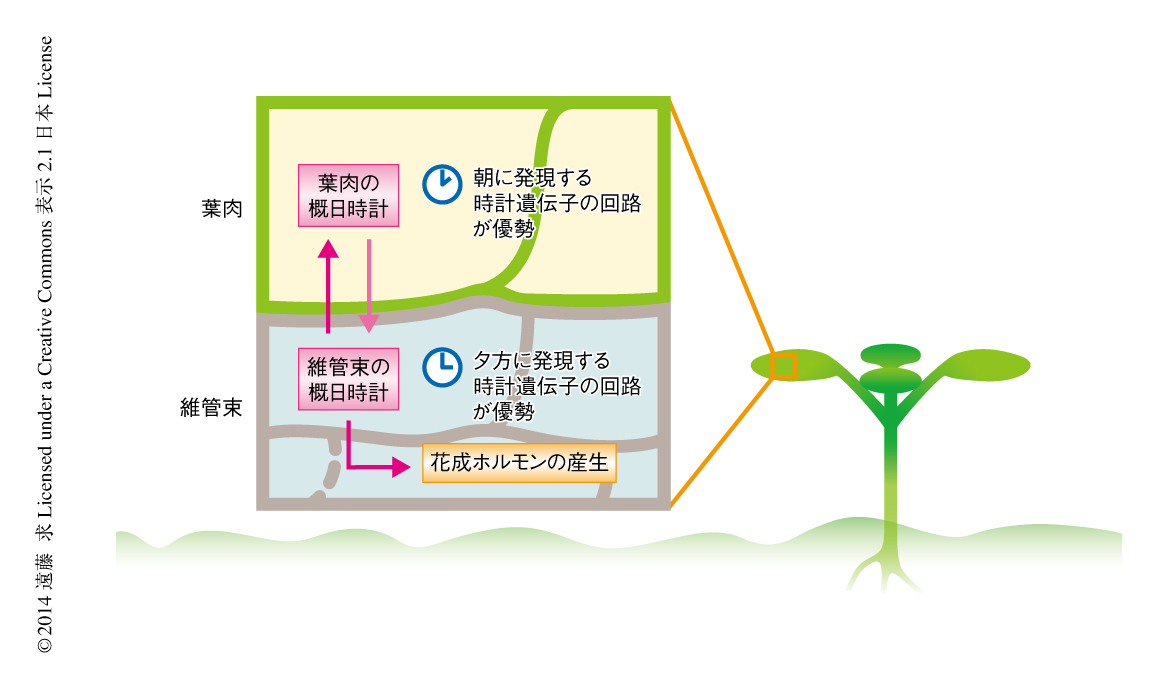
こうした結果から,組織特異的な概日時計の機能の存在は示されたが,そうした組織特異的な概日時計が生体においてどのような役割を担っているかについてはまったく不明であった.そこで,シロイヌナズナにおいて概日時計の構成タンパク質を過剰に発現させることにより概日リズムは完全に失われるという報告に着目し10),組織特異的な遺伝子プロモーターを用いて時計遺伝子を過剰に発現させることにより組織特異的に概日時計の機能を阻害した系統を作出した.葉肉において特異的に概日時計の機能を阻害した系統,および,維管束において特異的に概日時計の機能を阻害した系統を用いて,おのおのの組織における時計遺伝子TOC1遺伝子の発現のリズムを測定したところ,葉肉において概日時計を阻害した系統では葉肉および葉の全体において概日リズムが失われていた一方,維管束における概日リズムは影響をうけていなかった.ところが,維管束において概日時計を阻害した系統では維管束における概日リズムだけでなく葉肉あるいは葉の全体における概日リズムも失われていたことから,維管束の概日時計による葉肉の概日時計の制御が明らかになった.さらに,維管束の概日時計は葉肉だけでなく,花成ホルモンの産生をつうじ花成の光周性という個体レベルでの生理応答にも影響していることが明らかになった.
この研究により,概日時計の研究だけでなく,花成や細胞の伸長など概日時計により制御される生理応答の解析も組織レベルで行う必要のあることが明らかになった(図3).この研究において開発された手法を用いることにより,こうした組織レベルでの解析が大きく進むことが期待される.また,維管束における概日時計の機能を阻害するだけで花の咲くタイミングを遅らせることができたことから,植物の成長を制御する方法の開発において,維管束の概日時計が新たな標的となる可能性が期待される.
略歴:2007年 京都大学大学院理学研究科 修了,同年 同 ポスドク,2008年 米国California大学San Diego校 ポスドクを経て,2009年より京都大学大学院生命科学研究科 助教.2011年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:植物における環境応答の組織特異性.
関心事:基礎で得た知見を,いかに応用にまでもっていくか.
© 2014 遠藤 求 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 統合生命科学専攻分子代謝制御学分野)
email:遠藤 求
DOI: 10.7875/first.author.2014.135
Tissue-specific clocks in Arabidopsis show asymmetric coupling.
Motomu Endo, Hanako Shimizu, Maria A. Nohales, Takashi Araki, Steve A. Kay
Nature, 515, 419-422 (2014)
要 約
これまで,植物における概日時計の機能は細胞自律的であると考えられていたため,多くの解析は個体レベルあるいは器官レベルで行われ,組織レベルあるいは細胞レベルでの解析はほとんどなされていなかった.筆者らは,概日時計の役割を組織レベルにて明らかにするため,新たに,迅速な組織の単離法,および,組織特異的なレポーターアッセイ法を開発した.こうした方法を用いてシロイヌナズナの子葉の葉肉および維管束における概日リズムを詳細に解析したところ,葉肉と維管束の概日時計の系は大きく異なっていること,維管束から葉肉といった階層性をもつ制御が存在すること,維管束の概日時計は非常に頑健であること,維管束の概日時計はおもに花成の光周性を制御していること,などが明らかになった.こうした結果は,個体レベルでの解析ではかくされていた微小な組織における概日時計の重要性を示唆しており,今後,組織レベルでの解析がますます重要になると予想される.
はじめに
概日時計は地球の自転による約24時間の明暗周期や季節の変化に対応するための機構であり,多くの遺伝子の発現制御にかかわっている.これまでに,筆者らは,シロイヌナズナにおいて日長刺激の受容体が葉の維管束にて機能し花成を制御していることを明らかにしてきた1).また,概日時計の支配のもとにある花成の光周性の実行遺伝子の発現は葉の維管束に限定されている2,3).こうしたことは,外的符合モデルにおいて日長刺激と概日時計の両方のシグナルの統合が葉の維管束において行われており,概日時計の機能が組織ごとに異なる可能性を示唆するものであった.そこで,概日時計の機能の組織特異性を考慮にいれることにより,これまでのモデルより直感的に理解しやすく正確な概日時計のモデルを構築できるのではないかと考えた.
これまで,植物の概日時計は細胞自律的であると漠然と考えられてきており,組織特異的な概日時計の機能についてはほとんど考えられていられなかった.しかし,花成などの実現には個々の細胞のもつ概日リズムを個体レベルにて統合する必要のあること,ヒト,マウス,ショウジョウバエなどでは脳にある強大な概日時計の中枢(主要時計)と末梢の臓器にある弱い概日時計(末梢時計)というかたちで概日時計の機能の組織特異性が知られていること4),植物においても動物と同様に器官のあいだで概日リズムのシグナルをやりとりしている可能性のあること5),あるタンパク質の発現パターンとそのタンパク質の機能が必要な器官あるいは組織とは必ずしも一致せず,筆者らが明らかにした例も含め,こうした例は決してめずしいものではないこと1),などから,植物においても概日時計の機能に器官特異性あるいは組織特異性の存在することが強く予想された.
動物の主要時計は外科的な手術により中枢を切除し移植するといった実験により発見された6).しかし,植物は脳に対応する明確な中枢をもたず,特定の組織を外科的な方法により取り除くことが困難である.また,周囲の影響から切り離された培養細胞系などでは組織間あるいは細胞間の相互作用は失われ,生命現象を生体におけるコンテクストにおいて解析することは困難である.こうした問題を解決するためには生体における分子動態を高い時間分解能および空間分解能により測定することが必要であり,このことにより植物における概日時計の組織特異性の解析は大幅に進むと考えられた.
1.概日リズムの研究のための新しい組織の単離法の開発
これまでも,組織ごとに遺伝子の発現を測定するための方法はいくつか報告があり,代表的なものとして,レーザーを用いた顕微解剖法や,蛍光セルソーターなどを用いた組織あるいは細胞の直接的な単離法が知られていた7,8).しかし,こうした方法による組織あるいは細胞の単離は煩雑であり時間がかかるため,時々刻々と変化する時計遺伝子の発現のリズムを正確には測定できず,また,測定点を増やすことが困難という問題があった.
そこで,セルラーゼなどによる酵素処理と超音波処理とを併用することにより,葉を構成するすべての組織を30分以内に高純度で単離する方法を新たに開発した(図1).この方法により単離した組織は,葉肉および表皮については純度80%以上,維管束については純度90%以上であり,時間分解能だけでなく空間分解能にもすぐれていた.単離した組織を用いて葉におけるおのおのの組織の寄与率を計算したところ,RNAの約80%は葉肉に由来することが明らかになり,これまで,葉の全体を用いてきた概日リズムの解析はおもに葉肉における挙動を扱っていて,維管束における概日リズムについては平均化によりかくされていたことが示された.
維管束における概日時計の役割をより詳細に明らかにするため,葉の全体,単離した葉肉,単離した維管束を用いてマイクロアレイ解析を行った.発現の振動しているすべての遺伝子のうち,維管束において高い発現をもつ遺伝子は葉の全体また葉肉において発現が低く,逆に,維管束において発現の低かった遺伝子は葉の全体また葉肉において高く発現していた.さらに,発現の振動している遺伝子の発現の位相や制御されている遺伝子の構成なども,維管束と葉肉(および,葉の全体)とでは大きく異なっていた.さらに,個々の時計遺伝子に着目すると,朝に発現する遺伝子は葉肉において,また,夕方に発現する遺伝子は維管束において,それぞれ発現が高く,維管束と葉肉では概日時計の系がまったく異なる可能性が考えられた.
このことを確かめるため,葉の全体および維管束における時計遺伝子の発現をリアルタイムPCR法により測定したところ,連続明条件では葉の全体における時計遺伝子の発現のリズムは徐々に弱まり1週間後にはほとんど振幅がみられなくなった一方,維管束における時計遺伝子の発現は1週間後でも明確な振動が観察された.こうしたことから,維管束の概日時計は葉肉とは異なる特性をもつことが示唆された.
2.概日リズムの研究のための新しいレポーターアッセイ法の開発
マイクロアレイによる結果をさらに確かめるため,マイクロアレイとはまったく異なる原理による遺伝子発現の解析法として,ルシフェラーゼを用いたレポーターアッセイを行うことにした.しかし,従来の単純な方法では,すべての組織において発現しているような時計遺伝子について,特定の組織(とくに,維管束系のような深部の組織)に由来する発現のリズムのみを測定することは困難であった.そこで,特定の組織における遺伝子プロモーターの活性を正確に測定するための方法として,分割したルシフェラーゼおよび特異的なヘテロ二量体の形成を利用したTSLA(tissue-specific luciferase assay)法を新たに開発した(図2).この方法では,N末端側とC末端側に分割したルシフェラーゼに対し,それぞれ,特異的に二量体化するドメインとしてJunおよびFos 9) を融合させたものを,それぞれ,組織特異的な遺伝子プロモーターおよび時計遺伝子プロモーターにより発現させることで,両者の発現が重なる時間および空間においてのみルシフェラーゼが再構成され,組織特異的および時間特異的な発現のリズムが検出される.
この方法を用いて,維管束および葉の全体において時計遺伝子であるTOC1遺伝子の発現のリズムを測定したところ,維管束におけるTOC1遺伝子の発現の位相は葉の全体とはまったく異なっており,維管束と葉肉では異なる概日時計の系の存在する可能性がさらに支持された.
3.特定の組織において概日時計のはたらきを阻害した系統の作出
こうした結果から,組織特異的な概日時計の機能の存在は示されたが,そうした組織特異的な概日時計が生体においてどのような役割を担っているかについてはまったく不明であった.そこで,シロイヌナズナにおいて概日時計の構成タンパク質を過剰に発現させることにより概日リズムは完全に失われるという報告に着目し10),組織特異的な遺伝子プロモーターを用いて時計遺伝子を過剰に発現させることにより組織特異的に概日時計の機能を阻害した系統を作出した.葉肉において特異的に概日時計の機能を阻害した系統,および,維管束において特異的に概日時計の機能を阻害した系統を用いて,おのおのの組織における時計遺伝子TOC1遺伝子の発現のリズムを測定したところ,葉肉において概日時計を阻害した系統では葉肉および葉の全体において概日リズムが失われていた一方,維管束における概日リズムは影響をうけていなかった.ところが,維管束において概日時計を阻害した系統では維管束における概日リズムだけでなく葉肉あるいは葉の全体における概日リズムも失われていたことから,維管束の概日時計による葉肉の概日時計の制御が明らかになった.さらに,維管束の概日時計は葉肉だけでなく,花成ホルモンの産生をつうじ花成の光周性という個体レベルでの生理応答にも影響していることが明らかになった.
おわりに
この研究により,概日時計の研究だけでなく,花成や細胞の伸長など概日時計により制御される生理応答の解析も組織レベルで行う必要のあることが明らかになった(図3).この研究において開発された手法を用いることにより,こうした組織レベルでの解析が大きく進むことが期待される.また,維管束における概日時計の機能を阻害するだけで花の咲くタイミングを遅らせることができたことから,植物の成長を制御する方法の開発において,維管束の概日時計が新たな標的となる可能性が期待される.
文 献
- Endo, M., Mochizuki, N., Suzuki, T. et al.: CRYPTOCHROME2 in vascular bundles regulates flowering in Arabidopsis. Plant Cell, 19, 84-93 (2007)[PubMed]
- Takada, S. & Goto, K.: TERMINAL FLOWER2, an Arabidopsis homolog of HETEROCHROMATIN PROTEIN1, counteracts the activation of FLOWERING LOCUS T by CONSTANS in the vascular tissues of leaves to regulate flowering time. Plant Cell, 15, 2856-2865 (2003)[PubMed]
- An, H., Roussot, C., Suarez-Lopez, P. et al.: CONSTANS acts in the phloem to regulate a systemic signal that induces photoperiodic flowering of Arabidopsis. Development, 131, 3615-3626 (2004)[PubMed]
- Reppert, S. M. & Weaver, D. R.: Coordination of circadian timing in mammals. Nature, 418, 935-941 (2002)[PubMed]
- James, A. B., Monreal, J. A., Nimmo, G. A. et al.: The circadian clock in Arabidopsis roots is a simplified slave version of the clock in shoots. Science, 322, 1832-1835 (2008)[PubMed]
- Moore, R. Y. & Eichler, V. B.: Loss of circadian adrenal corticosterone rhythm following suprachiasmatic nucleus lesions in the rat. Brain Res., 42, 201-206 (1972)[PubMed]
- Casson, S., Spencer, M., Walker, K. et al.: Laser capture microdissection for the analysis of gene expression during embryogenesis of Arabidopsis. Plant J., 42, 111-123 (2005)[PubMed]
- Ivashikina, N., Deeken, R., Ache, P. et al.: Isolation of AtSUC2 promoter-GFP-marked companion cells for patch-clamp studies and expression profiling. Plant J., 36, 931-945 (2003)[PubMed]
- Olive, M., Krylov, D., Echlin, D. R. et al.: A dominant negative to Activation Protein-1 (AP1) that abolishes DNA binding and inhibits oncogenesis. J. Biol. Chem., 272, 18586-18594 (1997)[PubMed]
- Wang, Z. Y. & Tobin, E. M.: Constitutive expression of the CIRCADIAN CLOCK ASSOCIATED 1 (CCA1) gene disrupts circadian rhythms and suppresses its own expression. Cell, 93, 1207-1217 (1998)[PubMed]
著者プロフィール
略歴:2007年 京都大学大学院理学研究科 修了,同年 同 ポスドク,2008年 米国California大学San Diego校 ポスドクを経て,2009年より京都大学大学院生命科学研究科 助教.2011年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:植物における環境応答の組織特異性.
関心事:基礎で得た知見を,いかに応用にまでもっていくか.
© 2014 遠藤 求 Licensed under CC 表示 2.1 日本