紡錘体チェックポイント複合体は2分子のCdc20に作用して活性化型APC/Cを阻害する
伊澤 大介
(英国Cambridge大学Cancer Research UK Gurdon Institute)
email:伊澤大介
DOI: 10.7875/first.author.2014.139
The mitotic checkpoint complex binds a second CDC20 to inhibit active APC/C.
Daisuke Izawa, Jonathon Pines
Nature, 517, 631-634 (2015)
細胞分裂は均等な染色体分配をへて遺伝的に同一の情報をもつ2つの娘細胞をつくりだす過程である.分裂期の細胞における均等な染色体分配を保障するために必須な監視機構が紡錘体チェックポイントである.紡錘体チェックポイントは紡錘体に接着していない動原体において活性化し,細胞の全体に拡散する染色体分配に対する遅延シグナルが発せられる.接着していない動原体ひとつでほかのすべての染色体分配を遅延するのに十分なほど強力なシグナルであるが,その分子レベルでの本質的な理解にはいたっていない.これまでの知見から,紡錘体チェックポイントは染色体分配に必須なユビキンチンリガーゼAPC/Cの活性化タンパク質であるCdc20にはたらきかけMad2およびBubR1を含む紡錘体チェックポイント複合体に取り込むことによりAPC/Cの活性化をふせぐことが知られている.この研究においては,紡錘体チェックポイント複合体はCdc20を取り込むだけでなく,もう1分子のCdc20とも結合し,さらに,Cdc20の結合した活性化型APC/Cも阻害できることを発見した.この紡錘体チェックポイント複合体とCdc20との結合は紡錘体チェックポイントの活性に必要不可欠であることも示された.さらに,紡錘体チェックポイント複合体は染色体分配に対する遅延シグナルを消去した状況においても活性化型APC/Cを阻害したことから,紡錘体チェックポイント複合体それ自体が拡散性の染色体分配に対する遅延シグナルの正体である可能性が強く示唆された.
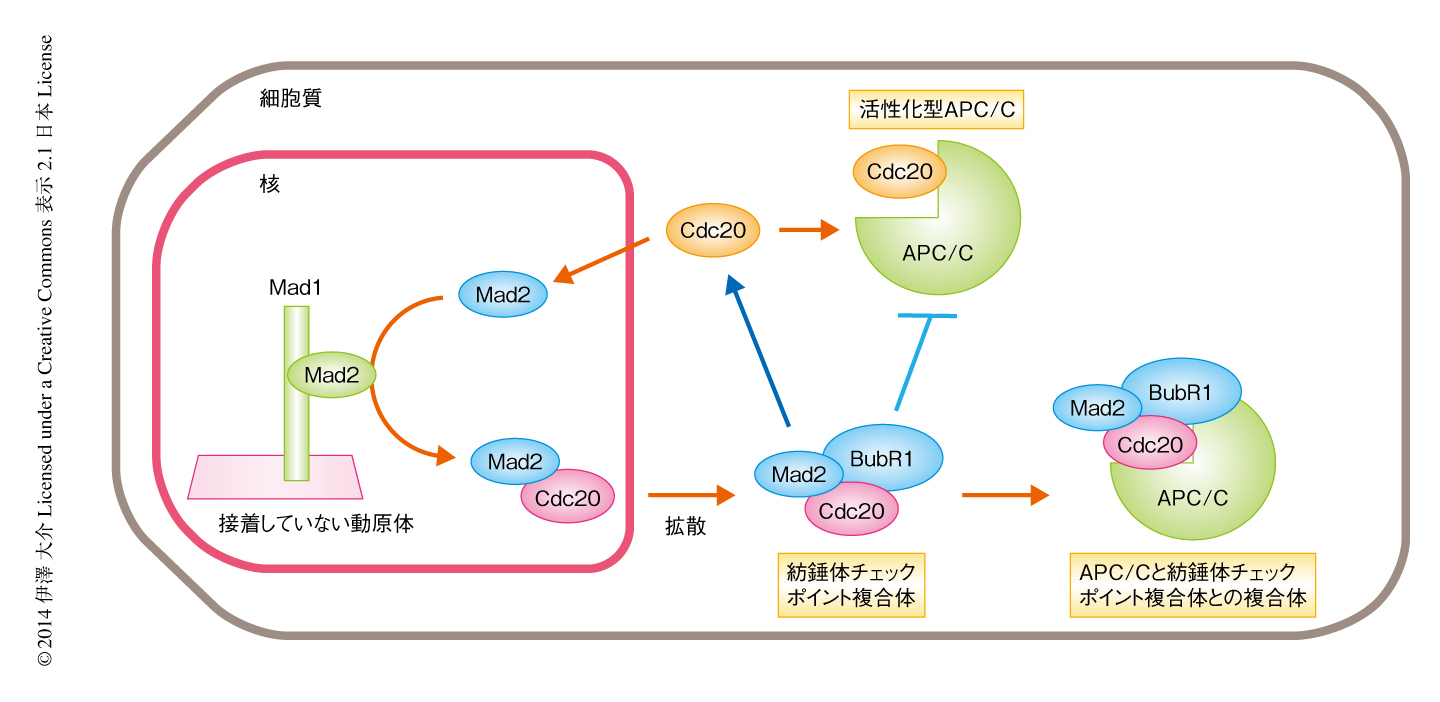
細胞分裂における均等な染色体分配に必須な過程は,分裂中期におけるすべての姉妹染色体が両極から紡錘体と結合し赤道面に配列したのちのAPC/C(anaphase promoting complex/cyclosome)の活性化,および,分裂後期における染色体分配の誘導である(図1).APC/Cはユビキチンリガーゼ複合体であり,ポリユビキチンの修飾を介して分裂後期の誘導に阻害的にはたらくセキュリンやサイクリンBなどさまざまなタンパク質の分解を促進する.分裂前中期においてすべての姉妹染色体が紡錘体と結合するまえには接着していない動原体が存在するため,この段階でAPC/Cが活性化してしまうと不均等な染色体分配がひき起こされ細胞死やがんなど重篤な疾患をひき起こすきっかけとなる.紡錘体チェックポイントはAPC/Cの活性化タンパク質であるCdc20の制御を介してAPC/Cの活性化の時期を制御しており,動原体において紡錘体への結合を監視し,接着していない動原体の存在により活性化される.これにより紡錘体チェックポイントは接着していない動原体が存在するというシグナルを細胞に発し,すべての染色体が赤道面に配列されるまで染色体分配を遅延させる.さらに,この遅延シグナルは接着していない動原体ひとつでも染色体分配を遅延させることのできる,細胞の全体に影響する拡散性の強力なシグナルであるが,その本質的な理解にはいたっていない.
紡錘体チェックポイントの分子機構についてはこれまでにかなりの知見が得られている1).接着していない動原体にMad1-Mad2複合体が結合し,もう1分子のMad2が結合することにより構造変化が誘導される.その結果,2分子目のMad2が活性化しCdc20との結合が可能になる2)(図2).そののち,Mad2-Cdc20複合体はBubR1と結合し紡錘体チェックポイント複合体(mitotic checkpoint complex,MCC)を形成する.紡錘体チェックポイント複合体がどの時点で細胞質に拡散するかは不明であるが,最終的にAPC/Cと結合しこれを不活性化する.この紡錘体チェックポイント複合体の形成機構は酵母からヒトまで真核生物において広く保存されており,その形成は紡錘体チェックポイントの活性に必須である.たとえば,Mad2あるいはBubR1のいずれかの不活性化は紡錘体チェックポイントの活性を消失させるのに十分である.Mad2およびBubR1がどのようにCdc20の活性を抑制するのかは分子レベルで解明されており,Mad2はCdc20のもつAPC/C活性化能を抑制し3),BubR1はCdc20の基質との結合能を抑制する4).
紡錘体チェックポイント複合体の形成を介したAPC/Cの阻害は非常に有力なモデルであったが,細胞において機能するためにはすべてのCdc20が接着していない動原体と結合して紡錘体チェックポイント複合体に取り込まれ,さらに,すべてのAPC/Cが紡錘体チェックポイント複合体と結合していなければならない(図2).しかし,紡錘体チェックポイントが活性化している細胞から精製されたAPC/Cは一部しか紡錘体チェックポイント複合体と結合しておらず5),いくつかの矛盾点を含んでいた.さらに最近の知見から,細胞質においては紡錘体チェックポイント複合体の不活性化を介してつねにCdc20が放出されており(図2),Cdc20の結合した活性化型APC/Cの形成を阻止し,Cdc20が接着していない動原体に優先的に結合して紡錘体チェックポイント複合体に取り込まれる機構は不明であった.べつの紡錘体チェックポイントタンパク質Bub1によるリン酸化を介したCdc20の活性の抑制6) など,いくつかのモデルが提唱されているが,染色体分配に対する遅延シグナルを分子レベルで説明するモデルは得られていない.さらに未解明の現象として,染色体分配に対する遅延シグナルによるAPC/C活性の抑制の速度の問題がある.分裂中期にCdc20がAPC/Cと結合しこれを活性化したのち,紡錘体を不安定化し紡錘体チェックポイントを再活性化させると,APC/Cの活性は5分以内に抑制される7).しかし,生化学的な解析により,Mad2単独あるいはBubR1単独では活性化型APC/Cを抑制できないことや,Mad2およびBubR1の存在のもとでも活性化型APC/Cの抑制には1時間も近くかかることから8),この現象を説明できない.
この研究では,精製したヒトの紡錘体チェックポイント複合体を用いた解析から,紡錘体チェックポイント複合体はCdc20を取り込むだけではなくもう1分子のCdc20に作用し,Cdc20の結合した活性化型APC/Cを阻害できることを発見した.紡錘体チェックポイント複合体とCdc20との相互作用の結合領域を同定しその変異を解析することにより,その相互作用は紡錘体チェックポイントの活性に必要不可欠であることも示された.染色体分配に対する遅延シグナルを消去した状況においても紡錘体チェックポイント複合体は活性化型APC/Cを阻害できたことから,紡錘体チェックポイント複合体それ自体が拡散性の染色体分配に対する遅延シグナルの正体である可能性が強く示唆された.また,紡錘体チェックポイント複合体が直接的に活性化型APC/Cを阻害できたことから,細胞において紡錘体チェックポイントが非常にすばやくAPC/Cの活性を抑制する機構を分子レベルで説明することもできた.
ヒトの紡錘体チェックポイント複合体のさらなる機能解析のため,ヒトに由来するCdc20,Mad2,BubR1を昆虫細胞においてバキュロウイルスを介し発現させ,2段階の精製をへて組換え紡錘体チェックポイント複合体として精製した.この組換え紡錘体チェックポイント複合体にべつに精製したCdc20をくわえたところ,結合活性が確認された.Mad2と結合できないCdc20変異体3) は組換え紡錘体チェックポイント複合体を形成できなかったが,2分子目のCdc20として組換え紡錘体チェックポイント複合体と結合できたことから,紡錘体チェックポイント複合体に含まれるCdc20と2分子目のCdc20とは結合様式の異なることが示唆された.組換え紡錘体チェックポイント複合体がCdc20と結合したことから,この結合がどのようにAPC/Cとの結合に影響するかを解析した結果,組換え紡錘体チェックポイント複合体はCdc20のAPC/Cとの結合を競争的に阻害することはなく,APC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体を形成した.しかも,組換え紡錘体チェックポイント複合体はCdc20の存在のもとではより強くAPC/Cと結合する傾向がみられた.
これらの実験結果は,紡錘体チェックポイント複合体がそれ自体に含まれるCdc20だけでなく,APC/Cと結合しているCdc20も阻害できる可能性を示唆した.この仮説を検証するため,APC/Cの活性を生化学的に測定する系に組換え紡錘体チェックポイント複合体をくわえて解析した.この系ではCdc20に依存的にAPC/Cが活性化されるが,組換え紡錘体チェックポイント複合体のみをくわえた条件ではAPC/Cは非常に弱くしか活性化されなかった.しかし,Cdc20および組換え紡錘体チェックポイント複合体を同時にくわえたところ,Cdc20によるAPC/Cの活性化が組換え紡錘体チェックポイント複合体により強く阻害された.さらに厳しい条件として,Cdc20の結合した活性化型APC/Cを用いた反応を進行させた5分後に組換え紡錘体チェックポイント複合体をくわえたときにもAPC/Cの活性化は強く阻害されたことから,紡錘体チェックポイント複合体は活性化型APC/Cの活性を直接的かつ迅速に阻害することが示唆された.
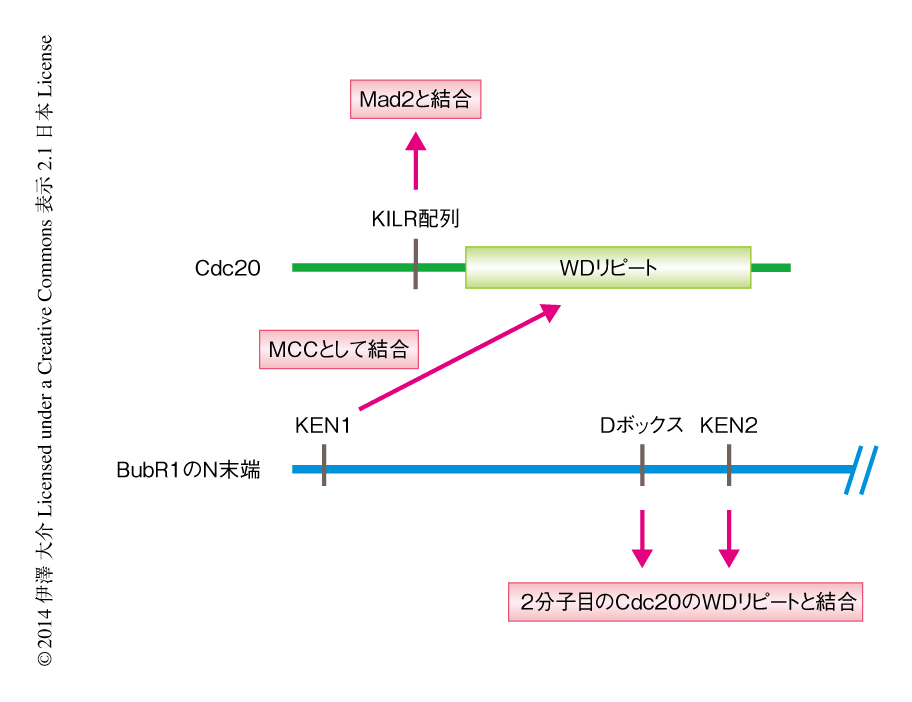
ヒトの細胞を用いて紡錘体チェックポイント複合体とCdc20との結合の紡錘体チェックポイントへの寄与について解析した.微小管重合阻害剤の存在のもとでは紡錘体の不安定化を介して紡錘体チェックポイントが恒常的に活性化し,細胞分裂は分裂前中期において長時間にわたり停止する.紡錘体チェックポイント複合体とCdc20との結合領域を同定し,その変異体を微小管重合阻害剤の存在のもとで解析することにより,紡錘体チェックポイントへの寄与を解析することができる.Cdc20は構造をもたないN末端領域とWDリピート構造をもつC末端領域からなる(図3).APC/Cの基質はDボックスおよびKENボックスとよばれるCdc20により認識される配列をもちCdc20のWDリピート構造と結合するが,その結合の様式は分裂酵母の紡錘体チェックポイント複合体の結晶構造解析により明らかにされている9).BubR1はAPC/Cの基質ではないが,いくつかのDボックスと2つのKENボックスをもち,この2つのKENボックスはいずれも紡錘体チェックポイントの活性に必要である4)(図3).とくに,1つ目のKENボックス(KEN1)はCdc20のWDリピート構造に結合し紡錘体チェックポイント複合体の形成に必須である.これらの配列に着目し,Dボックスおよび2つ目のKENボックス(KEN2)に変異をもつBubR1変異体を含む組換え紡錘体チェックポイント複合体,および,Dボックスとの結合部位あるいはKENボックスとの結合部位に変異をもつCdc20変異体を作製し,それぞれの結合活性について解析した.
Dボックスとの結合部位あるいはKENボックスとの結合部位に変異をもつCdc20変異体は組換え紡錘体チェックポイント複合体との結合が低下し,DボックスおよびKEN2に変異をもつBubR1を含む組換え紡錘体チェックポイント複合体もCdc20との結合能に低下がみられ,相補的な結果が得られた.BubR1のDボックスおよびKEN2は単体のCdc20との結合には必要ないことから,単にBubR1が2分子のCdc20と結合しているのではなく,紡錘体チェックポイント複合体としてもう1分子のCdc20と結合していることが示唆された.紡錘体チェックポイント複合体とCdc20との結合の紡錘体チェックポイントへの寄与について解析するため,RNAi法によりBubR1をノックダウンしDボックスに変異をもつBubR1変異体により相補した細胞を用いて紡錘体チェックポイントの活性を調べた.これまでの結果から,Dボックスに変異をもつBubR1変異体は紡錘体チェックポイント複合体を形成することがわかっていたことから,この実験により紡錘体チェックポイント複合体とCdc20との結合の低下による紡錘体チェックポイントへの影響を特異的に解析することができる.その結果,Dボックスに変異をもつBubR1変異体による相補状態では紡錘体チェックポイントの活性はほとんど検出されず,すなわち,紡錘体チェックポイント複合体がCdc20と結合することは紡錘体チェックポイントにおいて必須な機構であることが明らかにされた.
これまでの結果から,紡錘体チェックポイント複合体は2分子目のCdc20に作用して活性化型APC/Cを抑制し,その相互作用は紡錘体チェックポイントに必須であることがわかった.しかし,分裂前中期の細胞において紡錘体チェックポイント複合体が活性化型APC/Cを抑制していることを示す直接的な証拠を得ることは非常に困難であった.そこで,動原体に依存せずに形成され不活性化されない安定化型の紡錘体チェックポイント複合体を作製した.通常,分裂中期において紡錘体チェックポイント複合体は不活性化し,そこから解放されたCdc20がAPC/Cを活性化することにより染色体分配が誘導される.したがって,この安定化型の紡錘体チェックポイント複合体を細胞に発現させると,分裂中期において内在性のCdc20の結合した活性化型APC/Cが存在しつつ,外来性の安定化型の紡錘体チェックポイント複合体の存在する状況をつくりだすことができる.もし,この安定化型の紡錘体チェックポイント複合体が活性化型APC/Cを阻害できるのならば,この条件において染色体分配は遅延するはずである.実験を行ったところ,安定化型の紡錘体チェックポイント複合体は染色体分配を遅延もしくは完全に抑制するという予想どおりの結果が得られた.さらに,阻害剤を用いて染色体分配に対する遅延シグナルを消失させた状況においても,安定化型の紡錘体チェックポイント複合体は細胞の全体に拡散し染色体分配を遅延させたことから,紡錘体チェックポイント複合体は細胞の全体にはたらく拡散性の遅延シグナルそのものであることが強く示唆された.くわえて,この安定化型の紡錘体チェックポイント複合体の発現による染色体分配の遅延は,紡錘体チェックポイント複合体とCdc20との結合を弱めるDボックスに変異をもつBubR1変異体を導入することにより抑圧されたことから,安定化型の紡錘体チェックポイント複合体は活性化型APC/Cとの相互作用を介して染色体分配を遅延させることの確かな証拠が得られた.
ここまでの結果から,紡錘体チェックポイント複合体それ自体が細胞の全体にいきわたる拡散性の染色体分配に対する遅延シグナルの正体であるというモデルを提唱した(図2).いくつかの結果は,紡錘体チェックポイント複合体が細胞質に分布する活性化型APC/Cを阻害できることを示しているが,安定型の紡錘体チェックポイント複合体を用いているため完全には示し切れていない.内在性の紡錘体チェックポイント複合体がAPC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体をどのように形成するかについては議論の余地がありさらなる解析が必要とされるが,現実的には解析はむずかしく,新しい手法の開発が必要になるだろう.
今回の研究において,紡錘体チェックポイント複合体の新しい機能を発見し,紡錘体チェックポイントは紡錘体チェックポイント複合体の形成をとおして,APC/Cの活性化を“ふせぐ”というより活性化型APC/Cの直接的な“阻害剤”を形成していることが明らかにされた.この違いは非常に大きく,in silicoにおける研究を含めた紡錘体チェックポイントの研究分野の全般に大きな変革をひき起こすと考えられる.
最終的には,筆者本人ですら途方もないことを考えていると感じるくらいの結果になった.その結論にいたる過程においては,最初に,細胞において安定化型の紡錘体チェックポイント複合体が活性化型APC/Cを阻害するという実験結果が得られたが,その現象を説明する仮説や相補するほかの実験結果が得られず,その解釈は長いあいだ不明であった.紡錘体チェックポイント複合体はCdc20,Mad2,BubR1の1対1対1の複合体であることが結晶構造からも示されており,APC/Cと紡錘体チェックポイント複合体との複合体が形成されるとCdc20はもはやAPC/Cとは結合できないという固定観念にとらわれていた.きっかけは,APC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体が存在しうるという仮説を許容することからはじまり,別の目的で精製していた組換え紡錘体チェックポイント複合体を用いて生化学的な手法により解析したところまさにそのとおりであり,“途方もない仮説”が真実であることを確信した.そののち,紡錘体チェックポイント複合体とCdc20との結合領域をなんとか同定し,最終的に論文としてまとめあげることができた.2011年の筆者らの論文において,紡錘体チェックポイント複合体とCdc20はそれぞれAPC/Cの異なる領域において結合することを示していたが10)(新着論文レビュー でも掲載),今回の発見は,結果的に前回の発見の生理学的な意義を見い出し相補するかたちになった.
20年以上まえに紡錘体チェックポイントの概念が発見され,酵母の遺伝学から紡錘体チェックポイントにおける必須遺伝子が同定された.そののちの10年でMad2およびBubR1の詳細な機能解析とそれらの複合体である紡錘体チェックポイント複合体の発見,そして,2年前には分裂酵母の紡錘体チェックポイント複合体の結晶構造が解かれるにいたった.これら研究の進展に強い衝撃をうけるとともに,紡錘体チェックポイントの分野も折り返し地点を過ぎてしまったように感じていた.しかし,この研究の過程において分裂酵母とヒトの紡錘体チェックポイント複合体にはいくつかの相違点のあることが示唆され,まだまだやるべきことは多く残っていることを痛感している.
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年より英国Cambridge大学 研究員.
研究テーマ:ヒトの細胞における紡錘体チェックポイントの機構.
関心事:染色体分配の異常とがん化との関連.CNSでの論文発表よりむずかしい人生のいくつかのこと.
© 2014 伊澤 大介 Licensed under CC 表示 2.1 日本
(英国Cambridge大学Cancer Research UK Gurdon Institute)
email:伊澤大介
DOI: 10.7875/first.author.2014.139
The mitotic checkpoint complex binds a second CDC20 to inhibit active APC/C.
Daisuke Izawa, Jonathon Pines
Nature, 517, 631-634 (2015)
要 約
細胞分裂は均等な染色体分配をへて遺伝的に同一の情報をもつ2つの娘細胞をつくりだす過程である.分裂期の細胞における均等な染色体分配を保障するために必須な監視機構が紡錘体チェックポイントである.紡錘体チェックポイントは紡錘体に接着していない動原体において活性化し,細胞の全体に拡散する染色体分配に対する遅延シグナルが発せられる.接着していない動原体ひとつでほかのすべての染色体分配を遅延するのに十分なほど強力なシグナルであるが,その分子レベルでの本質的な理解にはいたっていない.これまでの知見から,紡錘体チェックポイントは染色体分配に必須なユビキンチンリガーゼAPC/Cの活性化タンパク質であるCdc20にはたらきかけMad2およびBubR1を含む紡錘体チェックポイント複合体に取り込むことによりAPC/Cの活性化をふせぐことが知られている.この研究においては,紡錘体チェックポイント複合体はCdc20を取り込むだけでなく,もう1分子のCdc20とも結合し,さらに,Cdc20の結合した活性化型APC/Cも阻害できることを発見した.この紡錘体チェックポイント複合体とCdc20との結合は紡錘体チェックポイントの活性に必要不可欠であることも示された.さらに,紡錘体チェックポイント複合体は染色体分配に対する遅延シグナルを消去した状況においても活性化型APC/Cを阻害したことから,紡錘体チェックポイント複合体それ自体が拡散性の染色体分配に対する遅延シグナルの正体である可能性が強く示唆された.
はじめに
細胞分裂における均等な染色体分配に必須な過程は,分裂中期におけるすべての姉妹染色体が両極から紡錘体と結合し赤道面に配列したのちのAPC/C(anaphase promoting complex/cyclosome)の活性化,および,分裂後期における染色体分配の誘導である(図1).APC/Cはユビキチンリガーゼ複合体であり,ポリユビキチンの修飾を介して分裂後期の誘導に阻害的にはたらくセキュリンやサイクリンBなどさまざまなタンパク質の分解を促進する.分裂前中期においてすべての姉妹染色体が紡錘体と結合するまえには接着していない動原体が存在するため,この段階でAPC/Cが活性化してしまうと不均等な染色体分配がひき起こされ細胞死やがんなど重篤な疾患をひき起こすきっかけとなる.紡錘体チェックポイントはAPC/Cの活性化タンパク質であるCdc20の制御を介してAPC/Cの活性化の時期を制御しており,動原体において紡錘体への結合を監視し,接着していない動原体の存在により活性化される.これにより紡錘体チェックポイントは接着していない動原体が存在するというシグナルを細胞に発し,すべての染色体が赤道面に配列されるまで染色体分配を遅延させる.さらに,この遅延シグナルは接着していない動原体ひとつでも染色体分配を遅延させることのできる,細胞の全体に影響する拡散性の強力なシグナルであるが,その本質的な理解にはいたっていない.
紡錘体チェックポイントの分子機構についてはこれまでにかなりの知見が得られている1).接着していない動原体にMad1-Mad2複合体が結合し,もう1分子のMad2が結合することにより構造変化が誘導される.その結果,2分子目のMad2が活性化しCdc20との結合が可能になる2)(図2).そののち,Mad2-Cdc20複合体はBubR1と結合し紡錘体チェックポイント複合体(mitotic checkpoint complex,MCC)を形成する.紡錘体チェックポイント複合体がどの時点で細胞質に拡散するかは不明であるが,最終的にAPC/Cと結合しこれを不活性化する.この紡錘体チェックポイント複合体の形成機構は酵母からヒトまで真核生物において広く保存されており,その形成は紡錘体チェックポイントの活性に必須である.たとえば,Mad2あるいはBubR1のいずれかの不活性化は紡錘体チェックポイントの活性を消失させるのに十分である.Mad2およびBubR1がどのようにCdc20の活性を抑制するのかは分子レベルで解明されており,Mad2はCdc20のもつAPC/C活性化能を抑制し3),BubR1はCdc20の基質との結合能を抑制する4).
紡錘体チェックポイント複合体の形成を介したAPC/Cの阻害は非常に有力なモデルであったが,細胞において機能するためにはすべてのCdc20が接着していない動原体と結合して紡錘体チェックポイント複合体に取り込まれ,さらに,すべてのAPC/Cが紡錘体チェックポイント複合体と結合していなければならない(図2).しかし,紡錘体チェックポイントが活性化している細胞から精製されたAPC/Cは一部しか紡錘体チェックポイント複合体と結合しておらず5),いくつかの矛盾点を含んでいた.さらに最近の知見から,細胞質においては紡錘体チェックポイント複合体の不活性化を介してつねにCdc20が放出されており(図2),Cdc20の結合した活性化型APC/Cの形成を阻止し,Cdc20が接着していない動原体に優先的に結合して紡錘体チェックポイント複合体に取り込まれる機構は不明であった.べつの紡錘体チェックポイントタンパク質Bub1によるリン酸化を介したCdc20の活性の抑制6) など,いくつかのモデルが提唱されているが,染色体分配に対する遅延シグナルを分子レベルで説明するモデルは得られていない.さらに未解明の現象として,染色体分配に対する遅延シグナルによるAPC/C活性の抑制の速度の問題がある.分裂中期にCdc20がAPC/Cと結合しこれを活性化したのち,紡錘体を不安定化し紡錘体チェックポイントを再活性化させると,APC/Cの活性は5分以内に抑制される7).しかし,生化学的な解析により,Mad2単独あるいはBubR1単独では活性化型APC/Cを抑制できないことや,Mad2およびBubR1の存在のもとでも活性化型APC/Cの抑制には1時間も近くかかることから8),この現象を説明できない.
この研究では,精製したヒトの紡錘体チェックポイント複合体を用いた解析から,紡錘体チェックポイント複合体はCdc20を取り込むだけではなくもう1分子のCdc20に作用し,Cdc20の結合した活性化型APC/Cを阻害できることを発見した.紡錘体チェックポイント複合体とCdc20との相互作用の結合領域を同定しその変異を解析することにより,その相互作用は紡錘体チェックポイントの活性に必要不可欠であることも示された.染色体分配に対する遅延シグナルを消去した状況においても紡錘体チェックポイント複合体は活性化型APC/Cを阻害できたことから,紡錘体チェックポイント複合体それ自体が拡散性の染色体分配に対する遅延シグナルの正体である可能性が強く示唆された.また,紡錘体チェックポイント複合体が直接的に活性化型APC/Cを阻害できたことから,細胞において紡錘体チェックポイントが非常にすばやくAPC/Cの活性を抑制する機構を分子レベルで説明することもできた.
1.紡錘体チェックポイント複合体は2分子目のCdc20と結合しその活性を抑制する
ヒトの紡錘体チェックポイント複合体のさらなる機能解析のため,ヒトに由来するCdc20,Mad2,BubR1を昆虫細胞においてバキュロウイルスを介し発現させ,2段階の精製をへて組換え紡錘体チェックポイント複合体として精製した.この組換え紡錘体チェックポイント複合体にべつに精製したCdc20をくわえたところ,結合活性が確認された.Mad2と結合できないCdc20変異体3) は組換え紡錘体チェックポイント複合体を形成できなかったが,2分子目のCdc20として組換え紡錘体チェックポイント複合体と結合できたことから,紡錘体チェックポイント複合体に含まれるCdc20と2分子目のCdc20とは結合様式の異なることが示唆された.組換え紡錘体チェックポイント複合体がCdc20と結合したことから,この結合がどのようにAPC/Cとの結合に影響するかを解析した結果,組換え紡錘体チェックポイント複合体はCdc20のAPC/Cとの結合を競争的に阻害することはなく,APC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体を形成した.しかも,組換え紡錘体チェックポイント複合体はCdc20の存在のもとではより強くAPC/Cと結合する傾向がみられた.
これらの実験結果は,紡錘体チェックポイント複合体がそれ自体に含まれるCdc20だけでなく,APC/Cと結合しているCdc20も阻害できる可能性を示唆した.この仮説を検証するため,APC/Cの活性を生化学的に測定する系に組換え紡錘体チェックポイント複合体をくわえて解析した.この系ではCdc20に依存的にAPC/Cが活性化されるが,組換え紡錘体チェックポイント複合体のみをくわえた条件ではAPC/Cは非常に弱くしか活性化されなかった.しかし,Cdc20および組換え紡錘体チェックポイント複合体を同時にくわえたところ,Cdc20によるAPC/Cの活性化が組換え紡錘体チェックポイント複合体により強く阻害された.さらに厳しい条件として,Cdc20の結合した活性化型APC/Cを用いた反応を進行させた5分後に組換え紡錘体チェックポイント複合体をくわえたときにもAPC/Cの活性化は強く阻害されたことから,紡錘体チェックポイント複合体は活性化型APC/Cの活性を直接的かつ迅速に阻害することが示唆された.
2.紡錘体チェックポイント複合体とCdc20との結合は紡錘体チェックポイントの活性に必須である
ヒトの細胞を用いて紡錘体チェックポイント複合体とCdc20との結合の紡錘体チェックポイントへの寄与について解析した.微小管重合阻害剤の存在のもとでは紡錘体の不安定化を介して紡錘体チェックポイントが恒常的に活性化し,細胞分裂は分裂前中期において長時間にわたり停止する.紡錘体チェックポイント複合体とCdc20との結合領域を同定し,その変異体を微小管重合阻害剤の存在のもとで解析することにより,紡錘体チェックポイントへの寄与を解析することができる.Cdc20は構造をもたないN末端領域とWDリピート構造をもつC末端領域からなる(図3).APC/Cの基質はDボックスおよびKENボックスとよばれるCdc20により認識される配列をもちCdc20のWDリピート構造と結合するが,その結合の様式は分裂酵母の紡錘体チェックポイント複合体の結晶構造解析により明らかにされている9).BubR1はAPC/Cの基質ではないが,いくつかのDボックスと2つのKENボックスをもち,この2つのKENボックスはいずれも紡錘体チェックポイントの活性に必要である4)(図3).とくに,1つ目のKENボックス(KEN1)はCdc20のWDリピート構造に結合し紡錘体チェックポイント複合体の形成に必須である.これらの配列に着目し,Dボックスおよび2つ目のKENボックス(KEN2)に変異をもつBubR1変異体を含む組換え紡錘体チェックポイント複合体,および,Dボックスとの結合部位あるいはKENボックスとの結合部位に変異をもつCdc20変異体を作製し,それぞれの結合活性について解析した.
Dボックスとの結合部位あるいはKENボックスとの結合部位に変異をもつCdc20変異体は組換え紡錘体チェックポイント複合体との結合が低下し,DボックスおよびKEN2に変異をもつBubR1を含む組換え紡錘体チェックポイント複合体もCdc20との結合能に低下がみられ,相補的な結果が得られた.BubR1のDボックスおよびKEN2は単体のCdc20との結合には必要ないことから,単にBubR1が2分子のCdc20と結合しているのではなく,紡錘体チェックポイント複合体としてもう1分子のCdc20と結合していることが示唆された.紡錘体チェックポイント複合体とCdc20との結合の紡錘体チェックポイントへの寄与について解析するため,RNAi法によりBubR1をノックダウンしDボックスに変異をもつBubR1変異体により相補した細胞を用いて紡錘体チェックポイントの活性を調べた.これまでの結果から,Dボックスに変異をもつBubR1変異体は紡錘体チェックポイント複合体を形成することがわかっていたことから,この実験により紡錘体チェックポイント複合体とCdc20との結合の低下による紡錘体チェックポイントへの影響を特異的に解析することができる.その結果,Dボックスに変異をもつBubR1変異体による相補状態では紡錘体チェックポイントの活性はほとんど検出されず,すなわち,紡錘体チェックポイント複合体がCdc20と結合することは紡錘体チェックポイントにおいて必須な機構であることが明らかにされた.
3.紡錘体チェックポイント複合体は染色体分配に対する遅延シグナルのない状態においても活性化型APC/Cを阻害する
これまでの結果から,紡錘体チェックポイント複合体は2分子目のCdc20に作用して活性化型APC/Cを抑制し,その相互作用は紡錘体チェックポイントに必須であることがわかった.しかし,分裂前中期の細胞において紡錘体チェックポイント複合体が活性化型APC/Cを抑制していることを示す直接的な証拠を得ることは非常に困難であった.そこで,動原体に依存せずに形成され不活性化されない安定化型の紡錘体チェックポイント複合体を作製した.通常,分裂中期において紡錘体チェックポイント複合体は不活性化し,そこから解放されたCdc20がAPC/Cを活性化することにより染色体分配が誘導される.したがって,この安定化型の紡錘体チェックポイント複合体を細胞に発現させると,分裂中期において内在性のCdc20の結合した活性化型APC/Cが存在しつつ,外来性の安定化型の紡錘体チェックポイント複合体の存在する状況をつくりだすことができる.もし,この安定化型の紡錘体チェックポイント複合体が活性化型APC/Cを阻害できるのならば,この条件において染色体分配は遅延するはずである.実験を行ったところ,安定化型の紡錘体チェックポイント複合体は染色体分配を遅延もしくは完全に抑制するという予想どおりの結果が得られた.さらに,阻害剤を用いて染色体分配に対する遅延シグナルを消失させた状況においても,安定化型の紡錘体チェックポイント複合体は細胞の全体に拡散し染色体分配を遅延させたことから,紡錘体チェックポイント複合体は細胞の全体にはたらく拡散性の遅延シグナルそのものであることが強く示唆された.くわえて,この安定化型の紡錘体チェックポイント複合体の発現による染色体分配の遅延は,紡錘体チェックポイント複合体とCdc20との結合を弱めるDボックスに変異をもつBubR1変異体を導入することにより抑圧されたことから,安定化型の紡錘体チェックポイント複合体は活性化型APC/Cとの相互作用を介して染色体分配を遅延させることの確かな証拠が得られた.
ここまでの結果から,紡錘体チェックポイント複合体それ自体が細胞の全体にいきわたる拡散性の染色体分配に対する遅延シグナルの正体であるというモデルを提唱した(図2).いくつかの結果は,紡錘体チェックポイント複合体が細胞質に分布する活性化型APC/Cを阻害できることを示しているが,安定型の紡錘体チェックポイント複合体を用いているため完全には示し切れていない.内在性の紡錘体チェックポイント複合体がAPC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体をどのように形成するかについては議論の余地がありさらなる解析が必要とされるが,現実的には解析はむずかしく,新しい手法の開発が必要になるだろう.
おわりに
今回の研究において,紡錘体チェックポイント複合体の新しい機能を発見し,紡錘体チェックポイントは紡錘体チェックポイント複合体の形成をとおして,APC/Cの活性化を“ふせぐ”というより活性化型APC/Cの直接的な“阻害剤”を形成していることが明らかにされた.この違いは非常に大きく,in silicoにおける研究を含めた紡錘体チェックポイントの研究分野の全般に大きな変革をひき起こすと考えられる.
最終的には,筆者本人ですら途方もないことを考えていると感じるくらいの結果になった.その結論にいたる過程においては,最初に,細胞において安定化型の紡錘体チェックポイント複合体が活性化型APC/Cを阻害するという実験結果が得られたが,その現象を説明する仮説や相補するほかの実験結果が得られず,その解釈は長いあいだ不明であった.紡錘体チェックポイント複合体はCdc20,Mad2,BubR1の1対1対1の複合体であることが結晶構造からも示されており,APC/Cと紡錘体チェックポイント複合体との複合体が形成されるとCdc20はもはやAPC/Cとは結合できないという固定観念にとらわれていた.きっかけは,APC/C,紡錘体チェックポイント複合体,Cdc20からなる複合体が存在しうるという仮説を許容することからはじまり,別の目的で精製していた組換え紡錘体チェックポイント複合体を用いて生化学的な手法により解析したところまさにそのとおりであり,“途方もない仮説”が真実であることを確信した.そののち,紡錘体チェックポイント複合体とCdc20との結合領域をなんとか同定し,最終的に論文としてまとめあげることができた.2011年の筆者らの論文において,紡錘体チェックポイント複合体とCdc20はそれぞれAPC/Cの異なる領域において結合することを示していたが10)(新着論文レビュー でも掲載),今回の発見は,結果的に前回の発見の生理学的な意義を見い出し相補するかたちになった.
20年以上まえに紡錘体チェックポイントの概念が発見され,酵母の遺伝学から紡錘体チェックポイントにおける必須遺伝子が同定された.そののちの10年でMad2およびBubR1の詳細な機能解析とそれらの複合体である紡錘体チェックポイント複合体の発見,そして,2年前には分裂酵母の紡錘体チェックポイント複合体の結晶構造が解かれるにいたった.これら研究の進展に強い衝撃をうけるとともに,紡錘体チェックポイントの分野も折り返し地点を過ぎてしまったように感じていた.しかし,この研究の過程において分裂酵母とヒトの紡錘体チェックポイント複合体にはいくつかの相違点のあることが示唆され,まだまだやるべきことは多く残っていることを痛感している.
文 献
- Lara-Gonzalez, P., Westhorpe, F. G. & Taylor, S. S.: The spindle assembly checkpoint. Curr. Biol., 22, R966-R980 (2012)[PubMed]
- De Antoni, A., Pearson, C. G., Cimini, D. et al.: The Mad1/Mad2 complex as a template for Mad2 activation in the spindle assembly checkpoint. Curr. Biol., 15, 214-225 (2005)[PubMed]
- Izawa, D. & Pines, J.: Mad2 and the APC/C compete for the same site on Cdc20 to ensure proper chromosome segregation. J. Cell Biol., 199, 27-37 (2012)[PubMed]
- Lara-Gonzalez, P., Scott, M. I., Diez, M. et al.: BubR1 blocks substrate recruitment to the APC/C in a KEN-box-dependent manner. J. Cell Sci., 124, 4332-4345 (2011)[PubMed]
- Herzog, F., Primorac, I., Dube, P. et al.: Structure of the anaphase-promoting complex/cyclosome interacting with a mitotic checkpoint complex. Science, 323, 1477-1481 (2009)[PubMed]
- Tang, Z., Shu, H., Oncel, D. et al.: Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle checkpoint. Mol. Cell, 16, 387-397 (2004)[PubMed]
- Dick, A. E. & Gerlich, D. W.: Kinetic framework of spindle assembly checkpoint signalling. Nat. Cell Biol., 15, 1370-1377 (2013)[PubMed]
- Han, J. S., Holland, A. J., Fachinetti, D. et al.: Catalytic assembly of the mitotic checkpoint inhibitor BubR1-Cdc20 by a Mad2-induced functional switch in Cdc20. Mol. Cell, 51, 92-104 (2013)[PubMed]
- Chao, W. C., Kulkarni, K., Zhang, Z. et al.: Structure of the mitotic checkpoint complex. Nature, 484, 208-213 (2012)[PubMed]
- Izawa, D. & Pines, J.: How APC/C-Cdc20 changes its substrate specificity in mitosis. Nat. Cell Biol., 13, 223-233 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科博士課程 修了,同年より英国Cambridge大学 研究員.
研究テーマ:ヒトの細胞における紡錘体チェックポイントの機構.
関心事:染色体分配の異常とがん化との関連.CNSでの論文発表よりむずかしい人生のいくつかのこと.
© 2014 伊澤 大介 Licensed under CC 表示 2.1 日本