遺伝性肺胞蛋白症に対する肺へのマクロファージの移植による治療
鈴木拓児・Bruce C. Trapnell
(米国Cincinnati Children's Hospital Medical Center,Perinatal Institute,Division of Pulmonary Biology)
email:鈴木拓児
DOI: 10.7875/first.author.2014.132
Pulmonary macrophage transplantation therapy.
Takuji Suzuki, Paritha Arumugam, Takuro Sakagami, Nico Lachmann, Claudia Chalk, Anthony Sallese, Shuichi Abe, Cole Trapnell, Brenna Carey, Thomas Moritz, Punam Malik, Carolyn Lutzko, Robert E. Wood, Bruce C. Trapnell
Nature, 514, 450-454 (2014)
骨髄移植は有効な治療法であるが,前処置として骨髄の破壊を必要とするため重篤な感染症の危険性がある.最近,組織マクロファージは定常状態においては末梢の血液に由来する造血細胞に依存せずに維持されていることが明らかになり,マクロファージが原因となる疾患に対し,骨髄移植ではなく臓器の局所を対象としたマクロファージの細胞治療が有効である可能性が考えられるようになった.GM-CSF受容体β鎖のノックアウトマウスはヒトのGM-CSF受容体α鎖あるいはGM-CSF受容体β鎖の遺伝子変異を原因とする遺伝性肺胞蛋白症のすぐれたモデルである.GM-CSF受容体β鎖のノックアウトマウスに対し,野生型マウスのマクロファージあるいはGM-CSF受容体β鎖の遺伝子を導入したマクロファージを用いて,前処置をせず肺へとマクロファージを移植したところ,安全性および認容性が確認され,1回のみの移植により肺の病態,2次的な全身症状,疾患に関連したバイオマーカーが改善され,疾患による死亡率は抑制された.肺に移植されたマクロファージは少なくとも1年は生着し治療効果を発揮した.この研究により,肺胞マクロファージの総数を制御する機構が明らかになり,肺胞マクロファージの表現型を決定する要因のひとつとしてGM-CSFが必要であることが明らかになった.肺へのマクロファージの移植は遺伝性肺胞蛋白症の患者への最初の特異的な治療法となりうる可能性が示唆された.
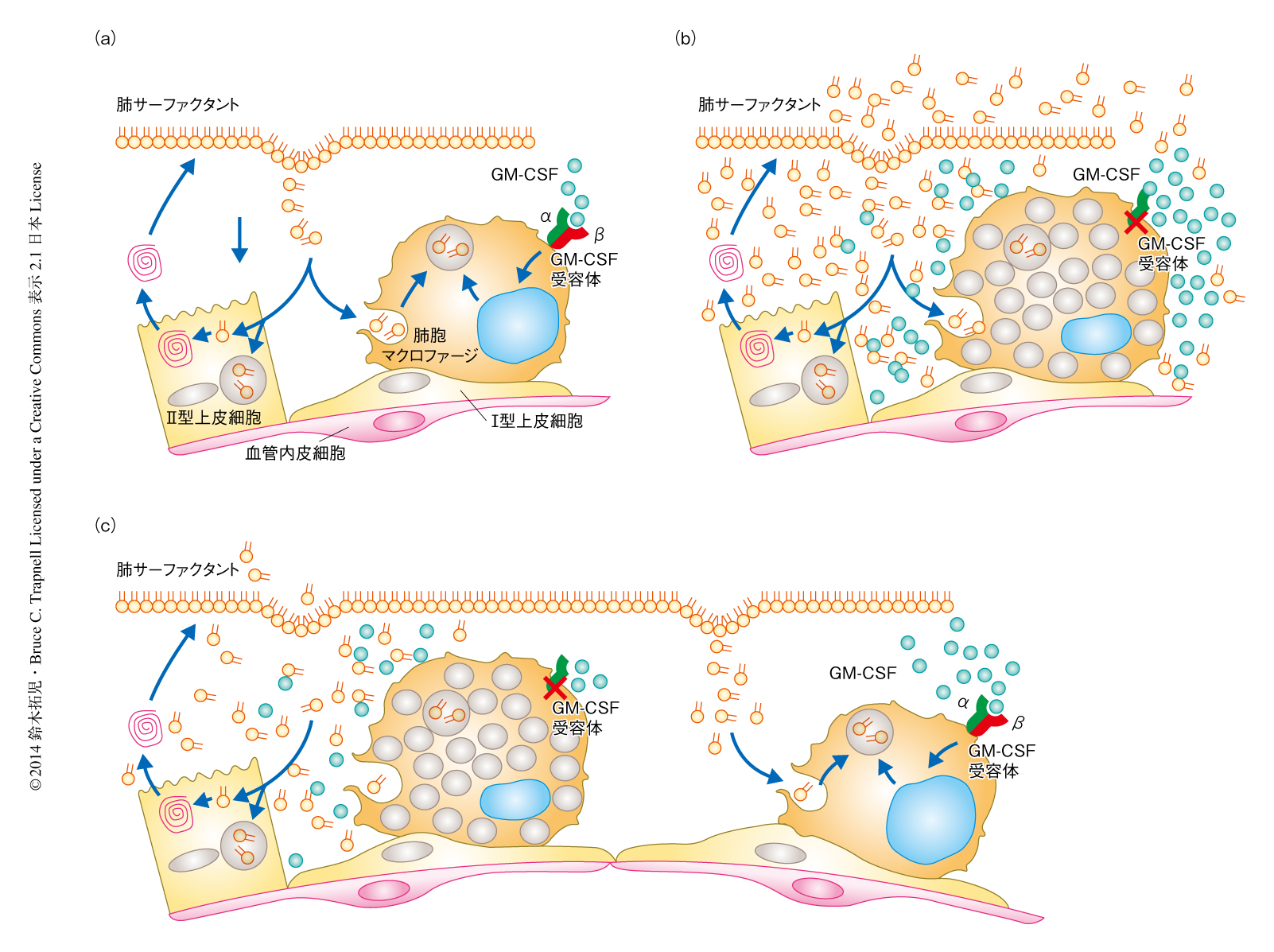
肺胞蛋白症は肺サーファクタントに由来する物質が肺の末梢の気腔に異常に貯留し呼吸不全にいたる疾患であり,1958年にはじめて記載されたが1),その原因は長らく不明であった.肺サーファクタントはII型肺胞上皮細胞において産生され,再利用されるとともに肺胞マクロファージにより処理され,その産生と分解のバランスにより肺における肺サーファクタントの恒常性は維持されている2)(図1a).1994年,GM-CSF(granulocyte macrophage colony-stimulating factor,顆粒球・マクロファージコロニー刺激因子)のノックアウトマウスが予想外にも肺胞蛋白症を生じることが明らかになり3,4),つづいて,GM-CSF受容体β鎖のノックアウトマウスにおいても同様の表現型が報告された5,6).こうしたマウスにおける研究から,GM-CSFは肺胞マクロファージが肺サーファクタントを処理するのに必要であり,肺の恒常性の維持において中心的な役割を担うことが明らかになった.一方,ヒトでは,1999年,当時は原因不明であった“特発性肺胞蛋白症”の患者の気管支肺胞の洗浄液からGM-CSFの生物活性を阻害する抗GM-CSF抗体が発見され7),現在では,この疾患は“自己免疫性肺胞蛋白症”と分類されるようになった.さらに2008年,抗GM-CSF抗体陰性の肺胞蛋白症の患者においてGM-CSF受容体α鎖の遺伝子に変異が発見され8,9),つづいて,GM-CSF受容体β鎖の遺伝子に変異をもつ患者も報告され10,11),これらは“遺伝性肺胞蛋白症”とよばれるようになった12)(図1b).そののち,血清におけるGM-CSF自体がこの疾患のバイオマーカーとして有用であることが報告された12).
現在,遺伝性肺胞蛋白症に対し有効とされている治療は全身麻酔のもと生理食塩水により肺をくり返し洗浄するという全肺洗浄法であり,重症な患者では頻回にくり返し施行する必要がある.マウスモデルでは骨髄移植の有効性が示されているが,ヒトにおいては骨髄移植など造血幹細胞の移植のまえに正常な幹細胞を受け入れる準備として抗がん剤治療や放射線治療といった骨髄を破壊するような前処置が行われ,それにともなう感染症などの副作用が起こりうる.治療の必要な重症の患者では肺や全身の状態が悪いため骨髄移植がむずかしいこともある.また,実際に骨髄移植を行った遺伝性肺胞蛋白症の患者においてドナーの骨髄が生着するまえに感染症のため亡くなった例が報告されている9).したがって,遺伝性肺胞蛋白症に特異的な新規の治療法の開発が期待されている.従来,組織マクロファージは骨髄に由来する単球がつねに前駆細胞として供給されることにより維持されていると考えられてきたが,最近の知見では,肺など多くの組織において生前からマクロファージの前駆細胞が存在し,定常状態では骨髄造血細胞に由来する細胞に依存せずに組織マクロファージが維持されていることが知られるようになり,臓器に特異的におのおのの組織マクロファージを維持する機構の存在することが示唆されている13-15).
GM-CSF受容体β鎖のノックアウトマウスでは,肺の病理所見や肺胞マクロファージの異常がヒトの遺伝性肺胞蛋白症と同じ所見を呈することのみならず,肺胞洗浄液の透明度,バイオマーカーの異常,肺胞マクロファージにおける遺伝子発現の異常などの所見がすべてヒトのGM-CSF受容体α鎖あるいはGM-CSF受容体β鎖の遺伝子変異による遺伝性肺胞蛋白症の病態を忠実に再現することが確認された.さらに,GM-CSF受容体β鎖のノックアウトマウスでは加齢とともに病態が進行し,慢性の呼吸不全にともなう2次性の多血症を生じることが認められた.
遺伝性肺胞蛋白症の患者およびそのモデルであるGM-CSF受容体β鎖のノックアウトマウスでは,おもな異常所見は肺だけであり,GM-CSFに反応できない機能不全の肺胞マクロファージが病態の中心であることから,肺胞マクロファージの機能さえ回復できれば病態の改善につながる可能性が考えられた.さらに,肺は生体の外から経気管的に細胞を投与できる特別な臓器であり,肺には骨髄造血細胞の供給に依存せずに肺胞マクロファージを維持する機構のあることが示唆されてきた.そこで,肺へのマクロファージの移植治療の可能性を探るため,野生型のマウスの骨髄よりマクロファージを作製し,GM-CSF受容体β鎖のノックアウトマウスに対し1回の経気管投与を行った(図1c).マクロファージの移植の2カ月のち,肺において移植されたマクロファージの存在が確認され,遺伝性肺胞蛋白症においてみられるバイオマーカーの異常の所見および肺胞マクロファージにおける遺伝子発現の異常は有意に改善した.GM-CSF受容体β鎖のノックアウトマウスの骨髄から作製したマクロファージを移植してもこのような効果は観察されなかったことから,GM-CSF受容体の機能に依存した効果であることが示唆された.さらに驚くべきことに,野生型のマクロファージを1回のみ移植した1年のちにも移植されたマクロファージは存続しており,その治療効果は持続していた.肺胞マクロファージはGM-CSF受容体β鎖のノックアウトマウスではヒトの肺胞蛋白症の患者と同様にPAS染色やオイルレッドO染色に陽性の大型な泡沫細胞を呈するが,移植を行ったマウスの肺のマクロファージは野生型のマクロファージに近い所見を呈した.さらに,肺病理組織の所見において,移植を行っていないマウスにおいては肺胞に経時的に蓄積し,これをうめつくす肺サーファクタントに由来する物質が,移植を行ったマウスでは大きく減少していることが確認された.さらに,高齢のGM-CSF受容体β鎖のノックアウトマウスでは慢性的な低酸素血症にともなう血清エリスロポイエチン値の上昇と2次性の多血症が観察されたが,移植を行ったマウスではそれらの有意な改善がみられ,肺の疾患にともなう全身の異常所見に対する効果も確認された.そして,移植を行ったGM-CSF受容体β鎖のノックアウトマウスでは移植を行っていないマウスに比べ生存期間の延長が観察された.移植ののちの末梢の血液の所見においては,血球数および分画にとくに異常は認められず,肺胞洗浄液に含まれる炎症性サイトカインに改善がみられ安全性が示唆された.
野生型のマウスに比べGM-CSF受容体β鎖のノックアウトマウスでは肺におけるGM-CSF値が上昇していたこと,GM-CSF受容体を発現している野生型マウスのマクロファージのみ肺においてGM-CSFに反応することができたことから,細胞がGM-CSFに反応できることによる選択的な生存優位性が移植されたマクロファージの生着の機構と考えられた.実際に,in vitroにおいて,野生型マウスおよびGM-CSF受容体β鎖のノックアウトマウスの骨髄から作製したマクロファージをGM-CSFおよびM-CSFの存在のもと競合的に共培養したところ,野生型マウスに由来するマクロファージがGM-CSF受容体β鎖のノックアウトマウスに由来するマクロファージに比べ優位に増殖することが示され,GM-CSFへの反応性による選択的な生存優位性が示唆された.さらに,in vivoにおいては,GM-CSF値の上昇のみられない野生型マウスにマクロファージを移植しても2カ月のちには移植された細胞は肺胞マクロファージの全体の5%以下であったのに対し,GM-CSF受容体β鎖のノックアウトマウスにおいては肺胞マクロファージの約20%が移植された細胞に由来しており有意に高い生着がみられた.GFPにより標識したマウスの骨髄から作製したマクロファージを用いて移植を行い,移植された細胞の肺における増殖についてKi67染色により検討した.その結果,移植された細胞が増殖していることが確認され,その割合を調べると,移植の1カ月のちにはその32%がKi67陽性,1年のちには11%がKi67陽性であった.肺胞マクロファージにおける移植された細胞の割合を経時的に観察すると,徐々に変化して1年のちには69%にまで上昇し,それにともない肺胞洗浄液におけるGM-CSF値は減少し,同様に治療効果の指標である肺胞洗浄液の透明度も徐々に減少した.興味深いことに,GM-CSF値がかなり減少した移植の1年のちのGM-CSF受容体を発現する移植された細胞に由来する肺胞マクロファージの数は,同じ週齢の移植を行っていない野生型マウスの肺胞マクロファージの数にほぼ近い値を示したことから,肺におけるGM-CSF値はそれに反応できるマクロファージにより制御され,かつ,肺胞マクロファージの総数は肺におけるGM-CSF値により左右される,といったフィードバックのある相互関係の存在が示唆された.
GFPにより標識したマウスの骨髄から作製したマクロファージを用いて移植を行い,肺における局在について病理組織を調べたところ,約9割が肺胞に存在し,約1割が間質に存在していた.移植ののちのマウスにおいてGFP陽性細胞の分布をフローサイトメトリーにより調べたところ,末梢の血液,脾臓,骨髄には観察されず,移植されたマクロファージは肺にとどまっていることが明らかになった.さらに,移植された細胞に特異的であるGFPの遺伝子をPCR法により調べても,あるいは,CD45.1陽性のマクロファージを移植したのちCD45.1陽性細胞をフローサイトメトリーにより調べても同様の結果であったことから,移植された細胞は肺,とくに大部分は肺胞腔にとどまるものと考えられた.一般に,臓器に特異的な環境が組織マクロファージの特徴を形成するものと考えられているが,野生型マウスの肺胞マクロファージがCD11b低発現SiglecF高発現の表現型を示すのに対し,骨髄から作製したマクロファージはCD11b高発現SiglecF低発現であるが,移植の1年のちの細胞は野生型の肺胞マクロファージと同様の表現型を示し,GM-CSFシグナルが肺胞マクロファージの表現型を決定する肺に特異的な環境因子のひとつであると考えられた.さらに,包括的な遺伝子発現への影響をみるため,同じ週齢の野生型マウス,移植を行っていないGM-CSF受容体β鎖のノックアウトマウス,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージについてDNAマイクロアレイ解析を行った.その結果,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージは,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスに比べ,野生型マウスにおける遺伝子発現により近似したパターンを示した.さらに,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージにおいて,野生型マウスに比べ低下していた細胞分裂,脂肪酸代謝,オルガネラへの局在,脂肪酸β酸化にかかわる遺伝子の発現は,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスにおいて上昇しており,逆に,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスにおいて発現の上昇していた細胞内代謝を制御する遺伝子や免疫系,RNA代謝,アポトーシス,シグナル伝達にかかわる遺伝子は,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスにおいて低下していた.
ヒトへの臨床応用をめざした際に,自己の細胞を用いれば他者の細胞を使用する際に起こりうる拒絶反応やその予防に用いる免疫抑制剤の使用を回避できるといった利点がある.遺伝性肺胞蛋白症はGM-CSF受容体の遺伝子の単一遺伝子に異常をもつ疾患であることから遺伝子治療の対象として適しており,肺へのマクロファージの移植において遺伝子治療を試みた.GM-CSF受容体β鎖のノックアウトマウスから骨髄造血幹細胞を分離し,レンチウイルスを用いてGM-CSF受容体β鎖の遺伝子を導入して,GM-CSFに対し正常に反応できるマクロファージへと分化させた.in vitroにおいて遺伝子導入したマクロファージは野生型のマクロファージと同様にGM-CSFに対し反応できることを確認したのち,野生型のマクロファージの移植と同じ方法により,この遺伝子導入マクロファージをGM-CSF受容体β鎖のノックアウトマウスの肺へ投与した.2カ月のちには野生型のマクロファージの移植と同様に細胞の生着がみられ,病態の有意な改善がみられた.その効果は1年のちにも持続していることが確認された.移植された細胞は末梢の血液,骨髄,脾臓においては検出できず,肺にのみ存在し,さらに,野生型のマクロファージの移植においてみられた移植されたマクロファージの表現型の変化がみられた.末梢の血液の検査における血球数および分画や肺胞洗浄液に含まれる炎症性サイトカインに大きな異常はなく,マクロファージ遺伝子治療の安全性が示唆された.
遺伝性肺胞蛋白症のモデルマウスであるGM-CSF受容体β鎖のノックアウトマウスにおいて肺におけるGM-CSF値が上昇していたことから,GM-CSF受容体の機能の正常なマクロファージを肺に直接に移植することにより,おそらく選択的な生存優位性の機構により移植されたマクロファージは長期にわたり生着することが確認された.従来の造血幹細胞の移植とは異なり,骨髄を破壊するような前処置を必要とせず,肺への経気管投与という臓器に特異的な投与法によりほかの臓器への影響もさけられた.造血幹細胞を用いた遺伝子治療においては頻繁な増殖分化にともなう遺伝子変異による発がんが起こりうるが,ある程度まで分化させたマクロファージを移植に使用することにより,こうした副作用の少ない可能性も考えられた.肺へのマクロファージの移植は安全性および認容性の高い有効な治療法と考えられた.遺伝性肺胞蛋白症の患者よりiPS細胞が作製され,これをマクロファージへと分化させると病態を再現できること,および,遺伝子導入することによりその病態を改善できることが報告されている16,17).今後,こうした技術を組み合わせることにより,肺へのマクロファージの移植が臨床に応用できるよう,さらなる研究の発展が期待される.
略歴:2001年 東北大学大学院医学系研究科 修了,東北大学医学部 助手,2005年 米国Cincinnati Children's Hospital Medical CenterにてResearch Fellow,同Instructorを経て,同Assistant Professor.
研究テーマ:肺の自然免疫,呼吸器疾患の病態.
抱負:難治性の呼吸器疾患の病態の解明と新規の治療法の開発に貢献したい.
Bruce C. Trapnell
米国Cincinnati Children's Hospital Medical CenterにてProfessor.
© 2014 鈴木拓児・Bruce C. Trapnell Licensed under CC 表示 2.1 日本
(米国Cincinnati Children's Hospital Medical Center,Perinatal Institute,Division of Pulmonary Biology)
email:鈴木拓児
DOI: 10.7875/first.author.2014.132
Pulmonary macrophage transplantation therapy.
Takuji Suzuki, Paritha Arumugam, Takuro Sakagami, Nico Lachmann, Claudia Chalk, Anthony Sallese, Shuichi Abe, Cole Trapnell, Brenna Carey, Thomas Moritz, Punam Malik, Carolyn Lutzko, Robert E. Wood, Bruce C. Trapnell
Nature, 514, 450-454 (2014)
要 約
骨髄移植は有効な治療法であるが,前処置として骨髄の破壊を必要とするため重篤な感染症の危険性がある.最近,組織マクロファージは定常状態においては末梢の血液に由来する造血細胞に依存せずに維持されていることが明らかになり,マクロファージが原因となる疾患に対し,骨髄移植ではなく臓器の局所を対象としたマクロファージの細胞治療が有効である可能性が考えられるようになった.GM-CSF受容体β鎖のノックアウトマウスはヒトのGM-CSF受容体α鎖あるいはGM-CSF受容体β鎖の遺伝子変異を原因とする遺伝性肺胞蛋白症のすぐれたモデルである.GM-CSF受容体β鎖のノックアウトマウスに対し,野生型マウスのマクロファージあるいはGM-CSF受容体β鎖の遺伝子を導入したマクロファージを用いて,前処置をせず肺へとマクロファージを移植したところ,安全性および認容性が確認され,1回のみの移植により肺の病態,2次的な全身症状,疾患に関連したバイオマーカーが改善され,疾患による死亡率は抑制された.肺に移植されたマクロファージは少なくとも1年は生着し治療効果を発揮した.この研究により,肺胞マクロファージの総数を制御する機構が明らかになり,肺胞マクロファージの表現型を決定する要因のひとつとしてGM-CSFが必要であることが明らかになった.肺へのマクロファージの移植は遺伝性肺胞蛋白症の患者への最初の特異的な治療法となりうる可能性が示唆された.
はじめに
肺胞蛋白症は肺サーファクタントに由来する物質が肺の末梢の気腔に異常に貯留し呼吸不全にいたる疾患であり,1958年にはじめて記載されたが1),その原因は長らく不明であった.肺サーファクタントはII型肺胞上皮細胞において産生され,再利用されるとともに肺胞マクロファージにより処理され,その産生と分解のバランスにより肺における肺サーファクタントの恒常性は維持されている2)(図1a).1994年,GM-CSF(granulocyte macrophage colony-stimulating factor,顆粒球・マクロファージコロニー刺激因子)のノックアウトマウスが予想外にも肺胞蛋白症を生じることが明らかになり3,4),つづいて,GM-CSF受容体β鎖のノックアウトマウスにおいても同様の表現型が報告された5,6).こうしたマウスにおける研究から,GM-CSFは肺胞マクロファージが肺サーファクタントを処理するのに必要であり,肺の恒常性の維持において中心的な役割を担うことが明らかになった.一方,ヒトでは,1999年,当時は原因不明であった“特発性肺胞蛋白症”の患者の気管支肺胞の洗浄液からGM-CSFの生物活性を阻害する抗GM-CSF抗体が発見され7),現在では,この疾患は“自己免疫性肺胞蛋白症”と分類されるようになった.さらに2008年,抗GM-CSF抗体陰性の肺胞蛋白症の患者においてGM-CSF受容体α鎖の遺伝子に変異が発見され8,9),つづいて,GM-CSF受容体β鎖の遺伝子に変異をもつ患者も報告され10,11),これらは“遺伝性肺胞蛋白症”とよばれるようになった12)(図1b).そののち,血清におけるGM-CSF自体がこの疾患のバイオマーカーとして有用であることが報告された12).
現在,遺伝性肺胞蛋白症に対し有効とされている治療は全身麻酔のもと生理食塩水により肺をくり返し洗浄するという全肺洗浄法であり,重症な患者では頻回にくり返し施行する必要がある.マウスモデルでは骨髄移植の有効性が示されているが,ヒトにおいては骨髄移植など造血幹細胞の移植のまえに正常な幹細胞を受け入れる準備として抗がん剤治療や放射線治療といった骨髄を破壊するような前処置が行われ,それにともなう感染症などの副作用が起こりうる.治療の必要な重症の患者では肺や全身の状態が悪いため骨髄移植がむずかしいこともある.また,実際に骨髄移植を行った遺伝性肺胞蛋白症の患者においてドナーの骨髄が生着するまえに感染症のため亡くなった例が報告されている9).したがって,遺伝性肺胞蛋白症に特異的な新規の治療法の開発が期待されている.従来,組織マクロファージは骨髄に由来する単球がつねに前駆細胞として供給されることにより維持されていると考えられてきたが,最近の知見では,肺など多くの組織において生前からマクロファージの前駆細胞が存在し,定常状態では骨髄造血細胞に由来する細胞に依存せずに組織マクロファージが維持されていることが知られるようになり,臓器に特異的におのおのの組織マクロファージを維持する機構の存在することが示唆されている13-15).
1.遺伝性肺胞蛋白症のマウスモデル
GM-CSF受容体β鎖のノックアウトマウスでは,肺の病理所見や肺胞マクロファージの異常がヒトの遺伝性肺胞蛋白症と同じ所見を呈することのみならず,肺胞洗浄液の透明度,バイオマーカーの異常,肺胞マクロファージにおける遺伝子発現の異常などの所見がすべてヒトのGM-CSF受容体α鎖あるいはGM-CSF受容体β鎖の遺伝子変異による遺伝性肺胞蛋白症の病態を忠実に再現することが確認された.さらに,GM-CSF受容体β鎖のノックアウトマウスでは加齢とともに病態が進行し,慢性の呼吸不全にともなう2次性の多血症を生じることが認められた.
2.肺へのマクロファージの移植
遺伝性肺胞蛋白症の患者およびそのモデルであるGM-CSF受容体β鎖のノックアウトマウスでは,おもな異常所見は肺だけであり,GM-CSFに反応できない機能不全の肺胞マクロファージが病態の中心であることから,肺胞マクロファージの機能さえ回復できれば病態の改善につながる可能性が考えられた.さらに,肺は生体の外から経気管的に細胞を投与できる特別な臓器であり,肺には骨髄造血細胞の供給に依存せずに肺胞マクロファージを維持する機構のあることが示唆されてきた.そこで,肺へのマクロファージの移植治療の可能性を探るため,野生型のマウスの骨髄よりマクロファージを作製し,GM-CSF受容体β鎖のノックアウトマウスに対し1回の経気管投与を行った(図1c).マクロファージの移植の2カ月のち,肺において移植されたマクロファージの存在が確認され,遺伝性肺胞蛋白症においてみられるバイオマーカーの異常の所見および肺胞マクロファージにおける遺伝子発現の異常は有意に改善した.GM-CSF受容体β鎖のノックアウトマウスの骨髄から作製したマクロファージを移植してもこのような効果は観察されなかったことから,GM-CSF受容体の機能に依存した効果であることが示唆された.さらに驚くべきことに,野生型のマクロファージを1回のみ移植した1年のちにも移植されたマクロファージは存続しており,その治療効果は持続していた.肺胞マクロファージはGM-CSF受容体β鎖のノックアウトマウスではヒトの肺胞蛋白症の患者と同様にPAS染色やオイルレッドO染色に陽性の大型な泡沫細胞を呈するが,移植を行ったマウスの肺のマクロファージは野生型のマクロファージに近い所見を呈した.さらに,肺病理組織の所見において,移植を行っていないマウスにおいては肺胞に経時的に蓄積し,これをうめつくす肺サーファクタントに由来する物質が,移植を行ったマウスでは大きく減少していることが確認された.さらに,高齢のGM-CSF受容体β鎖のノックアウトマウスでは慢性的な低酸素血症にともなう血清エリスロポイエチン値の上昇と2次性の多血症が観察されたが,移植を行ったマウスではそれらの有意な改善がみられ,肺の疾患にともなう全身の異常所見に対する効果も確認された.そして,移植を行ったGM-CSF受容体β鎖のノックアウトマウスでは移植を行っていないマウスに比べ生存期間の延長が観察された.移植ののちの末梢の血液の所見においては,血球数および分画にとくに異常は認められず,肺胞洗浄液に含まれる炎症性サイトカインに改善がみられ安全性が示唆された.
3.移植されたマクロファージの生着の機構
野生型のマウスに比べGM-CSF受容体β鎖のノックアウトマウスでは肺におけるGM-CSF値が上昇していたこと,GM-CSF受容体を発現している野生型マウスのマクロファージのみ肺においてGM-CSFに反応することができたことから,細胞がGM-CSFに反応できることによる選択的な生存優位性が移植されたマクロファージの生着の機構と考えられた.実際に,in vitroにおいて,野生型マウスおよびGM-CSF受容体β鎖のノックアウトマウスの骨髄から作製したマクロファージをGM-CSFおよびM-CSFの存在のもと競合的に共培養したところ,野生型マウスに由来するマクロファージがGM-CSF受容体β鎖のノックアウトマウスに由来するマクロファージに比べ優位に増殖することが示され,GM-CSFへの反応性による選択的な生存優位性が示唆された.さらに,in vivoにおいては,GM-CSF値の上昇のみられない野生型マウスにマクロファージを移植しても2カ月のちには移植された細胞は肺胞マクロファージの全体の5%以下であったのに対し,GM-CSF受容体β鎖のノックアウトマウスにおいては肺胞マクロファージの約20%が移植された細胞に由来しており有意に高い生着がみられた.GFPにより標識したマウスの骨髄から作製したマクロファージを用いて移植を行い,移植された細胞の肺における増殖についてKi67染色により検討した.その結果,移植された細胞が増殖していることが確認され,その割合を調べると,移植の1カ月のちにはその32%がKi67陽性,1年のちには11%がKi67陽性であった.肺胞マクロファージにおける移植された細胞の割合を経時的に観察すると,徐々に変化して1年のちには69%にまで上昇し,それにともない肺胞洗浄液におけるGM-CSF値は減少し,同様に治療効果の指標である肺胞洗浄液の透明度も徐々に減少した.興味深いことに,GM-CSF値がかなり減少した移植の1年のちのGM-CSF受容体を発現する移植された細胞に由来する肺胞マクロファージの数は,同じ週齢の移植を行っていない野生型マウスの肺胞マクロファージの数にほぼ近い値を示したことから,肺におけるGM-CSF値はそれに反応できるマクロファージにより制御され,かつ,肺胞マクロファージの総数は肺におけるGM-CSF値により左右される,といったフィードバックのある相互関係の存在が示唆された.
4.移植ののちの肺胞マクロファージの解析
GFPにより標識したマウスの骨髄から作製したマクロファージを用いて移植を行い,肺における局在について病理組織を調べたところ,約9割が肺胞に存在し,約1割が間質に存在していた.移植ののちのマウスにおいてGFP陽性細胞の分布をフローサイトメトリーにより調べたところ,末梢の血液,脾臓,骨髄には観察されず,移植されたマクロファージは肺にとどまっていることが明らかになった.さらに,移植された細胞に特異的であるGFPの遺伝子をPCR法により調べても,あるいは,CD45.1陽性のマクロファージを移植したのちCD45.1陽性細胞をフローサイトメトリーにより調べても同様の結果であったことから,移植された細胞は肺,とくに大部分は肺胞腔にとどまるものと考えられた.一般に,臓器に特異的な環境が組織マクロファージの特徴を形成するものと考えられているが,野生型マウスの肺胞マクロファージがCD11b低発現SiglecF高発現の表現型を示すのに対し,骨髄から作製したマクロファージはCD11b高発現SiglecF低発現であるが,移植の1年のちの細胞は野生型の肺胞マクロファージと同様の表現型を示し,GM-CSFシグナルが肺胞マクロファージの表現型を決定する肺に特異的な環境因子のひとつであると考えられた.さらに,包括的な遺伝子発現への影響をみるため,同じ週齢の野生型マウス,移植を行っていないGM-CSF受容体β鎖のノックアウトマウス,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージについてDNAマイクロアレイ解析を行った.その結果,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージは,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスに比べ,野生型マウスにおける遺伝子発現により近似したパターンを示した.さらに,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスの肺胞マクロファージにおいて,野生型マウスに比べ低下していた細胞分裂,脂肪酸代謝,オルガネラへの局在,脂肪酸β酸化にかかわる遺伝子の発現は,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスにおいて上昇しており,逆に,移植を行っていないGM-CSF受容体β鎖のノックアウトマウスにおいて発現の上昇していた細胞内代謝を制御する遺伝子や免疫系,RNA代謝,アポトーシス,シグナル伝達にかかわる遺伝子は,移植の1年のちのGM-CSF受容体β鎖のノックアウトマウスにおいて低下していた.
5.マクロファージ遺伝子治療
ヒトへの臨床応用をめざした際に,自己の細胞を用いれば他者の細胞を使用する際に起こりうる拒絶反応やその予防に用いる免疫抑制剤の使用を回避できるといった利点がある.遺伝性肺胞蛋白症はGM-CSF受容体の遺伝子の単一遺伝子に異常をもつ疾患であることから遺伝子治療の対象として適しており,肺へのマクロファージの移植において遺伝子治療を試みた.GM-CSF受容体β鎖のノックアウトマウスから骨髄造血幹細胞を分離し,レンチウイルスを用いてGM-CSF受容体β鎖の遺伝子を導入して,GM-CSFに対し正常に反応できるマクロファージへと分化させた.in vitroにおいて遺伝子導入したマクロファージは野生型のマクロファージと同様にGM-CSFに対し反応できることを確認したのち,野生型のマクロファージの移植と同じ方法により,この遺伝子導入マクロファージをGM-CSF受容体β鎖のノックアウトマウスの肺へ投与した.2カ月のちには野生型のマクロファージの移植と同様に細胞の生着がみられ,病態の有意な改善がみられた.その効果は1年のちにも持続していることが確認された.移植された細胞は末梢の血液,骨髄,脾臓においては検出できず,肺にのみ存在し,さらに,野生型のマクロファージの移植においてみられた移植されたマクロファージの表現型の変化がみられた.末梢の血液の検査における血球数および分画や肺胞洗浄液に含まれる炎症性サイトカインに大きな異常はなく,マクロファージ遺伝子治療の安全性が示唆された.
おわりに
遺伝性肺胞蛋白症のモデルマウスであるGM-CSF受容体β鎖のノックアウトマウスにおいて肺におけるGM-CSF値が上昇していたことから,GM-CSF受容体の機能の正常なマクロファージを肺に直接に移植することにより,おそらく選択的な生存優位性の機構により移植されたマクロファージは長期にわたり生着することが確認された.従来の造血幹細胞の移植とは異なり,骨髄を破壊するような前処置を必要とせず,肺への経気管投与という臓器に特異的な投与法によりほかの臓器への影響もさけられた.造血幹細胞を用いた遺伝子治療においては頻繁な増殖分化にともなう遺伝子変異による発がんが起こりうるが,ある程度まで分化させたマクロファージを移植に使用することにより,こうした副作用の少ない可能性も考えられた.肺へのマクロファージの移植は安全性および認容性の高い有効な治療法と考えられた.遺伝性肺胞蛋白症の患者よりiPS細胞が作製され,これをマクロファージへと分化させると病態を再現できること,および,遺伝子導入することによりその病態を改善できることが報告されている16,17).今後,こうした技術を組み合わせることにより,肺へのマクロファージの移植が臨床に応用できるよう,さらなる研究の発展が期待される.
文 献
- Rosen, S. H., Castleman, B. & Liebow, A. A.: Pulmonary alveolar proteinosis. N. Engl. J. Med., 258, 1123-1142 (1958)[PubMed]
- Trapnell, B. C., Whitsett, J. A. & Nakata, K.: Pulmonary alveolar proteinosis. N. Engl. J. Med., 349, 2527-2539 (2003)[PubMed]
- Dranoff, G., Crawford, A. D., Sadelain, M. et al.: Involvement of granulocyte-macrophage colony-stimulating factor in pulmonary homeostasis. Science, 264, 713-716 (1994)[PubMed]
- Stanley, E., Lieschke, G. J., Grail, D. et al.: Granulocyte/macrophage colony-stimulating factor-deficient mice show no major perturbation of hematopoiesis but develop a characteristic pulmonary pathology. Proc. Natl. Acad. Sci. USA, 91, 5592-5596 (1994)[PubMed]
- Nishinakamura, R., Nakayama, N., Hirabayashi, Y. et al.: Mice deficient for the IL-3/GM-CSF/IL-5 βc receptor exhibit lung pathology and impaired immune response, while beta IL3 receptor-deficient mice are normal. Immunity, 2, 211-222 (1995)[PubMed]
- Robb, L., Drinkwater, C. C., Metcalf, D. et al.: Hematopoietic and lung abnormalities in mice with a null mutation of the common beta subunit of the receptors for granulocyte-macrophage colony-stimulating factor and interleukins 3 and 5. Proc. Natl. Acad. Sci. USA, 92, 9565-9569 (1995)[PubMed]
- Kitamura, T., Tanaka, N., Watanabe, J. et al.: Idiopathic pulmonary alveolar proteinosis as an autoimmune disease with neutralizing antibody against granulocyte/macrophage colony-stimulating factor. J. Exp. Med., 190, 875-880 (1999)[PubMed]
- Suzuki, T., Sakagami, T., Rubin, B. K. et al.: Familial pulmonary alveolar proteinosis caused by mutations in CSF2RA. J. Exp. Med., 205, 2703-2710 (2008)[PubMed]
- Martinez-Moczygemba, M., Doan, M. L., Elidemir, O. et al.: Pulmonary alveolar proteinosis caused by deletion of the GM-CSFRα gene in the X chromosome pseudoautosomal region 1. J. Exp. Med., 205, 2711-2716 (2008)[PubMed]
- Suzuki, T., Maranda, B., Sakagami, T. et al.: Hereditary pulmonary alveolar proteinosis caused by recessive CSF2RB mutations. Eur. Respir. J., 37, 201-204 (2011)[PubMed]
- Tanaka, T., Motoi, N., Tsuchihashi, Y. et al.: Adult-onset hereditary pulmonary alveolar proteinosis caused by a single-base deletion in CSF2RB. J. Med. Genet., 48, 205-209 (2011)[PubMed]
- Suzuki, T., Sakagami, T., Young, L. R. et al.: Hereditary pulmonary alveolar proteinosis: pathogenesis, presentation, diagnosis, and therapy. Am. J. Respir. Crit. Care. Med., 182, 1292-1304 (2010)[PubMed]
- Guilliams, M., De Kleer, I., Henri, S. et al.: Alveolar macrophages develop from fetal monocytes that differentiate into long-lived cells in the first week of life via GM-CSF. J. Exp. Med., 210, 1977-1992 (2013)[PubMed]
- Hashimoto, D., Chow, A., Noizat. C. et al.: Tissue-resident macrophages self-maintain locally throughout adult life with minimal contribution from circulating monocytes. Immunity, 38, 792-804 (2013)[PubMed]
- Yona, S., Kim, K. W., Wolf, Y. et al.: Fate mapping reveals origins and dynamics of monocytes and tissue macrophages under homeostasis. Immunity, 38, 79-91 (2013)[PubMed]
- Suzuki, T., Mayhew, C., Sallese, A. et al.: Use of induced pluripotent stem cells to recapitulate pulmonary alveolar proteinosis pathogenesis. Am. J. Respir. Crit. Care. Med., 189, 183-193 (2014)[PubMed]
- Lachmann, N., Happle, C., Ackermann, M. et al.: Gene correction of human induced pluripotent stem cells repairs the cellular phenotype in pulmonary alveolar proteinosis. Am. J. Respir. Crit. Care. Med., 189, 167-182 (2014)[PubMed]
著者プロフィール
略歴:2001年 東北大学大学院医学系研究科 修了,東北大学医学部 助手,2005年 米国Cincinnati Children's Hospital Medical CenterにてResearch Fellow,同Instructorを経て,同Assistant Professor.
研究テーマ:肺の自然免疫,呼吸器疾患の病態.
抱負:難治性の呼吸器疾患の病態の解明と新規の治療法の開発に貢献したい.
Bruce C. Trapnell
米国Cincinnati Children's Hospital Medical CenterにてProfessor.
© 2014 鈴木拓児・Bruce C. Trapnell Licensed under CC 表示 2.1 日本