骨格筋タンパク質Dok-7の発現の増強は神経筋接合部の形成不全をともなう神経筋疾患のモデルマウスの病態を改善する
有村純暢・山梨裕司
(東京大学医科学研究所 腫瘍抑制分野)
email:山梨裕司
DOI: 10.7875/first.author.2014.124
DOK7 gene therapy benefits mouse models of diseases characterized by defects in the neuromuscular junction.
Sumimasa Arimura, Takashi Okada, Tohru Tezuka, Tomoko Chiyo, Yuko Kasahara, Toshiro Yoshimura, Masakatsu Motomura, Nobuaki Yoshida, David Beeson, Shin’ichi Takeda, Yuji Yamanashi
Science, 345, 1505-1508 (2014)
骨格筋の収縮には運動ニューロンの軸索の末端と骨格筋とを結ぶ神経筋接合部とよばれるシナプス構造が必要であり,神経筋接合部の形成の不全は易疲労性の筋力の低下を特徴とする筋無力症の原因となる.骨格筋タンパク質であるDok-7は神経筋接合部の形成に必須であり,その異常は神経筋接合部の形成不全を特徴とするDOK7型筋無力症を惹起する.今回,筆者らは,ヒトのDok-7を発現するアデノ随伴ウイルスベクターを作出し,このDok-7発現ベクターのマウスへの投与が神経筋接合部を高度に拡張することを見い出した.Dok-7発現ベクターの投与はDOK7型筋無力症のモデルマウスの異常に小さな神経筋接合部を大きくするとともに,このマウスに認められる筋力の低下を改善し,早期の致死性を回避した.さらに,DOK7型筋無力症とは別の,LMNA遺伝子の異常により発症する常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスにDok-7発現ベクターを投与したところ,このマウスの小さな神経筋接合部を拡張するとともに,筋力の低下を改善し生存期間を延ばした.この研究の成果は,神経筋接合部を拡張することにより運動機能を改善するという治療法が,神経筋接合部の形成不全をともなうさまざまな神経筋疾患に対するまったく新しい概念の治療法となる可能性を示した.
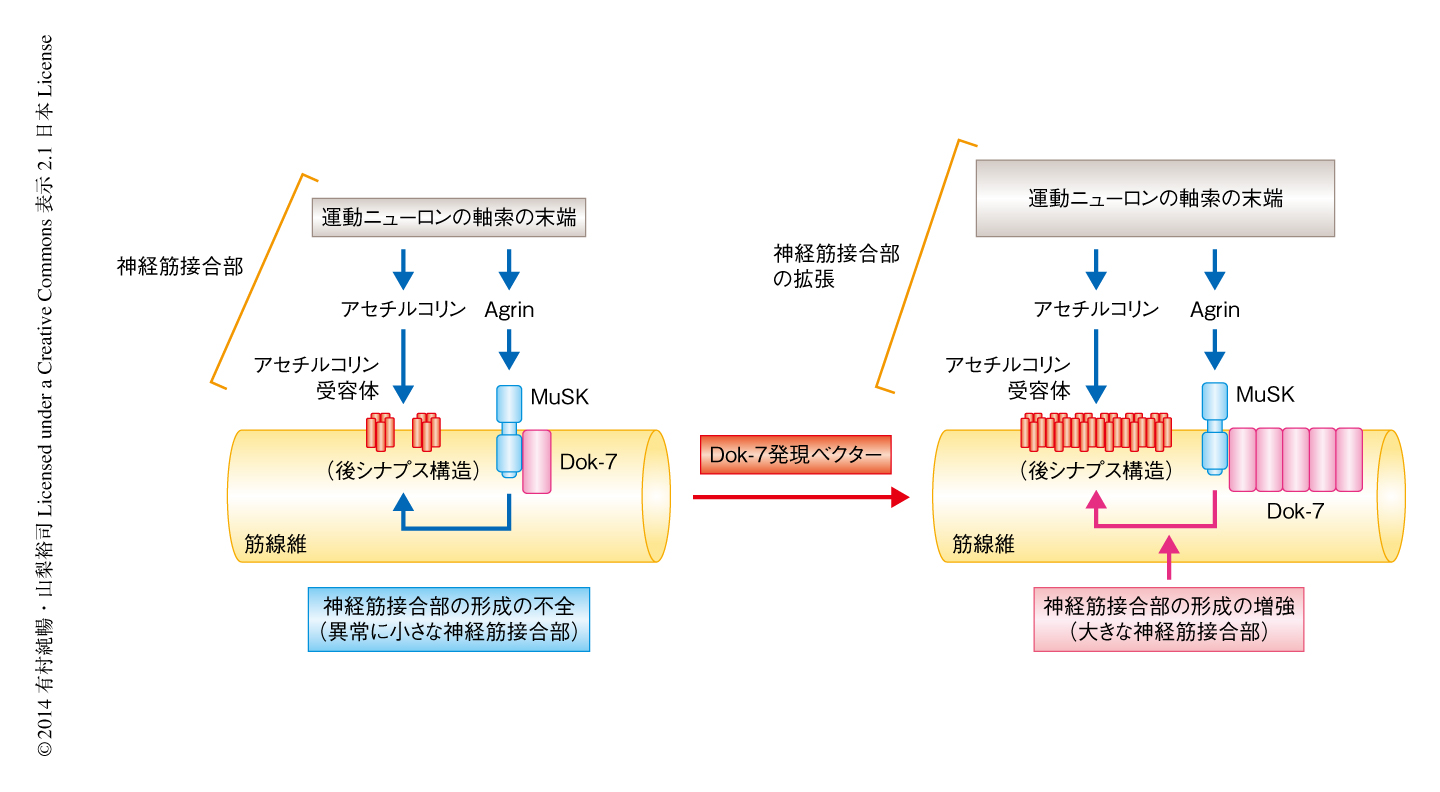
呼吸を含めた運動機能の制御には神経筋接合部とよばれるシナプス構造が必須であり,運動ニューロンの軸索の末端からの制御シグナルは神経筋接合部を介して骨格筋に伝達される.運動ニューロンが興奮すると,その軸索の末端からシナプス間隙に神経伝達物質であるアセチルコリンが放出され,筋線維の中央部に高密度に凝集したニコチン性アセチルコリン受容体を刺激することにより筋収縮がひき起こされる(図1).哺乳動物は一般に筋線維あたり1つの神経筋接合部をその中央部に形成し,神経筋接合部の喪失は呼吸を含めた運動機能の喪失を意味する.これまでに,筆者らのグループは,神経筋接合部の形成に必須のタンパク質としてDok-7を同定し1),また,ヒトのDOK7遺伝子の異常による劣性遺伝病としてDOK7型筋無力症を発見し,それが神経筋接合部の形成不全病であることを解明した2).さらに,Dok-7は神経筋接合部の形成に必須な受容体型チロシンキナーゼMuSKの筋細胞の内部からの活性化タンパク質であることも明らかにした3).一方で,筋無力症のほかにも,筋ジストロフィー,筋萎縮性側索硬化症,脊髄性筋萎縮症,加齢性筋肉減少症など,多様な神経筋疾患において,神経筋接合部の形成不全が報告されている4-10).しかしながら,これらの形成不全がおのおのの疾患の病態にどのくらい寄与しているのかは不明であった.このような状況のもと,筆者らのグループは,骨格筋において特異的にDok-7を高く発現するトランスジェニックマウスを作出し,このマウスは運動機能の異常を呈することなく,また,筋線維の中央部の正しい位置において神経筋接合部が拡張していることを報告した3).この知見をきっかけとして,Dok-7の発現の増強は神経筋接合部の形成不全をともなうさまざまな神経筋疾患に対する新たな治療技術の創出に直結すると考え研究を開始した.
これまでに筆者らは,神経筋接合部の形成におけるDok-7の役割を解明する目的で,骨格筋において特異的にDok-7を高く発現するトランスジェニックマウスを作出し,胚の発生の過程においてDok-7の過剰な発現が正常な筋線維の中央部における神経筋接合部の形成を増強することを報告していた3).そこで,このトランスジェニックマウスの成体における神経筋接合部について検討し,それが野生型マウスの神経筋接合部に比べきわめて大きいことを確認した.しかしながら,このトランスジェニックマウスの運動機能は野生型マウスと同等であり,また,1年齢になってもその運動機能に明らかな異常は認められなかった.そこで,Dok-7の発現を後天的かつ人為的に増強するために,ヒトの骨格筋における安全性,および,長期にわたり外来遺伝子を発現することにすぐれたアデノ随伴ウイルスを採用しヒトのDOK7遺伝子を発現するベクターを作製した.このDok-7発現ベクターを正常なマウスに投与したところ,投与からわずか1週間で神経筋接合部の拡張が確認された.運動機能の解析や組織学的な解析の結果,Dok-7発現ベクターの投与に起因すると思われる異常は認められなかった.これらの知見から,アデノ随伴ウイルスベクターを利用してDok-7を過剰に発現させることにより,後天的かつ安全に神経筋接合部の形成を増強することが可能であることが明らかになった.
Dok-7発現ベクターにより後天的な神経筋接合部の形成を人為的に増強することが可能となったことから,それを用いた治療実験を実施する目的で,DOK7型筋無力症患者に認められる遺伝子変異と同じ遺伝子変異を導入したノックインマウスを作製し,このマウスが神経筋接合部の形成不全をともなう筋無力症様の病態を呈することを確認した.そこで,このDOK7型筋無力症のモデルマウスが発症したのちにDok-7発現ベクターを投与したところ,神経筋接合部の形成シグナルの指標であるMuSKおよびアセチルコリン受容体のチロシンリン酸化の亢進とともに,形成不全を呈する神経筋接合部が拡張した.さらに,このマウスは3週齢までに死亡するが,発症ののちにDok-7発現ベクターを投与するとその致死性は回避され,運動機能は投与から数週間で正常なレベルにまで回復し,1年以上の延命効果を示した.これらの結果から,神経筋接合部の形成不全をともなう疾患に対し,発症ののちのDok-7の発現の増強が効果的な治療法となる可能性が示された.
近年,神経筋接合部の異常をその直接の原因とする筋無力症とは別の神経筋疾患において,神経筋接合部の形成不全が報告されるようになった4-10).これらの疾患においてもDok-7の発現の増強による神経筋接合部の拡張が病態を改善するのではないかと予想し,DOK7型筋無力症とはその原因遺伝子において無関係の,しかし,神経筋接合部の形成不全をともなう点では共通する神経筋疾患として,核ラミナの主要な構成タンパク質をコードするLMNA遺伝子の異常により発症する常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスに対し4),その発症ののちにDok-7発現ベクターを投与した.その結果,MuSKおよびアセチルコリン受容体のチロシンリン酸化が亢進するとともに,形成不全を呈する神経筋接合部が拡張され,運動機能が改善された.なお,常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスの延命効果は約4週間であったが,併発する心機能の障害により死に至っている可能性が示唆された.この点では,常染色体優性Emery-Dreifuss型筋ジストロフィーの患者の心機能の障害に対してはペースメーカーや植込み型除細動器による治療が効果的であることから,神経筋接合部の形成不全による筋機能の障害を標的とするこの治療との併用が効果的な治療になる可能性が考えられた.
今回,筆者らは,アデノ随伴ウイルスベクターを利用して神経筋接合部を後天的かつ安全に拡張する方法を創出し,神経筋接合部の形成不全をともなう多様な神経筋疾患に対し,神経筋接合部を大きくすることによりその運動機能を改善するというまったく新しい治療概念を確立した(図1).この概念にもとづく神経筋接合部の形成増強治療は,かりに原因不明の多因子性疾患であっても,神経筋接合部の形成不全がひき起こす病態を改善すると期待される.2012年にアデノ随伴ウイルスベクターを利用した遺伝子治療薬グリベラが承認され,また,多様な疾患に対しアデノ随伴ウイルスベクターを利用した臨床試験が実施されており,アデノ随伴ウイルスベクターを利用した治療の臨床応用の道はすでに切り開かれている.一方で,つねにさまざまな方法論にもとづく治療技術の開発が期待されるが,筆者らの知見は,Dok-7発現ベクターと同様に神経筋接合部を拡張できる新たな治療薬の開発を先導する発見ともいえる.今後は,創出された神経筋接合部の形成増強治療の適応あるいは不適応を常染色体優性Emery-Dreifuss型筋ジストロフィー以外の,筋ジストロフィー,筋萎縮性側索硬化症,脊髄性筋萎縮症,加齢性筋肉減少症を含む,多様な疾患のモデルマウスにおいて検討するとともに,中型あるいは大型の動物における神経筋接合部の拡張や安全性などについて検証したい.これらの神経筋接合部の形成不全をともなう神経筋疾患には根本的な治療法はないものの,現在,その治療技術の開発が精力的に推進されており,将来的に,神経筋接合部の形成増強治療とそれ以外の治療との併用が期待できる.
略歴:2009年 京都大学大学院医学研究科にて博士号取得,2010年 東京大学医科学研究所 研究員を経て,2013年より同 助教.
抱負:純粋なサイエンスへの興味を素に,難治性疾患に対する新たな診断法および治療法の開発に努力したい.
山梨 裕司(Yuji Yamanashi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/genetics/html/home.html
© 2014 有村純暢・山梨裕司 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 腫瘍抑制分野)
email:山梨裕司
DOI: 10.7875/first.author.2014.124
DOK7 gene therapy benefits mouse models of diseases characterized by defects in the neuromuscular junction.
Sumimasa Arimura, Takashi Okada, Tohru Tezuka, Tomoko Chiyo, Yuko Kasahara, Toshiro Yoshimura, Masakatsu Motomura, Nobuaki Yoshida, David Beeson, Shin’ichi Takeda, Yuji Yamanashi
Science, 345, 1505-1508 (2014)
要 約
骨格筋の収縮には運動ニューロンの軸索の末端と骨格筋とを結ぶ神経筋接合部とよばれるシナプス構造が必要であり,神経筋接合部の形成の不全は易疲労性の筋力の低下を特徴とする筋無力症の原因となる.骨格筋タンパク質であるDok-7は神経筋接合部の形成に必須であり,その異常は神経筋接合部の形成不全を特徴とするDOK7型筋無力症を惹起する.今回,筆者らは,ヒトのDok-7を発現するアデノ随伴ウイルスベクターを作出し,このDok-7発現ベクターのマウスへの投与が神経筋接合部を高度に拡張することを見い出した.Dok-7発現ベクターの投与はDOK7型筋無力症のモデルマウスの異常に小さな神経筋接合部を大きくするとともに,このマウスに認められる筋力の低下を改善し,早期の致死性を回避した.さらに,DOK7型筋無力症とは別の,LMNA遺伝子の異常により発症する常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスにDok-7発現ベクターを投与したところ,このマウスの小さな神経筋接合部を拡張するとともに,筋力の低下を改善し生存期間を延ばした.この研究の成果は,神経筋接合部を拡張することにより運動機能を改善するという治療法が,神経筋接合部の形成不全をともなうさまざまな神経筋疾患に対するまったく新しい概念の治療法となる可能性を示した.
はじめに
呼吸を含めた運動機能の制御には神経筋接合部とよばれるシナプス構造が必須であり,運動ニューロンの軸索の末端からの制御シグナルは神経筋接合部を介して骨格筋に伝達される.運動ニューロンが興奮すると,その軸索の末端からシナプス間隙に神経伝達物質であるアセチルコリンが放出され,筋線維の中央部に高密度に凝集したニコチン性アセチルコリン受容体を刺激することにより筋収縮がひき起こされる(図1).哺乳動物は一般に筋線維あたり1つの神経筋接合部をその中央部に形成し,神経筋接合部の喪失は呼吸を含めた運動機能の喪失を意味する.これまでに,筆者らのグループは,神経筋接合部の形成に必須のタンパク質としてDok-7を同定し1),また,ヒトのDOK7遺伝子の異常による劣性遺伝病としてDOK7型筋無力症を発見し,それが神経筋接合部の形成不全病であることを解明した2).さらに,Dok-7は神経筋接合部の形成に必須な受容体型チロシンキナーゼMuSKの筋細胞の内部からの活性化タンパク質であることも明らかにした3).一方で,筋無力症のほかにも,筋ジストロフィー,筋萎縮性側索硬化症,脊髄性筋萎縮症,加齢性筋肉減少症など,多様な神経筋疾患において,神経筋接合部の形成不全が報告されている4-10).しかしながら,これらの形成不全がおのおのの疾患の病態にどのくらい寄与しているのかは不明であった.このような状況のもと,筆者らのグループは,骨格筋において特異的にDok-7を高く発現するトランスジェニックマウスを作出し,このマウスは運動機能の異常を呈することなく,また,筋線維の中央部の正しい位置において神経筋接合部が拡張していることを報告した3).この知見をきっかけとして,Dok-7の発現の増強は神経筋接合部の形成不全をともなうさまざまな神経筋疾患に対する新たな治療技術の創出に直結すると考え研究を開始した.
1.Dok-7の発現の増強はマウスの神経筋接合部を拡張する
これまでに筆者らは,神経筋接合部の形成におけるDok-7の役割を解明する目的で,骨格筋において特異的にDok-7を高く発現するトランスジェニックマウスを作出し,胚の発生の過程においてDok-7の過剰な発現が正常な筋線維の中央部における神経筋接合部の形成を増強することを報告していた3).そこで,このトランスジェニックマウスの成体における神経筋接合部について検討し,それが野生型マウスの神経筋接合部に比べきわめて大きいことを確認した.しかしながら,このトランスジェニックマウスの運動機能は野生型マウスと同等であり,また,1年齢になってもその運動機能に明らかな異常は認められなかった.そこで,Dok-7の発現を後天的かつ人為的に増強するために,ヒトの骨格筋における安全性,および,長期にわたり外来遺伝子を発現することにすぐれたアデノ随伴ウイルスを採用しヒトのDOK7遺伝子を発現するベクターを作製した.このDok-7発現ベクターを正常なマウスに投与したところ,投与からわずか1週間で神経筋接合部の拡張が確認された.運動機能の解析や組織学的な解析の結果,Dok-7発現ベクターの投与に起因すると思われる異常は認められなかった.これらの知見から,アデノ随伴ウイルスベクターを利用してDok-7を過剰に発現させることにより,後天的かつ安全に神経筋接合部の形成を増強することが可能であることが明らかになった.
2.Dok-7の発現の増強による神経筋接合部の拡張はDOK7型筋無力症のモデルマウスの病態を改善する
Dok-7発現ベクターにより後天的な神経筋接合部の形成を人為的に増強することが可能となったことから,それを用いた治療実験を実施する目的で,DOK7型筋無力症患者に認められる遺伝子変異と同じ遺伝子変異を導入したノックインマウスを作製し,このマウスが神経筋接合部の形成不全をともなう筋無力症様の病態を呈することを確認した.そこで,このDOK7型筋無力症のモデルマウスが発症したのちにDok-7発現ベクターを投与したところ,神経筋接合部の形成シグナルの指標であるMuSKおよびアセチルコリン受容体のチロシンリン酸化の亢進とともに,形成不全を呈する神経筋接合部が拡張した.さらに,このマウスは3週齢までに死亡するが,発症ののちにDok-7発現ベクターを投与するとその致死性は回避され,運動機能は投与から数週間で正常なレベルにまで回復し,1年以上の延命効果を示した.これらの結果から,神経筋接合部の形成不全をともなう疾患に対し,発症ののちのDok-7の発現の増強が効果的な治療法となる可能性が示された.
3.Dok-7の発現の増強による神経筋接合部の拡張は神経筋接合部の形成不全をともなう筋ジストロフィーのモデルマウスの病態を改善する
近年,神経筋接合部の異常をその直接の原因とする筋無力症とは別の神経筋疾患において,神経筋接合部の形成不全が報告されるようになった4-10).これらの疾患においてもDok-7の発現の増強による神経筋接合部の拡張が病態を改善するのではないかと予想し,DOK7型筋無力症とはその原因遺伝子において無関係の,しかし,神経筋接合部の形成不全をともなう点では共通する神経筋疾患として,核ラミナの主要な構成タンパク質をコードするLMNA遺伝子の異常により発症する常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスに対し4),その発症ののちにDok-7発現ベクターを投与した.その結果,MuSKおよびアセチルコリン受容体のチロシンリン酸化が亢進するとともに,形成不全を呈する神経筋接合部が拡張され,運動機能が改善された.なお,常染色体優性Emery-Dreifuss型筋ジストロフィーのモデルマウスの延命効果は約4週間であったが,併発する心機能の障害により死に至っている可能性が示唆された.この点では,常染色体優性Emery-Dreifuss型筋ジストロフィーの患者の心機能の障害に対してはペースメーカーや植込み型除細動器による治療が効果的であることから,神経筋接合部の形成不全による筋機能の障害を標的とするこの治療との併用が効果的な治療になる可能性が考えられた.
おわりに
今回,筆者らは,アデノ随伴ウイルスベクターを利用して神経筋接合部を後天的かつ安全に拡張する方法を創出し,神経筋接合部の形成不全をともなう多様な神経筋疾患に対し,神経筋接合部を大きくすることによりその運動機能を改善するというまったく新しい治療概念を確立した(図1).この概念にもとづく神経筋接合部の形成増強治療は,かりに原因不明の多因子性疾患であっても,神経筋接合部の形成不全がひき起こす病態を改善すると期待される.2012年にアデノ随伴ウイルスベクターを利用した遺伝子治療薬グリベラが承認され,また,多様な疾患に対しアデノ随伴ウイルスベクターを利用した臨床試験が実施されており,アデノ随伴ウイルスベクターを利用した治療の臨床応用の道はすでに切り開かれている.一方で,つねにさまざまな方法論にもとづく治療技術の開発が期待されるが,筆者らの知見は,Dok-7発現ベクターと同様に神経筋接合部を拡張できる新たな治療薬の開発を先導する発見ともいえる.今後は,創出された神経筋接合部の形成増強治療の適応あるいは不適応を常染色体優性Emery-Dreifuss型筋ジストロフィー以外の,筋ジストロフィー,筋萎縮性側索硬化症,脊髄性筋萎縮症,加齢性筋肉減少症を含む,多様な疾患のモデルマウスにおいて検討するとともに,中型あるいは大型の動物における神経筋接合部の拡張や安全性などについて検証したい.これらの神経筋接合部の形成不全をともなう神経筋疾患には根本的な治療法はないものの,現在,その治療技術の開発が精力的に推進されており,将来的に,神経筋接合部の形成増強治療とそれ以外の治療との併用が期待できる.
文 献
- Okada, K., Inoue, A., Okada, M. et al.: The muscle protein Dok-7 is essential for neuromuscular synaptogenesis. Science, 312, 1802-1805 (2006)[PubMed]
- Beeson, D., Higuchi, O., Palace, J. et al.: Dok-7 mutations underlie a neuromuscular junction synaptopathy. Science, 313, 1975-1978 (2006)[PubMed]
- Inoue, A., Setoguchi, K., Matsubara, Y. et al.: Dok-7 activates the muscle receptor kinase MuSK and shapes synapse formation. Sci. Signal., 2, ra7 (2009)[PubMed]
- Mejat, A., Decostre, V., Li, J. et al.: Lamin A/C-mediated neuromuscular junction defects in Emery-Dreifuss muscular dystrophy. J. Cell Biol., 184, 31-44 (2009)[PubMed]
- Ghedini, P. C., Viel, T. A., Honda, L. et al.: Increased expression of acetylcholine receptors in the diaphragm muscle of mdx mice. Muscle Nerve, 38, 1585-1594 (2008)[PubMed]
- Gumerson, J. D., Davis, C. S., Kabaeva, Z. T. et al.: Muscle-specific expression of LARGE restores neuromuscular transmission deficits in dystrophic LARGEmyd mice. Hum. Mol. Genet., 22, 757-768 (2013)[PubMed]
- Saito, F., Masaki, T., Saito, Y. et al.: Defective peripheral nerve myelination and neuromuscular junction formation in fukutin-deficient chimeric mice. J. Neurochem., 101, 1712-1722 (2007)[PubMed]
- Fischer, L. R., Culver, D. G., Tennant, P. et al.: Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Exp. Neurol., 185, 232-240 (2004)[PubMed]
- Kariya, S., Park, G. H., Maeno-Hikichi, Y. et al.: Reduced SMN protein impairs maturation of the neuromuscular junctions in mouse models of spinal muscular atrophy. Hum. Mol. Genet., 17, 2552-2569 (2008)[PubMed]
- Jang, Y. C. & Remmen, H. V.: Age-associated alterations of the neuromuscular junction. Exp. Gerontol., 46, 193-198 (2011)[PubMed]
著者プロフィール
略歴:2009年 京都大学大学院医学研究科にて博士号取得,2010年 東京大学医科学研究所 研究員を経て,2013年より同 助教.
抱負:純粋なサイエンスへの興味を素に,難治性疾患に対する新たな診断法および治療法の開発に努力したい.
山梨 裕司(Yuji Yamanashi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/genetics/html/home.html
© 2014 有村純暢・山梨裕司 Licensed under CC 表示 2.1 日本