リソソームに局在するアミノ酸輸送体SLC15A4による炎症応答の制御
小林俊彦・反町典子
(国立国際医療研究センター研究所 分子炎症制御プロジェクト)
email:小林俊彦,反町典子
DOI: 10.7875/first.author.2014.125
The histidine transporter SLC15A4 coordinates mTOR-dependent inflammatory responses and pathogenic antibody production.
Toshihiko Kobayashi, Shiho Shimabukuro-Demoto, Reiko Yoshida-Sugitani, Kaori Furuyama-Tanaka, Hitomi Karyu, Yuki Sugiura, Yukiko Shimizu, Toshiaki Hosaka, Motohito Goto, Norihiro Kato, Tadashi Okamura, Makoto Suematsu, Shigeyuki Yokoyama, Noriko Toyama-Sorimachi
Immunity, 41, 375-388 (2014)
リソソーム系は細胞が外界から取り込んだ物質やそれ自体のオルガネラを分解する場であることが知られている一方,近年,免疫応答において,取り込んだ異物を認識し免疫反応を惹起するシグナル伝達の場としての重要性が明らかになりつつある.しかしながら,リソソームにおいてシグナル伝達がどのように制御されているかについては不明な点が多い.筆者らは,リソソーム膜に局在するアミノ酸輸送体SLC15A4が,リソソームから輸送基質であるヒスチジンやプロトンを汲み出すことによりリソソームの内部の環境を最適化し,mTORおよびToll様受容体に依存したI型インターフェロンの産生の制御を可能にしていること,さらに,このSLC15A4を介する制御機構はB細胞における病原性をもつ抗体の産生に必須であり,自己抗体の産生をともなう自己免疫疾患の病態の形成に寄与しうることを明らかにした.
リソソームはさまざまな物質の分解を担当するオルガネラである.受容体からのシグナル伝達においても,リソソームはリガンドと結合した受容体が分解をうけることによりシグナルが終結する場であると,長いあいだ考えられてきた.しかし近年では,シグナルの終結ではなくシグナルの伝達にかかわるオルガネラとして,シグナルの質,強度,時空間を精密に制御する重要な場であることが知られつつある1).
一方,輸送体の役割は細胞あるいは細胞の局所における必要な物質の取り込みあるいは不要な物質の排出にあるとされ,恒常性の維持に重要であることが知られているが,こうした輸送体を介した物質の移動の制御と免疫応答との関係についての報告は少ない.
アミノ酸輸送体SLC15A4は,その局在がリソソームであること,基質がヒスチジンを主とするかぎられたアミノ酸およびオリゴペプチドであり,輸送活性がpHに依存することが知られていたが2,3),生物学的な重要性については不明であった.筆者らを含む複数のグループは,独立にSLC15A4の機能について解析し,SLC15A4が自然免疫を担う細胞に強く発現しており,とくに,I型インターフェロンの産生に重要な樹状細胞のひとつである形質細胞様樹状細胞においてウイルスや細菌に対する応答に重要であることを報告してきた4,5).SLC15A4を欠損した形質細胞様樹状細胞ではウイルスのもつ核酸を認識する自然免疫センサーであるTLR7およびTLR9(TLR:Toll-like receptor,Toll様受容体)の応答性が低下し,炎症性サイトカインやI型インターフェロンの産生が阻害される.TLR7およびTLR9はリソソームにおいて炎症応答を惹起することから,同じリソソームに局在するSLC15A4がTLR7およびTLR9の応答性に影響をあたえることが推察されたが,なぜアミノ酸輸送体であるSLC15A4がこれらの免疫応答に必要なのか,その分子機構は不明であった.そこで,この研究においては,SLC15A4とTLR7およびTLR9の応答性とをつなぐ分子機構に焦点をあて,SLC15A4によるリソソームの内部のアミノ酸およびpH環境の制御が,mTOR複合体1,および,TLR7およびTLR9に依存したI型インターフェロンの産生の活性化にきわめて重要であることを見い出した.
SLC15A4ノックアウトマウスの血中の抗体価に異常が認められたことから,B細胞における抗体の産生能について詳細に検討した.その結果,SLC15A4を欠損したB細胞による免疫グロブリンMの産生は野生型のB細胞と同等であったのに対し,I型インターフェロンに依存的に産生され免疫疾患の病態の進行に深くかかわるとされる抗体サブクラスである免疫グロブリンG2aおよび免疫グロブリンG2cの産生能は低下していた.SLC15A4を欠損したB細胞では,TLR7およびTLR9の刺激により誘導される細胞の増殖にはほとんど異常は認められなかったが,炎症性サイトカインおよびI型インターフェロンの産生能がいちじるしく低下していた.SLC15A4を欠損したB細胞における免疫グロブリンG2aおよび免疫グロブリンG2cの産生の異常は培地にI型インターフェロンを添加することにより一部は回復したことから,SLC15A4の欠損による抗体の産生の異常はB細胞によるI型インターフェロンの産生の減弱によると考えられ,SLC15A4がI型インターフェロンの産生に依存した抗体の産生に重要な役割をはたすことが示された.
TLR7およびTLR9への刺激により誘導されるI型インターフェロンの産生には転写因子IRF7が必須である6).SLC15A4を欠損したB細胞では,TLR7およびTLR9のシグナルにより誘導されるIRF7のmRNA量およびタンパク質量が低下し,核へと移行するIRF7の量も減少していたことから,SLC15A4はIRF7の機能の発現に必須であることがわかった.I型インターフェロンの産生においては,TLR7およびTLR9への刺激により発現の誘導されたIRF7がさらにI型インターフェロンの発現を誘導し,それがさらにIRF7の発現を誘導するという正の制御機構が知られているが,この結果は,SLC15A4を欠損するとこの正の制御機構が破綻することを示していた.興味深いことに,SLC15A4を欠損したB細胞の培養系にI型インターフェロンを添加すると,IRF7のmRNA量は回復したがタンパク質量は回復せず,SLC15A4はIRF7の発現において転写および翻訳の両方に重要であることが明らかになった.IRF7ノックアウトマウスはSLC15A4ノックアウトマウスと同様に,血中およびB細胞自体から産生される免疫グロブリンG2aおよび免疫グロブリンG2cの量が野生型マウスに比べ減少していることも確認されたことから,SLC15A4の発現はIRF7-I型インターフェロンシグナル伝達経路に依存した免疫グロブリンG2aおよび免疫グロブリンG2cの産生に必要であると考えられた.その一方で,形質細胞様樹状細胞以外の樹状細胞やマクロファージにおいてI型インターフェロンの産生にかかわる転写因子IRF5については,SLC15A4の有無により発現量や活性に差異は認められなかった.
リソソームに局在するアミノ酸輸送体であるSLC15A4が,どのようにIRF7の転写や翻訳を制御するのだろうか? TLR7およびTLR9を介したIRF7の活性化にmTOR複合体1の活性が必要であること7),mTORシグナル伝達経路のプラットフォームがリソソームであること8),というこれまでの知見から,SLC15A4がmTORシグナル伝達経路を制御している可能性について検討した.
SLC15A4を欠損したB細胞において,TLR7およびTLR9への刺激のもとでmTORシグナル伝達経路について生化学的に解析した結果,翻訳制御タンパク質である4E-BP1,S6キナーゼをはじめ,mTORシグナル伝達経路に依存したシグナルの減弱が認められた.また,SLC15A4を欠損したB細胞では,RaptorおよびRaptorに結合するp62(SQSTM1)のリソソーム膜への局在化が減少しており,mTOR複合体1の形成の異常が示唆された.すなわち,SLC15A4を欠損するとリソソーム膜においてmTOR複合体1の形成が阻害され,mTORシグナル伝達経路に依存したIRF7の翻訳が低下したと考えられた.リソソームにおけるTLR7およびTLR9のシグナルもmTOR複合体1に依存することから7),SLC15A4の欠損におけるIRF7の転写の抑制はmTORシグナル伝達経路に依存したTLR7およびTLR9のシグナルの異常によると考えられた.
それでは,なぜSLC15A4を欠損するとmTOR複合体1の機能に異常が起こるのかという問題であるが,SLC15A4の有無によるリソソームのアミノ酸含量の変化を質量分析法を用いて解析した結果,SLC15A4を欠損したB細胞のリソソーム画分には野生型のB細胞と比較してヒスチジンが蓄積していることが明らかになった.近年,リソソームにおけるアミノ酸の増減によりmTOR複合体1の活性が変化することが明らかにされているが,SLC15A4の欠損の場合,アミノ酸量の変動による直接的なmTOR複合体1への影響というよりは,強い緩衝能をもつアミノ酸であるヒスチジンの過剰な蓄積によりリソソームの内部のpHに異常が生じ,その結果,pH依存性のアミノ酸センサーであるv-ATPase 9) の制御の異常を介してmTOR複合体1に影響をあたえていることを示唆する結果が得られた.実際に,SLC15A4を欠損した細胞においては,TLR7を刺激した際にリソソームの酸性化が障害されていた.
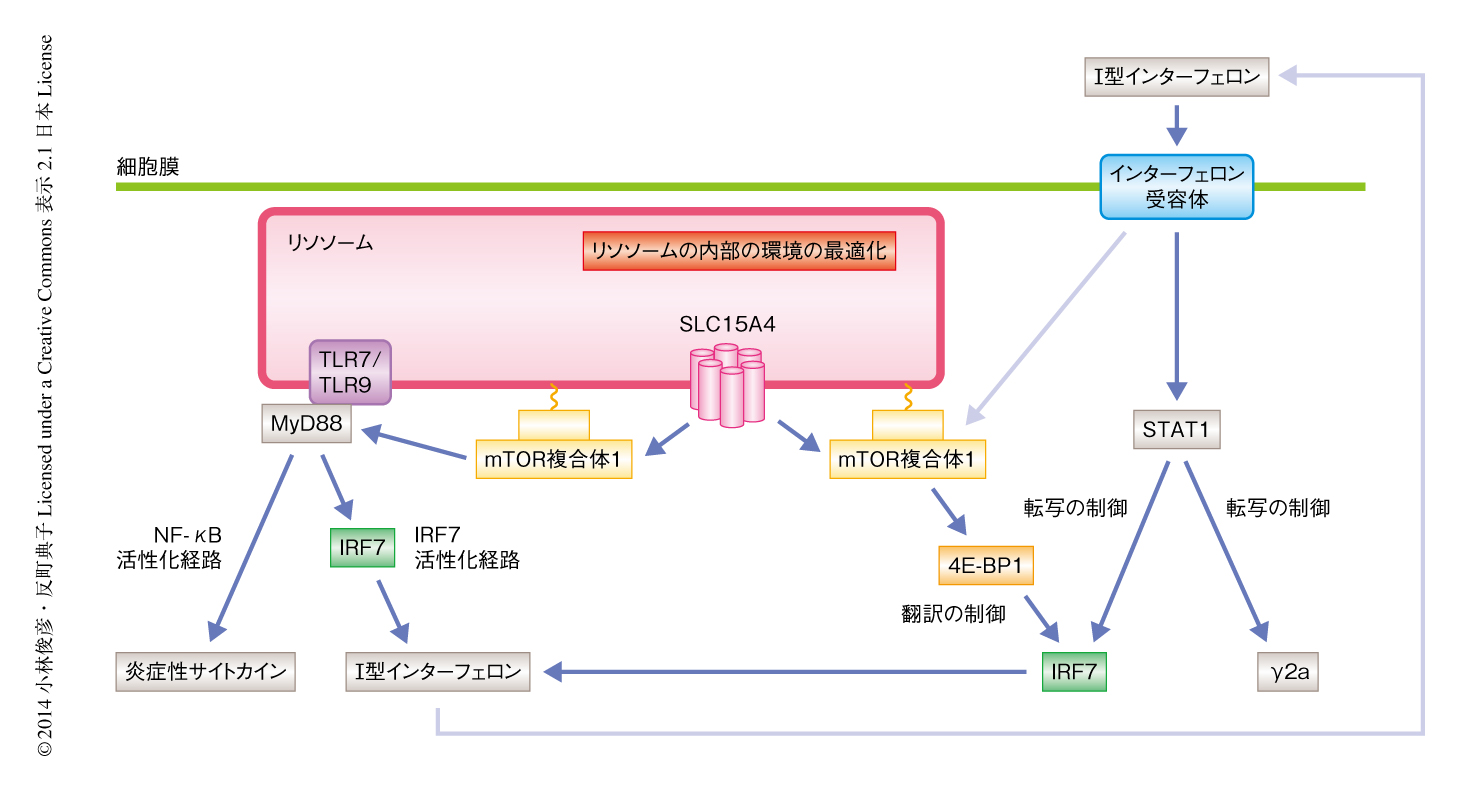
SLC15A4を欠損した細胞に輸送活性を欠損したSLC15A4変異体を再構築した細胞において,TLR7およびTLR9の刺激によるI型インターフェロンの産生およびIRF7の発現の誘導が回復しなかったことから,SLC15A4によるリソソームからの基質の汲み出しがmTOR複合体1に依存したTLR7/TLR9-IRF7-I型インターフェロンシグナル伝達経路に重要であることが裏づけられた.以上より,SLC15A4はその輸送活性によりリソソームにおけるアミノ酸,とくに,ヒスチジンのような緩衝作用の強いアミノ酸の量を制限し,近傍に存在するmTOR複合体1やTLR7およびTLR9が機能する環境を最適化していると考えられた(図1).
それでは,生体におけるSLC15A4を基軸としたB細胞のI型インターフェロンおよび抗体の産生の制御の意義は何だろうか? これまでに,ヒトゲノムの網羅的な解析により,炎症性自己免疫疾患のひとつである全身性エリテマトーデスとTLR7およびSLC15A4とのあいだに相関が報告されている10).全身性エリテマトーデスは抗核抗体や抗DNA抗体といった自己抗体の存在を特徴とする疾患で,これら自己抗体が全身の臓器を攻撃して炎症をひき起こすことが知られている.これらの自己抗体は核酸を認識するTLR7およびTLR9に依存的に産生されるため,SLC15A4の機能との関連が予想された.
そこで,全身性エリテマトーデスにおける自己抗体の産生にSLC15A4が関与しているかどうかを明らかにするため,複数の全身性エリテマトーデスのマウスモデルを用い解析した.その結果,SLC15A4ノックアウトマウスにおいては免疫グロブリンGの自己抗体,とくに,病態の進行に深くかかわる免疫グロブリンG2a(C57BL/6マウス系統では免疫グロブリンG2c)の自己抗体の産生に顕著な減少が認められた.さらに,骨髄キメラマウスを用いた実験から,B細胞それ自体のSLC15A4が免疫グロブリンG2aの自己抗体の産生に重要であることが明らかにされ,SLC15A4-mTOR-IRF7-I型インターフェロンシグナル伝達経路がB細胞において機能することが自己抗体の産生に結びつくことが示された.
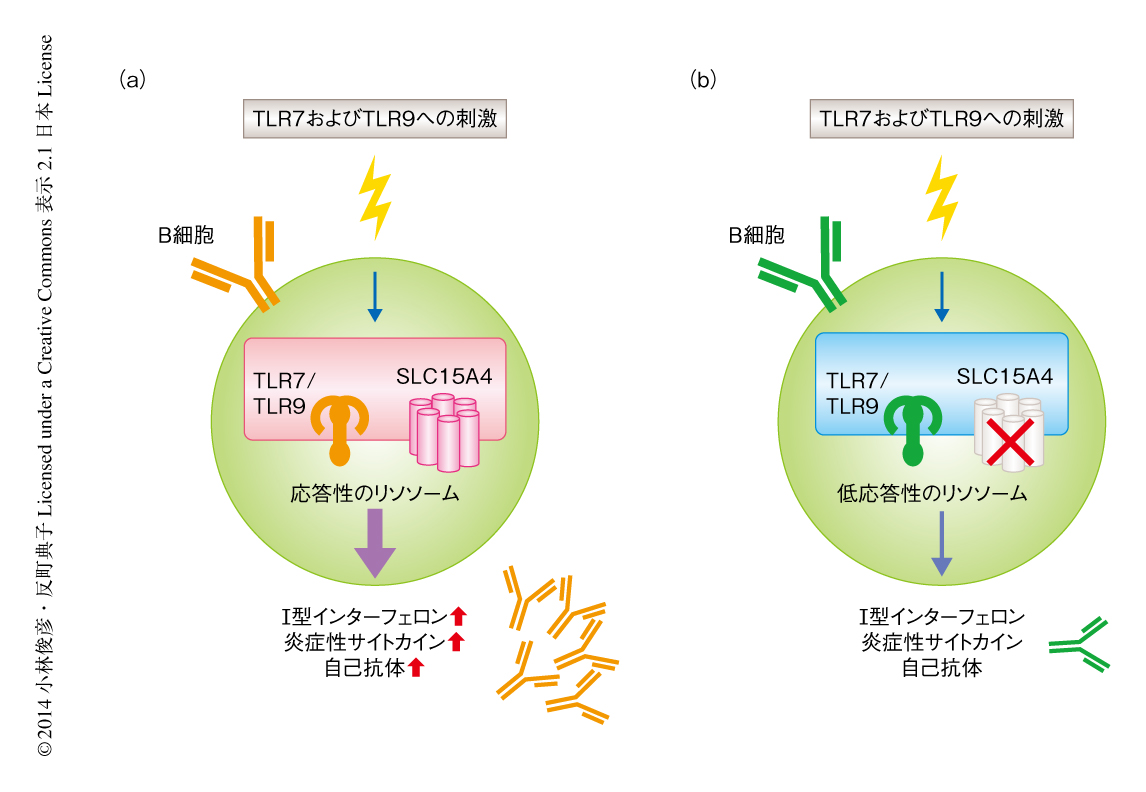
この研究においては,リソソームに局在するアミノ酸輸送体SLC15A4がどのような分子機構によりTLR7およびTLR9に依存した炎症応答を制御するのかが明らかにされた.とくにB細胞においては,TLR7の下流においてSLC15A4に依存的に産生されるI型インターフェロンと,それにより誘導される抗体の産生が自己免疫疾患の増悪につながる可能性が示された(図2).このことは,SLC15A4の機能の阻害が全身性エリテマトーデスをはじめとする自己抗体の産生をともなう自己免疫疾患の病態の改善に有益である可能性を示唆しており,SLC15A4の治療標的としての可能性が示された.
略歴:2007年 東京大学大学院医学系研究科 修了,米国Rockefeller大学 ポスドク研究員などを経て,2014年より国立国際医療研究センター研究所 副プロジェクト長.
研究テーマ:自然免疫応答と疾患とのかかわり.
反町 典子(Noriko Toyama-Sorimachi)
国立国際医療研究センター研究所 プロジェクト長.
研究室URL:http://square.umin.ac.jp/Sori_Lab/index.html
© 2014 小林俊彦・反町典子 Licensed under CC 表示 2.1 日本
(国立国際医療研究センター研究所 分子炎症制御プロジェクト)
email:小林俊彦,反町典子
DOI: 10.7875/first.author.2014.125
The histidine transporter SLC15A4 coordinates mTOR-dependent inflammatory responses and pathogenic antibody production.
Toshihiko Kobayashi, Shiho Shimabukuro-Demoto, Reiko Yoshida-Sugitani, Kaori Furuyama-Tanaka, Hitomi Karyu, Yuki Sugiura, Yukiko Shimizu, Toshiaki Hosaka, Motohito Goto, Norihiro Kato, Tadashi Okamura, Makoto Suematsu, Shigeyuki Yokoyama, Noriko Toyama-Sorimachi
Immunity, 41, 375-388 (2014)
要 約
リソソーム系は細胞が外界から取り込んだ物質やそれ自体のオルガネラを分解する場であることが知られている一方,近年,免疫応答において,取り込んだ異物を認識し免疫反応を惹起するシグナル伝達の場としての重要性が明らかになりつつある.しかしながら,リソソームにおいてシグナル伝達がどのように制御されているかについては不明な点が多い.筆者らは,リソソーム膜に局在するアミノ酸輸送体SLC15A4が,リソソームから輸送基質であるヒスチジンやプロトンを汲み出すことによりリソソームの内部の環境を最適化し,mTORおよびToll様受容体に依存したI型インターフェロンの産生の制御を可能にしていること,さらに,このSLC15A4を介する制御機構はB細胞における病原性をもつ抗体の産生に必須であり,自己抗体の産生をともなう自己免疫疾患の病態の形成に寄与しうることを明らかにした.
はじめに
リソソームはさまざまな物質の分解を担当するオルガネラである.受容体からのシグナル伝達においても,リソソームはリガンドと結合した受容体が分解をうけることによりシグナルが終結する場であると,長いあいだ考えられてきた.しかし近年では,シグナルの終結ではなくシグナルの伝達にかかわるオルガネラとして,シグナルの質,強度,時空間を精密に制御する重要な場であることが知られつつある1).
一方,輸送体の役割は細胞あるいは細胞の局所における必要な物質の取り込みあるいは不要な物質の排出にあるとされ,恒常性の維持に重要であることが知られているが,こうした輸送体を介した物質の移動の制御と免疫応答との関係についての報告は少ない.
アミノ酸輸送体SLC15A4は,その局在がリソソームであること,基質がヒスチジンを主とするかぎられたアミノ酸およびオリゴペプチドであり,輸送活性がpHに依存することが知られていたが2,3),生物学的な重要性については不明であった.筆者らを含む複数のグループは,独立にSLC15A4の機能について解析し,SLC15A4が自然免疫を担う細胞に強く発現しており,とくに,I型インターフェロンの産生に重要な樹状細胞のひとつである形質細胞様樹状細胞においてウイルスや細菌に対する応答に重要であることを報告してきた4,5).SLC15A4を欠損した形質細胞様樹状細胞ではウイルスのもつ核酸を認識する自然免疫センサーであるTLR7およびTLR9(TLR:Toll-like receptor,Toll様受容体)の応答性が低下し,炎症性サイトカインやI型インターフェロンの産生が阻害される.TLR7およびTLR9はリソソームにおいて炎症応答を惹起することから,同じリソソームに局在するSLC15A4がTLR7およびTLR9の応答性に影響をあたえることが推察されたが,なぜアミノ酸輸送体であるSLC15A4がこれらの免疫応答に必要なのか,その分子機構は不明であった.そこで,この研究においては,SLC15A4とTLR7およびTLR9の応答性とをつなぐ分子機構に焦点をあて,SLC15A4によるリソソームの内部のアミノ酸およびpH環境の制御が,mTOR複合体1,および,TLR7およびTLR9に依存したI型インターフェロンの産生の活性化にきわめて重要であることを見い出した.
1.SLC15A4はB細胞におけるTLR7およびTLR9の応答性と抗体の産生に必須である
SLC15A4ノックアウトマウスの血中の抗体価に異常が認められたことから,B細胞における抗体の産生能について詳細に検討した.その結果,SLC15A4を欠損したB細胞による免疫グロブリンMの産生は野生型のB細胞と同等であったのに対し,I型インターフェロンに依存的に産生され免疫疾患の病態の進行に深くかかわるとされる抗体サブクラスである免疫グロブリンG2aおよび免疫グロブリンG2cの産生能は低下していた.SLC15A4を欠損したB細胞では,TLR7およびTLR9の刺激により誘導される細胞の増殖にはほとんど異常は認められなかったが,炎症性サイトカインおよびI型インターフェロンの産生能がいちじるしく低下していた.SLC15A4を欠損したB細胞における免疫グロブリンG2aおよび免疫グロブリンG2cの産生の異常は培地にI型インターフェロンを添加することにより一部は回復したことから,SLC15A4の欠損による抗体の産生の異常はB細胞によるI型インターフェロンの産生の減弱によると考えられ,SLC15A4がI型インターフェロンの産生に依存した抗体の産生に重要な役割をはたすことが示された.
2.SLC15A4はI型インターフェロンの産生において重要な転写因子であるIRF7の活性化に必須である
TLR7およびTLR9への刺激により誘導されるI型インターフェロンの産生には転写因子IRF7が必須である6).SLC15A4を欠損したB細胞では,TLR7およびTLR9のシグナルにより誘導されるIRF7のmRNA量およびタンパク質量が低下し,核へと移行するIRF7の量も減少していたことから,SLC15A4はIRF7の機能の発現に必須であることがわかった.I型インターフェロンの産生においては,TLR7およびTLR9への刺激により発現の誘導されたIRF7がさらにI型インターフェロンの発現を誘導し,それがさらにIRF7の発現を誘導するという正の制御機構が知られているが,この結果は,SLC15A4を欠損するとこの正の制御機構が破綻することを示していた.興味深いことに,SLC15A4を欠損したB細胞の培養系にI型インターフェロンを添加すると,IRF7のmRNA量は回復したがタンパク質量は回復せず,SLC15A4はIRF7の発現において転写および翻訳の両方に重要であることが明らかになった.IRF7ノックアウトマウスはSLC15A4ノックアウトマウスと同様に,血中およびB細胞自体から産生される免疫グロブリンG2aおよび免疫グロブリンG2cの量が野生型マウスに比べ減少していることも確認されたことから,SLC15A4の発現はIRF7-I型インターフェロンシグナル伝達経路に依存した免疫グロブリンG2aおよび免疫グロブリンG2cの産生に必要であると考えられた.その一方で,形質細胞様樹状細胞以外の樹状細胞やマクロファージにおいてI型インターフェロンの産生にかかわる転写因子IRF5については,SLC15A4の有無により発現量や活性に差異は認められなかった.
3.SLC15A4によるリソソームの内部の環境の制御がリソソームに依存したシグナル伝達に重要である
リソソームに局在するアミノ酸輸送体であるSLC15A4が,どのようにIRF7の転写や翻訳を制御するのだろうか? TLR7およびTLR9を介したIRF7の活性化にmTOR複合体1の活性が必要であること7),mTORシグナル伝達経路のプラットフォームがリソソームであること8),というこれまでの知見から,SLC15A4がmTORシグナル伝達経路を制御している可能性について検討した.
SLC15A4を欠損したB細胞において,TLR7およびTLR9への刺激のもとでmTORシグナル伝達経路について生化学的に解析した結果,翻訳制御タンパク質である4E-BP1,S6キナーゼをはじめ,mTORシグナル伝達経路に依存したシグナルの減弱が認められた.また,SLC15A4を欠損したB細胞では,RaptorおよびRaptorに結合するp62(SQSTM1)のリソソーム膜への局在化が減少しており,mTOR複合体1の形成の異常が示唆された.すなわち,SLC15A4を欠損するとリソソーム膜においてmTOR複合体1の形成が阻害され,mTORシグナル伝達経路に依存したIRF7の翻訳が低下したと考えられた.リソソームにおけるTLR7およびTLR9のシグナルもmTOR複合体1に依存することから7),SLC15A4の欠損におけるIRF7の転写の抑制はmTORシグナル伝達経路に依存したTLR7およびTLR9のシグナルの異常によると考えられた.
それでは,なぜSLC15A4を欠損するとmTOR複合体1の機能に異常が起こるのかという問題であるが,SLC15A4の有無によるリソソームのアミノ酸含量の変化を質量分析法を用いて解析した結果,SLC15A4を欠損したB細胞のリソソーム画分には野生型のB細胞と比較してヒスチジンが蓄積していることが明らかになった.近年,リソソームにおけるアミノ酸の増減によりmTOR複合体1の活性が変化することが明らかにされているが,SLC15A4の欠損の場合,アミノ酸量の変動による直接的なmTOR複合体1への影響というよりは,強い緩衝能をもつアミノ酸であるヒスチジンの過剰な蓄積によりリソソームの内部のpHに異常が生じ,その結果,pH依存性のアミノ酸センサーであるv-ATPase 9) の制御の異常を介してmTOR複合体1に影響をあたえていることを示唆する結果が得られた.実際に,SLC15A4を欠損した細胞においては,TLR7を刺激した際にリソソームの酸性化が障害されていた.
SLC15A4を欠損した細胞に輸送活性を欠損したSLC15A4変異体を再構築した細胞において,TLR7およびTLR9の刺激によるI型インターフェロンの産生およびIRF7の発現の誘導が回復しなかったことから,SLC15A4によるリソソームからの基質の汲み出しがmTOR複合体1に依存したTLR7/TLR9-IRF7-I型インターフェロンシグナル伝達経路に重要であることが裏づけられた.以上より,SLC15A4はその輸送活性によりリソソームにおけるアミノ酸,とくに,ヒスチジンのような緩衝作用の強いアミノ酸の量を制限し,近傍に存在するmTOR複合体1やTLR7およびTLR9が機能する環境を最適化していると考えられた(図1).
4.疾患の病態の形成にかかわる自己抗体の産生にはSLC15A4が必要である
それでは,生体におけるSLC15A4を基軸としたB細胞のI型インターフェロンおよび抗体の産生の制御の意義は何だろうか? これまでに,ヒトゲノムの網羅的な解析により,炎症性自己免疫疾患のひとつである全身性エリテマトーデスとTLR7およびSLC15A4とのあいだに相関が報告されている10).全身性エリテマトーデスは抗核抗体や抗DNA抗体といった自己抗体の存在を特徴とする疾患で,これら自己抗体が全身の臓器を攻撃して炎症をひき起こすことが知られている.これらの自己抗体は核酸を認識するTLR7およびTLR9に依存的に産生されるため,SLC15A4の機能との関連が予想された.
そこで,全身性エリテマトーデスにおける自己抗体の産生にSLC15A4が関与しているかどうかを明らかにするため,複数の全身性エリテマトーデスのマウスモデルを用い解析した.その結果,SLC15A4ノックアウトマウスにおいては免疫グロブリンGの自己抗体,とくに,病態の進行に深くかかわる免疫グロブリンG2a(C57BL/6マウス系統では免疫グロブリンG2c)の自己抗体の産生に顕著な減少が認められた.さらに,骨髄キメラマウスを用いた実験から,B細胞それ自体のSLC15A4が免疫グロブリンG2aの自己抗体の産生に重要であることが明らかにされ,SLC15A4-mTOR-IRF7-I型インターフェロンシグナル伝達経路がB細胞において機能することが自己抗体の産生に結びつくことが示された.
おわりに
この研究においては,リソソームに局在するアミノ酸輸送体SLC15A4がどのような分子機構によりTLR7およびTLR9に依存した炎症応答を制御するのかが明らかにされた.とくにB細胞においては,TLR7の下流においてSLC15A4に依存的に産生されるI型インターフェロンと,それにより誘導される抗体の産生が自己免疫疾患の増悪につながる可能性が示された(図2).このことは,SLC15A4の機能の阻害が全身性エリテマトーデスをはじめとする自己抗体の産生をともなう自己免疫疾患の病態の改善に有益である可能性を示唆しており,SLC15A4の治療標的としての可能性が示された.
文 献
- Platta, H. W. & Stenmark, H.: Endocytosis and signaling. Curr. Opin. Cell Biol., 23, 393-403 (2011)[PubMed]
- Yamashita, T., Shimada, S., Guo, W. et al.: Cloning and functional expression of a brain peptide/histidine transporter. J. Biol. Chem., 272, 10205-10211 (1997)[PubMed]
- Bhardwaj, R. K., Herrera-Ruiz, D., Eltoukhy, N. et al.: The functional evaluation of human peptide/histidine transporter 1 (hPHT1) in transiently transfected COS-7 cells. Eur. J. Pharm. Sci., 27, 533-542 (2005)[PubMed]
- Sasawatari, S., Okamura, T., Kasumi, E. et al.: The solute carrier family 15A4 regulates TLR9 and NO1 functions in the innate immune system and promotes colitis in mice. Gastroenterology, 140, 1513-1525 (2011)[PubMed]
- Blasius, A. L., Arnold, C. N., Georgel, P. et al.: Slc15a4, AP-3, and Hermansky-Pudlak syndrome proteins are required for Toll-like receptors singaling in plasmacytoid dendritic cells. Proc. Natl. Acad. Sci. USA, 107, 19973-19978 (2010)[PubMed]
- Honda, K., Yanai, H., Negishi, H. et al.: IRF-7 is the master regulator of type-I interferon-dependent immune responses. Nature, 434, 772-777 (2005)[PubMed]
- Cao, W., Manicassamy, S., Tang, H. et al.: Toll-like receptor-mediated induction of type I interferon in plasmacytoid dendritic cells requires the rapamycin-sensitive PI(3)K-mTOR-p70S6K pathway. Nat. Immunol., 9, 1157-1164 (2008)[PubMed]
- Efeyan, A., Zoncu, R. & Sabatini, D. M.: Amino acids and mTORC1: from lysosome to disease. Trends. Mol. Med., 18, 524-533 (2012)[PubMed]
- Zoncu, R., Bar-Peled, L., Efeyan, A. et al.: mTORC1 senses lysosomal amino acids through an inside-out mechanism that requires the vacuolar H+-ATPase. Science, 334, 678-683 (2011)[PubMed]
- Tsokos, G. C.: Systemic lupus erythematosus. N. Engl. J. Med., 365, 2110-2121 (2011)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院医学系研究科 修了,米国Rockefeller大学 ポスドク研究員などを経て,2014年より国立国際医療研究センター研究所 副プロジェクト長.
研究テーマ:自然免疫応答と疾患とのかかわり.
反町 典子(Noriko Toyama-Sorimachi)
国立国際医療研究センター研究所 プロジェクト長.
研究室URL:http://square.umin.ac.jp/Sori_Lab/index.html
© 2014 小林俊彦・反町典子 Licensed under CC 表示 2.1 日本